部分化学药品注射剂高风险品种及其风险因素
医院常见高危药物管理及风险防范

医院常见高危药物管理及风险防范随着医学科技的不断进步,一些高危药物在临床上得到了广泛应用。
高危药物是指那些在使用过程中可能造成严重的不良反应或者产生严重后果的药物。
因此,对医院常见的高危药物的管理和风险防范显得尤为重要。
1.肾上腺素类:肾上腺素、去甲肾上腺素等。
2.抗心律失常药物:洋地黄、利多卡因等。
3.血管扩张剂:硝酸甘油、硝酸异山梨酯等。
4.抗凝血药物:肝素、华法林等。
5.糖皮质激素:泼尼松、地塞米松等。
6.抗生素:青霉素、链霉素等。
二、高危药物管理的措施1.严格的定量用药:将用药量控制在安全范围内,按照医嘱使用、防止超量和误用。
2.规范化用药:医生应根据病情、病史、体重等因素,合理规范用药,减少不良反应的发生。
3.严格的执行手册:每个病房和科室都应有相应的药物执行手册,包括药品名称、剂量、使用方法、不良反应等内容,便于医护人员查找和操作。
4.药物巡回检查:独立的药剂师或药学专家应定期对病房和科室的药品进行巡查,确保药品的管理和贮存符合规定。
5.对药品的质量控制:严格对进口药品和国产药品的质量进行测试和审核,确保药品品质。
三、风险防范1.对特殊人群要慎重使用:对孕妇、老人、婴幼儿、患有脑损伤、肝肾疾病的患者要慎重使用高危药物。
2.充分了解药品的作用和不良反应:医护人员应全面了解药品的作用、适应症、用量、不良反应等信息,减少药品使用时的风险。
3.严格按照用药规定用药:医生在用药时,应按照规定用药,确保不超量、不错用、不重复。
4.及时处理不良反应:对不良反应的处理应及时、准确、得当,必要时应立即停药并采取积极措施进行干预。
总之,高危药物的管理和风险防范非常重要,医院管理者应制定相关的管理规定和措施,确保医疗质量,保障患者安全。
同时,医护人员应充分了解药品的作用和不良反应,有效控制风险,杜绝质量问题的发生。
医院常见高危药物管理及风险防范

医院常见高危药物管理及风险防范医院是医疗保健服务的重要单位,而在医院的日常工作中,使用药物是不可或缺的一部分。
由于药物的特殊性质,其管理存在着一定的风险。
特别是一些高危药物的使用,如果管理不当,可能对患者的健康造成严重影响甚至危害患者生命安全。
医院对于高危药物的管理及风险防范显得尤为重要。
一、高危药物的定义高危药物是指在使用过程中可能导致患者死亡、伤害或造成不良后果的药物。
一般来说,高危药物具有以下特点:①具有明显的毒性或副作用,一旦使用不当可能对患者造成严重伤害;②具有一定的药物潜在危险性,例如易于引起过敏反应、药物相互作用等;③具有一定的处理风险,如化学药物需特殊设备处理或具有放射性的药物等。
二、医院常见高危药物1. 麻醉药物:如丙泊酚、阿托品等,这类药物在手术过程中使用,一旦用量或使用方式不当就有可能导致患者死亡。
2. 抗生素:如氨基糖苷类、青霉素类等,这类药物易导致药物耐药性,过量使用还会对患者的肾脏、肝脏等器官造成损害。
3. 化疗药物:如紫杉醇、环磷酰胺等,这类药物具有明显的毒性,一旦使用不当可能导致患者的免疫功能下降甚至引发恶性肿瘤。
4. 心血管药物:如利尿剂、β受体阻滞剂等,这类药物对患者的心血管系统产生直接影响,使用不当可能导致患者出现心脏骤停、心力衰竭等严重后果。
5. 抗凝药物:如华法林、肝素等,这类药物在使用过程中需要严格控制剂量,否则可能导致患者出现出血等严重不良反应。
以上只是举几例,实际上高危药物的范围非常广泛。
医院在使用这些药物时需要严格按照相关规定进行管理,以确保患者的安全。
三、管理高危药物的风险防范措施1. 形成科学规范的管理制度医院应建立健全的高危药物管理制度,包括高危药物的采购、存储、配药、使用等全过程的管理流程,明确责任部门和相关人员,并对其进行培训,使其熟悉药品的危险性及使用规范。
2. 加强药物的定量管理对高危药物的采购、存储、配药等环节进行精细化管理,加强对药品的定量控制,确保药品使用的数量和质量符合规范要求。
药迅10月(xin)
关于开展注射剂类药品生产工艺和处方核查工作的通知国家药品食品监督管理局决定开展注射剂类药品生产工艺和处方核查工作。
重点核查品种名单:部分化学药品注射剂高风险品种及其风险因素、部分中药注射剂高风险品种名单以及部分有严重不良反应报告的注射剂品种名单,望各临床医护人员谨慎使用此类药物,密切关注此类药物的不良反应。
大容量注射剂的处方核查将于今年底结束,其它静脉给药用注射剂核查将于2008年6月结束。
部分化学药品注射剂高风险品种及风险因素部分有严重不良反应报告的注射剂品种名单(选前20位)(按2006年报告数降序排列)NSAIDs引起的胃肠道溃疡致荷兰年花费增加4000多万欧元据一项疾病所致耗费研究结果显示:非甾体抗炎药(NSAIDs)致严重胃肠道溃疡直接导致荷兰年花费增加4275万欧元。
研究人员分析了自2001年11月至2003年12月间,来自152 989名城市居民中的104例因非甾体抗炎药致严重胃肠道溃疡的病例。
直接总费用(按2003年标准计算)包括:住院治疗费、急诊费、救护车运输费、血液制品费、内窥镜检查费、手术费、诊断费及实验室检查费。
直接总费用的中位数为5397欧元,直接总费用的平均数为8375欧元。
其中有11例住院病人死亡(10.6%)。
按2003年12月底荷兰人口16 258 032计,估计平均每年有5105人因此住院,并有541人死亡,其每年的直接医疗费用达42 754 375欧元。
研究发现子宫内暴露于已烯雌酚与先兆子痫相关挪威和美国研究者称,妇女产前子宫内暴露于已烯雌酚与孕期出现先兆子痫的风险轻度升高有关。
研究数据来自美国国立癌症研究院已烯雌酚队列随防研究(National Cancer Institute DES Combined Cohorts Follow-up Study)。
在7313例活产妇女中,明确为先兆子痫的有285例,其中的210例先兆子痫是因为这些妇女子宫内暴露于已烯雌酚所致。
部分化学药品注射剂高风险品种及其风险因素
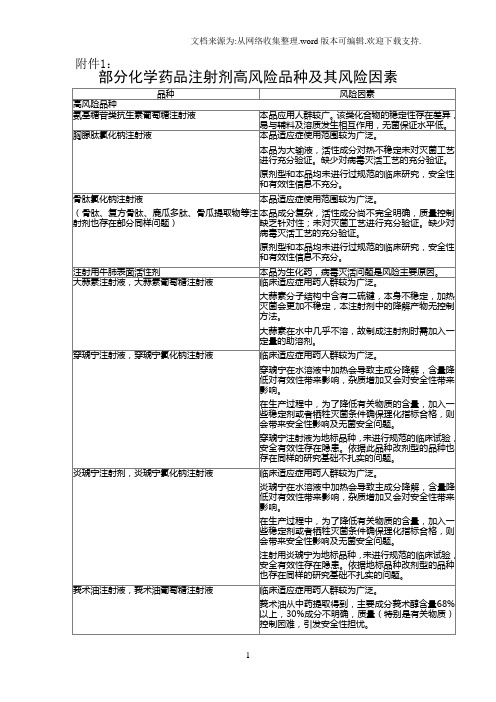
附件1:部分化学药品注射剂高风险品种及其风险因素附件2:附件3:部分有严重不良反应报告的注射剂品种名单(按2006年报告数降序排列)化学药品29.庆大霉素注射剂1.头孢曲松注射剂30.氟罗沙星注射剂2.青霉素注射剂31.利巴韦林注射剂3.克林霉素注射剂32.炎琥宁注射剂4.左氧氟沙星注射剂33.复方氨林巴比妥注射剂5.头孢噻肟钠注射剂34.奥沙利铂注射剂6.头孢派酮钠舒巴坦钠注射剂35.葛根素注射剂7.阿奇霉素注射剂36.甲硝唑注射剂8.加替沙星注射剂37.甲氨喋呤注射剂9.头孢拉定注射剂38.磷霉素注射剂10.头孢哌酮注射剂39.环丙沙星注射剂11.头孢唑林钠注射剂40.顺铂注射剂12.穿琥宁注射剂41.美洛西林注射剂13.头孢呋辛注射剂42.复方氨基比林注射剂14.多西他赛注射剂43.碘普罗胺注射剂15.复方氨基酸注射剂44.甘露醇注射剂16.维生素K1注射剂45.环磷酰胺注射剂17.头孢他啶注射剂46.洛美沙星注射剂18.硫普罗宁注射剂47.细辛脑注射剂19.右旋糖酐40注射剂48.碘海醇注射剂20.氨苄西林注射剂49.阿洛西林注射剂21.林可霉素注射剂50.阿莫西林注射剂22.氧氟沙星注射剂51.哌拉西林钠他唑巴坦钠注射剂23.紫杉醇注射剂52.氨苄西林钠舒巴坦钠注射剂24.胸腺肽注射剂53.丙泊酚注射剂25.利多卡因注射剂54.甲氧氯普胺注射剂26.莪术油注射剂55.骨肽注射剂27.阿昔洛韦注射剂28.阿米卡星注射剂中药13.莲必治注射剂1.双黄连注射剂14.灯盏花素注射剂2.鱼腥草注射剂15.生脉注射剂3.清开灵注射剂16.舒血宁注射剂4.刺五加注射剂17.茵栀黄注射剂5.参麦注射剂18.苦碟子注射剂6.脉络宁注射剂19.红花注射剂7.香丹注射剂20.丹参注射剂8.黄芪注射剂21.丹香冠心注射剂9.丹参注射剂22.血栓通注射剂10.血塞通注射剂23.柴胡注射剂11.灯盏细辛注射剂24.丹红注射剂12.复方丹参注射剂25.痰热清注射剂。
化学药品注射剂质量及稳定性研究与风险控制(霍秀敏)

17
方法适用性:辅料、杂质等干扰 方法的修订:试验或文献依据
新建立的方法:明确方法选择的依据,并进行 详细的方法学研究,验证方法的可行性
18
与具体品种相关的检测方法
例如:鉴别、有关物质检查、含量测定等 方法的建立与验证可参考相关的指导原则:
《化学药物质量标准建立的规范化过程技术指导原则》
《化学药物质量控制分析方法验证技术指导原则》 《化学药物杂质研究的技术指导原则》 《中国药典》附录中有关的指导原则
21
关注问题:杂质限度
创新性药物:基于杂质安全性评价的结果
国外上市但国内未上市药物: 基于国外上市产品的杂质检测结果、质量标准的控 制要求,原则上限度的控制不能低于国外上市产品的 要求
如果达不到国外上市产品的控制要求,或无法获得 国外上市产品的质量控制信息,参照创新性药物的要 求,进行相应的安全性研究
中国尚未上市
31
杂质问题
--杂质研究的原则性要求
建立合适的分析方法
进行充分的方法验证 确定合理的限度要求
32
杂质研究的突出问题 --检测方法的建立缺乏针对性,验证不规 范,不能有效检出产品中的杂质 --杂质限度的确定缺乏科学依据,杂质质 控难以保证产品安全性
33
100
80
方法对结果的影响 0.5% vs. 2.0%
22
国内上市药物及其改剂型、改盐品种:
必须与上市产品(原则上为原发厂产品)通过质量 对比研究确定限度的合理性;杂质的种类和含量应不 多(高)于已上市产品 如果杂质种类增多、含量增加,则应通过加强原辅 料质量控制、优化处方工艺等降至上市产品规定的质 控限度内;仍达不到要求,则进行必要的安全性研究
如果上市产品杂质限度的确定依据也不充分,则不 宜通过对比研究确定研制产品的限度
大容量注射剂工艺风险点

大容量注射剂工艺风险点
本次风险评估结论:主要高风险点存在于配料、洗瓶、胶塞清洗、灌装、灭菌、注射用水系统,生产中应做为检查监控的重点,车间质监员应将所有中等风险和高风险点作为质量控制点,在每批的生产中检查记录。
对所有已知的风险均采取了针对性措施:硬件方面从设计、安装杜绝风险的发生,软件方面通过文件规定、培训、检查监控来降低风险。
所有工艺设备和设施是为消除、控制上述风险设计并建设的。
所有生产设备和工艺都经过了验证,并规定了再验证周期。
公司的管理团队有丰富的注射剂生产管理经验和专业技术知识,有能力控制各种偶发的质量风险,保证有质量风险的产品不流入市场,产品的质量风险是完全可以控制的。
SFDA关于开展注射剂类药品生产工艺和处方核查工作的通知国食药监办[2007]504号
![SFDA关于开展注射剂类药品生产工艺和处方核查工作的通知国食药监办[2007]504号](https://img.taocdn.com/s3/m/996f378b02d276a200292e63.png)
在此次核查工作中, 对药品生产企业经过充分的 研究和验证而改变药品生产工艺和处方 , 且产品质量
能够得到保证的品种 , 各省局应要求生产企业按照相
1 2
维普资讯
2 0 o 7年 9月 1 日 、_ . N 5 5 71 07
一
关规定提交药品注册补充 申请 。 药品审评部门应当在 规定的时限内完成技术审评工作 。
四、 各省局应高度重视注射剂类药品生产工艺和 处方核查工作, 充分认识开展核查工作对降低药品安 全风 险确保人 民用药安全的重要意义 , 充分认识核查 工作 的紧迫性、复杂性和长期性 ,要切实加强领导 ,
一
三、药品生产企业作为药品安全第一责任人, 必
、
须对所生产的药品质量负责 , 必须按照要求如实 申报
注射剂类药品生产工艺和处方情况 。凡隐瞒事实 , 不 如实 申报生产工艺和处方 , 或者改变生产工艺和处方 仍不按规定提交药品注册补充申请的, 一经发现要坚
决查处 。
通过开展注射剂类药 品生产工艺和处方核查工 作, 进一步规范企业改变工艺和处方的研究和申报行 为, 排除注射剂类药品质量安全隐患 , 确保药品生产 质量 ,防 止严重 质量 事 故 的发生 。 药品生产企业必须严格按照注册 申报的生产工 艺、处方和 G MP要求组织生产 ,改变工艺和处方必 须按规定进行研究并依法申报 。
、
落实责任 , 制定切实可行 的实施方案, 确定牵头部门, 按照 实事求是的原则做好注射剂类药品生产工艺和 处方 的核查 工 作 。
国家局将对核查工作进行督查。 各省局在开展核 查工作中有何 问题 , 请及时与国家局药品安全监管司
联系。
艺和处方。 各省局应在 2 0 0 7年底前完成大容量注射 剂类药品生产工艺和处方核查工作并上报工作情况 ; 2 0 年 6月底前完成并上报其他静脉给药注射剂类 08 药品的核查工作 ; 其他类药品的核查工作 ,由各省局 根据辖区内的实际情况做出安排 , 核查工作进展及完 成情况应及时汇总并上报国家局。 二、 各省局应做好注射剂类药品生产工艺和处方 核查的宣传工作 , 加强与药品生产企业的沟通 , 动员
高风险药物分类目录

高风险药物分类目录引言高风险药物是指使用过程中存在潜在风险,可能对人体产生重大不良反应或者危害的药物。
为了确保医疗安全和减少患者的不良事件发生,对高风险药物进行分类和管理显得尤为重要。
本文档旨在梳理常见的高风险药物分类目录,以提供给医疗从业人员参考和使用。
分类目录本文档将常见的高风险药物分为以下几类:类别一:麻醉药物麻醉药物是高风险药物的典型代表之一,使用不当可能导致意识丧失、呼吸抑制等严重后果。
常见的高风险麻醉药物包括:芬太尼丙泊酚吗啡类别二:心血管药物心血管药物使用不当可能导致血压波动、心律失常等严重后果。
常见的高风险心血管药物包括:异丙肾上腺素硝酸甘油洋地黄类别三:抗生素抗生素是高风险药物中常用的一类,错误的使用可能导致耐药性增加、肝肾损害等不良效果。
常见的高风险抗生素包括:青霉素类大环内酯类链霉素类类别四:抗凝药物抗凝药物使用不当可能导致出血等严重后果。
常见的高风险抗凝药物包括:___肝素纳迪拉酮类别五:免疫抑制剂免疫抑制剂是高风险药物中常用于器官移植术后等情况的一类,若使用不当可能导致免疫功能下降、感染等严重后果。
常见的高风险免疫抑制剂包括:氟昔明噻克酸环孢素管理措施为了降低高风险药物的风险,医疗机构和从业人员应该采取以下管理措施:1.建立药物分类目录并进行定期更新。
2.对高风险药物进行特殊管理,例如限制开药、设置双人核对等。
3.组织开展相关培训,确保从业人员对高风险药物的正确使用和处理有足够的知识和技能。
4.建立不良事件监测和报告机制,及时发现和处理高风险药物使用中的问题。
结语高风险药物的分类目录对于医疗安全至关重要。
有针对性地管理和使用高风险药物,可以减少患者不良事件的发生,保障医疗质量。
医疗机构和从业人员应该将本文档提供的高风险药物分类目录作为参考,并采取相应的管理措施,以提高医疗安全水平。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附件1:
部分化学药品注射剂高风险品种及其风险因素
附件2:
附件3:
部分有严重不良反应报告的注射剂品种名单
(按2006年报告数降序排列)
化学药品29.庆大霉素注射剂
1.头孢曲松注射剂30.氟罗沙星注射剂
2.青霉素注射剂31.利巴韦林注射剂
3.克林霉素注射剂32.炎琥宁注射剂
4.左氧氟沙星注射剂33.复方氨林巴比妥注射剂
5.头孢噻肟钠注射剂34.奥沙利铂注射剂
6.头孢派酮钠舒巴坦钠注射剂35.葛根素注射剂
7.阿奇霉素注射剂36.甲硝唑注射剂
8.加替沙星注射剂37.甲氨喋呤注射剂
9.头孢拉定注射剂38.磷霉素注射剂
10.头孢哌酮注射剂39.环丙沙星注射剂
11.头孢唑林钠注射剂40.顺铂注射剂
12.穿琥宁注射剂41.美洛西林注射剂
13.头孢呋辛注射剂42.复方氨基比林注射剂
14.多西他赛注射剂43.碘普罗胺注射剂
15.复方氨基酸注射剂44.甘露醇注射剂
16.维生素K1注射剂45.环磷酰胺注射剂
17.头孢他啶注射剂46.洛美沙星注射剂
18.硫普罗宁注射剂47.细辛脑注射剂
19.右旋糖酐40注射剂48.碘海醇注射剂
20.氨苄西林注射剂49.阿洛西林注射剂
21.林可霉素注射剂50.阿莫西林注射剂
22.氧氟沙星注射剂51.哌拉西林钠他唑巴坦钠注射剂
23.紫杉醇注射剂52.氨苄西林钠舒巴坦钠注射剂
24.胸腺肽注射剂53.丙泊酚注射剂
25.利多卡因注射剂54.甲氧氯普胺注射剂
26.莪术油注射剂55.骨肽注射剂
27.阿昔洛韦注射剂
28.阿米卡星注射剂
中药13.莲必治注射剂
1.双黄连注射剂14.灯盏花素注射剂
2.鱼腥草注射剂15.生脉注射剂
3.清开灵注射剂16.舒血宁注射剂
4.刺五加注射剂17.茵栀黄注射剂
5.参麦注射剂18.苦碟子注射剂
6.脉络宁注射剂19.红花注射剂
7.香丹注射剂20.丹参注射剂
8.黄芪注射剂21.丹香冠心注射剂
9.丹参注射剂22.血栓通注射剂
10.血塞通注射剂23.柴胡注射剂
11.灯盏细辛注射剂24.丹红注射剂
12.复方丹参注射剂25.痰热清注射剂。
