分离工程课件第4讲
《化工分离工程》PPT课件-第4讲分离过程
y i = K i xi
C
i = 1,2,..., C
C
(2)摩尔分率加和方程: 2个 摩尔分率加和方程:
∑x
i =1
i
= 1 .0
∑y
i =1
i
= 1.0
2C+ 2C+2 C个
(3)汽液平衡常数关联式: 汽液平衡常数关联式:
Ki = f (T , P, x, y)
i = 1,2,...,C
变量数: 变量数:
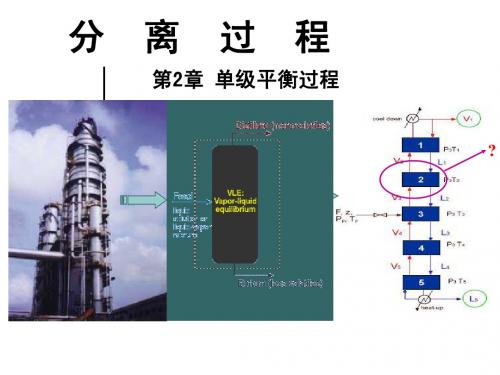
泡点和露点计算在设计计算中应用
精馏塔各级温度确定
泡点和露点计算在设计计算中应用
精馏塔操作压力的选择
① 塔顶蒸汽的冷凝温度和釜液的 沸腾温度 ② 对组分相对挥发度的影响 ③塔的造价和操作费用 ④对传质效率的影响
计算出发点: 计算出发点:
单级汽液平衡系统, 单级汽液平衡系统,汽液相具有相同的温度T和压力p, 组分的液相组成与汽相组成成平衡关系。 组分的液相组成与汽相组成成平衡关系。 (1)相平衡方程: 相平衡方程: 计 算 方 程: C个
( new )
yi
yi(old ) = (old ) ∑ yi
(3)判断收敛的准则或者是温度的调节方案直接 ) 关系到收敛速度和稳定性。 关系到收敛速度和稳定性。
二、泡点压力的计算
仍然依据的是泡点方程: 仍然依据的是泡点方程:
f ( p ) = ∑ K i xi − 1 = 0
i =1 C
当汽相为理想气体,液相为理想溶液时: 当汽相为理想气体,液相为理想溶液时:
f (T ) = ∑ K i xi − 1 = 0
i =1 C
泡点温度计算
泡点压力计算
一、泡点温度的计算
1. Ki与组成无关: 与组成无关: 泡点方程: 泡点方程: 假定T 假定
化工分离工程教学PPT--04

过程传质分离过程的严格模拟计算主要内容及要求:学习并掌握多组分多级分离过程的平衡级理论模型的建立及求解。
重点:泡点法(BP法)、流率加和法(SR 法)。
第五章传质分离过程的严格模拟计算5.1 平衡级的理论模型5.2 三对角矩阵法5.3 同时校正法5.4 多组分分离非平衡模型3☐多组分精馏过程简捷计算☐多组分吸收过程简捷计算1lg )1lg(---=A A N ϕϕ⏹⏹特殊精馏,多组分吸收,多组分萃取等过程也stream flow rates, stream compositions, and heatprocedures maywhen multicomponent physical properties stage efficiencies are not reasonably严格计算的原则:在给定的条件下,对每块塔板同时进行物料衡算,热量衡算及相平衡和归一化计算。
Aspen Plus,HYSIM,ProII等。
5.1 平衡级的理论模型U j W jF j L j V j L j-1V j+1Q j z i,j ,H F,j ,T F,j ,p F,jy i,j+1,H j+1,T j+1,p j+1x i,j ,h j ,T j ,p jx i,j-1,h j-1,T j-1,p j-1y i,j ,H j ,T j ,p j 第j级平衡级General equilibrium stageASSUME THAT:(1) PHASE EQUILIBRIUM IS ACHIEVED AT EACH STAGE各级上达到相平衡(2) NO CHEMICAL REACTIONS OCCUR无化学反应(3) ENTRAINMENT OF LIQUID DROPS IN VAPOR AND OCCLUSION OF VAPOR BUBBLES IN LIQUID ARE NEGLIGIBLE忽略雾沫夹带假定各级上达到相平衡且无化学反应。
化工分离工程PPT课件

7.1.1 分离用膜和膜分离设备
一、膜种类
二
天然膜 生物膜
、
天然物质改性膜 人工膜 无机膜 金属膜
设 备
非金属膜 有机膜 均质膜
微孔膜
管卷板 式式框
式
非对称性膜
复合膜
离子交换膜
➢ 膜性能:
1.分离透过性
a. 透过通量
单位时间通过单位膜面积的物理量。
b. 分离效率 用截留率表示: (R)
截留率:表示膜对溶质的截留能力,可用
操作中:
阳膜中带负电荷的基团“R SO3 ” 吸引溶液中带正电荷的离子,排斥带负电荷 的离子;
阴膜中带正电荷的基团“R N (CH3 )3 ” 吸引带负电荷的离子,排斥带正电荷的 离子
这种现象称:反粒子迁移
即:与膜所带电荷相反的离子穿过膜的现象 称反粒子迁移。
+++++++++++
1
Na
新型分离技术
第一节 膜分离技术 第二节 吸附分离 第三节 反应精馏
第一节 膜分离技术
➢ 膜的作用:
选择渗透
➢ 适用:
1.热敏性物质 ——可常温操作
2.特殊溶液 ——可用于大分子、无机盐、蛋
白质溶液等
第一节 膜分离技术
7.1.1 7.1.2 7.1.3 7.1.4 7.1.5
分离用膜和膜分离设备 反渗透 超滤与微滤 电渗析 其它膜分离
J — 时间时的渗透通量 kg / m 2 h m — 率减系数(小数)
2. 物化稳定性
强度、耐温、耐压性等
二、分离设备 (1)板框式膜具
↑↑
(2)卷式膜具 由四层组成
生化分离工程第4讲 膜分离技术

Pont
业、造纸工业等
Enka/AKZO,Gambro,Asahi Chemical
血液渗析、工业 废液等
Amicon Corp.,Koch Eng.Inc., 制药工业、乳品
Nittl Denko
工业等
Permea/Air Prod.,Ube Ind., Hoechst/Celanese
医疗、燃烧过程 等
膜分离优点和缺点
➢ 在常温下进行 ➢ 有效成分损失极少,特别适用于热敏性物质,如抗生素等医药、果汁、酶、蛋白的分离与浓缩
➢ 无相态变化 保持原有的风味,能耗极低,其费用约为蒸发浓缩或冷冻浓缩的1/3-1/8
➢ 无化学变化 典型的物理分离过程,不用化学试剂和添加剂,产品不受二次污染
➢ 选择性好 可在分子级内进行物质分离,具有普遍滤材无法取代的卓越性能
10. 亲和膜分离技术概念及特点 • 11 . 电渗析的工作原理 • 12.膜的污染与处理?
膜科学的发展史
年代
科学家
主要内容
1748 1827
Abbe Nollet Dutrochet
水能自发地穿过猪膀胱进入酒精溶液,发生 渗透现象
名词渗透作用(Osmosis)的引入
1831
J.V.Mitchell 气体透过橡胶膜的研究
硝酸纤维膜的出现。
初次成功使用了人工肾 合成膜的研究,发明了电渗析,微孔过滤和血液透析等 分离工程 相转化法制出了非对称反渗透膜 发明了液膜 制出了界面反应聚合复合膜
膜工业的发展史
分离过程 年代
目前主要厂商
应用
微滤 电渗析 反渗透
渗析 超滤 气体分离 渗透汽化
1925 1960 1965 1965 1970 1980 1990
分离工程(黄国文)第七章 其它分离方法4-116页精选文档

o 变压吸附。降低压力或抽真空使吸附剂脱吸,利用压力的 变化完成循环操作。
o 变浓度吸附。液体混合物中的某些组分在环境条件下选择 性的吸附,然后用少量强吸附性液体脱吸再生。
例 双塔式变压吸附空气分离制氮的原理
吸附性能
物理吸附
化学吸附
作用力 分子引力(范德华力)
剩余化学键力
选择性 吸附层 吸附热
没有选择性
有选择性
单分子或多分子吸附 层
只能形成单分子吸附层
较小,⋖4.9kJ/mol
较大,相当于化学反应热, 83.7-418.7kJ/mo化能 较慢,需要活化能
放热过程, 低温有利于吸附 可逆,较易解析
除去的污染物
染料
进水中有机物浓度,
温度升高,吸附速度增加 化学键大时,吸附不可逆
工业吸附对吸附剂的要求
(1) 吸附面积大 吸附能力强
(2) 选择性高 一次吸附的分离完全
(3) 机械强度好 抗磨损
(4) 满足一般的工业要求 化学稳定性、热稳定性、对流体的阻力小、价廉易得
常用吸附剂
(1) 活性炭: 非极性吸附剂,具有疏水性,可用于溶剂蒸气 的回收,油品和糖液的脱色,水的净化以及气体的脱臭。 (2) 分子筛: 强极性吸附剂。多用于气体或液体的干燥和精 制,混合物的吸附分离等。
吸附等温线:在恒定温度下,平衡时吸附剂的吸附量 q 与气 (液)相中的吸附质组分分压 p (或吸附质浓度C) 的关系曲线。
q 通常用Kg吸附质/Kg吸附剂表示,简写成 Kg • Kg-1
0.8
吸 0.6 附 量 q 0.4
0.2
C C l4 苯
分离工程课件

问 题
传递过程
单元操作和 传递过程研
过程的速率与 传递机理
究的问题
单元操作侧重
分离工程研究应用质量传递原理实现组分分离
过程的设备与
的基本原理及工程化问题
工程问题
§ 1.1 分离工程理论的形成和特征
Formation and feature of separation process theory
二、 工业生产中的分离过程
长 的 时 间 隧 道,袅
结束
● 原料:石脑油 沸程120~230K
●加氢重整后得到:轻油 非芳烃 苯 甲苯 二甲苯 高级芳烃
目的产物为对 二甲苯
● 特点:
沸点℃ 熔点℃
邻二甲苯
144.411 ﹣25.173
间二甲苯
139.104 ﹣47.872
对二甲苯 138.351 13.263
● 涉及到分离过程: 精馏:脱丁烷塔、甲苯塔、二甲苯回收塔
混合物 (气、液、固) 分 离 过 程
产品1 产品2 产品n
能量分离剂 ESA 物质分离剂 MSA
借助一定的分离剂,实现混合物中的组分分级、浓缩、富 集、纯化、精制与隔离等的过程称为分离过程。
分离剂:能量分离剂 ESA 、物质分离剂 MSA
① 能量分离剂 ESA:指传入或传出系统的热及输入 或输出系统的功。闪蒸、冷凝、精馏等。
三、 分离技术的特性
(3) 分离技术的复杂性
缺乏基础物性数据 缺乏大型塔器的可靠设计方法
化工分离技术新的挑战
能源,原料和环境保护
§ 1.2 分离过程的特征与分类
Classification and features of separation process
分离工程--第四章PPT

10.1.4 反胶团的溶解作用
由于反胶团内存在微水池,故可溶解氨基酸、肽和蛋白 质等生物分子,为生物分子提供易于生存的亲水微环境。 因此,反胶团萃取可用于氨基酸、肽和蛋白质等生物分 子的分离纯化,特别是蛋白质类生物大分子。关于反胶 团溶解蛋白质的形式,有人提出了四种模型,如图所示。 其中(a)为水壳模型,蛋白质位于水池的中心,周围存 在的水层将其与反胶团壁(表面活性剂)隔开;(b)蛋白 质分子表面存在强烈疏水区域,该疏水区域直接与有机 相接触;(c)蛋白质吸附于反胶团内壁;(d)蛋白质的疏 水区与几个反胶团的表面活性剂疏水尾发生相互作用, 被几个小反胶团所“溶解”。表面性质不同的蛋白质可 能以不同的形式溶解于反胶团相,但对于亲水性蛋白质, 目前普遍接受的是水壳模型。
阴离子表面活性剂形成的反胶束体系,情况正好相反。 此外,离子型表面活性剂的反离子并不都固定在反胶束 表面,对于AOT反胶束,约有30%的反离子处于解离状 态,同时,在反胶束“水池”内的离子和主体水相中的 离子会进行交换,这样,在萃取时会同蛋白质分子竞争 表面活性剂离子,从而降低了蛋白质和表面活性剂的静 电作用力。另一种解释则认为离子强度(盐浓度)影响蛋 白质与表面活性剂极性头之间的静电作用力是由于离解 的反离子在表面活性剂极性头附近建立了双电层,称为 德拜屏蔽,从而缩短了静电吸引力的作用范圈,抑制了 蛋白质的萃取,因此在萃取时要尽量避免后者的影响。 (2)位阻效应 许多亲水性物质,如蛋白质、核酸及氨基 酸等,都可以通过溶入反胶束“水池”来达到它们溶于 非水溶剂中的目的,但是反胶束“水池”的物理性(大小、
分离工程概述(ppt 58张)

Q W
进出系统物流变量: n,zi,H,S,Q
系统对环境作功: W
(2015-2016第2学年)
吉林大学 珠海学院
分离工程
按热力学第一定律: (能量守恒) n Q n W ( 6 1 ) jH j kH k
进 出
设等温可逆过程: Q T [ n S n ( 6 2 ) k k jS j]
非理想溶液: E E Q ( W ) n H n H min , T k k j j
出 进
(2015-2016第2学年)
吉林大学 珠海学院
分离工程
非等温分离: 系统的净功(总功):
过程可逆时,可得最小分离功:
(2015-2016第2学年)
吉林大学 珠海学院
分离工程
6.1.3 净功消耗和热力学效率 通常,分离过程所需的能量多半是以热能形式 而不是以功的形式提供的。 一般以W净计算能量: 净功学院
分离工程
有效能定义: B H T S 代入( 6 17 ) 0 T 0 n B n B T S ( 1 Q W ( 6 18 ) kk j j 0 产生 ) S T 出 进 由卡诺循环,可逆热机 等当功: T 0 W Q ( 1 ) (温度为 T 的热源向 T 环境传热所作 C 0 T
出 进
BF HF T 17601 .88 kJ/ kmol 0SF
W W W 入 出 净 T T 0 0 Q ( 1 ) Q ( 1 ) 6387113 . 3 kJ /h R C T T R C
B 分离23 .23 % W 净
(2015-2016第2学年)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1)
P i Pyi P i P i i xi
0
Pyi i 0 P i xi
方程(2) 方程(1)
(2)
计算 过程:
平衡数据 xi , yi i A 12 , A 21
注意:
此方法只要有一个平衡点的数据
(在一定的温度压力下,与一定的液相组成呈平衡的气相组成)
即可求出端值常数。 但是为了差少偏差,通常采用多组数据求平均值。 例题:102页2-6,2-7
ai i xi
E 则Gm x1RT ln a1 x2 RT ln a2 RT( x1 ln x1 x2 ln x2 )
x1RT ln 1x1 x 2 RT ln 2 x2 RT x1 ln x1 x2 ln x2 RT x1 ln x1 x2 ln x2 RT x1 ln 1 x2 ln 2 RT x1 ln x1 x2 ln x2
i 1 为理想体系; (3)当 A12 A21 0 时,
2 ln 1 Ax2
当 A12 0, A21 0时, i 1 为负偏差非理想体系;
i 1 为正偏差非理想体系。 当 A12 0, A21 0时,
A可用来判别实际溶液与理想溶液的偏离度 (4)由 ln i A12 , A21
E nGm RT ln i n i
T , P , n j i
求 i f ( xi )过程:
E (1)已知Gm 数学模型 E nGm ( 2)求 n i
T , P , ni n j
(3)通过上式得 i
3-2 双组分系统活度系数关联式
二、用恒沸物数据确定
已知: (1)恒沸体系 xi yi (2)存在恒沸物时的 T , P 求: A
计算过程:
0
Pyi i 0 P i xi
方程(3)
P i 0 P i
(3)
P, P i i xi
x2 ln 2 2 A12 (1 ) ln 1 x1 ln 1
方程(1)
目 录
第2 1周第4 2次课2014 2006年9月25 2008 20日 11
(摩尔)过剩自由焓:表示在恒温恒压下 由纯组分形成1mol实际溶液与形成1mol 理想溶液的混合自由焓的差值
3-1 过剩自由焓
实际溶液混合焓
E Gm G实际 G理想
G 表示在恒温恒压下由纯组分生成1mol溶液过程中自由 0 焓的变化称为混合自由焓。 i RT ln ai i ai i xi 对于理想溶液: 0 理想 i RT ln xi i G G G
ln 1 ln 1 A12
( x1 0 或 x2 0)
A12
A21
lim
x2 0
ln 2 ln 2 A21
(2)当 A12 A21 A 时, 此二元系统称对称系统, 变为单参数的对称方程:
ln 1 A x Ax
2 12 2
2 2
ln 2 A21 x12 Ax12
A12 (1 x2 ln 2 2 ) ln 1 x1 ln 1
(5)式中ln不能换成lg
x1 ln 1 2 A21 (1 ) ln 2 x2 ln 2
(6)范拉尔方程式没有考虑T,P的影响。
※2. 马格勒斯(Margules)方程: (1)双组分
Q
G
E m
--------范拉尔方程式(二参数方程) 参数 A12 , A21 称范拉尔常数,也称端值常数
(与组成无关,但是受温度和压力影响,一般压力对液体性质影响很 小,可忽略,温度不能忽略,但是当系统沸点范围很小,也可忽略)
由二元气液平衡数据确定
讨论:(1) A的物理意义
在无限稀释情况下
lim
x1 0
0 =( x11 x2 2 ) ( x110 x2 2 )
0 0 0 0 x ( RT ln x ) x ( RT ln x ) ( x x 1 2 2 2 1 1 2 2) 1 1
理想溶液混合焓
混后
混前
=RT ( x1 ln x1 x2 ln x2 ) RT xi ln xi
RTx1 ln 1 x2 ln 2 RT xi ln i
E 讨论:( 1)当 i 1时Gm 0(理想溶液) E (2)当 i 1时Gm 0(正偏差溶液) E (3)当 i 1时Gm 0(负偏差溶液)
E Gm RT xi ln i
(d)没考虑T, P影响
3. 威尔逊(Wilson)方程:
Q
E Gm
式中 12和 21 叫威尔逊参数,其定义为:
x1 21 x2 ln 1 1 lnx1 12 x2 x1 12 x2 x2 21 x1
RT
x1 ln(x1 12 x2 ) x2 ln(x2 21 x1 )
1
1 ln 12 21
1 ln 21 12
当 x2 0 时,ln 2
(2)当 12 1, 21 1 时,为理想体系; 当 12 1, 21 1 时,为负偏差非理想体系; 当 12 1, 21 1 时,为正偏差非理想体系。
12
21
Vm, 2 Vm,1
Vm,1 Vm, 2
12 11 exp RT
21 22 exp RT
ln (1)当 x1 0 时,
讨论:
x1 21 x2 ln 1 1 lnx1 12 x2 x1 12 x2 x2 21 x1
讨论(a)其他的活度系数按1 2 方式变换得到
x2 x3 A21 A13 A32 2 x1 ( A31 A13 ) 2 x3 ( A32 A23 ) C (1 2 x1 )
3 (b)当x3 =0时,为双组分马格勒斯方程
(c)C=0时为对称系统
(表征三组分系统性质的常数,由三组分系统平衡数据确定)
※1. 范拉尔方程:
Q
2
G
E m
ln 1
A12 A12 x1 1 A x 21 2
A12 A21 x1 x2 RT A x A x 21 2 12 1 A21 ln 2 2 A21 x2 1 A x 12 1
RT
x1x2 ( A21 x1 A12 x2 )
2 A12 2A21 A12 x1 ln 1 x2
ln 2 x A21 2 A12 A21 x2
2 1
(2)多组分(包括三组分)
ln 1 x22 A12 2 x1 A21 A12 x32 A13 2 x1 ( A31 A13 )
(4)当溶液为 nm ol 时
E nGm RT ln i n i
E nGm RT ni ln i
T , P , n j i
此式把任意组分 i 的活度系数和整个溶液的过剩自由焓 关联在一起,得过剩自由焓和活度系数间的基本关系式。 过剩自由焓可以判断实际溶液偏离理想溶液的程度。
对于上方蒸气符合理想气体的实际溶液:
G
实际
G混后 G混前 0 =( x11 x2 2 ) ( x110 x2 2 )
=RT ( x1 ln a1 x2 ln a2 ) RT xi ln ai
0 i RT ln ai i
0 0 0 0 x ( RT ln a ) x ( RT ln a ) ( x x 1 2 2 2 1 1 2 2) 1 1
可用来判别实际溶液与理想溶液的偏离度
注意: 1.
12 21 , ij ji但ij ji
适用范围很广,互溶溶液吻合较好 不足之处是不能用于部分互溶系统。
2. 该方程考虑了 T,P 的影响
3-3 端值常数的确定
一、由气液平衡数据确定
x2 ln 2 2 A12 (1 ) ln 1 x1 ln 1 x1 ln 1 2 A21 (1 ) ln 2 x2 ln 2
A12 , A21
作业 P150-2,4,9,10,
