二组分液液平衡系统相图
二组分气液平衡相图的测定

实验过程中的讲解(四)
实验数据记录要求和作图方法
1、把测得的数据填写在事先列好的数据表里; 2、填写数据要用钢笔或油笔,不得使用铅笔; 3、数据填写要真实、准确; 4、错误的数据不能用涂改液等随便涂改,可以 用笔划一下再在旁边写上正确的。 5、作图方法见教材第9页。
分析实验数据,讨论实验结果
二组分气- 液平衡相图愿始数据记录表
1、讲解阿贝折射仪的使用方法和注意事项 每次加入沸点仪的样品的浓度是否要一定,为什么?
2、调压器的电压要合适(多大?); 实验过程中要把握的重点
1、一定要在完全达到气-液平衡时才可取样测其折光率。
答:不需要,因为虽然加入沸点仪的样品的浓度不同会使样品的沸点发生变化,但是相对应的气液两相的组成也发生变化,不影响相
分析实验数据,讨论实验结果
沸点-组成图
85 80 75 70 65
1、该图为乙醇-环己烷的沸点组成图
2、最低共沸点为65.2℃,共沸 组成x=0.54
3、蓝线为气相线,以上为气 相;红线为液相线,以下为 液相;两线之间为气-液共 存区;两线有一切点。
沸点/C
60
0
0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9
1.3908
0.429
1.3968
0.502
1.3982
0.533
1.4021
0.542
1.4102
0.561
1.4167
0.617
1.4249
1.000
残掖试样 折光率(n) x环己烷 1.3602 0.000 1.3642 0.062 1.3689 0.109 1.3755 0.185 1.3888 0.354 1.3982 0.534 1.4107 0.745 1.4182 0.907 1.4205 0.935 1.4249 1.000
3.4 二组分系统固液平衡相图
t/℃
80
l(A+B)
•t
* B
液相线(凝固
60
点降低曲线)
• 40 t
* A
s(A)+l(A+B)
l (A+B)+sB
固相线
20 C
•E s(A)+s(B)
共晶线
D
(温度、三个相的
0.0 0.2 0.4 0.6 0.8 1.0 组成都不变)
邻硝基氯苯(A) xB
对硝基氯苯(B)
E点:液相能存在的
l+s s(A+B)
p/102kPa
t=60℃ l(A+B)
lg g(A+B)
d-香芹(A) wB
l-香芹(B)
图a 最高熔点液固相图
H2O(A)
yB
C2H5OH(B)
图b 最高恒沸点气液相图
2 液态完全互溶而固态完全不互溶
t/℃ 80
60
• 40 t
* A
20
C
•E
•t
* B
t/℃
•t
* A
p=101 325Pa
出的t-xB图,列表回答系统在5C,30C,50C时的
相数、相的聚集态及成分、各相的物质的量、系统所 在相区的条件自由度数。
解:
系统 相数
温度
t / C
5
2
相的聚集态 及成分
s (A), s (B)
30 2 s (B), l (A+B)
50 1
l (A+B)
各相的物量
ns(A) = 2 mol ns(B) = 8 mol
t
* B
l (A+B)
实验四二组分固-液平衡相图的测绘
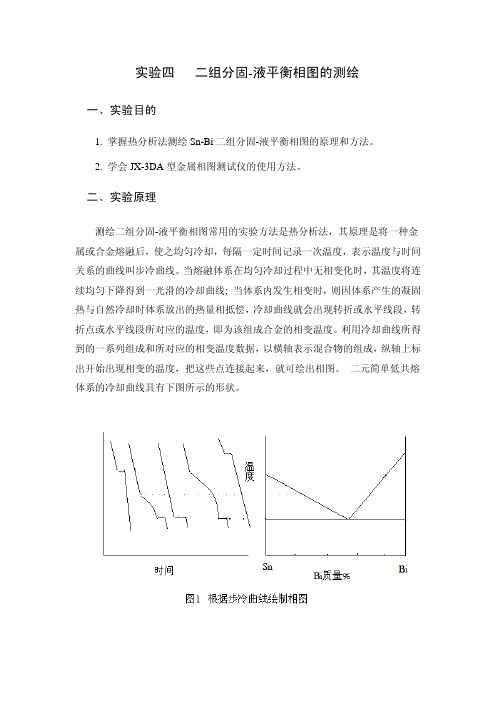
实验四二组分固-液平衡相图的测绘一、实验目的1. 掌握热分析法测绘Sn-Bi二组分固-液平衡相图的原理和方法。
2. 学会JX-3DA型金属相图测试仪的使用方法。
二、实验原理测绘二组分固-液平衡相图常用的实验方法是热分析法,其原理是将一种金属或合金熔融后,使之均匀冷却,每隔一定时间记录一次温度,表示温度与时间关系的曲线叫步冷曲线。
当熔融体系在均匀冷却过程中无相变化时,其温度将连续均匀下降得到一光滑的冷却曲线; 当体系内发生相变时,则因体系产生的凝固热与自然冷却时体系放出的热量相抵偿,冷却曲线就会出现转折或水平线段,转折点或水平线段所对应的温度,即为该组成合金的相变温度。
利用冷却曲线所得到的一系列组成和所对应的相变温度数据,以横轴表示混合物的组成,纵轴上标出开始出现相变的温度,把这些点连接起来,就可绘出相图。
二元简单低共熔体系的冷却曲线具有下图所示的形状。
用热分析法测绘相图时,被测体系必须时时处于或接近相平衡状态,因此必须保证冷却速度足够慢才能得到较好的效果(常用调压变压器或设置一定的保温功率控制电炉的冷却速度为6-8℃/min,因为小心控制冷却速度是实验成败的关键)。
此外,在冷却过程中,一个新的固相出现以前,常常发生过冷现象,轻微过冷则有利于测量相变温度;但严重过冷现象,却会使折点发生起伏,使相变温度的确定产生困难。
遇此情况,可延长dc线与ab线相交,交点e即为转折点温度。
三、仪器药品JX-3DA型金属相图测试仪1套;天平。
Sn(化学纯);Bi(化学纯);石墨粉;硅油四、实验步骤1. 样品配制用感量0.1g台称分别配制含铋0%,10%、30%、58%、70%、80%、90%和100%的铋锡混合物各100g分别置于对应的坩埚中,并在样品上方各覆盖一层石墨粉。
插入对应编号的热电偶(为改善导热性能应在热电偶套管内加些硅油)。
2. 测绘步冷曲线图3 JX-3DA型金属相图测试仪(1)按图3连接好各部件。
打开电源开关,预热10min。
二组分气-液平衡相图的测定

二组分气-液平衡相图的测定相图系指系统的相平衡状态图。
相图用图解的方法研究系统的相平衡行为,是相平衡热力学研究的重要手段之一。
相律只能给出系统的独立组分数、平衡共存相数和自由度数,而相图可以给出更加详尽得多的信息。
利用相图提供的信息,化学工程师可以进行工程(如精馏塔)设计及工艺操作(如利用盐-水系统相图进行盐类的精制);可以进行精馏分离或制备具有精确组成的标准样品(如恒沸蒸馏混合物);可以利用区域熔炼技术把金属提纯到极高的纯度,也可以把有机混合物或高分子混合物按照相对分子质量进行重新排布;利用二组分气-液平衡实验数据,结合实际溶液知识,可以测量实际溶液中溶剂或溶质的活度及活度因子。
合金相图是合金冶炼、金属热处理和表面处理的理论依据。
利用相图还可以估算纯组分的相变焓。
实验目的1.了解蒸馏法绘制具有恒沸点的二组分气-液平衡相图的原理与方法;2.了解阿贝折光仪的工作原理及样品折光指数的测量方法;3.用蒸馏法绘制无水乙醇-环己烷二组分气-液平衡相图。
实验原理由于系统性质的千差万别,系统的相图也各不相同。
大部分相图都靠实验测定。
目前,实验上测定相图的方法主要有三种:1、冷却曲线法(又称热分析法),此法一般用于具有较高相变温度的系统(如金属和合金相图)。
2、溶解度法,此法一般用于部分互溶凝聚系统(如苯胺和水的相图)。
3、蒸馏法,此法一般用于气-液平衡系统(如乙醇-苯相图)。
对于气-液平衡系统,按照蒸馏条件的不同,可分为蒸气压~组成图,即p~x图(恒温蒸馏)和沸点~组成图,即t~x图(恒压蒸馏)。
本实验测定常压下乙醇-环己烷的沸点~组成图,即t~x图。
因此,本实验的技术关键是如何正确测量所给系统的相平衡温度(沸点)和相平衡组成(气相组成,液相组成)。
仪器和药品平衡蒸馏仪一套(见图3-15);阿贝折光仪(附带超级恒温水浴);自偶调压器一台;放大镜一只;量筒、移液管、滴管等;环己烷(A·R);无水乙醇(A·R)。
4.3 二组分气-液平衡体系

五、完全不互溶双液体系--水蒸气蒸馏
如果两种液体在性质上差别很大,它们间 的相互溶解度很小,这样的体系可看作完全 不互溶的双液系。在这种体系中任一液体的 蒸气压与同温度单独存在时完全一样,并与 两种液体存在的量无关。溶液的总蒸气压等 于两纯组分饱和蒸气压之和。
即:
p p p
* A
* B
不管其相对数量如何,体系的总蒸气压P 大于任一纯组分的蒸气压,因此体系的沸点 必然低于任一液体的沸点。
(三)理想液态混合物的 p-x -y图
若将P=P*A+(P*B-P*A)xB 代入PyB=P*BxB 可得
Px yB * PA ( P P ) xB
* B B * * B A
(xA= 1-xB)
(yA =1-yB)
据此可以分别求得气相和液相的组成。 气相线总是在液相线的下面(见图)
这是 p-x 图的一种,把液相组成 x 和气相组成 y 画在 同一张图上即得 p-x-y 图
(一)产生正负偏差不大的体系
pB p B xA 如图所示,是对拉乌 yB p p 尔定律发生正偏差的情
* B
况,虚线为理论值,实 线为实验值。真实的蒸 气压大于理论计算值。 当正负偏差较小时,溶液 的总蒸气压介于两个纯组 分蒸气压之间。
如:CCl4-环己烷,CCl4-苯
一般偏差体系: p T一定
,
PB= P*BxB)
pA p xA yA p p
A B
pB p xB yB p p
y A p .x A y B p .xB
y A p .x A 若纯液体 B比纯液体A易挥发, y B p .xB 亦即p *> p *,则:
B A
1.双组份理想溶液的气液平衡相图
2.图中红色线为气相线t-y(露点线):它表
示混合液的沸点和平衡液相组成x之间的关系,此曲
线称为饱和液体线。
两组分溶液的气液平衡相图
1、温度-组成图(t-x-y图)
三个区域:
液相区:蓝线以下区域 过热蒸气区:红线以上区域 气液共存区:红线和蓝线包围的区域
两组分溶液的气液平衡相图
1、温度-组成图(t-x-y图)
两相区特点:
1.当两相温度相同时 y > x 2.当组成相同,t露点>t泡点
两组分溶液的气液平衡相图
1、温度-组成图(t-x-y图)
t/C
气相区
TB
露点
在总压一定的条件下,将组成为 xf
露点线
两相区
的溶液加热至该溶液的泡点 TA ,产 生第一个气泡的组成为 yA1,此时液 相组成为XA1。
TA
泡点
化学单元操作
两组分溶液的气液平衡相图
东明县职业中专
两组分溶液的气液平衡相图
1
Contents
温度-组成图(t-相图(y-x图)
两组分溶液的气液平衡相图
双组分理想溶液的气液平衡关系用相图表示比 较直观、清晰,而且影响蒸馏的因素可在相图上直 接反映出来。蒸馏中常用的相图为恒压下的温度组成( t-x-y )图和气相-液相组成( x-y )图。
两组分溶液的气液平衡相图
1、温度-组成图(t-x-y图)
t-x-y 图代表的是在总压 P 一定的条件 下,相平衡时气(液)相组成与温度 的关系。x、y均指易挥发组分的摩尔 分数。
两组分溶液的气液平衡相图
1、温度-组成图(t-x-y图)
两条线:
1.图中蓝色线为液相线t-x(泡点线):它表
示混合液的沸点和与液相平衡的汽相组成y之间的关 系,此曲线称为饱和蒸气线。
物化实验 二组分体系气液平衡相图绘制
实验四二组分体系气液平衡相图一.实验目的1.了解液体沸点的测定方法。
2.掌握温度计的露茎校正方法。
3.掌握阿贝折光仪的原理及使用方法4.测定环己烷——乙醇二元系统气液平衡数据,给出沸点组成图。
二.实验原理常温下两液态物质混合构成的体系称为双液系。
若该双液系能按任意比例混合成为一相则称为完全互溶双液系。
若只能在一定比例范围内混合成为一相,其它比例范围内为两相则称部分互溶双液系。
环己烷——乙醇体系是完全互溶双液系。
液体的沸点是指液体的蒸气压和外压相等时的温度。
在一定外压下纯液体的沸点有确定值。
但是双液系沸点不仅与外压有关还随双液系的组成的改变而改变。
同时,在一般情况下双液系蒸馏时的气相组成和液相组成并不相同,因此原则上可通过反复蒸馏即精馏的方法分离双液系中的两液体。
但是当双液系具有恒沸点时,不能用单纯蒸馏的方法分离两液体。
如图4.1所示,本实验所用体系环己烷——乙醇的温度组成图是一个典型的具有最低恒沸点的相图。
若将组成在恒沸点处的体系蒸馏时气相组成和液相组成完全一样,因此在整个蒸馏过程中沸点也恒定不变,无法通过蒸馏的方法分离两组分。
恒沸点和恒沸混合物的组成还和外压有关,因此在不同外压条件下实验时所得双液系的相图也不尽相同,通常压力变化不大时恒沸点和恒沸混合物的组成的变化也不大,在未注明压力时一般均指外压为101.325kPa。
图4.1 具有最低恒沸点体系相图示意图本实验采用回流冷凝法测定环己烷——乙醇溶液在不同组成时的沸点。
由于液体沸腾时易发生过热现象,同时气相又易出现分馏效应,因此沸点的准确测定不易。
本实验所用的沸点仪如图 4.2所示,称为奥斯默沸点仪,它是一支带有回流冷凝管的长颈圆底烧瓶,加热用的电热丝直接浸在溶液中,这样可以减少溶液的过热现象和防止暴沸。
冷凝管的底部有一个小球泡用以收集冷凝下来的气相样品,由于分馏作用会使获得的气相样品的组成与气液平衡时的气相组成发生偏差,为此须在吹制沸点仪时尽量缩短小球泡与烧瓶间的距离以减少分馏作用。
6-05 二组分真实液态混合物的气-液平衡相图
0.8 1.0 C6H6(B)
• 精馏分离原理
§66
xB
1 最 大 负 偏 差
0 A xB
1 B
0 A xB
1 B
0 A xB
1 B
§6-4 二组分真实液态混合物
1. 压力 组成图 压力-组成图
p
T一定 一定 最 大 正 偏 差
-
: , ( ), . 一定
p 0 T一定 一定 xB 1
最 大 负 偏 差
-
( ,
-
)
0 A xB
1 B
1. 压力 组成图 压力-组成图
140 t/℃ ℃ 120
p=101325Pa xB(G)=0.897 g xB(L)=0.897 g+l 78.15℃ ℃ l
* tB
* t A 100
g+l 80 60 40 0.0 0.2 H2O(A)
0.4 xB
0.6
0.8 1.0 C2H5OH(B)
最低恒沸点
•H2O(A) - C2H5OH(B) 系统的 温度 组成图 温度-组成图
60 50 p / kPa 40 30 * t =35 ℃ l L G p/102kPa /10 M
p
* B
1.1 t=55.1℃ xB(L)=0.36 ℃ 1.0 0.9
* pA 0.8
l
* pB
pA
20 10 0.0 A
g
P=0.75×105Pa × 0.7 xB(G)=0.36 0.6 0.0 0.2 CHCl3(A)
一般负偏差 t p一定 一定 一般 T p一定 一定 偏差
t
p一定 一定
g l
最 高 恒 沸 点
6-2二组分系统理想液态混合物的气—液平衡相图
(a)完全互溶
(b)完全不互溶 (c)部分互溶
液态完全互溶系统 p-x、t-x图
理想系统 真实系统
一般正偏差 最大正偏差
一般负偏差 最大负偏差
液态部分互溶系统 t-x图
气相组成介于两液相之间 气相组成位于两液相同侧
液态完全不互溶系统 t-x图
完全互溶系统:理想液态混合物系统气-液平衡相图
1. 压力—组成图
A、B形成理想液态混合物:均符合拉乌尔定律
A组分分压: pA pA* xA pA* 1 xB
B组分分压: pB pB* xB
pA,pB,p和xB均成
气相总压: p pA pB
直线关系
pA* 1 xB pB* xB
pA* pB* pA* xB
液相线:气相总压 p 与液相组成 xB 之间的关系曲线
nL
解: (1) 先确定系统点的总组成
xM
nB nA nB
6 46
0.6
利用
nG (xM yB ) nL (xB xM ) 即 nG (0.6 0.2) nL (0.7 0.6) (1)
nG nL n总 =4+6=10mol (2)
解得
nG =2mol
nL =8mol
(2) 气相中: 甲苯 nB nG yB 2 0.2 0.4mol 苯 nA nG yA 2 0.8 1.6mol
(4)最大负偏差系统
p实际 p理想
且在某一组成范围内比 难挥发组分的饱和蒸气 压还小,实际蒸气总压 出现最小值
液相线
氯仿(A)—丙酮(B)系统
加上气相线:
一般正偏差系统
一般负偏差系统
最大正偏差系统
液相线 气相线
3.2 二组分系统气液平衡相图
LG
定温连结线
80
t
* B
xl,B
l(A+B)
60
0.0
0.0 0.2 0.4 0.6 0.8 1.0
C6H5CH3(A)
xB
C6H6 (B)
图3-10 C6H5CH3(A) - C6H6 (B)系统的 沸点-组成图
15
0.0 t/℃
120
t
* A
100
80
60
yB 0.2 0.4 0.6 0.8 1.0
p/102kPa
(2) 蒸气压‐组成曲线有极值
0.0 0.2 1. 0
t=60℃ 0.8
0.6
0.4
pA*
0.2
xB 0.4 0.6
l(A+B) lg
0.8 1.0 xB=0.92
蒸气压有极大值,
yB=xB,气相线与液相 线相切
左半支:yB > xB pB* 右半支:yB < xB
g(A+B)
0.0 0.0 0.2
若pB* > p > pA*, 则 yB > xB, yA < xA. 可知:
饱和蒸气压不同的两种液体形成理想液态混合物成气液平衡时, 两相的组成并不相同, 易挥发组分在气相中的相 对含量大于它在液相中的相对含量.
气-液平衡时蒸气总压p与气相组成yB的关系: 结合式 p = pA* + (pB* - pA* ) xB 和式 yB = pB*xB /p 可得
• 从相图分析恒温降压变化过程.
• 与纯物质在恒温下有一定的饱和蒸气压不同, 由于液相在 气化过程中组成不断变化(剩余难挥发性组分愈来愈多), 使得其平衡蒸气压不断下降, 因而存在相变压力区间. 5
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 当体系的总组成(物系点)落在结线上时,体系两相共存。 • 且这两相的互比量(质量比)应遵守杠杆规则。
一、部分互溶液体的相互溶解度 •比如体系的总组成为 X 时,共轭溶液的组成分 别 为 X1 和 X2 , 而 这 两 个 相的互比量为:
Wl1 l1X Wl2 l2X
f= C + 1 = 22 + 1 = 1 右图中即为水-酚体系在恒压下的温度-组成图。
一、部分互溶液体的相互溶解度
• 图中ACB曲线以外的区域是单 相区,只有一个液相,自由度: f = C +1 = 2 1 + 1 = 2
(黄色阴影面)
• 在ACB曲线以内的区域是两相区, • 在此区域内有两个相互平衡的
或 :Wl 1 Xl2 Wl 2 Xl1
讨论
1. 在 50C 时,组成为 a 的溶液是酚在水中的不 饱和溶液。
• 如果在恒温度下往此溶液中加酚, 则体系的状态点(物系点) 将沿 a b 线向右移动;
当体系的总组成恰好落在ACB曲线上(即l1)时,体系中即 将出现组成为 X2 的另一液相 l2。
实用物理化学
目录图第表二章 相平衡
1 相律和相平衡的基本概念 2 单组分系统相平衡相图 3 二组分固-液平衡系统相图 4 气-液平衡系统相图 35 二组分液-液平衡系统相图 6 三组分平衡系统相图(自学)
第五节 二组分液-液平衡系统相图
【知识与能力目标】 1、理解部分互溶双液体系的相图 2、掌握水蒸气消耗系数及其物理意义
第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度 二、部分互溶液体的蒸馏 三、不互溶的液-液系统—水蒸气蒸馏
第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度
当两种液体性质上有明显的不同,体系的行 为比之理想溶液有很大的偏差时,会发生“部分互 溶”的现象,即一液体在另一液体中只有有限的溶 解度。
p 影响不大,通常是T-x图——溶解度曲线
第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度
例如
在通常温度下将少量的酚加入水中时,开始酚是 完全溶解的。
如果继续往水里加酚,在浓度超过一定数值以后, 就不再溶解。
这时溶液中出现两个液层,这两个液层是部分互 溶的饱和溶液,即:
一、部分互溶液体的相互溶解度
2.若某温度时有一组成为 d 的溶液,其状态点在ACB曲 线的外面,故此时只有一 个液相存在。
• 如果将此溶液冷却,则当温度降 低到 50C时,体系的状态点正
好落在ACB曲线的 l1 上,此时体 系即将出现另一液相 l 2;
温度继续降低,共轭溶液的组成会随之变改:
• l1 的组成向 A 方向移动;
7.5%
71.2% 7.5%
71.2% 7.5%
71.2% 7.5%
一、部分互溶液体的相互溶解度
部分互溶液体的温度-组成图 • 根据相律,在温度和压力一定的情
况下,共轭溶液的组成是确定的。 因为这时自由度: f= C + 0 = 22 + 0 = 0 • 而在压力一定的条件下,共轭溶液 的组成将随温度的不同而改变,因 为这时,自由度:
【教学重点】 1. 部分互溶双液系统的相图
【教学难点】 1.水蒸气蒸馏原理
第四节 二组分气-液平衡系统相图
一、 拉乌尔定律及理想溶液 二、 气相组成与液相组成 三、 非理想溶液对理想溶液的偏差 四、 蒸馏与精馏原理
第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度
当两种液体的性质差别较大时,可发生部分互 溶的现象,即在某温度范围内,两种液体的相互 溶解度都不大, 只有当一种液体的量很少,另一 种液体的量相对较多时,才能形成均匀的一相, 而在其它配比下,系统将分层而呈两个液相平衡 共存。此时将这两液相称为共轭溶液。
液相存在; • 自由度: f * = C +1 = 2 2 +1 = 1
(曲线ACB)
一、部分互溶液体的相互溶解度
在 50C 时,这两个相互 平衡的液相(即共轭溶液)
为l1 和 l2 ,其组成分别
为 X1 和 X2。
– X1 是酚在水中的饱和溶液组成;
– X2 是水在酚中的饱和溶液的组成。
71.2%<wB<100%
水的酚溶液
62.0%<wB<100% 50.0%<wB<100%
第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度
共轭溶液: T一定时,部分互溶的溶液浓度超过
一定范围,体系分Biblioteka 形成两个液相,当溶解达到 平衡时,这对彼此互相饱和的两个溶液。
◦ ① 酚在水中的饱和溶液; ◦ ② 水在酚中的饱和溶液。
表示在此温度以上,水与苯酚可以任意比例混溶而不分层,则C 点称为临界点,C点所对应的温度称为“最高临界溶解温度” 。
从上述图中可以看出:AC线相当于苯酚在水中的溶解度曲 线,BC线相当于水在苯酚的溶解度曲线
一、部分互溶液体的相互溶解度
水-苯酚系统溶解度图
线:(1)溶解度曲线;
• l2 的组成向 B 方向移动。
一、部分互溶液体的相互溶解度
如果升温,苯酚在水中的溶解度沿AC 线向上变化,水在苯酚中的溶解度沿 BC线向上变化,彼此的溶解度都增加。 如继续升温,则两层的组成逐渐接近, 最后汇集到C点,此时两层的浓度一样 而成单相溶液; 以C点以上,溶液成单相,自由度
F K 1 2 11 2
如果继续往此体系中加酚,则两个 液相的组成仍然为 X1 和 X2,但这 两个液相的互比量变化。随着酚的
不断加入,l1 相会减少,l2 相的量
会增加。当总组成为 X 时 :
• 当体系的总组成为 X2 时,l1 相恰好消失。
• 如果继续加酚至组成为 b 时,则体系中只有一个水在酚 中的不饱和溶液相了。
例如水(A)-苯酚(B): 在23.9℃及标准压力下,往水中逐渐加苯酚。
7.5%
0
7.5%
23.9 ℃ 0<wB<7.5%
酚的水溶液
50 ℃ 0<wB<11.5%
65 ℃ 0<wB<18.5%
71.2% 7.5%
71.2% 7.5%
71.2% 7.5%
7.5%<wB<71.2%
共轭溶液
11.5%<wB<62.0% 18.5%<wB<50.0%
