实验六组份合金体系相图的绘制
6物理化学实验金属相图.

七 数据处理
1. 根据记录的时间和温度绘 制步冷曲线图。
2. 找出各步冷曲线中拐点和
平台对应的温度值。
3. 以温度为纵坐标,以物质组成 为横坐标,绘出Sn—Bi金属相图。
Sn-Bi二元相图的绘制
0.3Bi b c a O A'
A
1.0Sn
0.6Bi
0.75Bi d e
1.0Bi
H
A 505
熔化物(单相)
H 546
F
F
C
B
C
G
Sn(s)+熔化物
熔化物+Bi(s)
D D' E
0.2
Sn 100%
D Sn(s)+Bi(s) 0.4 0.6
铋的质量分数
E
G
0.8
Bi 100%
Sn-Bi二元相图的绘制
八 实验成败的关键
(1)温度要适当,温度过高样品易氧化变质;温度过低或加 热时间不够则样品没有全部融化,步冷曲线转折点测不出。
(2)了解热电偶测量温度和进行热 电偶校正的方法。
三 实验原理
测绘金属相图常用的实验方法是热分析法,原理是将 一种金属或两种金属混合物熔融后,使之均匀冷却,每隔 一定时间记录一次温度,表示温度与时间关系的曲线称步 冷曲线。当熔融体系在均匀冷却过程中无相变时,温度将 连续均匀下降得一平滑的步冷曲线;当体系内发生相变则 因体系产生的相变热与自然冷却时体系放出的热量相抵消, 步冷曲线就会出现转折或水平线段,转折点对应的温度, 为该组成体系的相变温度。利用步冷曲线所得到的一系列 组成和所对应的相变温度数据,以横轴表示混合物的组成, 纵轴上标出开始出现相变的温度,把这些点连起来,就可 绘出相图。二元简单低共熔体系的冷却曲线具有图5-1所 示的形状
合金相图实验报告

含10%Sn 的合金的歩冷曲线由图可知:金属Bi 的熔点为:234.95℃金属Bi 和Sn 合金的最低共熔点为:136.82℃。
当压力p 一定时,而组分系统的相率表现形式为:Φ-=+Φ-=31K f因此,2131:=-==Φ→f B A ,组分为溶液相 1232:=-==Φ→f Bi C B ,和溶液共存,金属体系温度不变,和溶液共存,、金属金属,0333:=-==Φ→f Sn Bi D C 1232:=-==Φ→f Sn Bi E D ,共存,和金属金属2含Sn20%的合金 组数 1 2 3 4 5 6 7 8 9 10 11 12 时间/min 00.511.522.533.544.555.5温度/℃ 270 260 251 244 238 234 232 230 228 224 221 217 组数 131415161718192021222324时间/min 66.577.588.599.51010.51111.5温度/℃ 213 209 206 202 198 194 191 188 184 181 178 174 组数 252627282930313233343536时间/min 1212.51313.51414.51515.51616.51717.5温度/℃172 169 166 163 160 158 156 154 151 149 147 145含20%Sn 的合金的歩冷曲线由图可知:金属Bi 的熔点为:233.15℃金属Bi 和Sn 合金的最低共熔点为:140.00℃。
当压力p 一定时,而组分系统的相率表现形式为:Φ-=+Φ-=31K f因此,2131:=-==Φ→f B A ,组分为溶液相 1232:=-==Φ→f Bi C B ,和溶液共存,金属体系温度不变,和溶液共存,、金属金属,0333:=-==Φ→f Sn Bi D C 1232:=-==Φ→f Sn Bi E D ,共存,和金属金属3含Sn30%的合金组数 37 38 39 40 41 42 43 44 45 46 47 48 时间/min 1818.51919.52020.52121.52222.52323.5温度/℃ 143 142 141 142 141 141 140 140 139 139 138 137 组数 495051525354555657585960时间/min 2424.52525.52626.52727.52828.52929.5温度/℃137 136 135 133 131 129 127 125 123 121 119 117组数123456789101112时间/min 0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 5 5.5 温度/℃270263254247240235229224218214209204组数13 14 15 16 17 18 19 20 21 22 23 24 时间/min 6 6.5 7 7.5 8 8.5 9 9.5 10 10.5 11 11.5 温度/℃200196192188184181178174172169167165组数25 26 27 28 29 30 31 32 33 34 35 36 时间/min 12 12.5 13 13.5 14 14.5 15 15.5 16 16.5 17 17.5 温度/℃163162161159158156155153152150149147组数37 38 39 40 41 42 43 44 45 46 47 48 时间/min 18 18.5 19 19.5 20 20.5 21 21.5 22 22.5 23 23.5 温度/℃146145143142141141141141141141141141组数49 50 51 52 53 54 55 56 57 58 59 60 时间/min 24 24.5 25 25.5 26 26.5 27 27.5 28 28.5 29 29.5 温度/℃140140140140140139139139138138137136组数61 62 63 64 65 66 67 68 69 70 71 72 时间/min 30 30.5 31 31.5 32 32.5 33 33.5 34 34.5 35 35.5 温度/℃135132129127125123121119117115 113 111含30%Sn的合金的歩冷曲线由图可知:金属Bi 和Sn 合金的最低共熔点为:140.00℃。
实验二:二元合金组织观察

实验六:二元合金组织观察一、实验目的观察几种不同类型的二元合金显微组织,结合状态图分析讨论各类合金的组织特点二、实验说明1. Cu-Ni合金铜和镍两组元在液态及固态下都能无限互溶,在L+α两相区,自由度为1,结晶是在一个温度区内进行的(图5所示)。
任一Cu-Ni合金由液态极缓慢地冷却到室温时,可得到均匀的单相α固溶体,但在快速冷却(生产条件)时,扩散未能充分进行,使凝固过程偏离平衡条件而出现枝晶偏析,显微组织呈树枝状组织,枝干为富Ni的α(高熔点组元先凝固),枝间为富Cu的α(低熔点组元多)2. Pb-Sn合金Pb-Sn合金为液态下无限溶解,固态下有限互溶的共晶系(图6)。
当缓慢冷却时,合金按照相图平衡凝固。
合金Ⅰ为共晶组织(α+β),室温下全部为层片交替的共晶体,合金Ⅱ室温组织为β+(α+β)。
由于固溶体溶解度的变化,从初晶或共晶的α会析出β,(α+β)共晶保持共晶的特征,经4%硝酸酒精浸蚀,黑色为α相,白色为β3. Sn-Sb合金图7为Sn-Sb合金状态图,从图中可知,Sn-Sb在液态下完全互溶,在固态下有限互溶,具有如下两个包晶反应:其中β是金属化合物SnSb,冷却到325~320℃间转变为有序相β′;α是Sb在Sn中的固溶体;γ是Sn在Sb中的固溶体。
合金Ⅰ,室温显微组织为α固溶体的基体上分布由β′相,有时能看到β′呈枝晶状(达不到平衡条件所至)且在其上观察到αⅡ。
合金Ⅱ,冷却时首先析出γ固溶体,到425℃进行包晶反应,生成β相(包晶),反应结束仍有过剩液相,随后冷却过程,液相不断结晶成β,一直到结晶完毕,继续冷却β转变为β′。
若是平衡条件下最后得到均匀的单相组织β′。
但在包晶转变过程中,扩散极为困难,达不到平衡条件,所以当试样经4%硝酸酒精溶液浸蚀后,往往能看到白色的外包着灰色的β(富Sb)而基体为L转变成的β(暗黑色,富Sn)。
三、实验材料及设备1.典型试样(见下表)2.金相显微镜四、实验步骤及内容1.熟悉匀晶、共晶、包晶三类相图2.结合相图对已制好的典型试样进行观察3.绘制典型合金的组织示意图五、实验报告要求1.绘制六种典型合金的组织示意图,用箭头标明示意图中所示的组织,并注明处理状态、腐蚀剂和放大倍数。
湖北省大学生化学实验技能竞赛笔试题

湖北省大学生化学实验技能竞赛笔试题液体饱和蒸汽压的测定1.测量液体饱和蒸汽压的实验中,下列说法不正确的是。
A.测量液体饱和蒸汽压的方法一般有静态法、动态法和饱和气流法。
B.等压计U型管中的液体起着密封样品和平衡压力的作用。
C.饱和蒸汽压与温度的关系符合-方程式,由实验所测数据进行拟合可求得一定温度下的摩尔汽化热。
D.用等压计测液体蒸汽压所需试样少,方法简便,可用试样本身作封闭液而不影响测定结果。
2.静态法测定液体饱和蒸气压一般适用于体系。
A.蒸气压较小的纯液体C.蒸气压较大的纯液体B.含挥发性溶质的溶液D.固态易挥发物质3.液体饱和蒸汽压的实验测量,下列操作中不正确的是。
A.在排系统空气过程中,抽气速率必须慢,避免等压计中样品因抽气速率过快而挥发掉B.等压计样品上方空气必须排尽C.实验操作关键在于,在整个实验过程中,要严防空气倒灌进入样品的蒸气中,为防空气倒灌,应经常调节U型管液面,以防液差过大。
D.在升温测量过程中,当恒温槽温度恒定后,即可马上进行测量。
燃烧热的测定4.氧弹热量计是一种较为精密的实验仪器,燃烧热的测定是在环境温度恒定的条件下进行测定(以室温水夹套作为环境),同时用到雷诺温度校正,原因是。
A.校正燃烧前体系的温度。
B.校正燃烧后体系的温度。
C.校正环境的温度。
D.因热量计与周围环境的热交换无法完全避免,为了消除这一影响而进行校正。
5.用环境恒温法测定物质燃烧焓的实验中,为减少测量的实验误差,下列说法不正确的是。
A.确保样品在氧弹内燃烧完全B.样品需要精确称量C.在标定量热计热容和测定未知样品燃烧焓的前后两次实验中,内筒的盛水量随意D.使用高纯度氧气6.燃烧热的测定实验中点火与停止读数关闭电源后,打开氧弹若发现有黑色残渣说明样品燃烧不完全,其可能原因不正确的是。
A.氧气压力不足 B.氧弹漏气 C.氧弹中加水过多D.样品量太多凝固点降低法测定摩尔质量7.凝固点降低实验中,下列说法不正确的是。
合金相图的建立
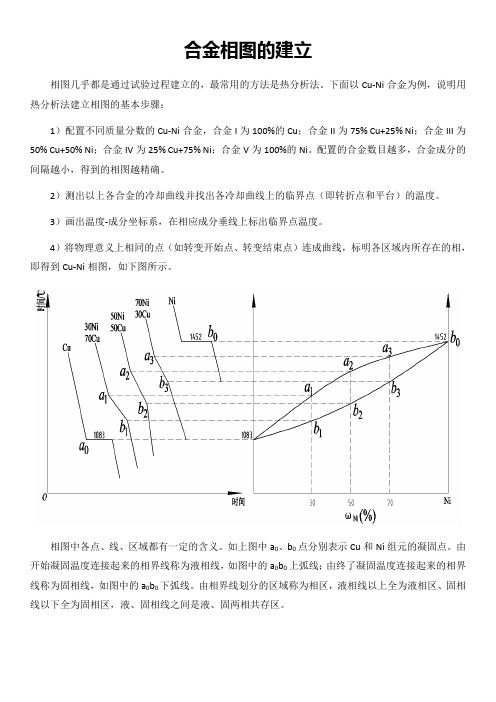
合金相图的建立相图几乎都是通过试验过程建立的,最常用的方法是热分析法。
下面以Cu-Ni合金为例,说明用热分析法建立相图的基本步骤:1)配置不同质量分数的Cu-Ni合金,合金I为100%的Cu;合金II为75% Cu+25% Ni;合金III为50% Cu+50% Ni;合金IV为25% Cu+75% Ni;合金V为100%的Ni。
配置的合金数目越多,合金成分的间隔越小,得到的相图越精确。
2)测出以上各合金的冷却曲线并找出各冷却曲线上的临界点(即转折点和平台)的温度。
3)画出温度-成分坐标系,在相应成分垂线上标出临界点温度。
4)将物理意义上相同的点(如转变开始点、转变结束点)连成曲线,标明各区域内所存在的相,即得到Cu-Ni相图,如下图所示。
相图中各点、线、区域都有一定的含义。
如上图中a0、b0点分别表示Cu和Ni组元的凝固点。
由开始凝固温度连接起来的相界线称为液相线,如图中的a0b0上弧线;由终了凝固温度连接起来的相界线称为固相线,如图中的a0b0下弧线。
由相界线划分的区域称为相区,液相线以上全为液相区、固相线以下全为固相区,液、固相线之间是液、固两相共存区。
晶体的同素异构某些金属在不同温度和压力下呈不同类型的晶体结构的现象称为同素异构转变。
常见的元素如铁、钛、锰、锡、碳等都具有同素异构转变。
在金属晶体中,铁的同素异构转变最为典型。
铁在结晶后继续冷却至室温的过程中,先后发生两次晶格转变,如右图所示,纯铁的冷却曲线及结构转变过程如下①:体心立方面心立方体心立方同素异构转变的过程,就是原子重新排列的过程,同样遵循形核与长大的基本规律。
如下图所示,当γ-Fe向α-Fe转变时,α-Fe晶核通常在γ-Fe的晶界处产生并长大,直至全部γ-Fe晶粒被α-Fe晶粒取代而转变结束。
由此可见,同素异构转变也是经过结晶来实现的,其特点是在固态下完成晶格的转变,属于二次结晶②。
铁的同素异构转变是钢铁能够进行热处理的内因和依据,也是钢铁材料性能多种多样、用途广泛的主要原因之一。
实验六 二组份合金体系相图的绘制

二组份合金体系相图的绘制一实验目的要求1.用热分析法测量铅、锡二元金属相图,了解固-液相图的基本特点。
2.学会热电偶测温技术。
3.掌握可控升降温电炉和数字式控温仪的使用方法。
二实验原理1.二组分固-液相图以体系所含物质的组成为自变量,温度为应变量所得到的T-X图是常见的一种相图。
二组分体系的自由度与相的数目有以下关系:自由度=组分数-相数+2 图Ⅱ-7-1(a)以邻-、对-硝基氯苯为例表示有低共溶点相图的构成情况:高温区为均匀的液相,下面是三个两相共存区,至于两个互不相溶的固相A、B 和液相L三相平衡共存现象则是固-液相图所特有的。
在三相共存的水平线上,自由度等于零。
处于这个平衡状态下的温度TE 、物质组成A、B和XE都不可改变。
TE 和XE构成的这一点称为低共熔点。
2.热分析法和步冷曲线热分析法是相图绘制工作中常用的一种实验方法。
按一定比例配成均匀的液相体系,让它缓慢冷却,以体系温度对时间作图,则为步冷曲线。
图Ⅱ-7-1(b)为与图(a)标示的三个组成相应的步冷曲线。
曲线(Ⅰ)表时,体系温度将保持恒定直到样品完全凝固。
曲线上示,将纯B液体冷却至TB出现一个水平段后再继续下降。
在一定压力下,单组分的两相平衡体系自由度是定值。
曲线(Ⅲ)具有低共溶物的成分。
该液体冷却时,情况与纯为零,TB的B体系相似。
曲线(Ⅱ)代表了上述两组成之间的情况。
设把一个组成为X1,即有B的固相析出。
与前两种情况不同,这时体系还有一个自液相冷却至T1由度,温度将可继续下降。
不过由于B的凝固所释放的热效应将使该曲线的斜处出现一个转折。
率明显变小,在T1三实验仪器与试剂KWL-09多头可控升降温电炉。
SWKY-1型数字控温仪,配控温热电偶和测温热电偶。
微型计算机,金属相图测绘软件。
1~6号样品,分别为含铅0、20、40、60、80、100%的铅锡合金实验者自备U盘一个。
四实验步骤1. 检查1~6号样品管是否依次放在试管架上,控温探头Ⅰ是否放入加热腔内,测温探头Ⅱ应放在1号样品管内。
相图的建立及匀晶相图分析.ppt
思考题
3. 匀晶合金的室温组织为单相固溶体。 A. 是 B. 否
答案:A 匀晶合金的室温组织为单相固溶体,即使是非平衡凝 固的匀晶合金也是如此。
35
思考题
4. 下述哪些下列说法哪些是正确的? A 温度高于液相线的合金为液态; B 温度低于液相线的合金为固态; C 温度低于固相线的合金为固态; D 温度高于固相线的合金为液态。
二元合金在两相共存时,两个相的成分可由过表象点的水 平线与相界线的交点确定。
6
二元相图中的成分按国家标准有两种表示法:
①质量分数(w):
wA
RA xA RA xA RB xB
, wB
RB xB RAxA RB xB
②摩尔分数(x):
xA
wA
/
wA / RA RA wB
/
RB
杠杆定理是利用相图确定和计算合金在两相区中, 两平衡相的成分和相对量的方法,由于它与力学中 的杠杆定律很相似,故称为杠杆定律。
WL X 2 X ob WS X X1 oa
WL ob 100% Wo ab Ws oa 100% Wo ab
WL
a
(X1)
o(X)
WS b (X2)
15
(6)二元相图中的几何规律
相图中所有的线条都代表发生相转变的温度和平衡相的 成分,所以相界线是相平衡的体现,平衡相成分必须沿着相 界线随温度而变化;
16
两个单相区之间必定有一个由该两相组成的两相区把它 们分开,而不能以一条线接界,两个两相区必须以单相区或 三相水平线隔开,也就是说,在二元相图中,相邻相区的相 数差为1(点接触情况除外),这个规则称为相区接触法则;
步冷曲线法绘制二元合金相图

步冷曲线法绘制二元合金相图
实验目的 实验原理 仪器和试剂 实验步骤 数据处理 思考题
实验目的
1. 用热分析法测熔融体步冷曲线,绘制 Sn—Bi二元合金相图。 2. 了解热分析法的实验技术及热电偶测 量温度的原理和方法。
实验原理
1. 相图 相图是多相体系处于相平衡状态时体系 的某些物理性质(如温度或压力)对体系的 组成作图所得的图形,因图中能反映出相图 平衡情况(相的数目及性质等),故称为相 图。由于压力对仅由液相和固相构成的凝聚 体系的相平衡影响很小,所以二元凝聚体系 的相图通常不考虑压力的影响,而常以组成 为横坐标,以温度为纵坐标作图。
思考题
1. 冷却曲线上的拐点是怎么来的? 2. 如果有两个样品,一个为纯金属A,另 一个为组成为低共熔体的合金(含A), 你如何通过冷却曲线对它们进行区分?
A
B
C
图A是单组分体系, 图B是二元混合物, 图 C是低共融体系的步冷曲线。
X-Y多通道数据采集仪
3.绘制二元合金相图 无论是步冷曲线上的平台还是转折,都 反映了相变化时的温度,把各种不同组成的 体系的步冷曲线的转折点和平台,在温度— 组成图上标志出来连成曲线就得到相图。
热电偶工作原理: 热电偶可将温度转换成电压信号(温差电势),在 一定温度范围内,镍铬-镍硅热电偶输出的温差电 势与其热端和冷端的温度差成近似线性关系,为此 只要绘制出热电偶的工作曲线(电势差-温差曲 线),即可通过它的线性关系方便地查到各电势差 所对应的温度差。热电偶工作时,如将冷端插入冰 水混合物中(0℃),热端插入待测样品中,热电偶 正负极接入X-Y多通道数据采集仪,连续采集样品 的电势差值,显示在电脑上,从而得到所需的冷却 曲线。在仪器的系统误差很小的前提下,可根据仪 器读取的电势差值直接去查“镍铬-镍硅热电偶值分 度表”,得出样品的温度来。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二组份合金体系相图的绘制
Ⅰ、目的要求
一、用热分析法测量铅、锡二元金属相图,了解固-液相图的基本特点。
二、学会热电偶测温技术。
三、掌握可控升降温电炉和数字式控温仪的使用方法。
Ⅱ、实验原理
一、二组分固-液相图
以体系所含物质的组成为自变量,温度为应变量所得到的T-X图是常见的一种相图。
二组分体系的自由度与相的数目有以下关系:
自由度=组分数-相数+2 图Ⅱ-7-1(a)以邻-、对-硝基氯苯为例表示有低共溶点相图的构成情况:高温区为均匀的液相,下面是三个两相共存区,至于两个互不相溶的固相A、B 和液相L三相平衡共存现象则是固-液相图所特有的。
在三相共存的水平线上,
自由度等于零。
处于这个平衡状态下的温度T
E 、物质组成A、B和X
E
都不可改
变。
T
E 和X
E
构成的这一点称为低共熔点。
二、热分析法和步冷曲线
热分析法是相图绘制工作中常用的一种实验方法。
按一定比例配成均匀的液相体系,让它缓慢冷却,以体系温度对时间作图,则为步冷曲线。
图Ⅱ-7-1(b)为与图(a)标示的三个组成相应的步冷曲线。
曲线(Ⅰ)表示,将纯B液体冷却至T
B
时,体系温度将保持恒定直到样品完全凝固。
曲线上出现一个水平段后再继续下降。
在一定压力下,单组分的两相平衡体系自由度
为零,T
B
是定值。
曲线(Ⅲ)具有低共溶物的成分。
该液体冷却时,情况与纯
B体系相似。
曲线(Ⅱ)代表了上述两组成之间的情况。
设把一个组成为X
1
的
液相冷却至T
,即有B的固相析出。
与前两种情况不同,这时体系还有一个自
1
由度,温度将可继续下降。
不过由于B的凝固所释放的热效应将使该曲线的斜
处出现一个转折。
率明显变小,在T
1
Ⅲ、仪器与试剂
KWL-09多头可控升降温电炉。
SWKY-1型数字控温仪,配控温热电偶和测温热电偶。
微型计算机,金属相图测绘软件。
1~6号样品,分别为含铅0、20、40、60、80、100%的铅锡合金
实验者自备U盘一个。
Ⅳ、实验步骤
1、检查1~6号样品管是否依次放在试管架上,控温探头Ⅰ是否放入加热腔内,测温探头Ⅱ应放在1号样品管内。
2、依次打开微型计算机和SWKY―1型数字控温仪的电源开关,调节SWKY―1型数字控温仪至380℃;按“工作/置数”键使工作指示灯亮,电炉开始通电升温。
3、从微型计算机桌面双击“金属相图1.5”软件,进入软件主界面,点击“设置坐标”,弹出对话框,设置温度范围0~400℃,时间20min。
4、从试管架上取出1号样品管放入电炉加热腔内,待“温度显示Ⅱ”示数(即样品的温度)升至380℃时(整个实验期间要绝对避免温度超过400℃,以免损坏仪器),小心将l号样品管连同测温热电偶移至冷却腔内,把2号样品管放入加热腔内加热。
待“温度显示Ⅱ”示数开始下降时,点击“开始绘图”,金属相图软件会记录1号样品的步冷曲线图,当温度降至140℃,点击“停止绘图”。
点击“保存”,文件名为“实验者姓名―00”,然后将1号样品管放回试管架原位置,将测温探头Ⅱ插入2号样品管内,待温度超过350℃时,小心将2号样品管连同测温热电偶移至冷却腔内,按照1号样品相同步骤冷却绘图,并保存文件名为“实验者姓名―20”。
5、用同样的方法测余下4个样品的步冷曲线图。
(在绘制6号样品图像的同时,把1号样品放在炉腔加热。
) 完毕后关闭SWKY―1型数字控温仪。
Ⅴ、[数据记录]
1、记下“实验者姓名-00”跟“实验者姓名-100”的平台温度,以及“实验者姓名-20”、“实验者姓名-40”、“实验者姓名-60”、“实验者姓名-80”的平台温度和拐点温度。
Pb% 0 20 40 60 80 100
平台温度
拐点温度――――
2、点击主界面“打开”键,在弹出对话框后选择文件“实验者姓名―00”,用鼠标点击图像,在平台曲线前中后各取1点,读取3点的“纵坐标”并取这3点“纵坐标”的平均值,记录于下表,同时清屏;打开“实验者姓名―100”用鼠标点击图像,在平台曲线前中后各取1点,读取3点的“纵坐标”并取这3点“纵坐标”的平均值,记录于下表,同时清屏;打开“实验者姓名―20”,点击第一拐点,读取并记录拐点温度,并找出该曲线的平台曲线温度,并记录于下表,同时清屏;依次读取“实验者姓名―20”“实验者姓名―40”、“实验者姓名―60”和“实验者姓名―80”的拐点与平台温度。
3、退出程序“金属相图1.5”,打开程序“金属相图1 .1”,设置坐标“温度0-400℃,时间20min”. 点击“步冷曲线/金属相图”后,设置坐标“0-400℃”,再点击“相点坐标”,弹出对话框“金属相图坐标点”,输入低共熔点温度(即“实验者姓名―20”、“实验者姓名―40”、“实验者姓名―60”、“实验者姓名―80”平台温度的平均数),测试次数为6。
点击“添加”,此时下方会给出6组数据填写框,在其左侧方格内分别填入实验者姓名―00平台温度、实验者姓名―100平台温度、实验者姓名―20拐点温度、实验者姓名―40拐点温度、实验者姓名―60拐点温度、实验者姓名―80拐点温度,在右侧依次为0、100、20、40、60、80,点击“确定”后,在主界面上点击“绘制相图”,此时软件会拟合出金属相图,保存文件名为“实验者姓名-TU”。
按键盘上“Print Screen SysRq”键进行拷屏,将其粘贴在word文档中并存盘至“金属相图数据文件夹”下,文件名为“实验者姓名TU”,用U盘将其拷回作为电子版实验报告数据相图。
4、关闭电脑,整理实验台面。
VI 、数据处理
气温:气压:
Pb% 0 20 40 60 80 100
平台温
度
拐点温
――――
度。
