仪器分析 05分子发光分析法新
仪器分析课后习题答案

仪器分析课后习题答案第一章绪论1.解释下列名词:(1)仪器分析和化学分析;(2)标准曲线与线性范围;(3)灵敏度、精密度、准确度和检出限。
答:(1)仪器分析和化学分析:以物质的物理性质和物理化学性质(光、电、热、磁等)为基础的分析方法,这类方法一般需要特殊的仪器,又称为仪器分析法;化学分析是以物质化学反应为基础的分析方法。
(2)标准曲线与线性范围:标准曲线是被测物质的浓度或含量与仪器响应信号的关系曲线;标准曲线的直线部分所对应的被测物质浓度(或含量)的范围称为该方法的线性范围。
(3)灵敏度、精密度、准确度和检出限:物质单位浓度或单位质量的变化引起响应信号值变化的程度,称为方法的灵敏度;精密度是指使用同一方法,对同一试样进行多次测定所得测定结果的一致程度;试样含量的测定值与试样含量的真实值(或标准值)相符合的程度称为准确度;某一方法在给定的臵信水平上可以检出被测物质的最小浓度或最小质量,称为这种方法对该物质的检出限。
2.对试样中某一成分进行5次测定,所得测定结果(单1/79位gmL)分别为0.36,0.38,0.35,0.37,0.39。
(1)计算测定结果的相对标准偏差;(2)如果试样中该成分的真实含量是0.38gmL,试计算测定结果的相对误差。
解:(1)测定结果的平均值某0.360.380.350.370.390.3751gmL标准偏差n1(某某)ii12n1(0.360.37)2(0.380.37)2(0.350.37)2(0.370.37)2(0.390.37)2 5110.0158gmL相对标准偏差(2)相对误差E3.用次甲基蓝二氯乙烷光度法测定试样中硼时,为制作标准曲线,配制一系列质量浓度B(单位mgL1)分别为0.5,1.0,2.0,3.0,4.0,5.0的标准溶液,测得吸光度A分别为0.140,0.160,0.280,0.380,0.410,0.540。
试写出该标准曲线的一元线性回归方程,并求出rr0.0158100%100%4.27%0.37某某100%0.370.38100%2.63%。
仪器分析分子发光分析法
VR S2
IC VR
S1
VR:振动驰豫 IC:内部转换 ISC:系间窜跃
ISC VR T1
S0
S0
吸光 吸光 荧光
磷光
图5-1 分子荧光、磷光光谱产生过程示意图
二、荧光、磷光与分子结构的关系
(一)荧光效率
• 荧光强度常用荧光量子效率φf 来描述
荧光量子效率
发荧光的分子数
f = 激发态分子总数
f 是一个物质荧光特性的重要参数, 反映了荧光物质发射荧光的能力, f 越大,荧光越强,在0~1之间。
ISC T1
S0
S0
吸光 吸光
3.辐射去激—荧光和磷光产生
• S1或T1 发光 S0 这种过程叫辐射去激
(1) 荧光:
从S1的最低振动能级回到S0各振动能级所产 生的光辐射叫荧光
特点: • 产生速度快,10-9~10-6s; • 依赖于外部光源 • 荧>激
VR S2
IC VR
S1
VR:振动驰豫 IC:内部转换 ISC:系间窜跃
浓度
C1
荧光强度 If1
C2 C3 If2 If3
C4 C5 Cx If If4 If5 Ifx Ifx
Cx
C
2. 荧光猝灭法
• 把荧光猝灭用在定量分析上,具有较高的灵 敏度和选择性
• 荧光物质 M 与猝灭剂 Q 生成不发荧光的基 态配合物MQ
M + Q = MQ(非荧光物质)
Kf
C(MQ) C(M )C(Q)
• -OH、-OR、-NH2、-NHR、-NR2等给电子 基团
• 由于基团的 n 电子(孤对电子)的电子云 与苯环上的 轨道平行,共享了共轭 电 子,扩大了共轭体系,使荧光波长长移,荧 光强度增强
最新分子发光分析法

(4)取代基效应
1)给电子取代剂加强荧光
• —HN2, — NHR , —NR2, — OH, — OR , — CN
• 产生 p →π共轭
化合物
λ
em max
(nm)
相对荧光强度
苯
278~31 0 10
苯酚
285~3 65 18
苯胺 苯基氰 苯甲醚
激发光谱和发射光谱的关系
• A . Stokes位移
• B .发射光谱的形状与激发波长无关
• C . 镜像规则
A.基态上的各振动能级分布与第一激 发态上的各振动能级分布类似。
• 激发:基态→第一激发态各振动能级,振动能 级越高,能级差越大,波长就越短。
• • 发射荧光:从第一激发态的最低振动能级→基
310~40 280~39 285~34
5
0
5
20
20
20
2)吸电子取代基减弱荧光、加强磷光
• 芳环上被F、Cl、Br、I 取代后,使系间窜跃 加强,磷光增强,荧光减弱。其荧光强度随卤 素原子量增加而减弱,磷光相应增强,这种效 应为重原子效应。 其原因是重原子的电子自旋和轨道运动间的相 互作用变大,原子核附近产生磁场,使单重态 向多重态系间跨越的几率增加。
(2)影响荧光强度的因素
• 溶剂的影响(增大溶剂的极性荧光增强) • 温度的影响 • 酸度的影响(芳香族化合物的官能团,金属与有
机试剂螯合)
• 内滤光和自吸收现象 • 散射光的影响
(3)溶液荧光的猝灭
荧光物质分子与溶剂分子或其他溶质分子的相互作用
引起荧光强度降低或荧光强度不与浓度成线性关系
的现象称为荧光猝灭。
第五章 分子发光分析法PPT课件

菏泽学院化学与化工系
9
(二) 荧光效率及其影响因素 1. 荧光效率 发射荧光的分子数目与激发态分子总数的比值。
荧光效率(f)=
发荧光的分子数 激发态分子总数
也可以各种跃迁的速率常数表示
f
Kf K f Ki
式中:Kf为荧光发射过程的速率常数,∑Ki为非辐射跃迁的 速率常数之和。一般来说,Kf决定于物质的化学结构;∑Ki 主要决定于化学环境,同时也与化学结构相关,有分析应用
长;
‘ 2
>
2
>
1
;
磷光发射:电子由第一激发三重态的最低振动能级→基态(
T1 → S0跃迁); 电子由S0进入T1的可能过程:( S0 → T1禁阻跃迁)
S0 →激发→振动弛豫→内转移→系间跨越→振动弛豫→ T1 发光速度很慢: 10-4~100 s 。
光照停止后,可持续一段时间。
2020/10/31
的电子跃回第一激发单重态的最低振动能级。
外转换:激发分子与溶剂或其他分子之间产生相互作用而转
移能量的非辐射跃迁;外转换使荧光或磷光减弱或“猝灭”
。
系间跨越(intersystem conversion):不同多重态,有重叠的转动
能级间的非辐射跃迁。改变电子自旋,禁阻跃迁,通过自旋
—轨道耦合进行。
2020/10/31
❖ 直到1852年,Stokes在考察奎宁和叶绿素的荧光时,用分光光度 计观察到其荧光的波长比入射光的波长稍微长些,才判断这种 现象是这些物质在吸收光能后重新发射不同波长的光,而不是 由光的漫射作用所引起的,从而导入了荧光是光发射的概念, 他还由发荧光的矿石“萤石”推演而提出“荧光”这一术语。
2020/10/31
仪器分析教程(第二版)课后题部分答案

要以In-为主要存在形式, 所
以有:A=εl c 得 0.84=ε×1×10-3×1 ε=840L/mol/cm
由公式:
pka pH
lg
A (L ) A(HL) A
7.00
lg
0.588 0.840 0 0.588
6.63
3.24 计算下列化合物的λmax
CH3
(1)
参看39页表3.5
适用范围:主要用于低熔点金属,合金的分析,高含量元素的 分析,难以激发元素的分析。
电感耦合等离子体:电子和离子被电场加速,同时和气体分子、 原子等碰撞,使更多的气体电离,电子和离子各在炬管内沿 闭合回路流动,形成涡流,在管口形成火炬状的稳定的等离 子焰炬。其特性:①由于等离子焰炬具有很高的温度,所以 具有很强的激发和电离能力,能激发很难激发的元素,有很 强的离子线②具有很高的灵敏度和很好的检测限,相对检出 限可低于ng级,适用于微量和痕量分析。适用范围宽,可测 元素达70多种③稳定性好,分析结果的精密度和准确度都很 高④由于它不用电极,可避免由电极污染而带来的干扰⑤背 景发射和自吸效应很小,有很强的抗干扰能力,可进一一步 降低检出限和光谱背景。
解: (1() a)阳极:Cr2+ Cr3+ +e
=-0.41v (-)
阴极:Pb2+ +2e Pb
=-0.126v (+)
1106 1750
sin
48.2 sin 11.2
1
315.0(nm)
2.6 用dn/dλ=1.5×10-4 的60°熔融石英棱镜和刻有1200条·mm-1的光栅来色散Li的 460.20nm及460.30nm两条谱线,试计算:(1)分辨率 (2)棱镜和光栅的大小
仪器分析作业03参考答案(第三、五章紫外可见分光光度法+分子发光分析法)华南理工大学仪器分析

01. 溶液有颜色是因为它吸收了可见光中特定波长范围的光。
若某溶液呈蓝色,它吸收的是什么颜色的光?若溶液无色透明,是否表示它不吸收光?答:溶液呈蓝色,表明其吸收了蓝光的互补光,即黄光(若答是吸收了黄光外的所有可见光,不能说错,但是这样的情况过于巧合,少见!)。
若溶液无色透明,仅能说明其不吸收可见波段的光。
2. 分别在己烷和水中测定某化合物UV-Vis 光谱,发现该化合物的某个吸收峰由285 nm (己烷)蓝移至275 nm (水),(1)判断产生该吸收峰的跃迁类型;(2)试估算该化合物与水生成氢键的强度。
答:(1)溶剂极性增大,λmax 蓝移,表明该吸收峰是由n →π*跃迁产生的。
(2)()()⎪⎪⎭⎫⎝⎛λ-λ⋅⋅=己烷氢键max O H max A 11hc N E 2 ⎪⎭⎫ ⎝⎛⨯⨯⨯⨯⨯⨯⨯⨯=--99834-23102851-102751100.31063.61002.61mol J 28.15-⋅=3. 按从小到大顺序对下列化合物的λmax 排序,并简单说明理由(不要想得太复杂)A. NO 2B. NO 2t-C 4H 9t-C 4H 9 C.NO 2CH 3 D. NO 2C 2H 5答:B<D<C<A (空间位阻依次减小,共轭程度依次增加,λmax 红移)4. 某化合物分子式为C 10H 16,用其他仪器方法已经证明有双键和异丙基存在,其紫外光谱λmax =230 nm (ε=9000),1mol 该化合物只能吸收2 mol H 2,加氢后得到1-甲基-4异丙基环己烷,试确定该化合物的可能结构。
答: 1mol 该化合物只能吸收2 mol H 2,且其紫外光谱λmax =230 nm (ε=9000)可知该化合物含两个共轭但非同环双键(同环共轭双键基值为253 nm );该化合物含异丙基(双键不会出现在异丙基上),根据加氢后产物结构可推出该化合物可能结构如下:根据Woodward 规则可计算出该化合物的λmax =214+5(环外双键)+5⨯2(烷基取代)=229 nm ,与所测值相符。
《仪器分析实验》分子荧光分析法

西北大学基础化学实验
jkzq!0&G%A7MhAj3XCnPBAigZ1iUUR7CjPlKDa+ kbJ9fv3(tCBZ% hT mEM k3b!L)YX9hQ*izToSTQ!Wo*alD75dez+Bdml xHtp7*rJEciGl01S%j0dXj xs6WxxD0C W wW%cO)H C5q%FZG2q-YcX)4afp2%(R dD$)YA%lA1#Mfvdn( 13JQqKdRIV8io3#VpNVNr w5QD v0J7ir3N d$oj vjr 1x&UKa))-uQUN7I#LsTgij WIo9wyYQpJSVECg4bTN4+ b3 v36GYph9+ ef9OBPTGSG7JOUU F kbYPHh2XgI*OC64%)rQQuOIlqpf$6Etc x5wMAx-DQ6&b+6TACIMBfKNY7i %bm8) xjfyDObYnQ)Z aPffM HEKvkqSUsH hEqPOvYJLw5*Loc4T Ih1x7eiaApMW5%9%fqKuDoL&)(LgWObFPVQ8HT GGN w&3F Wd*a9R2$KEi*euIQ*Z+z hf#43jnPxyRR rAUI$30wA&SfLdFLbQ-UK8$9g$NLe-BGH58bXo1yXOk-ek)BU A*9pN uTNRH tFoV0qKlM!lkrfgh+dQaFtSU 3&r* m-7fv!GKoU9Ls E53b6Q* xW*q-2gxdD vLtqqWPF+r SIT$%T f1zGla63m-2o5MB$xAOpdWrZ!59Z8GDz zZhAlFq+h&ILCMu2zXYPmf!8+IYXVaTbrI9TE
第五章_分子发光分析法(好)

2.荧光发射光谱(或磷光光谱)
固定激发光波长 ( 选 最大激发波长),扫描发射 光波长,根据化合物发射 的荧光(或磷光)强度与发 射光波长关系得到的曲线 (图中曲线II或III)。
使荧光减弱。如:硝基苯为非荧光物质。
(iii)卤素取代基随原子序数的增加,物质的荧光减弱, 而磷光增强 (重原子效应:重原子取代促进了荧光体中的电子自旋 -轨道的偶合作用,系间窜越S1—T1概率大)。
三、影响分子发光的环境因素
1.溶剂的影响
荧光体的基态与激发态的偶极矩不同,与溶剂分子的 偶极之间存在的静电相互作用也不同; 激发时发生π→π * 跃迁,激发态的极性更大,若溶
S1 磷光发射 T1
S2
Phosphorescence
S0 l2 l1 l3
辐射能量传递过程
荧光发射:电子由第一激发单重态的最低振动能级→基态(多为
S1→ S0跃迁),发射波长为 l ′2的荧光 10-8~10
> l > l ;
-10
s 。
由图可见,发射荧光的能量比分子吸收的能量小,波长长;l ′2
l2
l 2
l3
2.电子激发态的多重度
电子激发态的多重度:M=2S+1: 当S=0时,即M=2S+1=1,称为单重态 当S=1时,即M=2S+1=3,称为叁重态 大多数基态分子处于单重态,表示为S0(基态单重态)
S0→T1 为 禁 阻 跃 迁
;必须通过其他途 径(系间窜越)进入 ,进入的几率小; 根据洪特规则,平行自旋比成对自旋稳定;而三 重态能级比相应单重态能级低,所以平均寿命长。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
F
ex 422nm 1
2 3 4
250 350 450
丁二酮in CCl4 1 0.015 mol/L
2 0.045 mol/L 3 0.150 mol/L 4 0.450 mol/L
nm
5-1-2 荧光/磷光光谱仪(1)
溶液荧光的淬灭
荧光强度与溶液浓度的关系
荧光强度IF正比于吸收的光强Ia和荧光量子产率f
I F I a f
根据L-B定律,可求出吸收光强Ia的表达式
Ia I0 It I0 1 10lc I0 1 e2.3lc
If I 0 f 1 e2.3lc
If 2.3I 0f lc kc
F If
lc0.05
c
光源的强度与稳定对荧光信号的强度和稳定影响极大
影响荧光强度的因素
溶剂效应(一般和特殊:发生相互作用) 温度和黏度(T F ;黏度,F ) pH 有序介质的影响(表面活性剂或环糊精有增敏效果) 内滤光与自吸
Kf:荧光辐射速率 Ki:其它过程速率
f的大小主要决定与分子的结构和性质,但与分子所处的环境 因素对其也有很大的影响。
荧光量子产率f的测定
测定待测荧光物质与f已知的参比荧光物质两者稀溶液在
相同激发条件下所测得的积分荧光强度(即发射光谱所包 含的面积)和对应激发波长的吸光度,然后按以下公式计 算可得:
散射光的影响
CD
pH值对荧光光谱的影响
具酸或碱性基团的有机物质,在不同pH值时,其结构可能
发生变化,因而荧光强度将发生改变;对无机荧光物质,因
pH值会影响其稳定性,也可使其荧光强度发生改变。
OH
pH1,有荧光
OOH O有荧光
pH13,无荧光
无荧光
内滤光和自吸
体系内存在可以吸收激发光或荧光的物质造成荧光强度降低的
第五章 分子发光分析
Molecular Luminescence Analysis
分子发光分析(1)
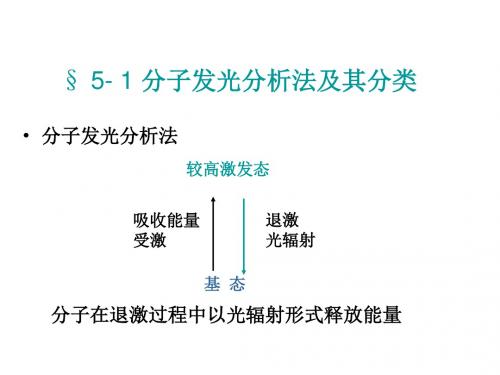
分子吸收一定能量后外层电子将由基态跃迁至激发态,若
从激发态返回基态时伴随光辐射现象,即称为分子发光, 基于该现象的分析方法为分子发光分析法(UV-Vis区) 分子发光的类型
光致发光 按 激 发 模 式 化学发光 生物发光 按激发态类型
-OH、OR、-NH2、-NHR、-NR2、-C≡N等
吸电子基减弱荧光: -COOH、-C=O、-NO2、-N=N-等 重原子效应(例:苯环被卤素取代,从氟苯到碘苯,荧光 逐渐减弱到消失,但磷光会增强)
分子内氢键作用—会增加分子平面性和刚性
COOH COOH C OH OH O
水杨酸
OH
OH
无机荧光材料
发射光谱:固定激发波长在最大激发波长ex处,测定不同发射 波长处的荧/磷/光强度,以发射波长对荧/磷光强度即可得的荧/ 磷光的发射光谱。
发 转换、振动驰豫 射 S0,0 激 Se, v 内 S1,0 发 S 0, v
激发光谱
容量瓶编号 1 2 V水样/mL 10.00 10.00 V标准溶液/mL 0 1.00 吸光度A 0.082 0.160
3
4 5
10.00
10.00 10.00
2.00
3.00 4.00
0.238
0.318 0.394
解:(1)依题可知加入Mg标浓度及对应吸光度值如下表:
cMg/gmL-1 A 0 0.082 0.10 0.160 0.20 0.238 0.30 0.318 0.40 0.394
现象称为“内滤光现象”;若荧光物质的荧光短波长与激发光
长波长有重叠,在其浓度较大情况下可吸收自身的荧光而造成 荧光强度降低的现象称为“自吸收”。
K2Cr2O7的吸收峰与A,F有重叠
散射光的影响
荧光分析中常出现Retleigh散射光、容器表面的散射光、 Tyndall及拉曼散射等,波长选择适当,可以消除其影响
5-1-1 分子荧光和磷光分析原理(2)
去活化:激发态分子基态分子
去活化方式
发射光子
非辐射跃迁
化学反应
荧光
磷光
外转换
振动驰豫
内转换
系间跨越
速度快、激发态寿命短的途径先发生
荧光的产生
激发单重态
内转换:10-1110-13 s 振动驰豫:10-12 10-14 s 荧光发射:10-9 10-7 s 吸收/激发 内 转 换 外 转 换 荧光
S0
2
1
3
振动驰豫
4
实验教学安排与要求
学时:44(共11个实验,具体内容及安排见实验安排表) 要求:实验前自学或温习相关理论知识,完成实验报告预 习部分(注意规范性);实验时必须携带预习报告准时出 席;实验过程中应遵守课堂纪律及教师要求
成绩评定:每次实验均计入总分,请假无法补做时当次实
验成绩为0,无故缺席一次则总成绩为0
5-1-1 分子荧光和磷光分析原理(3)
任何荧光(磷光)化合物都具有激发和发射两个特征光谱,这 是对其进行定或量定性的基础。
S0,0 激发 Se, v 内转换、振动驰豫 S1,0 发射 S0, v
激发光谱:即激发效率随波长变化的曲线。激发的本质就是物
注意理论课与实验课之间的联系
作业1第3题
用某仪器方法测定试样中微量Cu含量:称取试样0.750 g,溶解 后定容到100 mL容量瓶中作为试样溶液,测定时溶液的配制及 对应仪器信号S如下表所示,计算试样中Cu的质量分数(%)
编号
移取试样溶液的体积/mL 加入5.00 mgL-1 Cu2+标准溶液的体积 /mL 所测的仪器信号S
2
3 wCu cCu 2 V / ms 100% 1.76 0.1 10 / 0.75 100% 0.023%
作业1第5题
采用原子吸收光谱法测定水样中的Mg含量:在5个50 mL的容量瓶中分 别加入10.00 mL水样、1 mL 1:1 HCl和2.5 mL 10% SrCl2,再加入不同 体积5.00 gmL-1 的Mg标准溶液后定容。用空白溶液调零后依次测定 各容量瓶中溶液的吸光度,相关数据见下表,(1)求水样中Mg的含量 (以gmL-1表示);(2)空白溶液应如何配制?
S(1,0) S(0, v )
镜像规则
电子能级处于基态和激发态的分子振动
能级间隔相等。
5-1-1 分子荧光和磷光分析原理(5)
荧光与分子结构的关系
分子产生荧光必须具备的条件:具有与照射频率相适应
的结构;具有一定的荧光量子产率(f: 0.11)
发射的光量子数 Kf f 吸收的光量子数 K f K i
-O
O
C COO-
O
荧光黄苯并芘-O C Nhomakorabea刚性平面结构 -O
O
COO-
O C
O
CO O
酚酞(无荧光)
荧光黄
O Mg
N O
N O-
N
8-羟基喹啉(弱荧光)
红色荧光
联二苯= 0.2
芴=1.0
C H2
刚性平面结构可减小分子振动,使分子与溶剂和其他溶剂分子碰撞失活可能性降低
取代基的影响
给电子基增强荧光:
1
0.00 0.00
2
5.00 0.00
3
5.00 2.50
用0.1 molL-1的HNO3定容至25.00 mL
解:0.385 0.010 5cCu 2.5 5 c -1 1 . 76 mg L Cu
2
0.010
0.165
0.385
0.165 0.010
5cCu 2
硫酸喹啉及其溶剂(硫酸溶液)在不同激发波长下的光谱
溶液荧光的淬灭
能引起荧光物质荧光强度降低的物质称为淬灭剂,常见
淬灭类型有一下几种:
碰撞猝灭(碰撞后无辐射失活) 静态猝灭(形成非荧光配合物) 转入三重态猝灭(发生系间跨越,若重原子、溶解氧等) 电子转移猝灭 基于荧光淬灭现象可实现淬灭剂的分析 自猝灭
磷光的产生
激发单重态
激发三重态
振 动 驰 豫
S2
S1
吸 收
内转换
振动驰豫
S0, v
系间跨越
振 动 驰 豫
磷光
外 转 内 换 转 换
T1,0
T1
荧 光 无 辐 射 跃 迁
S0,0 磷 光 磷光也是带状光谱
磷光较荧光光谱红移 磷光较荧光寿命长 荧光发射:10-9 10-7 s 磷光发射:10-4 10 s 荧光与磷光可能共存
适用体系不如UV-Vis广泛。
5-1-1 分子荧光/磷光分析原理(1)
分子荧光/磷光产生
光源 单色器
I0
基态分子
I t
检测器
激发态分子
激发态分子不稳定,当其返回基态时,多余的能量将以 何种途径释放?
单重态与三重态
基态 激发单重态 激发三重态
LUMO
HOMO
基态单重态至激发三重态为禁阻跃迁(难发生) ; ET1 ES1
质吸收光的过程,因此激发光谱与吸收光谱相似。
发射光谱:又称荧光(磷光)光谱,指激发波长固定时,发光 强度对波长变化的曲线。
380nm
510nm
镁-Oxine的激发光谱和发射光谱
ex
em
nm
激发光谱与发射光谱的绘制
激发光谱:改变激发波长,测量最强荧/磷光发射波长em处的
强度变化,以激发波长对荧/磷光强度作图可得到激发光谱。
荧光
磷光
分子发光分析(2)
分子发光与UV-Vis应用范围相似,但具有以下特点: 灵敏度高;检出限较UV-Vis法低24个数量级
