NSCLC诊断及治疗进展
晚期NSCLC一线化疗后维持治疗的进展

64
72
80
88
96
*PFS从随机化开始接受维持治疗计算;每6周评估一次
F. Cappuzzo. et al, Lancet Oncology 2010
EORTC08021 研究设计
接受一线4周期 含铂化疗的晚期 NSCLC患者 (N=173)
CR PR SD
安慰剂 (n=87) R 易瑞沙 (N=86)
Gaafar RM, et al. J Clin Oncol 28:7s, 2010 (suppl; abstr 7518).
– 进展风险降低39%
HR (95% CI)=0.61 (0.45, 0.83)
无进展生存概率 (%)
Log-rank p=0.002
中位OS (月, 95% CI) 安慰剂:2.9 (2.6, 3.7) 吉非替尼:4.1 (3.3, 6.0)
晚期NSCLC一线化疗后 维持治疗的进展
中山大学肿瘤防治中心 2011年2月19日 张力 教授 上海
维持治疗定义
一线含铂两联化疗 维持 (4 周期)
2-3线
诊断
缓解或稳定
PD
死亡
肿瘤体积最小时给予治疗
进展前尽可能拖延无进展生存期
临床目标:缓解症状复发或恶化
维持治疗定义
一线含铂两联化疗 维持 (4 周期)
换药维持治疗
Median PFS(月)
研究
Westeel Fidias Ciuleanu
维持药物
对照组 Vinorelbine 多西他赛 培美曲赛 3 2.7 2 维持组 5 5.7 4
HR(95% CL) for PFS
0.77(0.55-1.07) 0.71(0.55-0.92) 0.60(0.49-0.73)
非小细胞肺癌诊疗现状与展望

非小细胞肺癌诊疗现状与展望肺癌是世界范围内最常见的致死性恶性肿瘤之一,据统计每年全球新发肺癌病例约为180万,其中非小细胞肺癌(NSCLC)占80%至85%。
NSCLC不仅有较高的发病率和死亡率,而且此病患者大多已处于较晚期就诊,加之临床症状与体征不显著,因此极具挑战性。
本文旨在探讨NSCLC的诊断与治疗现状,以及未来的发展方向。
一、 NSCLC的分类与分期NSCLC包括腺癌、鳞癌和大细胞癌等亚型,其中腺癌是最常见的类型。
分期是NSCLC的关键因素之一,可以指导患者接受合理的治疗方案。
临床上常用的分期方法包括TNM分期和分子分期。
TNM分期主要依据肺癌的肿物大小(T)、淋巴结转移情况(N)和是否有血管内转移(M)等三个参数来分期,而分子分期则基于分子标志物对肿瘤进行分类和分期。
二、 NSCLC的临床症状与诊断NSCLC的临床症状常不明显,仅有乏力、咳嗽、胸闷等轻微体征,并且多出现在晚期。
因此,只有通过严谨的诊断程序才能确诊。
诊断过程通常包括肺部影像学和组织学检查,如X线、CT、MRI、PET-CT等检查。
此外,该疾病的确诊还需通过活检和组织学检查,以明确肺癌类型和分期。
三、 NSCLC的治疗现状NSCLC的治疗方案既包括手术、放疗、化疗等传统的治疗手段,也包括分子靶向治疗、免疫治疗等新型治疗手段。
对于不同层次的患者,治疗方案也存在相应的变化。
对于早期的NSCLC患者,手术是最主要也是最有效的治疗手段;对于中晚期患者,传统的化疗和放疗等手段常被用于综合治疗和缓解症状;而对于EGFR突变、ALK、ROS1重排等NSCLC患者,分子靶向治疗能够非常明显地提高生存率和治疗效果;最新的免疫治疗也已成为NSCLC治疗的新指南,该治疗方式通过抑制恶性肿瘤细胞的免疫逃逸,增强机体免疫应答,达到治疗效果。
四、 NSCLC治疗展望尽管现有的治疗手段已经取得了很大的进展和成就,但仍然有很多未解决的问题。
其中,如何精准分期和诊断、如何选择最佳治疗方案、如何提高治疗精准度和效果等问题是最紧迫的。
驱动基因阴性晚期NSCLC 一线免疫治疗

驱动基因阴性晚期NSCLC一线免疫治疗肺癌作为发病率第一的肿瘤,严重威胁人们的健康。
近年来,肺癌的诊疗从化疗到靶向治疗再到免疫治疗,引领肿瘤的精准治疗模式。
对于驱动基因阴性晚期非小细胞肺癌( non-small-cell lung cancer,NSCLC) 患者,多种程序性死亡受体 1( programmed death 1,PD-1) 和程序性死亡配体 1( programmed death-ligand 1,PD-L1) 抑制剂取得显著疗效,在晚期 NSCLC 一线、二线治疗中获得适应证,并丰富了从单药治疗到联合治疗的格局,使得“chemo- free”有望成为可能。
免疫治疗为肺癌治疗模式带来改变的同时,也对肺癌治疗方案、生物标志物的选择和相关不良反应的治疗带来一定的挑战。
2011 年 Nature 发表的《Cancer immunotherapy comes of age》点燃了免疫治疗的燎原之火,众多研究陆续推出,主要集中于程序性死亡受体1( programmed death 1,PD-1) 、程序性死亡配体1( programmed death-ligand 1,PD-L1) 和细胞毒性 T 淋巴细胞相关抗原-4( cytotoxic T lympho- cyte-associated antigen 4,CTLA-4) 抑制剂。
自 2013年美国《科学》杂志将癌症免疫治疗评为“重大突破”以来,PD-1 /PD-L1 抑制剂作为免疫治疗中的主力军,在癌症治疗领域备受瞩目。
2014 年美国食品药品监督管理局( Federal Food and Drug Adminstra- tion,FDA) 首先批准pembrolizumab 和nivolumab 用于晚期黑色素瘤治疗,其适应证不扩大。
其中,对非小细胞肺癌( non-small-cell lung cancer,NSCLC) 治疗的不断探索:从二线到一线,从晚期到局部晚期再到早期,从单药到联合,从泛人群到精准治疗,使得免疫治疗遍地开花。
靶向治疗在NSCLC治疗进展

针对肿瘤转移的靶向治疗
针对肿瘤细胞转移的靶向治疗
肿瘤细胞的转移过程包括粘附、侵袭、转移和增殖等阶段,针对这些阶段的靶向 药物包括抑制粘附分子、抑制转移相关激酶、抑制血管生成的靶向药物等,可抑 制肿瘤细胞的转移。
针对肿瘤微环境的靶向治疗
肿瘤微环境包括基质细胞、细胞外基质、血管等,针对这些成分的靶向药物包括 基质金属蛋白酶抑制剂、血管生成抑制剂等,可调节肿瘤微环境,抑制肿瘤细胞 的转移。
靶向治疗的临床应用
靶向治疗可作为nsclc患者的一线治疗
多项临床研究证实,对于EGFR突变或ALK融合的nsclc患者,TKI治疗或克唑替尼治疗可作为一线治疗方案,有 效缓解肿瘤进展并延长患者生存期。
靶向治疗联合化疗可提高疗效
多项研究证实,对于未突变或ALK融合的nsclc患者,采用TKI或克唑替尼联合化疗可进一步提高疗效,降低肿 瘤复发的风险。
nsclc概述
NSCLC是肺癌的一种类型,占所有 肺癌的80%~85%。
VS
它包括腺癌、鳞状细胞癌和小细胞 肺癌三个亚型。
靶向治疗在nsclc中的重要性
靶向治疗的出现为NSCLC患者提供了更多的 治疗选择和更好的生存获益。
它为患者提供了更安全的治疗方法,减少了 对身体的损害。
02
nsclc靶向治疗与其他治疗方式(如免疫治疗、化疗等)联合应用,以提高疗效、克服耐药性。
精准医疗
运用基因测序等精准医疗技术,为患者提供个性化的靶向治疗方案。
耐药性机制研究
深入探究靶向治疗的耐药性机制,为克服耐药性提供新思路。
针对未来nsclc治疗的建议与展望
要点一
加强国际合作
1
靶向治疗是一种有效的NSCLC治疗策略,能够 显著延长患者的生存期。
非小细胞肺癌2017版NCCN治疗指南中文版

非小细胞肺癌2017版NCCN治疗指南中文版非小细胞肺癌(NSCLC)是肺癌中最常见的类型,约占肺癌总数的80%至 85%。
对于 NSCLC 的治疗,科学合理的方案至关重要。
2017版 NCCN 治疗指南为临床医生提供了重要的参考和指导。
首先,我们来了解一下 NSCLC 的基本情况。
NSCLC 包括腺癌、鳞状细胞癌和大细胞癌等多种亚型。
其发病与吸烟、环境因素、遗传因素等密切相关。
患者在早期可能没有明显症状,随着病情进展,可能会出现咳嗽、咯血、胸痛、呼吸困难等表现。
在诊断方面,影像学检查如胸部 X 线、CT 扫描等是常用的方法。
对于疑似病例,往往需要进行病理活检来明确诊断和确定肿瘤的亚型。
此外,还会进行一系列的评估,包括肿瘤的大小、位置、是否有转移等,以制定个性化的治疗方案。
2017 版 NCCN 治疗指南对于早期 NSCLC 的治疗有明确的建议。
对于可手术的早期 NSCLC(IA、IB、IIA 和 IIB 期),手术切除是主要的治疗手段。
手术方式包括肺叶切除术、全肺切除术等,并可能会进行淋巴结清扫。
术后,根据肿瘤的病理特征和患者的具体情况,可能会考虑辅助化疗或放疗,以降低复发风险。
对于局部晚期 NSCLC(IIIA 和 IIIB 期),治疗方案则相对复杂。
对于一些可切除的病例,手术联合术前新辅助治疗或术后辅助治疗是常见的策略。
新辅助治疗通常包括化疗、放疗或同步放化疗,目的是缩小肿瘤体积,提高手术切除的成功率。
对于不可切除的局部晚期NSCLC,同步放化疗是主要的治疗方法。
晚期 NSCLC(IV 期)的治疗则侧重于全身性治疗。
化疗是常用的治疗手段之一,但随着医学的发展,靶向治疗和免疫治疗也在 NSCLC的治疗中发挥着越来越重要的作用。
靶向治疗是针对肿瘤细胞特定的分子靶点进行治疗。
例如,对于存在 EGFR 基因突变的患者,EGFR 酪氨酸激酶抑制剂(如吉非替尼、厄洛替尼等)可能会取得较好的疗效。
对于ALK 融合基因阳性的患者,ALK 抑制剂(如克唑替尼等)则是有效的治疗选择。
驱动基因阴性NSCLC

BEYOND:证实一线贝伐珠单抗联合含铂双药 化疗在中国人群中显著延长PFS及OS
中国,2011.5~2012.5
• 中国初治 • IIIB/IV期非鳞NSCLC • 年龄 ≥18岁 • ECOG PS 0-1 • n=276
1:1
贝伐珠单抗+卡铂/紫杉醇 3周方案, n=138 R
6个周期
贝伐珠单抗单药
RET • Cabozantinib • Alectinib • Apatinib • Vandetanib • Ponatinib • Lenvatinib
NTRK1 • Entrectinib • LOXO-101 • Cabozantinib • DS-6051b PIK3CA • LY3023414 • PQR 309 MET • Crizotinib • Cabozantinib
ECOG 4599:贝伐珠单抗对比化疗一线治疗晚期非鳞 NSCLC的3期多中心临床研究
OS首次延长至1年以上,显著改善ORR/PFS/OS 美国,(2001.7~2004.4)
• • • • • 初治的 IIIB, IV期或复发 非鳞癌 NSCLC n=878 贝伐珠单抗 +卡铂/紫杉醇 3周方案, n=434
EGFR敏感 • Gefitinib • Erlotinib • Afatinib • Osimertinib ALK • Crizotinib • Alectinib • Ceritinib • Lorlatinib • Brigatinib
ROS1 • Crizotinib • Cabozantinib • Ceritinib • Lorlatinib • DS-6051B HER2 • Trastuzumab emtansine • Afatinib • Dacomitinib
驱动基因阴性晚期NSCLC一线免疫治疗

驱动基因阴性晚期NSCLC 一线免疫治疗肺癌作为发病率第一的肿瘤,严重威胁人们的健康。
近年来,肺癌的诊疗从化疗到靶向治疗再到免疫治疗,引领肿瘤的精准治疗模式。
对于驱动基因阴性晚期非小细胞肺癌 ( non-small-cell lung cancer,NSCLC) 患者,多种程序性死亡受体 1( programmed death 1,PD-1) 和程序性死亡配体 1( programmed death-ligand 1,PD-L1) 抑制剂取得显著疗效,在晚期NSCLC 一线、二线治疗中获得适应证,并丰富了从单药治疗到联合治疗的格局,使得“chemo- free”有望成为可能。
免疫治疗为肺癌治疗模式带来改变的同时,也对肺癌治疗方案、生物标志物的选择和相关不良反应的治疗带来一定的挑战。
20n 年 Nature 发表的《Cancer immunotherapy comes of age》点燃了免疫治疗的燎原之火,众多研究陆续推出,主要集中于程序性死亡受体1( programmed death 1,PD-1) 、程序性死亡配体1( programmed death-ligand 1 PD-L1)和细胞毒性 T 淋巴细胞相关抗原-4( cytotoxic T lympho- cyte-associated antigen 4,CTLA-4) 抑制剂。
自 2013年美国《科学》杂志将癌症免疫治疗评为“重大突破”以来,PD-1/PD-L1抑制剂作为免疫治疗中的主力军,在癌症治疗领域备受瞩目。
2014 年美国食品药品监督管理局( Federal Food and Drug Adminstra- tion,FDA) 首先批准pembrolizumab 和nivolumab用于晚期黑色素瘤治疗,其适应证不扩大。
其中,对非小细胞肺癌(non-small-cell lung cancer NSCLC)治疗的不断探索:从二线到一线,从晚期到局部晚期再到早期,从单药到联合,从泛人群到精准治疗,使得免疫治疗遍地开花。
晚期NSCLC化疗进展课件
0.66 (0.58-0.75)
<0.001
0.06
8
1年生存率
2药 vs. 单药
13
4125
0.80 (0.70-0.91)
<0.001
0.03
5
3药 vs. 2药
10
22498
1.01 (0.85-1.21)
0.88
0.59
0
中位生存期
2药 vs. 单药
30
6022
Delbaldo C, et al. JAMA 2004; 292:470-484.
疗效
研究数
患者数
OR (95%CI)
P值 (治疗效应)
P值(异质性)
绝对获益(%)
ORR
2药 vs. 单药
33
7175
0.42 (0.37-0.47)
<0.001
<0.001
13
3药 vs. 2药
35
铂类单药地位的确立
第三代化疗药物含铂双药
中位总生存
6-8个月
8-10个月
10-16个月
组织学指导下的个体化治疗
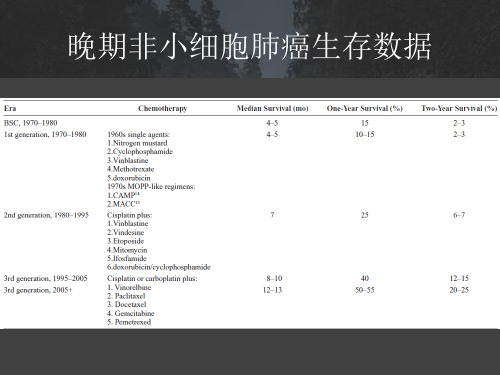
1998年《临床肿瘤研究杂志》 “1990s的研究显示,应用紫杉醇、多西紫杉醇、吉西他滨、长春瑞滨和伊立替康五种药物治疗具有更高的有效率和更长的生存期”
Bunn PA Jr. Kelly K. Clin Cancer Res. 1998; 4(5):1087-100
培美曲塞非鳞癌优选:开创化疗药物组织学分型治疗先河
NSCLC组织学分组
一线治疗Pem/Cis vs. Gem/Cis
维持治疗Pem vs. Placebo
二线治疗Pem vs. Doc
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 2.放射治疗
• 3.化学药物治疗
•
4.靶向治疗
•
5.中医中药(中国特色)
(一)外科治疗
• 适应症:I、II期的NSCLC和部分经过选择的IIIa (如T3N1M0)期。有N2的患者不宜马上进行手术切 除。至于IIIb、IV期肺癌,手术不应列为主要的 治疗手段。
• 方法:根据手术的程度和性质,分为四种: • ①完全性切除; • ②不完全性切除; • ③不确定切除 • ④剖胸探查术
• 8.原发肿瘤同一叶内出现单个或多个卫星结节
T4
• 任何大小的肿瘤已直接侵犯了下述结构之一者: • 1.纵膈 • 2.心脏或大血管 • 3.气管 • 4.喉返神经 • 5.食管 • 6.椎体 • 7.隆突 • 8.同侧非原发肿瘤所在的其他肺叶出现单个或多个结节
N——区域淋巴结
NNNx01: : :区没同域有侧淋区支巴域 气结淋 管不巴 周能结 围评转 淋价移 巴结和(或)同侧肺 门淋巴结和肺内淋巴结转移,包括原发肿瘤
截瘫,控制肿瘤对身体局部的破坏和改善症状。
• 3.术前放疗:目前不主张(肺上沟瘤除外),仅仅限于临床研究。
• 4.术后放疗:用于肿瘤切除不彻底,有残留,或术后病理证实手术切
全肺
• T2a:>3cm,≤5cm • T2b:>5cm,≤7cm
T : •
3
肿瘤最大径>7cm或任何大小的肿瘤已经直接侵犯了下述结构之一者:
• 1.胸壁(包括上沟瘤);
• 2.膈肌;
• 3.膈神经;
• 4.纵膈胸膜;
• 5.心包;
• 6.肿瘤位于距离隆突2cm以内的主支气管但尚未累及隆突;
• 7.全肺的肺不张或阻塞性炎症;
M1b:远处器官转移
2009第7版肺癌国际分期标准
TNM分期
• TNM分期包括非小细胞肺癌和小细胞肺癌,
以前小细胞肺癌所用的“局限期”和“广泛 期”两分法已不适用。
• 此外,目前国际上提出了在有条件的医院,
可探索肺癌的分子分期,即应用分子生物学 技术检测胸腔内淋巴结、外周血和骨髓标本 中应用常规方法检测不到的微转移来判断肺 癌的分期,更能准确地反映患者病期的早晚, 更个体化地制订治疗方案。但目前的方法尚 不成熟。
二、NSCLC治疗
治疗原则:
• 根据患者的身心状况; • 肿瘤的具体部位、病理类型、侵犯范围(病
期)和发展趋向;
• 结合细胞分子生物的改变,有计划地、合理
地应用现有的多学科各种有效治疗手段;
• 以最适当的经济费用取得最好的治疗效果,
同时最大限度地改善患者的生活质量。
NSCLC治疗方法:
• 1.外科治疗
的直接侵犯 N2:同侧纵膈和(或)隆突下淋巴结转移 N侧3斜:角对肌侧或纵锁膈骨、上对淋侧巴肺结门转淋移巴结,同侧或对
M——远处转移
M0:没有远处转移
M1:有远处转移
M1a:对侧肺叶出现的肿瘤结节、胸膜结节、 恶性胸腔积液或恶性心包积液
(大部分肺癌患者的胸前或心包积液是由肿瘤引起的,但如果胸腔积液 的多次细胞学检查未能找到癌细胞,胸腔积液又是非血性和非渗出性的, 临床判断该胸腔积液与肿瘤无关,这类型的胸腔积液不影响分期,患者 应归结于M0)
NSCLC治疗及其进展
Outline
• 1.肺癌TNM分期 • 2.肺癌治疗 • 3.中晚期NSCLC的综合治疗 • 4.NSCLC的专家共识(2013)
一、肺癌的TNM分期
• 目前采用的是2009年国际抗癌联盟(UICC)和国
际肺癌研究会(International Association for the Study of Lung Cancer,IASLC)公布的第7 版肺癌国际分期
公肺式段为数:—e拟po切FE除V1的=p没re有FE阻V1×塞(的1肺9—段阻数塞)的/ (19-阻塞的肺段数)
• (部分全)肺)epoFEV1=preFEV1×(1—拟切除的 • 肺段分为:右上叶3、右中叶2、右下叶5、
左上叶3、左舌叶2、左下叶4(共19)
术前肺功能评估
• 术后FEV1预测值和一氧化碳弥散量(DLCO)
预测值均>40%,血氧饱和度>90%的肺手术 死亡率低于10%,属于低危险组,可考虑手 术
• 术后FEV1预测值和一氧化碳弥散量(DLCO)
预测值均<40%者属于高危人群,不宜手术 治疗。
术前肺功能评估
• 3种试验值的其他任何组合属于肺功能临界
人群,可考虑做最大氧耗量(VO2max)运 动试验。
• VO2max>15ml/(kg·min)者可考虑肺叶或
术前肺功能评价
• FEV1>1.5L→肺叶切除术; • FEV1>2L→全肺切除术; • 对于以上不符合条件的患者,应进一步做肺
弥散功能,静息状态下的血氧饱和度测定和 (或)吸氧前后动脉血气分析,以及放射性 核素定量肺灌注扫描预测术后肺功能情况。
术前肺功能评估
• 术后FEV1预测值(epoFEV1) • (的肺肺段叶数))ep/o1F9E;V1=如pr果e有FE阻V1×塞(的1肺9段—拟,切计除算
T——原发肿瘤
• Tx:原发肿瘤不能评价;或痰、支 气管冲洗液找到癌细胞,但影像学 或支气管镜没有可视肿瘤。(即隐 性肺癌)
• T0:没有原发肿瘤证据 • Tis:原位癌
Tห้องสมุดไป่ตู้:
• 指肿瘤最大直径≤3cm,周围为肺或脏层胸膜所包
绕,镜下肿瘤没有累及叶支气管以上(即没有累 及主支气管)
• T1a:≤2cm(任何大小的非常见的表浅肿瘤,只
要局限于支气管壁,即使累及主支气管,也定义 为T1a)
• T1b:>2cm,≤3cm
T2:
• 指肿瘤最大直径>3cm但≤7cm,或符合以下任何 一点(具有这些特点的T2肿瘤,如果≤5cm或大小不能确定的归为T2a,如果>5cm和≤7cm归为T2b)
• 1.累及主支气管,但距离隆突≥2cm; • 2.累及脏层胸膜 • 3.扩展到肺门的肺不张或阻塞性肺炎,但不累及
全肺切除,术后死亡率低于20%
• VO2max<15ml/(kg·min)者可考虑局限性
切除(手术死亡率低于10%)或放疗/化疗 (死亡率<1%)。
二、放射治疗
• 肺癌放射治疗的分类:
• 1.根治性放疗:适合于原因不能手术或拒绝手术的I~II期的患者,局
部晚期的III期患者。
• 2.姑息性放疗:晚期肺癌骨转移的疼痛,脑转移的瘫痪,脊髓压迫的
