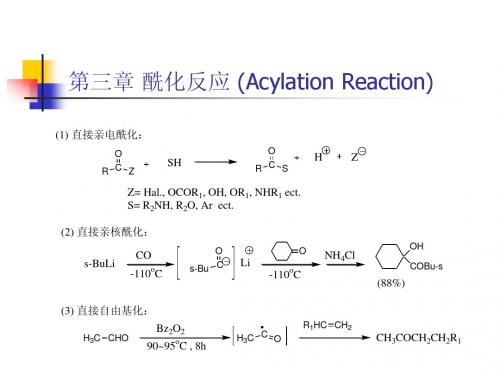
第三章 酰化反应
第三章 酰化反应

N
RCOOH + N S S N
2,2-二吡啶二硫化物
NO2
Ph3P Ph3P=O Et3N
RCOOH +
O N S C Cl
O N S C R
RCOCl + N SH
吡啶硫酚
Et3N
2-吡啶硫醇酯
优点:对仲、叔醇以及有位阻的伯醇效果较好;缺点: 硫醇酯具有特殊气味及毒性,应用受到限制。
CH3 H3C CH3 CH 3 (CH3)3COH/CH3CN/CuCl2 r.t. , 12min (96%) H3C CH3 COCl N SH H3C
CH3 CO CH3 S N
COOC(CH3)3
b.羧酸吡啶酯
OH HO(CH3)nCOOH I N CH3 (CH2)n O C O N CH3 O X Et3N , 7.5~8h I N CH3 O (CH2)n C O
c.羧酸三硝基苯酯 d. 羧酸异丙烯酯
3. 酸酐为酰化剂 酸酐是一个强酰化剂,反应具有不可逆性。酸酐多用 在反应困难或位阻较大的醇羟基的酰化上。 ①催化剂 酸性催化剂:硫酸、对甲苯磺酸、三氟化硼、氯化锌、 氯化钴 碱性催化剂:羧酸钠、吡啶、三乙胺、喹啉、N、N-二 甲基苯胺,作用:a.除掉氯化氢;b.催化作用。
C2H5
喹诺酮类抗菌药依诺沙星中间体 ③转变成其它基团
CH3 AlCl3/CS2 5℃, 3h CH3 COCH3 CH3COCl
CH(CH3)2
CH(CH3)2
(2)药物结构修饰 )
S OAc COO NHCOCH3 F3C N CH2CH2CH2 N (1) CH2OCOCH2CH2COOH CO HO OH NHCOCHCl2 CH OH O (3) O2N (4) CH CH2OCOC15H31 (2) N CH2CH2OCOC6H13
药物合成反应第三章酰化反应

+ CH3OH
O O C(CH2)3CH3
+ H2O
CH=CH-COOCH3
COOH
对甲苯磺酸
TsOH
+ C12H25OH Xylene
HO
OH
OH
COOC12H25
HO
OH
OH
(c) DCC 二环己基碳二亚胺
R-N=C=N-R
CH3-N=C=N-C(CH3)3 CH3CH2-N=C=N-(CH2)3-NEt2 (CH3)2CH-N=C=N-CH(CH3)2
OH O=C-R
+OH R-C-OC(CH3)3
属于SN1机理
-H+
O
R-C-OC(CH3)3
按SN1机理进
行反应,是烷 氧键断裂
* 3oROH按此反应机理进行酯化。 * 由于R3C+易与碱性较强的水结合,不易与羧酸结合,
故逆向反应比正向反应易进行。所以3oROH的酯化 反应产率很低。
该反应机理也 从同位素方法 中得到了证明
②羧酸的结构
R带吸电子基团-利于进行反应;R带给电子不利于反应 R的体积若庞大,则亲核试剂对羰基的进攻有位阻,不利于反应进行 羰基的a位连有不饱和基和芳基,除诱导效应外,还有共轭效应,使酸性增强
③催化剂 i提高羧酸反应活性
(a)质子酸催化法: 浓硫酸,氯化氢气体,磺酸等
O
H+
R C OH
O R''OH + R C OH R'
O R'' HO C R ' - H+
R'' OH
H O
O
C
第三章酰化反应-药物合成反应gcz

v 1 0.84 0.84 0.64 0.68 0.47 0.026
10
叔醇由于其立体位阻大且在酸性介质中易脱去羟基形成正碳 离子,同时形成的酯也已发生脱酯氧基而形成正碳离子,正碳 离子的稳定性使得反应不易生成酯。
C OH+H C + RCOOH
C OH2
C +H2O
O
C O CR +H
与叔醇一样,苄醇、烯丙醇由于脱羟基形成稳定的碳正离子,碳正离子与水 作用而恢复成醇的趋向大于形成酯的趋向,故同样酰化较为困难。
配 位 键 (增 加 C的 正 电 性 )
O AlCl3
OAlCl3
R
R
OH -HCl
OAlCl2
OAlCl3 R
OAlCl2
B F 3 / E t 2 O
H O O C C H C H C O O H + C H 3 O H2 0 hH 3 C O O C C H C H C O O C H 3
C O 2 H + C H 3 O HB F 3
C O 2 C H 3
对于不稳定的酸和醇(如含双键)不能用质子酸催化,而
这类催化剂尤其是BF3可避免双键的分解或重排。
15
(3) 酸性树脂(Vesley)催化法: 采用强酸型离子交换树脂加硫酸钙法,此法可加
快反应速度、提高收率。
而且此法后处理简单。
V esley法
C H 3C O O H+C H 3O H
O O
21
第三章 酰化反应
氧原子上的酰化反应(酯的制备)
由于三苯基鏻的位阻较大,所以形成醇-三苯基鏻活泼中间体 的能力与醇的大小有很大关系,这一点可以用来对不同取代的 醇进行选择性酯化。
P h 3 P + E tO O C -N + N -C O O E t
第三章 酰化反应 (Acylation Reaction)
RCOOR1
N N N N C O O C 2H 5 CH3 C H COOCH3
R C O O R 1=
C O O C 2H 5 OCH3
(9 9 % )
(9 7 % )
(9 7 % )
4. 酰氯为酰化剂
RCOCl 反应机理: R 1O H RCOCl
N O R H C OR N N COR
o
OAc C 9H 19
HO
C H 2O A c
(6 8 % ) Py
AcO C H 2O A c
HO
C H 2O H
(6 2 % )
(1)羧酸-三氟乙酸混合酸酐
RCOOH (C F 3 C O ) 2 O
O R F 3C C O C O
RCO O CO CF3
C F 3C O O H
OH
H
R F 3C
R 1O
M eO O C
COOMe O O
i- P r O O C
C O O P r -i O O
i-P rO H
T i(O P r-i) 4 70 C , 3h
o
(9 1 % )
M eO O O
C 12H 25
OH Ar
DM AP
O Ar O O
C 12H 25
A r-= 1 -萘 基
O COOMe Ph OH
Ph OCOPh O TM S OCOPh
B u 2 S n O /T o l re flu x
Ph O O S nB u2
PhC O C l r.t., 1 h
TM SCl r.t., 1 ~ 2 h
Ph
O TM S
(9 8 % )
药物合成反应-第三章---酰化反应

第二节 氧原子的酰化反应
O ROH + R' C L
O R' C
OR + HL
• 是一类形成羧酸酯的反应 • 是羧酸的酯化反应 • 是羧酸衍生物的醇解反应
一、醇的氧酰化
•1) 羧酸为酰化剂
R-OH + R'COOH
• 提高收率:
R'COOR + H2O
第三章 酰化反应
Chapter 3
Acylation Reaction
概述
• 1 定义: 有机物分子中O、N、C原子上导入 酰基的反应
O
R C L + Nu-H
酰化剂
被酰化物
O R C Nu + HL
L: X, OCOR, OH, OR', NHR Nu: R'O(O), R''NH(N), Ar(C)
仅有少量空阻大的羧酸按此反应机理进行
(3)影响因素
① 醇结构影响
•醇的结构对酰化反应的影响 •立体影响因素:伯醇>仲醇>叔醇、烯丙醇 •叔碳正离子倾向与水反应而逆转
• 电子效应的影响 • 羟基a位吸电子基团通过诱导效应降低O上
电子云密度, 使亲核能力降低 • 苄醇、烯丙醇由于p-p共轭, 使活性降低
O
I
96%
ii 用来提高醇的反应活性
偶氮二羧酸酯法(活化醇制备羧酸酯)
Mitsunobu reaction.
Mechanism
(4)应用特点
•① 伯醇酯的制备
• ② 仲醇酯的制备 薄荷醇
• ③ 叔醇酯的制备
• 2.羧酸酯为酰化剂 • (1)反应通式
第三章++酰化反应

RCOCl O R C N HOR'
N
N COR Cl
Cl
N H
Cl
+ RCOOR'
28
H3C
N CH3
CH3 N CH3 OH OBz
OH
OH
TMEDA + BzCl -78oC, 2h
99%
Bu-t OH Cl + Cl Bu-t O O
DMAP AlCl3 reflux
Bu-t O Cl Bu-t O O AlCl3
O R C OR'' OR'
RCOOR' + R''O
RCOOR'' -R'O
MeO O O
C12H25 +
OH DMAP Ar
O Ar O O
C12H25
Ar = 1-Naphtyl 97%
14
为了提高酯的酰化能力,开发了许多酰化能力比较强的活性 酯,以用于合成较为复杂的化合物,如肽、大环内酯等,这 里重点介绍几类活性酯。
NMe2 DMF/POCl3
NMe2 CHNMe2 Cl H2O
NMe2 CHO
2
酰化反应的难易由被酰化物结构和酰化剂(acylating agents) 活性决定 总的来说:
RCH2 > RNH > RO > RNH2 > ROH
RCOX > (RCO)2O > RCOOR', RCOOH > RCONHR'
+ CH3COCH3
92%
20
(5)1-羟基苯并三唑(HOBt)的羧酸酯(温和条件下面反应)
《药物合成反应》-闻韧主编第三章酰化反应-知识点总结

#2.11打卡# 完成学习目标第三章酰化反应Acylation Reaction1 定义:有机物分子中O、N、C原子上导入酰基的反应.2 分类:根据接受酰基原子的不同可分为:氧酰化、氮酰化、碳酰化3 用途:药物本身有酰基活性化合物的必要官能团结构修饰和前体药物羟基、胺基等基团的保护。
酰化机理:加成-消除机理加成阶段反应是否易于进行决定于羰基的活性:若L的电子效应是吸电子的,不仅有利于亲核试剂的进攻,而且使中间体稳定;若是给电子的作用相反。
根据上述的反应机理可以看出,作为被酰化物质来讲,无疑其亲核性越强越容易被酰化。
具有不同结构的被酰化物的亲核能力一般规律为;RCH2->R—NH->R—O->R—NH2>R—OH。
在消除阶段反应是否易于进行主要取决于L的离去倾向:L-碱性越强,越不容易离去,Cl- 是很弱的碱,-OCOR的碱性较强些,OH-、OR-是相当强的碱,NH2-是更强的碱。
RCOCl>(RCO)2O>RCOOH 、RCOOR′ >RCONH2>RCONR2′R: R为吸电子基团利于进行反应;R为给电子基团不利于反应R的体积若庞大,则亲核试剂对羰基的进攻有位阻,不利于反应进行酸碱催化碱催化作用是可以使较弱的亲核试剂H-Nu转化成亲核性较强的亲核试剂Nu-,从而加速反应。
酸催化的作用是它可以使羰基质子化,转化成羰基碳上带有更大正电性、更容易受亲核试剂进攻的基团,从而加速反应进行。
氧原子的酰化反应是一类形成羧酸酯的反应,是羧酸和醇的酯化反应,是羧酸衍生物的醇解反应醇的结构对酰化反应的影响伯醇(苄醇、烯丙醇除外)>仲醇>叔醇1) 羧酸为酰化剂:提高收率:(1)增加反应物浓度(2)不断蒸出反应产物之一(3)共沸除水、添加脱水剂或分子筛除水。
(无水CuSO4,无水Al2(SO4)3,(CF3CO)2O,DCC。
)加快反应速率:(1)提高温度(2)催化剂(降低活化能)催化剂(1)质子酸催化法: 无机酸:浓硫酸,氯化氢气体,有机酸:苯磺酸,对甲苯磺酸等。
酰化反应

定义:有机化合物分子中引入
酰基的反应称为酰化反 应。
用途1:活性化合物的必要官能团
O2N OHNH2 C C CH2OH H H OHNHCOCHCl2 C C CH2OH H H Cl2CHCO2Me
O2N
降低氨基毒性
COOH OCOCH3
O N H
N N S SO2NH2
用途2:结构修饰和前体药物
H N Cl N O O O Cl N H N O OH
用途3:羟基、胺基等基团的保护
H2N Me Ac2O
AcHN
Me
KMnO4
AcHN
CO2H
H2O/H+
H2N
CO2H
防止氧化副反应
酰化反应
直接酰化反应 间接酰化反应
主要发生在碳、氧、氮、硫原子上
反应类型
•亲电酰化反应 •亲核酰化反应
•自由基酰化反应
COOH
+
OH PPA/DCC COO 12h NO2 90% NO2
COOH +
OH
H2SO4/H3BO3 COO 24h 100%
Ac-TMH
Ac-TMH
• 3.1.8 羟基保护
方法:
• 甲酸酯
• 乙酸酯
• 苯甲酸酯及其衍生物
3.1.8.1.甲酸酯保护基
• 特点是易于形成,并可以在乙酰基及其他酰基存在
• 3.1.1.3 Vesley法:强酸性阳离子交换树脂
3.1.1.4 DCC及其类似物脱水法
• DCC (二环己基碳二亚胺)
R C
O O H O
+
N C N NH + R' O H N O N C N H H
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O R C O R C O R C
第一节 氧、氮原子上的酰化反应
第二节 碳原子上的酰化反应
第一节 氧、氮原子上 的酰化反应
活性:胺基>羟基
脂胺>芳胺
伯胺>仲胺 醇>酚 伯醇>仲醇>叔醇
常用的酰化试剂:
酰胺、酯、羧酸、 酸酐、酰卤、烯酮
• 烯酮作酰化剂
R2C C O + R'OH R2C C OH OR' R2CH O C OR'
• 醇的卤置换 • 酚的卤置换
• 醚的卤置换 • 羧酸的卤置换 • 卤化物的卤置换
一、醇的卤置换:亲核取代
ROH + HX
• 醇羟基活性:
RX + H2O
• 卤化剂:HX, PX3, PX5, SOCl2等
烯丙基醇>苄醇>叔醇>仲醇>伯醇
• HX活性:HI>HBr>HCl>HF
亲核取代机理
ROH + HX SN1: ROH2
Cl
CCl2 H CCl2 O
O CHCl2 H2O
CHO
Vilsmeier甲酰化反应
芳香化合物、杂环化合物及活泼 烯烃化合物用二取代甲酰胺及氧氯化 磷处理得到醛类的反应称Vilsmeier甲 酰化反应。是芳香环的甲酰化反应最 普通的方法。
ArH + R1 R2 N C H O POCl3 R1 ArCHO + NH R2
酚类、酚醚及许多杂环化合物如 吡咯、吲哚、呋喃和噻吩等可反应。
CH3O AlCl3 HCN,HCl HO CHO OH Zn(CN) 2 HCl OH CHO
Hoesch反应
腈类化合物与HCl在ZnCl2催化下, 与具有羟基或烷氧基的芳烃进行反应 生成酮亚胺盐,水解成具有羟基或烷 氧基的芳香酮的反应称为Hoesch反应。
机理
R1 R2 N C H + POCl3 O R1 R2 Cl N C H OPOCl3 R1 R2 Cl N C H OPOCl3
R3 N
R4 + R1 R2 Cl N C H
R3 N
R4 H CH N Cl R4 N CHO + HN R1 R2 H R1 R2
R3 N
R4 CH N Cl R1 R2 H2O
eg:
CH3 CH COOC2H5 + CH2 C O OH H2SO4 CH3 CH COOC2H5 OCOCH3 t BuOH + CH2 C O
(98%)
CH3COOBu t
(89%)
• 酰卤作酰化剂
O RC X + R'NH2 RCONHR' + HX
吡啶,三乙胺,N,N-二甲基苯胺等缚酸剂
•-烷氧基乙酰化
•烷氧羰基化 •邻苯二甲酰化(氨基保护)
第二节
碳原子上 的酰化反应
一、芳烃的C-酰化
二、烯烃的C-酰化 三、羰基化合物的-位C-酰化 四、“ 极性反转”的应用
一、芳烃的C-酰化
1.羧酸衍生物在Lewis酸催化下对
芳烃的直接亲电酰化反应 2.通过某些具有碳正离子活性的中 间体对芳烃进行亲电取代后再经 分解转化为酰基的间接酰化反应
对双键、羰基、烷氧基、酯基影响很少
•草酰氯(COCl)2用于结构中有对酸 敏感的官能团或结构的羧酸。
O OH (COCl)2 O OH COCl
PhH r.t CO2K O O CO2H
Cl C C Cl/PhH r.t, 12h OAc
COCl
OAc
~97%
Ph CH CH CO2H
SOCl2 , 60min
+ +
快
+
ROH2 + X
+
-
慢 快
R + H2O RX
形成R+离子,∴叔醇、苄醇、烯丙醇为SN1
R +X
-
SN2:
+ ROH2+ X
-
X R OH2
X R + H2O
伯 醇
过渡态
• 高活性叔醇、苄醇可用浓盐酸或HCl反 应 CH CH
3
CH3 C OH CH3
HCl
3
CH3 C Cl CH3
Friedel-Crafts酰化反应
酰卤、酸酐、羧酸、羧酸酯、
烯酮等酰化剂在Lewis酸催化下对 芳烃进行亲电取代而生成芳香酮类
的反应称为Friedel-Crafts酰化反应。
它是制备芳酮的最重要的方法之一。
+ RCOZ
Lewis酸
COR + HZ
Z=X, R’COO-, R”O-, HO-等
Lewis酸有:AlCl3,FeCl3,BF3,SnCl4
60~70℃, 0.5hr
三、醚的卤置换
R O R' HX RX + R'OH
HX:HI, HBr, KI/H3PO4
eg:
KI/H3PO4/P2O5 O , 3hr ICH2CH2CH2CH2I
1,4-二碘丁烷
四、羧酸的卤置换
O R C OH
卤化剂
O R C X
卤化剂:PX3, PX5, POX3,SOX2
Br2/NaOH 或NaOBr H2O
O (CH3)3CCCBr3
(CH3)3CCOOH + HCBr3
溴仿
五、羧酸衍生物的-卤取代
亲电取代机理
RCOX, RCN, (RCO)2O, CH2
COOC2H5 COOC2H5
eg:
CH2
COOC2H5 COOC2H5 Br CH
Br2, CCl4
COOC2H5 COOC2H5
Ph CH CH COCl SOCl2 CH2COCl 。 CH2CO2Me 30~40 , cker(汉斯狄克)反应
羧酸银盐和溴或碘反应,脱去 CO2,生成比原反应物少一个C的
卤代烃。
RCO2Ag + X2 RX + AgX + CO2
R3
H3C H3C
N
DMF/POCl3 H3C H3C Ph N N H COOC 2H5 CH3
N
CHO
84%
/POCl3
CHO ,1h
CHO N H COOC 2H5
99.5%
二、烯烃的C-酰化
烯烃与酰氯在AlCl3存在下可发生脂肪 碳原子的Friedel-Crafts反应,从而生成C-
酰化物。
Dieckmann分子内酯缩合反应
己二酸、庚二酸和辛二酸酯用金属 钠处理时,发生分子内Claisen酯缩合
分别得到5,6,7员环化合物的反应称为 Dieckmann分子内缩合反应。
-NR2为-N(CH3)2, -N=C(NMe2)2,
N
• 酸酐作酰化剂
混 H3C 合 酸 酐 法
CH3 H3C (CF3CO)2O r.t. 10min CH3 H3C COO CH3 H C 3 Cl CH3(CH2)2 CH COOH + t CH3 (CH3)2N 1.5h N CH3(CH2)2 CH COOBu CH3 t BuOH + Cl COCl Cl COOH + HO CH3 H3C H3C
CH2(COCl)2 + 2 (CH3)3COH C6H5N(CH3)2 CH2[COOC(CH3)3]2 。 30 ,4h
(84%)
COCl
HN(CH3)2
CON(CH3)2
(89%)
4-取代氨基吡啶催化剂
NR2 + RCOX N R'OH
NR2 H N OR'
O C NR2 RCOOR' + N H X R
• 伯醇常用Lucas试剂(浓HCl+ZnCl2反应)
浓HCl CH3(CH2)2CH2Cl CH3(CH2)2CH2OH ZnCl2
二、酚的卤置换
酚羟基活性小,必须用PCl5, POCl3, 而不用 HX, SOCl2
CH3 POCl3 N OH OH , 0.5hr N Cl Br CH3
Ph3PBr2 CH3CN
第三章 酰化反应
• 碱催化机理
C C H O OH C C O X X OH 慢 (-H 2O) C C O X2 C C
快 X O ( -X )
卤仿反应
乙醛或甲基酮(CH3CO-)在 碱性条件下与过量卤素作用, -H全被X取代生成少一个碳原 子的酸和卤仿。
O (CH3)3CCCH3
-甲基酮
活性:脂肪羧酸>芳香羧酸
芳香羧酸:推电子取代基>无取代
>吸电子取代基
• PCl5活性大,适用于吸电子基芳酸
O2N COOH PCl5 O2N , 0.5hr COCl
• PBr3/PCl3活性较小,一般用于脂肪羧酸
PBr3 COOH COBr
• SOCl2是由羧酸制备酰氯常用试剂
RCOOH + SOCl2 RCOCl + SO2 + HCl
+ Ph3P O N S C R O
(2)羧酸吡啶酯
+ HOOC N CH3.I CH2 OH n O C O C O + ( CH2 )n O Cl CH2 Et3N, OH 7.5~8h n
N CH3.I
N CH3
O
n=5 (89%) n=11 (69%)
羟基及氨基的保护
•甲酰化
•乙酰化 •卤代乙酰化
(97%)
(95%)
• 羧酸作酰化剂
DCC脱水法(二环己基碳化二亚胺)
