新鲁科版选择性必修2第3章 第1节 认识晶体课件(54张)
合集下载
认识晶体鲁科版课件
关键是第三层,对第一、二层来说,第三层可以有两种最紧密的堆积方式。
六方最密堆积
第二种排列方式: 是将球对准第一层的 2,4,6 位,不同于 AB 两层的位置,这是 C 层。
1
2
3
4
5
6
1
2
3
4
5
6
1
2
3
4
5
6
1
2
3
4
5
6
面心立方最密堆积的前视图
A
B
CALeabharlann ABC第四层再排 A,于是形成 ABC ABC 三层一个周期。 得到面心立方最密堆积—A1型
2:假如:晶胞是六方柱型,晶胞中微粒数如何算?
晶胞中微粒数=顶点微粒数X 1/6+棱微粒数X 1/3 +面微粒数 X 1/2 +体内微粒数 X 1
12 X 1/6 + 2 x ½ + 3 x 1 = 6
立方晶胞
体心:
1
面心:
1/2
棱边:
1/4
顶点:
1/8
小结:晶胞
1、概念:描述晶体结构的基本单元
如NaCl配位数为6,即每个Na+离子周围直接连有6个CI-,反之亦然。
分子的密堆积
(与CO2分子距离最近的CO2分子共有12个 )
干冰的晶体结构图
由于范德华力没有方向性 和饱和性,因此分子间尽可 能采取紧密排列方式,但分 子的排列方式与分子的形状 有关。如:作为直线型分子 的二氧化碳在空间是以A1型 密堆积方式形成晶体的。
三﹑晶胞
1. 晶胞:描述晶体结构的基本单元
蜂巢与蜂室
铜晶体
铜晶胞
晶体与晶胞的关系可用蜂巢与峰室的关系比喻然而蜂巢是有形的,晶胞是无形的,是人为划定的。
六方最密堆积
第二种排列方式: 是将球对准第一层的 2,4,6 位,不同于 AB 两层的位置,这是 C 层。
1
2
3
4
5
6
1
2
3
4
5
6
1
2
3
4
5
6
1
2
3
4
5
6
面心立方最密堆积的前视图
A
B
CALeabharlann ABC第四层再排 A,于是形成 ABC ABC 三层一个周期。 得到面心立方最密堆积—A1型
2:假如:晶胞是六方柱型,晶胞中微粒数如何算?
晶胞中微粒数=顶点微粒数X 1/6+棱微粒数X 1/3 +面微粒数 X 1/2 +体内微粒数 X 1
12 X 1/6 + 2 x ½ + 3 x 1 = 6
立方晶胞
体心:
1
面心:
1/2
棱边:
1/4
顶点:
1/8
小结:晶胞
1、概念:描述晶体结构的基本单元
如NaCl配位数为6,即每个Na+离子周围直接连有6个CI-,反之亦然。
分子的密堆积
(与CO2分子距离最近的CO2分子共有12个 )
干冰的晶体结构图
由于范德华力没有方向性 和饱和性,因此分子间尽可 能采取紧密排列方式,但分 子的排列方式与分子的形状 有关。如:作为直线型分子 的二氧化碳在空间是以A1型 密堆积方式形成晶体的。
三﹑晶胞
1. 晶胞:描述晶体结构的基本单元
蜂巢与蜂室
铜晶体
铜晶胞
晶体与晶胞的关系可用蜂巢与峰室的关系比喻然而蜂巢是有形的,晶胞是无形的,是人为划定的。
第三章第一节认识晶体课件高二化学鲁科版选择性必修2

特定的对称性 固定的熔沸点
晶体类型
离子晶体 金属晶体 共价晶体 分子晶体
构成微粒
微粒间的相互作用
阴阳离子 金属阳离子、自由电子
离子键 金属键
原子 分子
共价键 分子间作用力
实例
NaCl Cu 金刚石 冰
思考感悟
1.分子晶体与共价晶体都是由非金属元素组成的,其微粒间的作用力都是分子间作用力吗? 提示:不是,共价晶体微粒间作用力为共价键,分子晶体微粒间作用力为分子间作用力, 包括范德华力和氢键。
第三章
不同聚集状态的物质与性质
第一节 认识晶体
学习目标
熟知晶体的概念、晶体的类型和晶体的分类依据;
知道晶胞的概念及其与晶体的关系,会用“切割法”确定晶胞 中微粒的数目和化学式。
复习回顾
金属键:_“__自___由__电__子__”__和___金__属__阳__离___子__之__间__的__相___互__作__用__。_________________________________________________ 离子键:_阴__阳___离__子__间__的__静___电__作__用__,___包__括__静__电__吸___引__力__和__静__电___排__斥__力__。______________________________________ 配位键:_一__方___提__供__空__轨__道___,__一__方__提___供__孤__电__子__对___形__成__的__化__学___键__。__________________________________________ 分子间作用力包括___范__德__华___力______和___氢__键____。 共同影响物质的__熔___沸__点________________。___氢__键_______还影响物质的___溶___解_______和____电__离__________。
鲁科版高二化学选修三第三章 第1节 认识晶体课件(共33张PPT)

第1课时 晶体的特性和晶体结构的堆积模型
【学习目标】
1.了解晶体的概念、重要特征和简单分类。
2.通过等径圆球与非等径圆球的堆积模 型认识晶体中微粒排列的周期性规律。
观察图片,这些固体在外形上有什么区别?
Cu晶 体结 构示 意图
NaCl晶 体结构 示意图
构成晶体与非晶体的微粒在空间的排列有何不同?
12
6
3
54
12
6
3
54
在密置双层的基础上再加【第三层】的方式: 第三层球与第一层球重叠(即A3型密堆积)
第三层球的位置不同于第一、二层球的位置 (即A 1型密堆积)
关键是第三层,对第一、二层来说,第三层可以有
两种最紧密的堆积方式。 第一种是排列方式:将球对准第
下图是A3型最 密堆积的前视图
一层的球。
二、晶体结构的堆积模型
【问题导学】
1、各类晶体的构成微粒为什么尽可能采 取密堆积的形式形成晶体?
2、如何通过建立模型认知紧密堆积模型?
3、各类晶体内部微粒的堆积原理有何异 同?
1、为什么在金属晶体、离子晶体、分 子晶体中各微粒尽量采取紧密堆积的 排列方式?
【提示】 由于在金属晶体、离子晶体和分子晶 体的结构中,金属键、离子键和分子间作用力均 无方向性,因此都趋向于使原子、离子或分子吸 引尽可能多的其他原子、离子或分子分布于其周 围,并以密堆积的方式降低体系的能量,使晶体 变得比较稳定。
B
A
12
C
6
3
B
54 A
A1型最密堆积的前视图
:在密堆积中,一个原子或离 子周围所邻接的原子或离子数目。
A3型最密堆积
配位数 12 ( 同层 6,上下层各3 )
【学习目标】
1.了解晶体的概念、重要特征和简单分类。
2.通过等径圆球与非等径圆球的堆积模 型认识晶体中微粒排列的周期性规律。
观察图片,这些固体在外形上有什么区别?
Cu晶 体结 构示 意图
NaCl晶 体结构 示意图
构成晶体与非晶体的微粒在空间的排列有何不同?
12
6
3
54
12
6
3
54
在密置双层的基础上再加【第三层】的方式: 第三层球与第一层球重叠(即A3型密堆积)
第三层球的位置不同于第一、二层球的位置 (即A 1型密堆积)
关键是第三层,对第一、二层来说,第三层可以有
两种最紧密的堆积方式。 第一种是排列方式:将球对准第
下图是A3型最 密堆积的前视图
一层的球。
二、晶体结构的堆积模型
【问题导学】
1、各类晶体的构成微粒为什么尽可能采 取密堆积的形式形成晶体?
2、如何通过建立模型认知紧密堆积模型?
3、各类晶体内部微粒的堆积原理有何异 同?
1、为什么在金属晶体、离子晶体、分 子晶体中各微粒尽量采取紧密堆积的 排列方式?
【提示】 由于在金属晶体、离子晶体和分子晶 体的结构中,金属键、离子键和分子间作用力均 无方向性,因此都趋向于使原子、离子或分子吸 引尽可能多的其他原子、离子或分子分布于其周 围,并以密堆积的方式降低体系的能量,使晶体 变得比较稳定。
B
A
12
C
6
3
B
54 A
A1型最密堆积的前视图
:在密堆积中,一个原子或离 子周围所邻接的原子或离子数目。
A3型最密堆积
配位数 12 ( 同层 6,上下层各3 )
最新-高中化学 第三章第一节《认识晶体》课件 鲁科版选修3 精品

化学精品课件:第三章 第一节《认识晶体》
(鲁科版选修3)
《认识晶体》
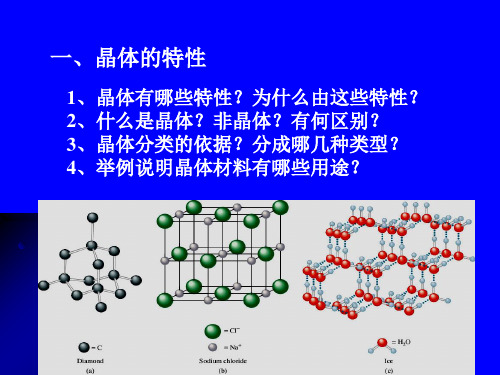
食盐
雪花
金刚石
一、离子晶体
1、定义
离子间通过离子键结 合而成的晶体。
每个Na+周围有六个Cl-
每个Cl-周围有六个Na+
2、离子晶体的特点 (1)无单个分子存在
(2)硬、密度较大 熔、沸点较高
熔点 沸点
NaCl 801℃ 1413℃ CsCl 645℃ 1290℃
(A)食盐和冰的熔化 (B)金刚石和晶体硅的熔化 (C)二氧化硅和干冰的熔化 (D)纯碱和烧碱的熔化
2、下列各组物质的晶体中化学键类型相
同,晶体类型也相同的是( B ) (A)SO2和SiO2 (B)CO2和H2O (C)NaCl和HCl
(D)NaOH和Na2O2
【作业】
1、阅读教材,复习本节所讲内容 2、完成《目标测试》P30~P31习题。
三种晶体的比较
晶体类型 微粒 结合力 熔沸点 典型实例
离子晶体 离子 离子键 分子晶体 分子 范德华力 原子晶体 原子 共价键
较高 较低 很高
NaCl、NH4Cl CO2、He金刚石、SiO2关于金石和石墨性质的比较金刚石
石墨
【反馈练习】
1、实现下列变化时,需克服相同类型作
用力的是( B D )
分子间作用力存在“分子之间”。
2、强度:
化学键>分子间作用力
2、分子晶体的特点
(1)有单个分子存在
(2)熔、沸点较低 硬、密度较小
熔点 沸点
CO -199℃ -191.5℃
干冰
(CO2)
-78.4℃
3、易形成分子晶体的物质
H2、Cl2、He
(鲁科版选修3)
《认识晶体》
食盐
雪花
金刚石
一、离子晶体
1、定义
离子间通过离子键结 合而成的晶体。
每个Na+周围有六个Cl-
每个Cl-周围有六个Na+
2、离子晶体的特点 (1)无单个分子存在
(2)硬、密度较大 熔、沸点较高
熔点 沸点
NaCl 801℃ 1413℃ CsCl 645℃ 1290℃
(A)食盐和冰的熔化 (B)金刚石和晶体硅的熔化 (C)二氧化硅和干冰的熔化 (D)纯碱和烧碱的熔化
2、下列各组物质的晶体中化学键类型相
同,晶体类型也相同的是( B ) (A)SO2和SiO2 (B)CO2和H2O (C)NaCl和HCl
(D)NaOH和Na2O2
【作业】
1、阅读教材,复习本节所讲内容 2、完成《目标测试》P30~P31习题。
三种晶体的比较
晶体类型 微粒 结合力 熔沸点 典型实例
离子晶体 离子 离子键 分子晶体 分子 范德华力 原子晶体 原子 共价键
较高 较低 很高
NaCl、NH4Cl CO2、He金刚石、SiO2关于金石和石墨性质的比较金刚石
石墨
【反馈练习】
1、实现下列变化时,需克服相同类型作
用力的是( B D )
分子间作用力存在“分子之间”。
2、强度:
化学键>分子间作用力
2、分子晶体的特点
(1)有单个分子存在
(2)熔、沸点较低 硬、密度较小
熔点 沸点
CO -199℃ -191.5℃
干冰
(CO2)
-78.4℃
3、易形成分子晶体的物质
H2、Cl2、He
【课件】认识晶体+课件高二下学期化学鲁科版(2019)选择性必修2

X射线衍射测定晶体结构的实验原理示意图
晶体形成的途径
1、熔融态物质凝固 4. 什么是晶胞?
2、气态物质冷却不 经液态直接凝固 (凝
华)
3、溶质从溶液中 析出
二. 晶体结构的基本重复单元——晶胞
1.晶胞含义:晶体结构中最小的重复单元。
墙与砖 整个晶体就是晶胞重复排列而成的。 可以从一个晶胞推断晶体的结构和性质。
3.晶体的分类 根据晶体内部微粒和相互作用不同
晶体
微粒种 类
相互作 用力
离子晶体 阴阳离子 离子键
金属晶体 金属阳离子 和自由电子
金属键
共价晶体 分子晶体
原子 共价键
分子
分子间作用力
(范德华力、氢键)
晶体类别的判断:
离子晶体:含离子键的化合物 金属晶体:金属单质与合金 分子晶体:稀有气体、只含共价键的大多数物质 原子晶体:只含共价键的少数物质:金刚石、石墨、 晶体硅、晶体硼、碳化硅、SiO2等
非晶体:内部微粒无周期性重复排列构成的固体物质。
晶体的内部微粒排列 非晶体的内部微粒排列
3
多姿多彩的晶体
多姿多彩的晶体
几种非晶体
玻 璃
橡 胶
非晶体可以打磨成规则的几何外形,但仍不是晶体。 2.晶体有哪些基本特征?
一、晶体的特性
1、自范性:在适宜的条件下晶体可以自发地呈现封闭的、规则的 多面体外形.具有规则的几何外形
NaCl晶胞
钠离子:1+12×1/4 = 4 氯离子:8 ×1/8+6×1/2 = 4
CsCl晶胞
铯离子:1 氯离子:8 ×1/8= 1
下图晶胞中,晶体内与每个“Ti”紧邻的氧原子数 和这种晶体材料的化学式分别是(各元素所带的电荷 均已略去)
晶体形成的途径
1、熔融态物质凝固 4. 什么是晶胞?
2、气态物质冷却不 经液态直接凝固 (凝
华)
3、溶质从溶液中 析出
二. 晶体结构的基本重复单元——晶胞
1.晶胞含义:晶体结构中最小的重复单元。
墙与砖 整个晶体就是晶胞重复排列而成的。 可以从一个晶胞推断晶体的结构和性质。
3.晶体的分类 根据晶体内部微粒和相互作用不同
晶体
微粒种 类
相互作 用力
离子晶体 阴阳离子 离子键
金属晶体 金属阳离子 和自由电子
金属键
共价晶体 分子晶体
原子 共价键
分子
分子间作用力
(范德华力、氢键)
晶体类别的判断:
离子晶体:含离子键的化合物 金属晶体:金属单质与合金 分子晶体:稀有气体、只含共价键的大多数物质 原子晶体:只含共价键的少数物质:金刚石、石墨、 晶体硅、晶体硼、碳化硅、SiO2等
非晶体:内部微粒无周期性重复排列构成的固体物质。
晶体的内部微粒排列 非晶体的内部微粒排列
3
多姿多彩的晶体
多姿多彩的晶体
几种非晶体
玻 璃
橡 胶
非晶体可以打磨成规则的几何外形,但仍不是晶体。 2.晶体有哪些基本特征?
一、晶体的特性
1、自范性:在适宜的条件下晶体可以自发地呈现封闭的、规则的 多面体外形.具有规则的几何外形
NaCl晶胞
钠离子:1+12×1/4 = 4 氯离子:8 ×1/8+6×1/2 = 4
CsCl晶胞
铯离子:1 氯离子:8 ×1/8= 1
下图晶胞中,晶体内与每个“Ti”紧邻的氧原子数 和这种晶体材料的化学式分别是(各元素所带的电荷 均已略去)
2022-2023学年鲁科版选择性必修二 3-1 认识晶体 课件(32张)

2.如图是 CsCl 晶体的一个晶胞,相邻的两个 Cs+的核间距为 a cm,NA 为阿伏加德罗常数,CsCl 的相对分子质量用 M 表示,则 CsCl 晶体的密度(g·cm-3)为( )
A.N8AM·a3
B.Hale Waihona Puke 6AM·a3C.N4AM·a3
D.NAM·a3
D [由均摊法求得 CsCl 晶胞含有 1 个 CsCl 微粒,其质量是 M/NA g,再由相邻的两个 Cs+的核间距为 a cm,求出该晶胞的体积 是 a3cm3,所以晶胞的密度是NAM·a3g·cm-3,晶体的密度和晶胞的密度 是一样的。]
固体 晶体
外观 具有规 则的几 何外形
微观结构 自范性 各向异性 熔点
微粒在三维 空间周期性 有
有序排列
各向 异性
固定
固体
非晶体
本质 区别
外观 不具有规 则的几何
外形
微观结构 自范性 各向异性 熔点
微粒排列 相对无序
没有
各向 同性
不固定
微观粒子在三维空间是否呈现周期性有序排列
1.(2021·四川乐山高二期末)区别晶体与非晶体的最科学的方法
(2)计算密度:利用公式 ρ=NNA·M·V g/cm3, 式中 N 与晶胞的组成有关,M 为晶体的摩尔 质量,NA 为阿伏加德罗常数,V 为晶胞的体 积,其单位为 cm3,ρ 为晶体的密度,其单 位为 g/cm3。如图所示为 NaCl 晶体的晶胞,图中晶胞的边长为 a cm, 则 ρ=mV=4N×A5·a83.5 g/cm3。
3.如图所示的甲、乙、丙三种晶体:
甲
乙
丙
试推断甲晶体的化学式(X 为阳离子)为________,乙晶体中 A、
B、C 三种微粒的个数比是________,丙晶体中每个 D 周围结合 E
新教材2023版高中化学第3章不同聚集状态的物质与性质第1节认识晶体课件鲁科版选择性必修2

排列方式
微粒在空间按一定规律做____________
周期性重复排列
原子、离子
构成的固体物质
或分子
微粒无周期性排列的固体物质
2.晶体的特性
晶体的特性
自范性
对称性
具体表现
举例或应用
在适宜的条件下,晶体能够自
水晶完好时呈六棱柱
发地呈现封闭的、规则的多面
状
体外形
由于晶体内部的微粒在空间按
照一定规律做周期性重复排列,
2.下列物质具有自范性、各向异性的是(
A.钢化玻璃
B.塑料
C.水晶
D.陶瓷
)
答案:C
解析:晶体具有自范性和各向异性,钢化玻璃、塑料、陶瓷均不属于晶体。
知识点二 晶体结构的基本重复单元——晶胞
1.晶胞的定义
(1)定义:晶体中的微粒呈现________________排列,晶体结构中基
可重复的周期性
本的________称为晶胞,晶胞的形状为___________。
重复单元
平行六面体
(2)金属铜和金属镁晶体及其中截取出的晶胞
金属
金属铜及其晶胞
金属镁及其晶胞
图示
结构
特点
8个顶点各有1个粒子,6个面 8个顶点各有1个粒子,体
的面心各有1个粒子
心有1个粒子
2.晶胞与晶体的关系
将一个个晶胞及其中包含的微粒_____________________并置,就构
垂直
各向异性
强度、光学性质等)
的方向上的电导率数
值的1万倍
加热晶体,温度达到熔点时即
具有固定的 开始熔化,在没有全部熔化之 氯化钠、冰等都具有
__________
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
期性有序排列,C 正确;冰晶体中水分子间存在氢键和范德华力,
课 时
破
碘晶体中碘分子之间只有范德华力,二者晶体中相互作用力不相同,
分 层
学
作
科 素
D 错误。]
业
养
应
用
养
返
成
首
页
·
26
·
·
必
备 知 识
自
晶胞中微粒数目的计算一切割法
双
(素养养成——证据推理与模型认知)
基 达
主 预
标
·
习
随
堂
关
检
键
测
能
力
1.平行六面体晶胞中不同位置的微粒数的计算
[晶体的规则几何外形是自发形成的,有些固体尽管有规则
基 达
主 预
标
·
习
的几何外形,但由于不是自发形成的,所以不属于晶体,因此,A、
随 堂
关 键 能
D 项错误。晶体是由晶胞通过无隙并置形成的,构成晶体的微粒在
检 测
力
核 心 突
三维空间呈现周期性的有序排列,因此,晶体研碎成小的颗粒仍然
课 时
破
是晶体,所以 C 项错误。自范性是晶体和非晶体的本质区别,B 项
基
达
微粒在三维
标
各向
·
随
空间周期性 有
异性
固定
堂 检
测
有序排列
不具有规 则的几何
外形
微粒排列 相对无序
没有
各向 同性
课 时 分
不固定 层
作 业
微观粒子在三维空间是否呈现周期性有序排列
返
首 页
19
·
·
必
备
知 识
双 基
自
达
主 预
【例 1】 区分晶体和非晶体最可靠的科学方法是( )
标
·
习
随
关
A.测定熔点、沸点
素
作 业
养
应 及晶体化学式。
用
养
返
成
首
页
·
·
·
·
必 备 知 识
自
主
预 习
关
必备
知识
键
能
力
核 心 突 破
学 科 素 养
应 用 养 成
3
·
双 基 达 标
随 堂 检 测
课
自主预习
时 分
层
作
业
返 首 页
4
·
·
必
备
知 识
双 基
自
达
主 预
标
·
习
一、晶体的特性
随 堂
关
检
键 能
1.晶体的概念
测
力
核 心 突
(1)晶体:内部微粒(原子、离子或分子)在空间按一定规律做
时 分
层
学 科 素
中 Mg 原子和 B 原子的个数比为 3∶2,化学式为 Mg3B2,B 正确。]
作 业
养
应
用
养
返
成
首
页
·
33
·
·
必
备
知 识
双 基
自 主 预
1.某物质的晶体中含 A、B、C 三种元素,其晶胞中原子的排列
达 标
·
习
随
方式如图所示,晶体中 A、B、C 的原子个数比为( )
关
堂 检
键
测
能 力
分 层
学
作
科 素
正确。]
业
养
应
用
养
返
成
首
页
·
24
·
·
必
备
知 识
双 基
自
达
主 预
2.下列叙述正确的是( )
标
·
习
随
关
A.固体 SiO2 一定是晶体
堂 检
键
测
能 力
B.晶体有固定的组成,非晶体没有固定的组成
核
课
心 突 破
C.晶体内部的微粒按一定规律呈周期性有序排列
时 分
层
学 科
D.冰和固体碘晶体中相互作用力相同
自 主 预
B
[根据晶体结构单元可知,在正六棱柱顶点上的镁原子被
6
达 标
·
习
个正六棱柱所共用,在上、下面上的镁原子被
2
个正六棱柱所共用,
随 堂
关
检
键 能
侧棱上的硼原子被 3 个正六棱柱所共用,根据均摊法可知晶胞中 Mg
测
力
核
课
心 突 破
原子个数为 2×12+2×6×16=3,B 原子的个数为 6×13=2,所以晶体
A.1∶3∶1
核
课
心 突
B.2∶3∶1
时
破
分
层
学
C.1∶2∶1
作
科 素
业
养 应
D.1∶3∶3
用
养
返
成
首
页
·
34
·
·
必
备
知 识
双 基
自
达
主 预
标
·
习 关
C
[由题图可知,该晶胞中 A 原子个数为 8×18=1,B 原子个数
随 堂 检
键
测
能 力
核 心 突
为 4×12=2,C 原子个数为 1,所以晶体中 A、B、C 的原子个数比
返
成
首
页
·
14
·
·
必
备
知 识
双 基
自
达
主 预
B [描述晶体结构的基本单元(最小重复单元)叫晶胞,A 正确; 标
·
习
随
关
相同晶体中晶胞的大小和形状完全相同,不同晶体中晶胞的大小和
堂 检
键
测
能 力
形状不一定相同,B 错误;晶胞中有的微粒被若干个晶胞所共用,而
核
课
心 突 破
不专属于某个晶胞,C 正确;根据晶胞的组成,可以利用“均摊法”
时 分
层
学 科
推知晶体的组成,D 正确。]
素
作 业
养
应
用
养
返
成
首
页
·
·
·
·
必 备 知 识
自
主
预 习
关
关键
能力
键
能
力
核 心 突 破
学 科 素 养
应 用 养 成
15
·
双 基 达 标
随 堂 检 测
课
核心突破
时 分
层
作
业
返 首 页
16
·
·
必
备 知 识
自
晶体与非晶体的区别
双
(素养养成——宏观辨识与微观探析)
双 基
自
达
主 预 习
单元:镁原子间形成正六棱柱,且棱柱的上、下面还各有一个镁原子;
·
标 随
堂
关 6 个硼原子位于棱柱的侧棱上,则该化合物的化学式可表示为(
键 能 力
)
检 测
核
课
心
突 破
A.MgB
B.Mg3B2
时 分
层
学 科
C.MgB2
素
D.Mg2B3
作 业
养
应
用
养
返
成
首
页
·
32
·
·
必
备
知 识
双 基
·
·
必
备 知
(2)分类
识
自 主
晶体类型
预
构成微粒
双
基
微Байду номын сангаас间的相互作用
实例
达 标
·
习
离子晶体
_阴__、__阳__离__子_
关
键
能 力
金属晶体 金__属__阳__离__子__、__自__由__电__子_
_离__子__键___ __金__属__键__
随
NaCl
堂 检
测
铜
核
心 突
共价晶体(原子
破
学
晶体)
科
素
核
课
心 突 破
射线衍射实验,所以只有 C 选项正确。]
时 分
层
学
作
科 素
业
养
应
用
养
返
成
首
页
·
21
·
·
必
备
知 识
双 基
自
达
主 预
标
·
习
随
堂
关 键
检
依据晶体的特性判断固体是不是晶体,存在一定的不确定性, 测
能
力
核 心
应从本质特征上进行把握。
突
课 时
破
分
层
学
作
科 素
业
养
应
用
养
返
成
首
页
·
22
·
·
必
备
知 识
课 时
破 为 1∶2∶1,C 正确。]
分 层
学
作
科 素
业
养
应
用
养
返
成
首
页
·
35
·
·
必
备
知 识
2.某晶体的晶胞结构如图所示,这种晶体中 A、B、C 三种原 双 基
自
主 预
