11取代酸概要
合集下载
有机化学 第十一章 取代酸

CH -C-CO H O 3 O
苹果酸
Tollen试 试 or Fehling CH CO H + CO O 3 2
强氧化剂(如高锰酸钾溶液)或某些弱氧化剂( 强氧化剂(如高锰酸钾溶液)或某些弱氧化剂(如 托伦试剂、斐林试剂) 托伦试剂、斐林试剂)能把酮酸氧化成少一个碳原子的 羧酸并放出CO 这类反应称为氧化脱羧反应 氧化脱羧反应。 羧酸并放出CO2,这类反应称为氧化脱羧反应。
P217. 11.1 a, e, h, m; 11.2 a; 11.3 b, g, j。 。
第十一章 取代酸 (substituted acid)
本章学习要求 1、熟练掌握羟基酸、羰基酸的 熟练掌握羟基酸、 化学性质和命名; 化学性质和命名; 2、从分子结构来分析理解这两 类化合物的性质 (hydroxyl carboxylic acid) )
醇酸 羟 基 连 接 在脂 肪 烃 基 或脂 环 烃基 上
2. 互变异构现象 一些特有的性质 A、具有酮和酯的典型反应 、 B、能使溴的四氯化碳溶液退色 、 C、与钠作用放出氢 、 D、与三氯化铁作用显紫红色 、 存在如下平衡: 存在如下平衡:
O CH3-C-CH2-C-OC2H5 O OH O
CH3-C-CH2-COOC2H5 O
CH3-C=CH-C-OC2H5
酮式结构(93%) 酮式结构(93%)
烯醇式结构(7%) 烯醇式结构(7%)
产生互变异构的原因: 产生互变异构的原因: 1、在酮式异构体中亚甲基受双重吸电子的影响 烯醇式异构体中C=C C=C与 2、烯醇式异构体中C=C与C=O 形成其轭体系 3、烯醇式构体可形成分子内氢键 HC
3
O-C2H5 H
OH
HO CH COOH CH2 COOH
苹果酸
Tollen试 试 or Fehling CH CO H + CO O 3 2
强氧化剂(如高锰酸钾溶液)或某些弱氧化剂( 强氧化剂(如高锰酸钾溶液)或某些弱氧化剂(如 托伦试剂、斐林试剂) 托伦试剂、斐林试剂)能把酮酸氧化成少一个碳原子的 羧酸并放出CO 这类反应称为氧化脱羧反应 氧化脱羧反应。 羧酸并放出CO2,这类反应称为氧化脱羧反应。
P217. 11.1 a, e, h, m; 11.2 a; 11.3 b, g, j。 。
第十一章 取代酸 (substituted acid)
本章学习要求 1、熟练掌握羟基酸、羰基酸的 熟练掌握羟基酸、 化学性质和命名; 化学性质和命名; 2、从分子结构来分析理解这两 类化合物的性质 (hydroxyl carboxylic acid) )
醇酸 羟 基 连 接 在脂 肪 烃 基 或脂 环 烃基 上
2. 互变异构现象 一些特有的性质 A、具有酮和酯的典型反应 、 B、能使溴的四氯化碳溶液退色 、 C、与钠作用放出氢 、 D、与三氯化铁作用显紫红色 、 存在如下平衡: 存在如下平衡:
O CH3-C-CH2-C-OC2H5 O OH O
CH3-C-CH2-COOC2H5 O
CH3-C=CH-C-OC2H5
酮式结构(93%) 酮式结构(93%)
烯醇式结构(7%) 烯醇式结构(7%)
产生互变异构的原因: 产生互变异构的原因: 1、在酮式异构体中亚甲基受双重吸电子的影响 烯醇式异构体中C=C C=C与 2、烯醇式异构体中C=C与C=O 形成其轭体系 3、烯醇式构体可形成分子内氢键 HC
3
O-C2H5 H
OH
HO CH COOH CH2 COOH
11取代羧酸

H—C—COOH O 乙醛酸
CH3 C COOH O
α-丙酮酸
β-丁酮酸
CH3 C CH2COOH O
一、 酮酸的命名
以羧酸为母体, 酮基作取代基, 酮基的位次用阿 拉伯数字或希腊字母标明。酮基也可称为氧代。
O
O
O
C CH2COOH CH3CCOOH H CH C 3CH 2COOH a b
丙酮酸或2-氧代丙酸 b -丁酮酸(乙酰乙酸)
2.β-酮酸的分解反应
(1) 脱羧反应
β-酮酸比α-酮酸更易脱羧, 通常β-酮酸只能在低温下保存。
O CH3 C CH2COOH
温热
O CH3 C CH3
CO2
β-酮酸由于羧基受β-羰基的影响, 同时也由于 形成6员环的分子内氢键而使脱羧更加容易。其反 应机制为:
O H CH3 C O C O β-丁酮酸
O H CH3 C O C O
CO2
微热
CH3 C CH2 烯醇式
OH
O CH3 C CH3
由于β-酮酸脱羧产物是酮,故称为酮式分解。
(2) 酸式分解
β-酮酸与浓碱共热,分解为两分子羧酸盐,称为酸式分解。
O CH3CH2CCH2CO2H β-戊酮酸 NaOH
△
CH3CH2CO2Na 丙酸钠
CH3CO2Na 乙酸钠
CO2H
> HO
4.54
CO2H
邻位-OH: +C效应 间位-OH主要 及 分 子 内 氢 键 . 后 表现为 -I 效应 者使酸性明显增强
对位-OH主要 表现 +C 效应
OH C O O H
O C O O H
H
2.酚酸的脱羧反应
11取代酸
COOC2H5
Na
CH
COOC2H5
COOC2H5
pKa = 13
RX R CH COOC2H5
Ⅱ、羰基酸 水解脱羧: 丙二酸二乙酯及其取代衍生物水解生成丙二酸,丙 二酸不稳定,易脱羧成为羧酸。
COOC2H5 R CH COOC2H5 R R' COOC2H5 C COOC2H5 COOC2H5 COOC2H5 NaOH H2O NaOH H2O NaOH H2O COONa R CH (1) H R CH2COOH CO2
CH3COCH2COOC2H5
?
O
C CH3
BrCH2(CH2)2CH2Br
[CH3COCHCOOC2H5] Na
CH3COCHCOOC2H5 BrCH2CH2CH2CH2
CH3CH2ONa
CH3COCCOOC2H5
BrCH2CH2CH2CH2
COOEt COCH3
1) OH (稀)
2) H+
3)
O C CH3
Ⅱ、羰基酸
CH3COCH2COOC2H5
O RX
CH3CH2ONa
[CH3COCHCOOC2H5] Na+
O 酮式分解 CH3 C CH2R
②①
RCOX
CH3C CH COOC2H5 R O
甲基酮
O
CH3C CH COOC2H5
RCOCH2X O
酮式分解
O
CH3 C CH2 C R
O O
1,3-二酮
Ⅰ、羟基酸 > 一、醇酸
许多水果中含有乳酸; 在人体中S-(+)-乳酸作为葡萄糖的氧化产物 而存于血液和肌肉中; 酸牛奶中含有RS-(+/-)-乳酸; 在工业上由乳糖、麦芽糖或葡萄糖的发酵生 产乳酸,选用不同菌类,可以得到S-(+)-乳酸或 RS-(+/-)-乳酸。
ch10取代羧酸11
CH3COCHCOOC 2H5 CH2CH2CH3
CH3 CH3CH2CH2CHCOOH
①C2H5ONa ②CH3Br
① 40%NaOH ②H ,△
+
3. 酮酸的合成
CH3COCH2CH2COOH
①C2H5ONa ②ClCH2COOC2H5
CH3COCH2COOC 2H5
CH3COCHCOOC 2H5 CH2COOC 2H5
HOOCCH2CH2COOH
CH3COCH2COOC 2H5 ①C2H5ONa ②ClCH2COOC2H5 CH3COCHCOOC 2H5 CH2COOC 2H5
① 40%NaOH ②H ,△
+
HOOCCH2CH2COOH
四、丙二酸二乙酯
(一)制备
CH3COOH +Cl2
P
ClCH2COOH
NaOH
① 5%NaOH ②H+,△
CH3COCH2CH2COOH
4. 二酮的合成
O
O
CH3CCH2CH2CCH3
①C2H5ONa ②ClCH2COCH3
CH3COCH2COOC 2H5
CH3COCHCOOC 2H5 CH2COCH3
① 5%NaOH ②H+,△
O
O
CH3CCH2CH2CCH3
5. 二元羧酸的合成
①C2H5ONa/C2H5OH ②CH3CH2Br
CH2(COOC2H5)2
①C2H5ONa/C2H5OH ②CH3Br
CH3CH2CH(COOC2H5)2
水解
CH3CH2C(COOC 2H5)2 CH3
△,- CO 2
CH3CH2CHCOOH CH3
第11章 取代酸

定义:脂肪族羧酸碳链上含有羰基的化合物 分类: 醛酸
H C CH2 COOH O
酮酸
CH3 C COOH O α-
CH3 C CH2COOH O β-
CH3 C CH2CH2COOH O γ-
10
命名:
H C CH2 COOH O
CH3 C CH2COOH O
丙醛酸 3-氧代丙酸 3-氧代丙酸 3-羰基丙酸 3-羰基丙酸 甲酰乙酸
14
三. 乙酰乙酸及其酯
乙酰乙酸不稳定,易脱羧(β 1. 乙酰乙酸不稳定,易脱羧( β-酮酸共性)。
CH3 C CH2 COOH O
CH3 C CH3 + CO2 O
R
C C H2 C OOH O
R
C C H 3 + C O2 O
15
2. 乙酰乙酸乙酯 (1) 制备
2 CH3COOC2H5
C2H5ONa
CH3 C CH2 COOC2H5 O
Claisen酯缩合 Claisen酯缩合
C2H5ONa O CH2 C OC2H5 H O CH3 C OC2H5 + O CH3 C CH2 C2H5O- + Na+ C2H5OO CH2 C OC2H5 O CH3 C OC2H5 O
C OC2H5 + C2H5O
18
(4) 乙酰乙酸乙酯在合成上的应用 A: 成酮分解
CH3 C CH2 COOC2H5 O CH3 C CH O R COOC2H5
C2H5ONa
CH3 C CH O O CH3 C CH2
COOC2H5
RX
R + CO2 + C2H5OH
19
合成甲基酮类化合物
H C CH2 COOH O
酮酸
CH3 C COOH O α-
CH3 C CH2COOH O β-
CH3 C CH2CH2COOH O γ-
10
命名:
H C CH2 COOH O
CH3 C CH2COOH O
丙醛酸 3-氧代丙酸 3-氧代丙酸 3-羰基丙酸 3-羰基丙酸 甲酰乙酸
14
三. 乙酰乙酸及其酯
乙酰乙酸不稳定,易脱羧(β 1. 乙酰乙酸不稳定,易脱羧( β-酮酸共性)。
CH3 C CH2 COOH O
CH3 C CH3 + CO2 O
R
C C H2 C OOH O
R
C C H 3 + C O2 O
15
2. 乙酰乙酸乙酯 (1) 制备
2 CH3COOC2H5
C2H5ONa
CH3 C CH2 COOC2H5 O
Claisen酯缩合 Claisen酯缩合
C2H5ONa O CH2 C OC2H5 H O CH3 C OC2H5 + O CH3 C CH2 C2H5O- + Na+ C2H5OO CH2 C OC2H5 O CH3 C OC2H5 O
C OC2H5 + C2H5O
18
(4) 乙酰乙酸乙酯在合成上的应用 A: 成酮分解
CH3 C CH2 COOC2H5 O CH3 C CH O R COOC2H5
C2H5ONa
CH3 C CH O O CH3 C CH2
COOC2H5
RX
R + CO2 + C2H5OH
19
合成甲基酮类化合物
取代酸的名词解释

取代酸的名词解释取代酸,是一种有机化合物,具有取代基与酸基团共存的特性。
它在化学反应中充当酸的角色,可以和碱反应形成盐,并释放出氢离子。
取代酸的名称中常常包含酸的特定基团,以反映其结构和性质。
本文将通过解释取代酸的定义、特性和应用领域,深入探讨取代酸的本质和意义。
取代酸是有机化学中一种重要的化合物,它在许多自然和人工合成的物质中都起着重要作用。
通过在取代基上引入酸基团,取代酸可以增强原有物质的酸性,从而使其具有更多的化学反应性。
常见的取代酸包括硝基酸、羧酸、磺酸等。
首先,硝基酸是一种含有硝基(-NO2)基团的化合物。
它在有机合成中常常用作氧化剂和亲电试剂。
硝基酸可以与各种碱反应,形成相应的盐和水。
硝基酸的应用十分广泛,例如硝酸可以用作炸药的原料,硝酸酯则被广泛用于有机合成中的取代反应。
其次,羧酸是一类含有羧基(-COOH)的有机酸。
羧酸可以通过取代基上的氧原子与碱发生酸碱反应,形成盐和水。
羧酸具有广泛的应用领域,例如乙酸是一种常用的有机酸,被广泛用于制备醋酸纤维丝和染料中。
另外,柠檬酸是一种常见的天然羧酸,被广泛应用于食品和药品工业。
最后,磺酸是一类含有磺酸基团(-SO3H)的有机酸。
磺酸通常具有强酸性,并且在化学反应中起着重要的催化作用。
磺酸可以通过与碱反应形成相应的盐和水。
磺酸的应用十分广泛,它在染料、药物、表面活性剂等领域有着重要的用途。
综上所述,取代酸是一类具有取代基和酸基团的有机化合物。
它们具有酸性、反应性和催化性的特点,被广泛应用于有机合成、材料科学、生命科学等领域。
通过引入不同的基团,取代酸的性质可以得到调控和改善,从而实现更加精确和高效的化学反应。
在未来的科学研究和工业应用中,取代酸的作用将继续发挥着重要的作用。
取代酸
•1)酸性
• 羟基的吸电子效应,羟基酸比相应的羧酸酸性强,诱导 效应随距离增长而减弱,故羟基离羧基越远酸性越弱
• 比较下列化合物酸性
CH3
CH2
COOH
CH3
CH OH
COOH
CH2 OH
CH2
COOH
•2)α—羟基酸的氧化
• α-羟基酸可被氧化成α-羰基酸
H3C CH COOH OH 乳酸
[ O]
一 羟基酸
• 1. 命名
• 常用俗名 • 系统命名:含羟基和羧基的最长碳链为主链,编号从 离羟基最近的羧基开始,也可用α 、β 、γ 等表示羟 基的位置
H3C CH COOH 乳 酸 2-羟 基 丙 酸 OH α ?羟 基 酸 HO CH2 CH2 COOH 3-羟 基 丙 酸 β -羟 基 酸
HO
(乙 酰 乙 酸 )(β -酮 酸 )
•主要化合物
• 1乙醛酸
2 COOH
O
CHO COOH
CHO
NaOH
CH2OH COONa
COOH
COONa
+
COONa
• 2 丙 酮 酸 CH3
CH2OH CH2OH COOH
2
C
COOH –有机体内糖代谢的中间产物。可有乳酸氧化,也可 COOH COOH COOH
CH CH3 C O H C OC2H5 O 较稳定 亚甲基上氢的酸性,易离开。 原因 共轭。 分子内氢键。 CH3 C CH COC2H5 OH O
一般的烯醇式结构是不稳定的: 例如: CH3 C CH3
O
CH2
C OH
CH3
仅占2.0×10-2 %
3. 乙酰乙酸乙酯的分解 酮式分解(稀碱)
[理学]第十一章取代酸
OH
OH
4.17
3.0
4.12
4.54
13
a、邻位效应:不论是钝化基团还是活化基团 (氨基除外)在邻位时,都能使苯甲酸的 酸性增强。这种特殊影响叫邻位效应。
b、邻位羟基上的H可与羧基中的O形成分子内 氢键,从而增强了羧基中O-H键的极性,使H 较易离解,同时也使形成的负离子更加稳定, 所以,酸性增强。
2018/11/22 27
2)命名
1.选择含羰基和羧基的最长碳链作主链, 叫作某醛酸或某酮酸 2.酮酸需注明羰基的位置 3.亦可用酰基取代酸来命名,醛基以“甲 酰基”表示,称为某酰某酸。
存在:未成熟的果实内;植物的叶 子中;自然界中存在的是左旋体。
用途:制药和食品工业。
2018/11/22
HO
COOH COOH
24
H2C
苹果酸
③
酒石酸
HO HO H C COOH
存在:多种水果中;或以盐的形 式存在于水果中。 用途:可用作酸味剂,其锑钾盐 有抗血吸虫作用。 ④ 柠檬酸 存在:多种植物的果实中;动 物组织与体液中,为无色晶体。 用途: 食品工业的调味品(有 酸味),也用于制药业。
H O H3C C C OH O H
H O HO C C CH3 O H
-2H2O
O C H3C CH O O CH CH3 C O 18
2018/11/22
B)β-醇酸脱水----α,β-不饱和酸
-H2O CH3CH CHCOOH CH3CH=CHCOOH OH H
2018/11/22
19
C)γ-醇酸和δ-醇酸脱水---五元 或六元环内酯
2018基酸的氧化反应
α- 羟基酸中的羟基比醇中羟基易氧化。 Tollen 试剂与醇不反应,但能把 α- 羟基酸氧化 为α-羰基酸。
胡勇-有机化学教学 第十一章 羧酸和取代羧酸 104页PPT文档
羧酸酸性的强弱取决于电离后所形成的羧酸根负 离子(即共轭碱)的相对稳定性 。
H C O O H C H 3 C O O H C l C H 2 C O O H C H 3 C H 2 C O O H C 6 H 5 C O O H
3 . 7 7 4 . 7 4
2 . 8 6
4 . 8 8
4 . 2 0
41
2 反应机理
这步反应 不会逆转
RCH2COOH PBr3
O
互变异构
OH BrB-r
RCH2CBr
RCH=CBr
+ OH
RC H -CBr + Br -
-HBr
O RC H -CBr RCH2COOH
Br
Br
Br
O
催化剂的作用是将羧酸转化为酰 卤,酰卤的α-H具有较高的活性而易 于转变为烯醇式,从而使卤化反应 发生。所以用10%~30%的乙酰氯或 乙酸酐同样可以起催化作用。
21
• 取代基的吸电子(-I效应)强弱次序(以饱和C-H键 的诱导效应为零。)
• 取代基的供电子(+I效应)强弱次序:
• [补充]——注意与苯环、1,3-丁二烯和烯烃的-,p-
共轭效应比较: 共轭效应是指在共轭体系中原子间的一
种相互影响,这种影响造成分子更加稳定,内能更小,键长
趋于平均化. 共轭效应常与诱导效应同时存在,共同起作
液态脂肪酸以二聚体形式存在。所以羧酸的沸点 比相对分子质量相当的烷烃高。 所有的二元酸都是结晶化合物。
10
13.3 羧酸的物理性质
• 羧酸的沸点高于质量相近的醇——双分子缔合。 • 低级羧酸溶于水,但高级羧酸不溶于水,能溶于 酒精,乙醚等有机溶剂。
有机化学第十一章取代酸
C H O 成乙醛或乙
酸C O2
O
+ C H3 C C O O H浓 H2 S O4 C H3 C O O H C O
酮和羧酸都不易氧化,但丙酮酸却极易氧化。两价铁存在时, 能被H2O2氧化成乙酸+二氧化碳 。
01
01
H3C三.C乙酰CH 乙2酸 COOH O有机体内脂肪代谢的中间产物。
R C 易失C 羧H ,2β—C 酮O 酸O的H共性:
)
二.成酮式分解:稀酸作用**
OO
O
+ H 3 C C C H 2 C O C 2 H 5 浓H 碱 3 C C O H C 2 H O 5H
OO
O H O
H C 3 CC H 2 CO C H 25
H C 3 C HC H CO C H 25
二、乙酮 酰式 乙(9 2 .5 % )
互 变 异 构 烯 醇 式 (7 .5 % )
OO
H C 3
C C H 2
N a O C 2 H 5
C O C H 25
H C 3
C C H N + aC O C H 25
三、乙酰乙酸 乙酯的在有机 合成中的应用
O
O
H3C C CNHa+ C OC2H5
O
O
H3C C CH C OC2H5 R
O
O
RX
H3C C CH C OC2H5
稀酸 浓碱
R O
[O ]
H C 3 CC O O H O 丙 酮 酸
COOH
CH2OH CH2OH COOH
COOH H2O C O H
HC COOH
COOH C O CO2
CH2 COOH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3COOC2H5 + H-CH2COOEt EtONa CH3COCH2COOEt + EtOH
Claisen缩合,两分子乙酸乙酯在EtONa作用下起缩合反应生成β-羰基酯
结构与性质
a. 性质: 与金属Na反应放出H2生成钠盐。 含活泼H
与Br2/CCl4溶液反应褪色
说明含不饱和键
与FeCl3溶液呈紫色反应 说明含C=C-OH烯醇式结构
H
OEt Na+ RX
O R` O
R`X H3C C C C OEt
R
注意:·RX一般不宜用30RX和乙烯式卤代烃,最好用10RX。 ·如在亚甲基上引入两个取代基,通常第一次引入较大的基团。
酮式分解和酸式分解
酮式分解:乙酰乙酸乙酯受稀碱作用, 发生皂化,加热则脱羧生成酮。
酸式分解:乙酰乙酸乙酯用强碱溶液, 加热所得到的主要产物是酸。
1. 物理性质:
多为结晶固体,或为糖浆状液体。 由于分子中同时含羟基和羧基两个极性基 团,可形成氢键,水溶性较大。
2.化学性质
① 酸性 由于羟基的吸电子性,其酸性比羧酸强。
②α-羟基酸的氧化:α-羟基酸中的羟基比醇羟基容易氧化。
托伦试剂与醇不发生反应,但能把α-羟基酸氧化为α-羰基酸。
H3C
H C
COOH Ag(NH3)2NO3
OH
H3C C COOH O
③α-羟基酸的分解
R CH COOH 稀 H2SO4 OH
RCHO + HCOOH
④ 失水反应
两分子α-羟基酸,形成环酯(又叫交酯)
O
O
C
C
R CH OH
△ R CH O
HO
OH
HO CH R C
O
O CH R
C O 交酯
β-羟基酸中失水形成α,β- 不饱和酸
R
H C
H2 C COOH
△
OH
HH R C C COOH+ H2O
γ或δ羟基酸发生分子 内的酯化, 产物叫内酯
3.自然界中的醇酸
⑴ 乳酸: 结构
H H3C C COOH
OH
存在 酸牛奶(外消旋)、蔗糖发酵(左旋的)、
肌肉中(右旋的)。
用途 具有很强的吸湿性;工业上作除钙剂(钙盐
不溶于水);食品工业中作增酸剂;钙盐可补钙。
与羟胺、苯肼等生成苯腙
与HCN、NaHSO3等反应
说明含C=O
b. 互变异构
OO
室温
H3C
C
CC H2
OEt
92.5 %酮式
亚甲基活泼H的反应
OH O
H3C C
C H
C
OEt
7.5%烯醇式
OO
H3C C
CC H2
OEt EtONa
O HO H3C C C C
OEt
EtON a
R
O H3C C
C-
O C
OH COOCH3
水扬酸甲酯是由冬青树叶中取得 的主要成分(也叫冬青油),可 做香料和外用扭伤药。
2.五倍子酸和五倍子丹宁
COOH
结构
HO
OH
OH
⑴ 五倍子酸(又叫没食子酸)
存在 为无色晶体,以丹宁形式存在于许多植物中。(丹宁是一种天
然产物)
⑵ 五倍子丹宁
是由葡萄糖与不同数目的五倍子酸形成的酯的混合 物
3、了解自然界的醇酸的基本知识。
11-1 羟基酸
一、醇酸 二、酚酸
11-2 羰基酸 一、乙醛酸(OHCCOOH) 二、丙酮酸(CH3COCOOH) 三、乙酰乙酸及其酯
一、醇酸
H H3C C COOH
OH 乳酸 (2-羟基丙酸或α -羟基丙酸)
H HO C COOH
H2C COOH 苹果酸 (羟基丁二酸)
例一:
COCH3
O
H3C C
CH2COOEt
1.EtO Na
2.Br(CH2)3Br
稀OH -
O
H2 C
H3C CCH CH2 C H2
1.EtO Na 2. 卤代
OO
H3C C C C OEt
H2C CH2 C H2
COOH
草酰乙酸烯醇式
COOH C O - CO2 CH2 COOH 草酰乙酸
COOH CO CH3
丙酮酸
2. 性质
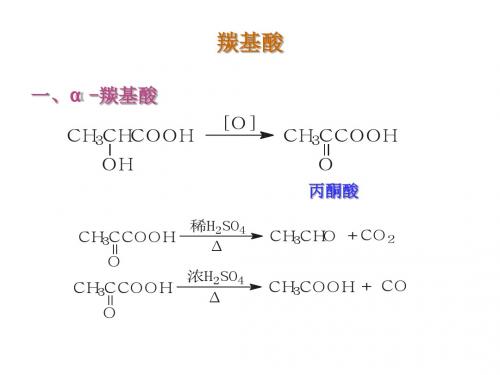
H3C C COOH O
稀 H2SO4
CH3CHO + CO2
H3C C COOH O
浓 H2SO4
或△
CH3COOH + CO
O H3C C COOH Fe2+ + H2O2 CH3COOH + CO2
结构 p.174 存在 多种植物中;有鞣皮的作用(即将生皮变为皮革)。 用途 有杀菌、防腐和凝固蛋白质的作用,可用作止血及收敛剂等。
二、 丙酮酸(CH3COCOOH) 1.制备
H
O
H3C C COOH
H3C C COOH
OH
O
COOH CHOH CHOH COOH 酒石酸
- H2O
Байду номын сангаас
COOH C OH CH
O HO
H3C C C C OEt
R
稀碱 CH3COCH2R 酮式分解 强碱 RCH2COOH 酸式分解
④ 乙酰乙酸乙酯和丙二酸二乙酯在有 机合成中的应用
乙酰乙酸乙酯在合成中的应用(作业)
a. 合成直链甲基酮. b. 合成支链甲基酮 c. 合成二元酮. d. 合成直链一元酸. e. 合成支链一元酸. f. 合成二元酸. g. 合成酮酸.
⑵ 苹果酸(α-羟基酸)
H HO C COOH
结构
H2C COOH
存在 未成熟的果实内;植物的叶子中;自然界中存
在的是左旋体。
用途 制药和食品工业。
⑶ 洒石酸
结构 存在
H HO C COOH
HO CH COOH
多种水果中;或以盐的形式存在于水果中。
用途 可用作酸味剂,其锑钾盐有抗血吸虫作用。
⑷ 柠檬酸 结构
第十一章 取代酸
主讲教师:李敬芬
目的要求:
1、掌握羟基酸和酮酸的分类,命名;几种重醇酸的 俗名;羟基酸的酸性,脱水反应;α-羟基酸氧化;
2、熟悉β-酮酸的脱羧,乙酰乙酸乙酯的酮式分解和 酸式分解,酮式-烯醇式互变及其在合成中的应用 ,丙二酸二乙酯在合成中的应用;α-羟基酸的分解 ;α-酮酸的氧化,脱羧,脱一氧化碳。
H HO C COOH HO C COOH
H2C COOH
存在 多种植物的果实中;动物组织与体液中,
为无色晶体。
用途 食品工业的调味品(有酸味),也用于制
药业。
二、酚酸
1.水扬酸(邻羟基苯甲酸)
OH
OCOCH3
结构
COOH
COOH
用途 乙酰水扬酸即阿司匹灵(aspirin),有解热、镇痛作
用,能抑制血小板凝聚,防止血栓的形成。
O
3. 乙酰乙酸及其酯
① 乙酰乙酸的结构 CH3COCH2COOH 是β—酮酸,它是肌体
同脂肪代谢的中间产物。
② β—酮酸的共性
H3C C CH2COOH
△
O
H3C C CH3 + CO2 O
R C CH2COOH
△
O
R C CH3 + CO2 O
③ 乙酰乙酸乙酯
结构: 制备:
H3C C CH2COOCH2CH3 O
