二氧化氯的制备方法
制取二氧化氯的化学方程式

制取二氧化氯的化学方程式1.氯酸钠与浓盐酸反应法(Kestiog法) 目前,欧洲一些国家主要采用氯酸钠(NaClO3)氧化浓盐酸的制备方法,化学反应方程式为:2NaClO3+4HCl(浓)=2NaCl+Cl2↑+2ClO2↑+2H2O.此法的缺点主要是同时产生了大量的氯气,不仅产率低,而且产品难以分离,同时很有可能造成环境污染. 2.亚氯酸钠与氯气反应法我国的科学家经过科学探索,发现一种优于欧洲的制备方法,将经干燥空气稀释的氯气通入填充有固体亚氯酸钠(NaClO2)的反应柱内制得.化学反应方程式为:2NaClO2+Cl2=2NaCl+2ClO2.此法的特点是安全性好,没有产生毒副产品. 3.草酸还原法最近,科学家又研究出了一种新的制备方法,在酸性溶液中用草酸(H2C2O4)还原氯酸钠,化学反应方程式为:H2C2O4+2NaClO3+H2SO4 =△= Na2SO4+2CO2↑+2ClO2↑+2H2O 和2KClO3+H2C2O4=K2CO3+CO2↑+2ClO2↑+H2O此法的最大特点是由于反应过程中生成的二氧化碳的稀释作用,大大提高了生产及储存、运输的安全性. 4.亚氯酸钠与盐酸反应法目前,常用的制备高纯二氧化氯的方法,化学反应方程式为:5NaClO2+4HCl=4ClO2+5NaCl+2H2O,此工艺产物中纯度一般高达95%以上,需要现场制备现场使用.运用高耐腐材料制作的二氧化氯发生器能够满足应用. 5.氯酸钾与二氧化硫反应法优点是可以利用二氧化硫减少空气污染,化学反应方程式为:2KClO3+SO2=2ClO2+K2SO4、 6.氯酸钠与亚硫酸钠反应法实验室常用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,化学反应方程式为:2NaClO3+Na2SO3+H2SO4==△==2ClO2↑+2Na2SO4+H2O。
二氧化氯制取方法

二氧化氯制取方法
1. 二氧化氯是一种强氧化剂,可以通过电解氯化钠溶液来制取。
将氯化钠溶解在水中,形成氯化钠溶液。
2. 接下来,将制备好的氯化钠溶液倒入电解槽中,并加入电解质,如盐酸或硫酸。
电解质的作用是增加溶液的电导率,促进电解过程的进行。
3. 在电解槽中,有两个电极,分别是阳极和阴极。
阳极通常由钛制成,而阴极可以
是钢制的。
将阳极和阴极连接到电源上,开始电解过程。
4. 在电解过程中,氯化钠分解成氯气和氢气。
氯气从阳极释放出来,而氢气则从阴
极释放出来。
5. 在阳极产生的氯气和水反应,生成次氯酸和氯酸。
这两种反应的平衡可以通过调
整电解槽中的温度和电流密度来控制。
6. 次氯酸和氯酸被瞬间转变为二氧化氯和氯离子。
这是因为二氧化氯比次氯酸和氯
酸更稳定,因此会迅速形成。
7. 在电解槽中生成的二氧化氯溶液被收集和储存。
该溶液通常具有浓度依赖于电解
过程中的参数设置和操作条件。
8. 制备二氧化氯的方法也可以通过混合氯气和二氧化氯气来实现。
这种方法需要控
制混合比例和适当的混合条件。
9. 另一种方法是使用氯酸钠和酸反应,生成二氧化氯。
在此反应中,酸可以是盐酸、硫酸或醋酸等。
10. 在制取二氧化氯的过程中,需要注意安全操作和处理电解槽中产生的气体。
防止
氯气泄漏和与氢气的混合,造成危险。
二氧化氯(ClO2)是如何制取的

二氧化氯(ClO2)是如何制取的我国自八十年代引进国外二氧化氯产品并开始研究其生产工艺以来,经过十几年的时间,不仅有了国产二氧化氯产品,而且生产工艺有了较大的提高,对二氧化氯作为氧化消毒剂的问题出也有了相当的认识和应用。
随着产品的广泛应用,促进了产品剂型的发展,目前已有二氧化氯发生器、稳定性二氧化氯、以及片剂等固态二氧化氯产品。
现将用于消毒的二氧化氯剂型情况综述如下。
1.二化氯发生器1.1二氧化氯的性质和制备二氧化氯是氯的氧化物,具有与氯气类似的刺激性气味,分子式ClO2,分子量67.457,熔点-59°C,沸点11°C,在室温下以气体形式存在,为一种黄绿色气体。
浓度增加时,颜色变为橙红色,气体二氧化氯极不稳定。
二氧化氯易溶于水,在20°C下溶解度为107.98mg/L,可制成不稳定的液体,其液体和气体对温度、压力和光均较敏感,当空气中的含量高于10%时,火花即可引爆[1],二氧化氯是一种不稳定的化合物,在水中可变成HClO2和HClO3.,在室温下每天约有2-10%的离解率[2],因此不利于大批量制备和运输,一般多在使用场所现用现制备。
二氧化氯发生器制备二氧化氯的方法主要有电解法和化学法,电解法使用广泛的是隔膜电解法,以食盐为原料,在电场的作用下生成含有二氧化氯,次氯酸钠、双氧水、臭氧的混合溶液,二氧化氯的浓度一般仅为10-30%左右,大多为氯气。
化学法主要有以氯酸钠和亚氯酸钠为原料的两类发生二氧化氯的方法。
在氯酸钠法生产二氧化氯过程中,若用氯离子作还原剂,则制得的二氧化氯存在纯度低的缺点,而亚氯酸钠法制得的二氧化氯比例高,一般在90%以上。
1.2设备和杀菌性能国外引进的发生器主要有Tetraralent公司、RioLindo公司、德国的Prominent等,李玲文等[3]报道了Tetraralent公司的二氧化氯协同消毒器的协同杀菌作用,该发生器利用电解食盐溶液,同时产生二氧化氯、氯气、臭氧和双氧水,溶于水中,协同杀菌,其杀菌效果优于上述任何一种消毒剂,实验结果还说明,电解槽的电解电压、电流、电解质浓度及阳极有效面积对消毒器的产气量都有影响。
二氧化氯的制备方法

二氧化氯的制备方法二氧化氯(ClO2)是一种重要的化学品,具有强氧化性和消毒能力,广泛应用于水处理、工业生产和医疗卫生等领域。
下面将介绍几种常见的二氧化氯的制备方法。
1.二氯化钠酸化法:将二次氯化钠固体(NaClO2)溶解在水中,然后加入酸(如盐酸)进行酸化反应。
反应过程中生成的二氯化钠(NaCl)被进一步氧化为二氧化氯。
反应方程式如下:4NaClO2+4HCl→4ClO2+2H2O+2NaCl此方法操作简单,并且生成的二氧化氯浓度较高。
2.氢氧化钠酸化法:将二氯化钠固体溶解在水中,然后加入氢氧化钠进行酸化反应。
反应过程中生成的二氯化钠被氧化为二氧化氯。
反应方程式如下:3NaClO2+2NaOH→2ClO2+NaCl+NaClO3+H2O该方法中,氢氧化钠作为酸化剂,同时产生了多余的氯酸钠(NaClO3)。
3.过硫酸盐法:将过硫酸钠固体溶解在水中,然后加入二氯化钠进行反应。
反应过程中生成的过硫酸钠(Na2S2O8)与二氯化钠反应生成二氧化氯。
反应方程式如下:2NaClO2+Na2S2O8+2H2O→2ClO2+2NaHSO4+NaCl该方法中,过硫酸钠作为氧化剂,在反应中被还原为硫酸钠(NaHSO4)。
4.氯酸钠酸化法:将氯酸钠溶解在水中,然后加入酸进行酸化反应。
反应过程中生成的氯酸钠被氧化为二氧化氯。
NaClO3+2HCl→ClO2+H2O+NaCl该方法操作简单,但由于氯酸钠的价格相对较高,制备成本较高。
总结:以上是几种常见的二氧化氯的制备方法,它们有各自的特点和适用范围。
在实际应用中需根据具体情况选择适合的制备方法,并注意操作安全。
二氧化氯是一种有毒气体,应严格控制其浓度和排放,防止对环境和人体健康造成危害。
二氧化氯配制方法及记录

二氧化氯配制方法及记录二氧化氯是一种强氧化剂,具有强烈的氧化能力和杀菌作用。
它可以用于水处理、空气消毒、固体表面消毒等多个领域。
在使用过程中,正确的配制方法和记录是非常重要的。
下面,我将详细介绍二氧化氯的配制方法及记录。
一、二氧化氯配制方法1.材料准备-氯酸钠(NaClO3)或次氯酸钠(NaClO):作为原料,用来制备二氧化氯。
-氢酸(HCl)或者稀硫酸(H2SO4):用于反应过程中的酸化反应。
-水:作为溶剂,用来配制二氧化氯溶液。
2.配制过程-步骤1:将一定量的氯酸钠或次氯酸钠溶解在一定体积的水中,生成次氯酸钠溶液。
-步骤2:在次氯酸钠溶液中加入适量的氢酸或稀硫酸,使其酸化,生成二氧化氯。
3.反应方程式反应1:2NaClO3+4HCl→2ClO2+Cl2+2H2O+2NaCl反应2:5NaClO+4HCl→4ClO2+Cl2+2H2O+5NaCl二、二氧化氯配制记录配制二氧化氯时,需要进行相应的记录,以确保配制的准确性和追溯性。
以下是配制二氧化氯的记录信息的详细格式:日期:记录配制二氧化氯的日期。
配制人员:记录参与配制工作的人员信息。
配制原料及用量:-氯酸钠(或次氯酸钠):记录使用的氯酸钠或次氯酸钠的批号、使用量等信息。
-氢酸(或稀硫酸):记录使用的氢酸或稀硫酸的批号、使用量等信息。
配制过程:-步骤1:记录溶解氯酸钠或次氯酸钠的过程,包括使用的容器、溶解时间等信息。
-步骤2:记录加入氢酸或稀硫酸酸化的过程,包括使用的容器、酸化时间等信息。
反应情况:-反应方程:记录配制二氧化氯的反应方程式。
-反应时间:记录反应的时间,包括酸化反应和反应生成二氧化氯的时间。
-反应温度:记录反应过程中的温度变化。
配制结果:-生成物:记录配制过程中生成的二氧化氯的质量、浓度等信息。
-配制状态:记录配制成功、失败或有异常情况。
清理及储存:-清理过程:记录清理反应容器的过程,包括使用的清洗剂、清洗时间等信息。
-储存方式:记录储存二氧化氯溶液的方式,包括储存容器、储存条件等信息。
二氧化氯的制取

二氧化氯的制取一、引言二氧化氯是一种强氧化剂,具有广泛的应用领域,如水处理、消毒、漂白等。
本文将介绍二氧化氯的制取方法及其工艺流程。
二、二氧化氯的制取方法1. 常温常压法常温常压法是制取二氧化氯的一种常用方法。
具体步骤如下:(1)将氯气通过液体二氧化硫中,生成氯气溶液。
(2)将氯气溶液通过激光照射或电解的方式,将氯气转化为二氧化氯气体。
(3)利用冷凝器将二氧化氯气体冷却成液态二氧化氯。
2. 高温高压法高温高压法是另一种常用的制取二氧化氯的方法。
具体步骤如下:(1)将氯气通过液体二氧化硫中,生成氯气溶液。
(2)将氯气溶液通过高温高压反应器,反应生成二氧化氯。
(3)利用冷凝器将二氧化氯冷却成液态。
三、二氧化氯的工艺流程1. 氯气制备氯气是二氧化氯制备的原料之一。
常见的氯气制备方法有电解法和氯化法。
其中,电解法是最常用的方法,通过电解食盐水或氯化铵溶液,产生氯气。
2. 二氧化硫制备二氧化硫是二氧化氯制备的另一个原料。
常见的二氧化硫制备方法有燃烧硫磺和矿石还原法。
其中,燃烧硫磺是最常用的方法,通过将硫磺燃烧产生二氧化硫气体。
3. 氯气溶液制备将氯气通过液体二氧化硫中,生成氯气溶液。
这一步骤可以在常温常压下进行。
4. 二氧化氯制备将氯气溶液通过激光照射或电解的方式,将氯气转化为二氧化氯气体。
这一步骤可以在常温常压下进行,也可以通过高温高压反应器进行。
5. 二氧化氯液体制备利用冷凝器将二氧化氯气体冷却成液态二氧化氯。
这一步骤可以在常温常压下进行。
四、二氧化氯的应用领域1. 水处理二氧化氯可以用于水处理,能有效杀灭水中的细菌、病毒和寄生虫等微生物,净化水质。
2. 消毒由于二氧化氯具有强氧化性,可以用于消毒。
它可以杀灭空气中的细菌、病毒,保持空气清洁。
3. 漂白二氧化氯也可以用于漂白过程。
它可以去除纸浆中的色素和杂质,使纸张更加白净。
五、结论二氧化氯的制取方法主要包括常温常压法和高温高压法。
其工艺流程包括氯气制备、二氧化硫制备、氯气溶液制备、二氧化氯制备和二氧化氯液体制备。
二氧化氯使用方法

二氧化氯使用方法二氧化氯是一种具有强氧化性能的化学物质,可用于消毒和净化水源、空气等环境中的有害物质。
下面将从二氧化氯的定义、制备方法、使用注意事项以及常见的应用领域等方面进行详细介绍。
一、二氧化氯的定义二氧化氯(ClO2)是一种黄绿色气体,其化学式为ClO2。
它具有很强的氧化性能,能有效杀灭细菌、病毒、真菌和其他有害微生物,同时能分解有机物和氯化副产物。
二、二氧化氯的制备方法常见的二氧化氯制备方法有两种:酸法和碱法。
1. 酸法制备:将硫酸与亚氯酸反应,生成亚氯酸氯根离子和离子氧并释放出二氧化氯气体,然后通过净化设备去除杂质得到纯净的二氧化氯气体。
2. 碱法制备:将氯气气体通入氢氧化钠溶液中,经氧化反应生成二氧化氯溶液,再通过蒸发和冷凝得到纯净的二氧化氯气体。
三、二氧化氯的使用方法1. 水源消毒:将适量二氧化氯粉末或液体投入水中,通过搅拌或循环泵进行混合,使二氧化氯充分接触水体中的有害微生物,起到杀菌消毒的作用。
具体投药量根据水质、水量和所需消毒效果而定。
2. 空气净化:可以将二氧化氯溶液或气体喷洒或释放到空气中,使其接触空气中的有害气体和微生物,具有净化空气、消除异味的效果。
使用时注意通风,避免浓度过高对人体造成伤害。
3. 食品消毒:对生鲜食品、水果、蔬菜等进行消毒处理。
可以将食品浸泡在含有二氧化氯的水中,或使用二氧化氯溶液喷洒在食品表面,消除细菌、病毒和其他有害微生物。
4. 医疗领域:二氧化氯可以用于医疗设施、手术室、病房、药品包装等的消毒和灭菌。
注意在使用时选择适当的剂量和处理方法,以确保消毒效果和安全性。
5. 工业应用:二氧化氯广泛应用于造纸、纺织、化工、食品加工等工业领域,用于漂白纸浆、除去颜色、净化废水等。
四、二氧化氯的注意事项1. 二氧化氯具有一定的毒性,使用时要佩戴适当的防护用品,如手套、口罩、护目镜等,以确保安全。
2. 使用时要遵循正确的使用方法和剂量,严禁超量使用。
3. 二氧化氯遇到明火或高温会发生爆炸,存储和使用时要注意避免接触火源。
二氧化氯的制备方法
二氧化氯的制备二氧化氯是一种黄绿色具有刺激性气味的气体。
沸点11℃,凝固点-59℃,易溶于水。
液态或气态的二氧化氯都不安定,易挥发,易爆炸。
早在1811年就由英国化学家hu mphre y davey制得,但由于二氧化氯的不稳定性使得大规模的应用受到了限制。
直到近十几年来才引起人们的极大关注,国外正在积极开发和研制各种新产品,扩大应用范围。
目前国际上公认二氧化氯很有开发和应用的价值,市场前景广阔。
但是,二氧化氯在我国的应用尚不够广泛,为此本文将介绍有关二氧化氯的各种制备方法及在各领域中的应用。
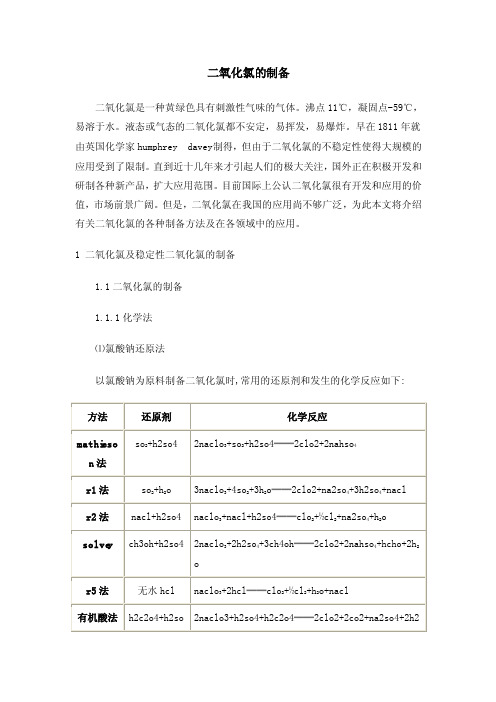
1 二氧化氯及稳定性二氧化氯的制备1.1二氧化氯的制备1.1.1化学法⑴氯酸钠还原法以氯酸钠为原料制备二氧化氯时,常用的还原剂和发生的化学反应如下:⑵亚氯酸钠氧化法a.与氯气反应2naclo2+cl2══2clo2+2naclb.与盐酸反应5naclo2+4hcl══4clo2+5nacl+2h2oc.与硫酸反应10nacl o2+5h2so4══8clo2+5na2so4+2hcl+4h2od.与酸化后的次氯酸钠反应naclo+hcl══nacl+hoclhcl+hocl+2naclo2══2clo2+2nacl+h2o1.1.2电解法目前仍采用亚氯酸盐电解氧化和氯酸盐电解还原法制备二氧化氯.此法较化学法制备的二氧化氯纯度高,但要求的电极材质高,电耗也较大.因此,目前在大规模的生产中,还无法与传统的化学法竞争.在饮用水消毒工艺中,也常用电解饱和浓度的食盐溶液制取二氧化氯,但反应过程中还伴生有氯气、臭氧、氢气等其他气体。
1.2稳定性二氧化氯的制备稳定性二氧化氯是80年代为推广应用二氧化氯而开发的新型产品。
它无色、无味、无毒、无腐蚀性,不易燃,不挥发。
