无机含氧酸的氧化性
高中化学 无机含氧酸分子的酸性比较

含氧酸的酸性强弱比较规律含氧酸一般是指,除了成酸元素外,分子组成中还含有羟基,这样的一类物质。
由于这种羟基上的氢原子能以氢离子的形式被电离出来,而使水溶液表现出酸性,所以它也被称之为“羟基酸”。
成酸元素不同、或其价态不同的含氧酸,在酸性强弱方面是有区别的。
含氧酸的组成与其酸性强弱间的关联,在中学化学及无机化学教学中,都占有一定的位置,也是一些化学工作者的关注点之一。
以至于在某些无机化学教材及文献中,也会出现相关讨论。
笔者在这里的工作,只是试图把这些不同层次教学中,有关含氧酸酸性强弱的内容,归纳起来,并使其能有一些关联性及系统性而已。
含氧酸的酸性一般存在如下规律:(1)同一成酸元素若能形成几种不同氧化态的含氧酸,其酸性依氧化数递增而递增;如〔原因:从HClO到HClO4非羟基氧原子逐渐增多,羟基-O-H键的极性增强,质子转移程度增强,故酸性增强〕(2)在同一主族中,处于相同氧化态的成酸元素,其含氧酸的酸性随原子序数递增,自上而下减弱。
如〔原因:同主族元素自上而下,成酸元素的电负性逐渐减小,原子半径增大,吸引羟基氧原子的能力依次减小,羟基-O-H键的极性依次减小,所以酸性依次减弱。
〕(3)在同一周期中,处于最高氧化态的成酸元素,其含氧酸的酸性随原子序数递增,自左至右增强。
如〔原因:同一周期中,从左至右元素的非金属性逐渐增强,成酸元素的电负性逐渐增大,吸引电子对的能力逐渐减小,电子偏向成酸元素R一方的程度增大,含氧酸分子中的氢原子的极化程度增大,所以酸性增强〕•无机含氧酸:•可以的分子式为H m RO n,其通式可以写成(HO)m RO n,也可写成RO m-,其中R称为成酸元素,无机含氧酸在水溶液中的酸强度取决于酸n OH n分子中羟基-O-H的电离程度,也可以用Pka值来衡量。
酸分子羟基中的质子在电离过程中脱离氧原子,转移到水分子中的孤对电子对上,其转移的难易程度取决于成酸元素R吸引羟基氧原子电子的能力。
第二、三周期主族元素无机含氧酸的氧化性
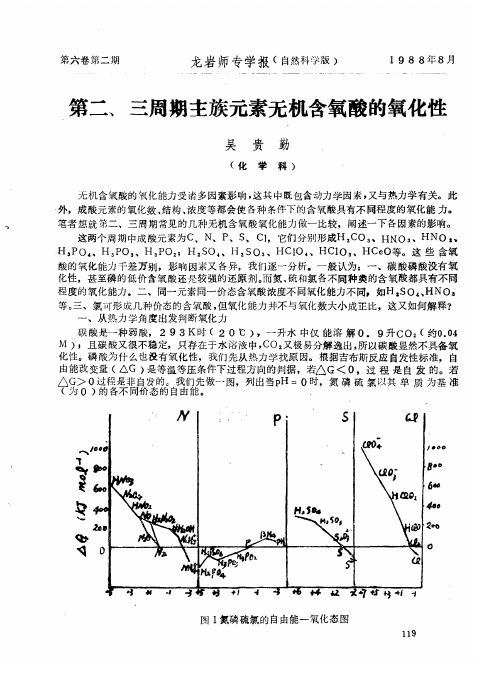
还 要考 虑 成 酸原 子 与氧原 子 结 合 的 化学键 数 目
同一 元 素不 同 价 态 的 含 氧 酸
,
,
氧 化能 力
的差 别 主 要体 现在还 原 过程 中所应 破坏 的 成 酸原 子 与 氧 原 子 之 间 键 的 不 同 氧原 子 结 合 的 键 的 数 目 多
于稀 硝 酸
, ,
氧 化数 高者 必 与
,
H
二
O 时 的 自由 能 图 解 与 N
,
、
S
、
C I不 同
。
,
磷 的不 如C
u
“争
同 价态的 含氧 酸 的 自 由 能 为负值 也可 将 单 质磷 氧 化到 H
:
这 就 使 得 单 质 磷极 易 被 氧 化
:
直 到 生成 H
P O
`
。
PO Z P
`
,
反 应如 下
S C廿 5 0
`
+
+
S H: O
P O
`
、
N
、
P
4
、
、
S H
, :
、
C l
3
,
它 们 分 别 形成
H C IO
;
、 。
H
C O
3
、
3
、
H 尺O
e
:
、
H N O
:、H源自3pO:、
H
。
p o
,
:
,
:
5 0
5 0
、
H C 10
HC
:
O等
。
这 些 含氧
酸 的 氧 化 能 力千差 万 别
无机含氧酸的氧化还原性及其影响因素

3.其他过程的能量效应
❖在氧化过程中常伴随其他一些非氧 化还原反应。
❖使熵增大或者使焓减小都有利于反 应的进行。如非电解质的形成,沉 淀或者配合物的形成,溶剂化或者 去溶剂化都将影响含氧酸的酸性
元素最高氧化数的氧化性增强
还无 原机 性含 及氧 影酸 响的 因氧 素化
曾巽凌 董思琦 叶美玲
Contents
含氧酸氧化还原性强弱的规律 2 影响含氧酸氧化能力的因素
Click to add title in here
1.同一周期元素高氧化数的 氧化性随原子序数的增加而增强
❖如H2SiO4<H3PO4<H2SO4<HClO4 ❖如HClO>HBrO>HIO
4.含氧酸的氧化性强于含氧酸盐, 在酸性介质中的氧化性强于碱性介质
❖ 如KMn04在酸性溶液中可以氧化Cl-离子,在碱
性溶液中无法氧化
从电极电势上看,增大酸根或氢离子的浓度,氧化能力 增强,这可由Nernst方程解释:
E=Eθ+0.0592/n lg(ox)m/(red)n, 对于有 H+ 参加的反应,氧化态物质应包括 H+ ,由此方 程式可知:增大H+浓度,可提高电极电势,从而使酸的 氧化性增强。
Reason2 中心原子X与氧原子之间键的强度
❖当X-O键越强,X-O键数越多时,所 需能量越多,含氧酸越稳定,氧化能力 越弱
❖so 稳定性
HClO4>HClO3>HClO3>HClO
On the other hand X-O键的强度与中心原子X的电子层结构,成键情况
,温度及H离子的反极化作用有关
无机含氧酸分子的酸性

无机含氧酸分子的酸性
无机含氧酸分子是有机化学中至关重要的一类物质,具有独特的特性和性质。
它们被广泛用于医学、农业、材料科学和其他领域。
本文将就无机含氧酸分子的酸性及其影响因素进行分析和研究。
无机含氧酸分子的酸性是指其具有质子交换性的特性。
因此,它们具有很高的溶解性,能与其他物质形成溶液。
此外,它们能将氢离子与其他离子结合起来,帮助生物体构建细胞结构、维持酸-碱平衡等。
然而,由于无机含氧酸分子的酸性特性,它们也可能引起环境污染、腐蚀金属和引发人体皮肤疾病。
无机含氧酸分子的酸性受到多种因素的影响,其中包括电子结构、氧化态、元素组成和分子结构等。
首先,电子结构是影响无机含氧酸分子酸性最主要的因素。
通过仔细检查它们的电子结构,能够识别它们是否是碱性或酸性。
其次,氧化态是影响无机含氧酸分子酸性的重要因素。
当无机含氧酸分子的氧化态发生变化时,它们的性质也会发生变化,从而影响它们的酸性。
此外,化学元素的组成也会影响无机含氧酸分子的酸性。
如果包含有碱性元素,则其有机含氧酸分子会产生较高的酸性。
最后,无机含氧酸分子的分子结构也会影响它们的酸性。
如果分子结构更加紧凑,则分子的酸性就更强。
无机含氧酸分子的酸性是有机化学重要的一个方面,它们不仅可以用于多种应用,而且还可能引发环境污染和人体疾病。
因此,研究无机含氧酸分子的酸性和它们的影响因素是非常重要的。
通过研究无机含氧酸分子的酸性,我们可以更好地利用它们,并避免它们对环境
和人体健康的不良影响。
无机含氧酸的氧化性

无机含氧酸的氧化性(2005.5.28,2中)一、含氧酸氧化性强弱的规律性1、同周期元素最高价含氧酸的氧化性,随着中心元素原子序数的增加而增强。
H 2SiO 3<H 3PO 4<H 2SO 4<HClO 4φφ2、同族元素最高价含氧酸的氧化性,随着中心元素原子序数的增加,主族元素呈现起伏的 “锯齿形”变化,副族元素则表现出减弱的趋势。
HClO 4<HBrO 4>H 5IO 6;HMnO 4>HTeO 4>HReO 4高卤酸的氧化性2Mn +5H 5IO 6→2MnO - 4+5IO -3+7H 2O+11H在三种高卤酸中,BrO 4-/BrO 3-的电势最高(φ =1.76V )。
但是,在室温下HBrO 4的氧化性不易表现,要到100℃时反应才明显。
HClO 更不易表现氧化性。
3、同周期的族序相同的主、副元素最高价含氧酸的氧化性,一般说来,主族元素比副族元素为强。
例如,HBrO 4>HMnO 4;H 2SeO 4>H 2CrO 44、同一元素不同价态含氧酸的氧化性,在稀溶液中随着价态的升高而减弱(即低价态的氧.....化性较强....)。
HClO ~HClO 2>HClO 3>HClO 4,HNO 2>HNO 3(稀),H 2SO 3>H 2SO 4(稀),H 2SeO 3>H 2SeO 4(稀)NO - 3+4H ++3e-NO+2H 2O φ 3/NO)=0.96V, HNO 2+H ++e -NO+H 2O φ0(HNO 2/NO)=1.00V, H 2SO 4+6H ++6e -S+4H 2O ,φ=0.37V ;H 2SO 3+4H ++4e -S+3H 2O ,φ=0.45V ;MnO 4-+4H ++3e -=MnO 2+2H 2O ,φ ;MnO 2- 4+4H ++2e -=MnO 2+2H 2O ,φ ; MnO 4-+4H ++3e -=MnO 2+2H 2O ,φ =1.69V ;MnO 2- 4+4H ++2e -=MnO 2+2H 2O ,φ =2.26V ; MnO 4-+2H 2O+3e -=MnO 2+4OH -,φ=0.60V ;MnO 2- 4+2H 2O+2e -=MnO 2+4OH -,φ=0.62V ; {次卤酸不稳定,至今尚未制得纯的HOX 。
无机含氧酸的酸性及氧化性的比较与影响因素

无机含氧酸的酸性及氧化性的比较与影响因素1 无机含氧酸的酸性无机含氧酸可以的分子式为HmROn,其通式可以写成Hl-Rm--〔O-H〕n,〔其中l,m可以为0,n≥0〕,也可写成ROm-nOHn,其中R称为成酸元素,.无机含氧酸在水溶液中的酸强度取决于酸分子中羟基-O-H的电离程度,也可以用Pka值来衡量。
酸分子羟基中的质子在电离过程中脱离氧原子,转移到水分子中的孤对电子对上,其转移的难易程度取决于成酸元素R吸引羟基氧原子电子的能力。
如果成酸无素R的电负性越大,R周围的非羟基氧原子数目越多,则其酸性越强。
原因是成酸元素R的电负性越大,则其偏移O的电子越少,从而减小了O原子周围的电子密度增大的趋势,使得其对质子的吸引减弱,有利于质子的转移;非羟基氧原子越多,则分子周围越易形成离域π键,这种键将成酸R原子及O原子包裹在其中,一方面增强了羟基-O-H键的极性,有利于质子的转移,其次使得整个酸基团周围的空间减小,阻碍了质子与O原子上孤对电子的结合,从而使得酸性增强。
含氧酸的酸性一般存在如下规律[1]:(1) 同一成酸元素若能形成几种不同氧化态的含氧酸,其酸性依氧化数递增而递增;如HClO4>HClO3>HClO2>HClO〔原因:从HClO 到HClO4非羟基氧原子逐渐增多,羟基-O-H键的极性增强,质子转移程度增强,故酸性增强〕(2) 在同一主族中,处于相同氧化态的成酸元素,其含氧酸的酸性随原子序数递增,自上而下减弱。
如H ClO>HBrO>HIO,HClO2>HBrO2>HIO2、HClO3>HBrO3>键HIO3、HClO4>HBrO4>HIO4〔原因:同主族元素自上而下,成酸元素的电负性逐渐减小,原子半径增大,吸引羟基氧原子的能力依次减小,羟基-O-H键的极性依次减小,所以酸性依次减弱。
〕(3) 在同一周期中,处于最高氧化态的成酸元素,其含氧酸的酸性随原子序数递增,自左至右增强。
如HClO4>H2SO4>H3PO4〔原因:同一周期中,从左至右元素的非金属性逐渐增强,成酸元素的电负性逐渐增大,吸引电子对的能力逐渐减小,电子偏向成酸元素R一方的程度增大,含氧酸分子中的氢原子的极化程度增大,所以酸性增强.〕查阅相关资料可知此类酸的酸性强弱可以有鲍林规则来初步判断,具体规则如下:鲍林规则[2]:规则Ⅰ:多元酸的逐级电离常数Ka1、Ka2、Ka3…其数值之比为1∶1×10-5∶1×10-10…如:H3PO4 Ka1=7.6×10-3 Ka2=6.3×10-8 Ka3= 4.4×10-13在P区元素中,其它含氧酸如H2SO3,H2CO3,H3AsO4等均符合规则Ⅰ,其它如H5IO6、H6TeO6、H2SiO3不符合规则Ⅰ。
钼酸
molybdicacid
分子式:H2MoO4或MoO3·H2O
分子量:162
CAS号:7782-91-4
性 质:无机酸,钼的含氧酸,氧化性较弱。胶状。白色或带有黄色的块状或粉末。密度3.124g/cm3(15℃)。加热到70℃失去一个分子结晶水。微溶于水,溶于液碱、氨水或氢氧化铵溶液。钼酸的盐中仅碱金属、铵、Be、Mg、Tl可溶,其余难溶。PbMoO4可用于做Mo的质量检定。酸化钼(IV)酸盐溶液加热至40~60℃可制得钼酸。由钼酸铵与浓硝酸作用可得一水合钼酸H2­MoO4·H2O,黄色柱状单斜晶系,难溶于水。
生产方法
主要采用钼酸铵硝酸中和法,即将辉钼矿(二硫化钼)经空气氧化焙烧后用氨水浸出除去杂质,再与硝酸中和,经过洗涤、干燥而得。
应用领域
用于制取其他钼的化合物和金属钼。制造钼类催化剂(如石油催化剂等),蓝色陶瓷釉药和涂料。用作制造钼盐的原料.其中仲相酸铵是实验室常用试剂,也是微量元素肥料。分析化学中用于定量分析磷,磷酸盐及铝。医药、金属电镀着色,并用作釉药、油画和水彩画颜料等。钼酸盐溶液在酸性条件下易发生缩聚作用生成同多酸根离子,pH越小,缩合度越大。
无机含氧酸氧化性强弱的标度
宁夏 师范 学院 学报
篓 rde iNr 帆 t le) y a n ∞ ( sc
— — — — — — — —
— —
—
—
—
2, = ;
, 一 ’ 一 ‘
无机 含 氧酸 氧化 性 强弱 的标 度
梁永 锋 , 立红 , 刘 李永 红
( 宁夏师 范学院 化学工程系 , 宁夏 固原 7 60 ) 5 00
摘
要: 本文在相同的外界条件下 , 就含氧酸的组成、 结构与氧化性的关 系进行 了讨论 , 出其氧化性 提
强弱的定量计算公式 , 并计算 了常见含 氧酸的 E 值. 0
关键词 : 含氧酸; 氧化性; 标度 中图分类号 : 2 16 O 4 . 文献标识码 : A 文章编号 :0 1— 4 12 0 l3— 0 9— 3 10 0 9 (0 7 0 0 8 0 收稿 日期 :0 7— 2— 1 20 0 2
作者简介 : 粱永锋 (9 3 ) 甘肃庆阳人 , 16 一 男, 硕士、 副教授 , 主要研 究方向 : 学基 础理论及化 学学科教 化
学.
无机含氧酸的氧化性是其重要的化学性质之一 , 在科学研究和化学教学 中都具有广泛的应用. 但 现行的无机化学教材和教学中对其定性讨论 的多而缺乏定量研究. 本文在分析无机含氧酸的组成、 结 构与氧化性关系的基础上 , 就相同的外界条件下 , 对其氧化性的强弱进行 了定量讨论. 同时, 将计算结 果与标准电极电势 E 进行了比较. 。
l6 1 3
25 .5
16 6 . 3
23 .l
14 .7
23 .l
14 .0
维普资讯
9 0
。 — — — — — — — — — — —
第九章 p区元素
• 3.第二周期和第四周期p区元素性质的特殊性 • 第二周期 • p区元素的第二周期显示出反常性 • ①半径较小、电负性较大,获得电子的能力较强,形成共价键的 趋势大。 • ②与第三周期元素相比,它们的原子半径较小,成键时键长较短, 参与成键的电子之间的排斥力较大,导致单键键能较小,这与同 族元素中单键键能从上到下依次递减的规律不符。
X2 氧化性: X- 还原性: 结论: 强 弱 弱 强
氧化性最强的是F2,还原性最强的是Iˉ。
与H2O反应:
4HX O2 氧化反应: X2 2H2O 激烈程度 F2 Cl 2 Br2 X2 H2O HXO HX 歧化反应: Cl 2 Br2 I 2
K (Cl2 ) 4.210
• 第四周期
• 第四周期由于 d 电子的填入,除原子半径明显减小以外,也导致 其性质的异常。在第ⅦA族元素的含氧酸中,溴酸、高溴酸的氧 化性均较氯酸、高氯酸强。
• 4.p区元素的生物学效应 • P区元素中有很多属于人体的必需元素,包括12种常量元素中的7 种(O、C、N、P、S、Cl、Si)和13种人体必需微量元素中的五 种(Sn、F、Se和As)。但有些元素具有明显的毒性,如Pb、Tl 等。有很多元素及其化合物可以作为药物应用。
• 2.原子半径 • 同一周期中,原子半径随原子序数的增加而减小。 • 同一族中各元素价层电子数相同,第一个元素的原子电负性最大, 半径最小,得电子能力最强,随着原子序数的增加,电子层数增 加,原子半径逐渐增加。原子半径越大,元素得电子能力减弱, 元素得非金属也随之增加,金属性增加。P区各族元素都是从特 征的非金属元素开始,逐渐过渡到金属元素。
• 2.影响含氧酸氧化能力的因素 • (1)中心原子结合电子的能力:含氧酸的还原过程是中心原子 接受电子,氧化数降低的过程。因此中心原子结合电子的能力越 强,越容易被还原,含氧酸的氧化能力就越强。
无机含氧酸
无机含氧酸无机含氧酸是一类包含氧原子的无机化合物,其主要特性是具有较强的氧化和还原性,并能物理或化学地溶解在水中,在一定条件下可以催化氧化还原反应,是一种不可缺少的化学物质。
无机含氧酸可以分为氢氧化物、硝酸盐和酸盐三大类,这三大类含氧酸需要先行经过氧化和还原反应才能起作用。
其中,氢氧化物是由氢原子和氧原子构成的物质,它们可以通过氧化反应发生变化,兼具潜力强的还原作用,氢氧化物主要分为金属氢氧化物、半金属氢氧化物和非金属氢氧化物以及无机离子氢氧化物。
另外,硝酸盐是由氮原子、氧原子和氢原子组成的化合物,它可以通过氧化和还原反应作用来改变性质。
硝酸盐主要分为氮氧化物(硫酸盐)、氢氧化物(硝酸盐)和二元硝酸盐(氯硝酸盐)等几类。
最后,酸盐是由官能团和离子组成的无机物质,它们是一类分子较大且在水中可以溶解的物质,可以通过氧化还原反应来改变氧化性和还原性,其中包括氢盐酸、碱金属酸盐、次碱金属酸盐、无机离子酸盐以及有机酸盐等等。
无机含氧酸在日常生活中有着广泛的应用,其中最常见的就是在清洁剂中,清洁剂的主要成分是含氧酸,它的主要原理是当酸中的氧原子将污染物中的一些结合态物质氧化分解,就可以清洗表面上的污渍。
无机含氧酸在医药领域中也有着重要作用。
它可以改变某些物质的氧化性和还原性,从而产生更强的药效。
比如,有些药物分子中的官能团可以被氧化或还原,从而改变药物的药理作用和功效等。
无机含氧酸在工业生产过程中也有着重要的应用。
它可以在一定条件下起到催化或助剂的作用,缩短反应的时间,降低反应的温度,从而提高反应的效率。
除了乳化剂、吸收剂外,无机含氧酸还被广泛用于制造某些精细化学品,比如无机盐、烃类等。
总之,无机含氧酸是一类具有较强氧化和还原性、可以物理或化学地溶解于水中,有着非常广泛应用的无机化合物,是当今世界不可缺少的化学物质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无机含氧酸的氧化性汪涛(2007210426)易千慧(2007210425)(华中师范大学化学学院,武汉,430079)摘要:本文阐述了无机含氧酸的氧化性与酸度、浓度、稳定性和结构之间的关系,列举了几种常见的无机含氧酸的氧化性的递变规律并分析其影响因素。
关键词:无机含氧酸氧化性酸度稳定性常见无机含氧酸氧化性的强弱受到多种因素的共同影响。
其中,对氧化性影响最大的是其自身的结构和稳定性。
溶液中的酸度、酸的浓度和酸自身的解离常数也对其氧化性有一定的影响,本文从一些常见的无机含氧酸来分别介绍这些影响因素:1 结构无机含氧酸的氧化性具有明显的区域性和递变规律。
例如,p 区高价含氧酸就随着周期变化而变化。
在第二周期p 区元素的高价含氧酸分子中均存在有∏64 键。
第三周期P区元素高价含氧酸分子中均存在有∏85 键。
由于π键离域的范围越大,体系的能量越低,分子越稳定,所以第三周期p 区各元素的高价含氧酸与其同族第二周期的元素相比,其氧化性减弱。
第四周期的p 区元素的4d 轨道与氧原子的2p 轨道相比,能量相差较大,不能进行有效地组合,其含氧酸分子中无离域的∏85 键存在,分子的稳定性减小,氧化性较第二、三周期同族元素含氧酸的氧化性强。
第五周期的p 区元素,其中心原子半径较大,且5d 轨道的成键倾向又较强,故它们能以激发态sp3d2 杂化轨道形成八面体结构,其周围的R-O 数目增加,稳定性增大,氧化性减弱。
第六周期元素由于惰性电子对效应而造成其含氧酸氧化性增大。
表1 p 区高价含氧酸的电极电势(Φ/eV)同时,酸的氧化性还受到中心原子电负性、离子电荷半径比的影响。
但其影响对各元素最高氧化态含氧酸氧化性的影响完全可以归于对其中心离子电子云形状的影响,该电子云形状偏离球形对称结构的程度越大,含氧酸氧化性就越强。
能够这样考虑的实质在于中心离子的球形对称结构就像一个弹性球体,当受到外来阳离子、负电荷作用时,部分区域受到压缩而靠近原子核,因受到离子内部电子的排斥具有抵制压缩的能力;其它部分区域被挤出而远离原子核,由于原子核对电子的吸引力而具有抵制被挤出的能力。
当中心离子受到外来正电荷、正离子作用时,可得出相近的结论。
另外,中心离子有一定数目的正电荷,它可以排斥外来正电荷、正离子的干扰,也可以中和外来阴离子的负电荷,减小影响使其电子形状尽量保持球形对称结构。
总之,中心离子是球形对称结构时,对外来电荷有强的抵抗和缓冲能力而保持其自身稳定性。
但是,中心离子成酸后,就偏离了球形对称结构,这种缓冲能力下降或消失,易受还原剂影响,因而氧化性就强。
就像在硝酸盐中,N 原子采取sp2 杂化,三个杂化轨道与三个氧原子之间形成三个σ键,N的p轨道上的一对电子和三个氧原子形成一个四中心六电子的离域∏64 键,这种结构在弱酸或碱性的溶液中是非常稳定的,几乎没有氧化性。
但在硝酸中,N 原子采取sp2 杂化,其p 轨道上的一对电子和两个氧原子上的成单电子形成一个三中心四电子的离域∏43 键,羟基氧原子和氢原子组成σ键,氢原子与非羟基氧原子键能形成分子内氢键,具有这种结构是HNO3 中N 原子的氧化数为+5 的结构对称性差,当浓度很大时酸分子效应显著,再受到H+ 的反极化作用,进一步使HNO3 的稳定性降低,氧化性增强[1]~ [4]。
就HClO、HClO3 和HClO4 来说(表2),由于其对称性逐步变好,形状越来越接近一个球体。
故他们的稳定性逐渐增强,氧化性逐渐减弱。
所以当受到还原剂进攻时,HClO 分子最容易发生有效的碰撞,共价键也就易断开而发生氧化还原反应。
此外,ClO3- 离子的中心Cl原子围绕着三个O 原子,ClO4- 离子的中心Cl 原子围绕着四个O 原子,而HclO 分子的中心Cl 原子只围绕着一个–OH 基团,前者的空间位阻比后者大,使得前者比后者更不易与还原剂离子或分子相接触而发生作用。
这也是次氯酸的氧化性比氯酸和高氯酸强的缘故。
如果以次氯酸(HClO)、氯酸(HClO3) 和高氯酸(HClO4)都还原成单质Cl2 气的反应来比较它们的氧化性,则反应终点差异可忽略。
在氧化还原反应中,需要断裂化学键,断裂化学键应消耗一定的能量,要把ClO3- 还原成单质Cl2 需要破坏三个Cl—O 单键,ClO4- 还原成单质Cl2 则需要破坏四个Cl-O 单键,而HClO 分子还原成单质Cl2 则只须破坏一个Cl-O 单键。
假定他们断裂的Cl—O 键所需消耗的能量相同(根据表二我们可知他们的键能并不相等:HClO4>HClO3>HClO),显然断裂Cl-O 的数目越多,所需要的能量就越多,即把HClO 还原成单质Cl2 所需的能量比将ClO4- 或是ClO3- 还原成单质Cl2 所需的能量少,氧化还原反应更容易发生,即次氯酸(HClO)氧化性比氯酸(HClO3)和高氯酸强(HClO4)[5]~ [6]。
表2 氯元素几种含氧酸的某些参数酸根键长酸根形状酸根结合能电极电势ClO-0.170(nm) 直线型209(KJ/mol)EθHClO/Cl2=1.63VClO3-0.157(nm) 三角锥形243.7(KJ/mol)EθHClO3/Cl2=1.47VClO4-0.145(nm) 正四面体363.5(KJ/mol)EθHClO4/Cl2=1.39V2 酸常数、酸度在水溶液中,酸会解离形成H+和酸根离子,同时酸根离子也会和H+结合形成酸分子。
此时,溶液中酸分子的多少取决于溶液的酸度、酸常数和酸的浓度的综合影响。
例如,由于HClO 是极弱的酸(Ka=2.95×10-8),而HClO3的酸性较强(Ka>0.1)。
所以在溶液中,HClO 基本以分子形态存在,而HClO3 则基本上已经完全电离。
在无机含氧酸中,H+ 的反极化作用是显著存在的。
在HClO 分子中,H+离子的体积很小,正电荷的密度很大,对含氧酸中的0原子有强烈的反极化作用,从而影响O 原子的负电荷分布,使负电荷偏向H+ 离子这一边,削弱Cl 原子对O 原子的极化,使其电子云的重叠部分减小,导致Cl-O 键的键长(170 pm)比ClO3- 中Cl-O 键的键长(157 pm)长得多。
因此,次氯酸中的Cl-O 键比ClO3- 中的Cl-O 键要弱的多(氯酸的Cl-O 键能为243.7KJ/mol,而次氯酸的Cl-O 键能仅为209 KJ/mol)。
当次氯酸分子与外界的其它还原剂物种接触时,次氯酸中的Cl-O 键就容易断裂,即容易发生氧化还原反应。
众所周知,几乎所以的氧化剂的氧化性都会受到溶液中酸度的影响,但不同的氧化剂受到酸度的影响还是有一定差异的。
总的来说,氧化剂所对应的含氧酸的酸常数越小,其氧化性受到酸度影响的程度就越小。
例如,由下列电极电势可以看出,在强酸性条件下,KMnO4 能将H2O2氧化成O2,而在强碱性条件下,H2O2 却能将Gr3+ 氧化成GrO42-。
MnO4-+5e-+8H+=Mn2++4H2O Eθ=1.491VGr2O72-+14H++6e_=Gr3++7H2O Eθ=1.23V2MnO4-+5H2O2+6H+=2Mn2++5O2+8H2O Eθ=0.83V2Gr(OH)3+3H2O2+2OH-=2GrO42-+6H2O Eθ=0.99V其实KMnO4 和K2GrO4 在酸性的条件下氧化性相当,但反应相差这么远就是因为H202的酸常数比较小,即使在强碱性条件下也无法完全电离,而KMnO4 和K2Gr2O7所对应的HMnO4 和H2Gr2O7却是强酸,在碱性条件下基本上以酸根的形式存在,受到H+(一方面H+ 的浓度太低,另一方面它们本身又不含有H+)的反极化作用非常小,所以其氧化性的降低相对于弱酸的H2O2来说要大得多。
从HClO、PbO2 和NaBiO3 的变化情况也可以看出来酸常数对氧化性的影响,由下列电极电势可以看出,在强酸性条件下,HClO的氧化性甚至小于PbO2 和NaBiO3 的氧化性。
可是在碱性条件下,ClO- 却可以将Pb2+ 氧化成PbO2,也可将Bi3+ 氧化成BiO3-。
PbO2+4H++2e-=Pb2++2H2O Eθ=1.682VBiO3-+6H++2e-=Bi3++3H2O Eθ=1.6VHClO+H++2e-=Cl-+H2O Eθ=1.49V2Bi3++2ClO-+8OH-=2BiO3-+2Cl-+4H2O Eθ=0.17VPb(OH)3-+ClO-= PbO2+Cl-+H2O+OH- Eθ=0.59V造成这些影响的一个很重要的因素就是HClO 的酸常数太小,即使在强碱性溶液中也可以结合游离的H+ 形成相应的酸,进而发生氧化还原反应。
[7]~ [10]3 浓度酸分子论指出:无机含氧酸之所以具有氧化性,其重要原因之一是因为它具有未离解的酸分子,也就是说含氧酸的氧化性是由酸分子表现出来的。
如果同一物质的量浓度的含氧酸溶液中含氧酸分子浓度越大,则其氧化性越强。
然而随中心原子价态的升高,与它相结合的氧原子的个数也有所增加,受这些电负性较大的氧原子影响,中心原子的电子密度进一步降低,以至使中心原子所带的正电荷进一步增加,于是每个氧原子的电子密度也相应地降低了,致使O-H键减弱,因而酸性也增强了,从而导致其氧化性相应地降低。
同时,随着浓度的增加,含氧酸中未电离的酸分子数也增加,而体系中酸度的增强则抑制了酸的进一步电离,又有利于提高酸的氧化性。
稀硫酸基本上是不具有氧化性的(基本上体现出来的是H+的氧化性)。
但其浓度一旦增大,就是一种很强的氧化剂,可以氧化许多金属和非金属。
这时它所具有的强氧化性和脱水性就是由硫酸分子直接引起的。
SO42-+2e-+4H+=SO2+2H2O Eθ=0.17VCu+2H2SO4(浓)=CuSO4+SO2+2H2OC+2H2SO4(浓)=CO2+2SO2+2H2O所以,随着浓度的增大,体系中酸度的增大,无机含氧酸的未解离分子数增多,酸的氧化性会明显增强[11]~ [13]。
小结无机含氧酸的氧化性的递变规律是受到众多因素所共同影响的,其中,内在因素(结构、稳定性)起了主要的作用,结构越对称性越小,其共价键越弱,稳定性越低,则氧化性越强。
同时,其本身的浓度越大,酸度越大,酸常数越小,则存在的酸分子数越多,受H+的反极化作用越强,氧化性就越强。
无机含氧酸的氧化性是受到多种因素影响且有规律可循的,所以我们应当在学习的过程中不断归纳与总结,才能学得更好。
参考文献[1] 杨辉,张理平,吕傻芳. 最高氧化态含氧酸或酸酐氧化性周期性的一种解释方法. 延安大学学报(自然科学版).1995,14(4):68~72.[2] 武汉大学、吉林大学等校编. 无机化学,下册,第二版. 北京:高等教育出版社. 1983:41~42,119~133,390~394.610~ 620.[3] 周公度. 无机结构化学. 第十一卷.北京:科学出版社.1982;252~253,286,334~337。
