17 杂环化合物-五元杂环
合集下载
有机化学---第17章 杂环化合物

、 内酯、环状酸酐等。
环为平面型共轭体系,环内π电子数符合4n+2规 则,具有一定芳香性的杂环化合物。
2
2、杂环化合物的分类
五元杂环, 如 单杂环 六元杂环, 如 杂环化合物 稠杂环 两个以上单杂环稠并
N N N H
O N
N H
S
苯环与单杂环稠并, 如 N H
N
N
3
3、杂环化合物的命名 (1)音译法 ——在同音汉字左边 + 口字旁
N ..
H2SO4,HgSO4 220℃
N
N
NO2
β-硝基吡啶
SO3H
β-吡啶磺酸
34
当吡啶环上连有供电子基团时,将有利于亲电取
代反应的发生;反之,就更难以进行亲电取代反应。
NO2
HNO3,H2SO4
H3 C N CH3
100℃
H3 C
N
CH3
吡啶环也象硝基苯一样,不能发生F―C烷基化和 酰基化反应。
吲哚具有芳香性,亲电取代反应发生在吡咯环上; 吲哚亲电取代反应的活性比苯高,但比吡咯低。 亲电取代反应的位置:
5 4 3 7
E+
1
苯 环
6
N H
2
吡咯环
26
进攻 C2 N H + E
+
进攻 C3
只有一个带有完 E N 2 H 整苯环的共振杂化体。 H 3 E 3 E H H + + N N H H
OH
6
S1
苯并呋喃
1
苯并吡咯 喹啉
N
9 7 8
苯并噻唑
N N
3
5 4
HO
N H
OH
17杂环化合物

吸电子诱导-I:O(3.5) > N(3.0) > S(2.6), 供电子共轭+C:N > O > S
结论:贡献电子N最多,O其次,S最少。 b 、亲电取代反应的活性为:吡咯>呋喃>噻吩>苯; 亲电取代反应主要在a-位发生;若a、a'两个位置已有基团 存在,则亲电取代在b位发生。 结论:噻吩、吡咯的芳香性较强,所以易取代而不易加成; 呋喃的芳香性较弱,虽然也能与大多数亲电试剂发生亲电取代, 但在强亲核试剂存在下,能发生亲核加成;吡咯、呋喃对酸及氧 化剂比较敏感; 由于这些五元杂环容易被破坏,稳定性差,因而对试剂及 反应条件应有所控制。
p电子密度: 稳定性 : 芳香性 : 亲电反应活性 :
杂环 杂环 杂环 杂环
> < < >
苯环 苯环 苯环 苯环
2、 呋喃、吡咯、噻吩的物理性质
(1)主要物理性质和鉴别:
三者均为无色液体,都不溶于水,溶于有机溶剂。
呋喃遇到盐酸浸湿的松木片呈绿色---松木片反应; O 吡咯遇到盐酸浸湿的松木片呈红色; 噻吩在硫酸下遇到吲哚醌呈蓝色。 红外光谱:
N CH3 CH3
CH3 CH3
CH2CH2CONH 2 N N CH3 CH3
维生素B12
CH3
O CH2OH
H
7、 噻唑和咪唑
S
噻唑
N
N H
N
(thiazole)
(imidazole) 咪唑
2 1 α 3 4
CH CH3
CH2
CH3 CH CH2
NH
δ
N
β
N Fe
N
N
8 7 γ
HN
5 6
CH3
N
结论:贡献电子N最多,O其次,S最少。 b 、亲电取代反应的活性为:吡咯>呋喃>噻吩>苯; 亲电取代反应主要在a-位发生;若a、a'两个位置已有基团 存在,则亲电取代在b位发生。 结论:噻吩、吡咯的芳香性较强,所以易取代而不易加成; 呋喃的芳香性较弱,虽然也能与大多数亲电试剂发生亲电取代, 但在强亲核试剂存在下,能发生亲核加成;吡咯、呋喃对酸及氧 化剂比较敏感; 由于这些五元杂环容易被破坏,稳定性差,因而对试剂及 反应条件应有所控制。
p电子密度: 稳定性 : 芳香性 : 亲电反应活性 :
杂环 杂环 杂环 杂环
> < < >
苯环 苯环 苯环 苯环
2、 呋喃、吡咯、噻吩的物理性质
(1)主要物理性质和鉴别:
三者均为无色液体,都不溶于水,溶于有机溶剂。
呋喃遇到盐酸浸湿的松木片呈绿色---松木片反应; O 吡咯遇到盐酸浸湿的松木片呈红色; 噻吩在硫酸下遇到吲哚醌呈蓝色。 红外光谱:
N CH3 CH3
CH3 CH3
CH2CH2CONH 2 N N CH3 CH3
维生素B12
CH3
O CH2OH
H
7、 噻唑和咪唑
S
噻唑
N
N H
N
(thiazole)
(imidazole) 咪唑
2 1 α 3 4
CH CH3
CH2
CH3 CH CH2
NH
δ
N
β
N Fe
N
N
8 7 γ
HN
5 6
CH3
N
大学有机化学第十七章杂环

杂环化合物也可以发生还 原反应,如喹啉可以还原 为二氢喹啉。
还原反应通常涉及还原剂 对杂环的攻击,导致电子 转移和还原产物的生成。
杂环化合物在有机合成中的
06
应用
作为合成子构建复杂分子结构
01 杂环化合物作为合成子
杂环化合物具有丰富的反应性和多样的结构,可 以作为合成子用于构建更复杂的分子结构。
02 杂环合成策略
在天然产物的全合成中,杂环的合成是关键步骤 之一。通过设计合理的合成路线,可以实现杂环 的高效构建。
03 实例分析
以某些具有代表性的天然产物为例,阐述杂环化 合物在天然产物全合成中的应用。
在药物设计和合成中的应用
药物分子的结构特点
许多药物分子都含有杂环结构,这些结构对于药物与靶标 的相互作用具有重要影响。
咪唑
由两个氮原子和三个碳原子组成的五元杂环化合物,具有芳香性。咪唑及其衍生物在医药和农药等领域有重要应 用,如抗真菌药物克霉唑、抗寄生虫药物甲硝唑等。
噻唑
由一个硫原子、一个氮原子和三个碳原子组成的五元杂环化合物,具有芳香性。噻唑及其衍生物在染料、农药和 医药等领域有广泛应用,如杀菌剂稻瘟灵、抗癫痫药物卡马西平等。
大学有机化学第十七 章杂环
目录
• 杂环化合物概述 • 五元杂环化合物 • 六元杂环化合物 • 杂环化合物的合成方法 • 杂环化合物的反应与机理 • 杂环化合物在有机合成中的应用
01
杂环化合物概述
定义与分类
定义
杂环化合物是指分子中含有杂原子(非碳原子)的环状 有机化合物。
分类
根据杂原子的种类和数量,杂环化合物可分为单杂环和 多杂环两大类。其中,单杂环又分为含氮杂环、含氧杂 环和含硫杂环等。
呋喃
有机化学-第十七章 杂环化合物
Br
Br
N H
Br2
N H
乙 醇
Br
Br
噻吩对氧化剂稳定,可用一般的硝化剂和磺化剂
H2SO4 , 25℃
S
SO3H S
α-噻吩磺酸
呋喃和吡咯对及氧化剂都比较敏感,应使用特殊的试
剂乙酰硝酸酯进行硝化,使用吡啶三氧化硫进行磺化。
+
N
SO3
-
SO3H O
O CH3 C ONO2 (CH3CO)2O,-10 ℃
O
α-呋喃磺酸
N H
N H
α-硝基吡咯
NO2
吡啶比苯难发生亲电取代反应,反应条件要求和硝基
苯差不多;在发生反应时取代基主要进入β-位。
HNO3 , H2SO4
NO2 N
β(3)-硝基吡啶
N
300 ℃
吡啶的氯代要用AlCl3催化且要加热; 吡啶的磺化要用发烟H2SO4并要加热;
(2) 氧化反应 吡啶环对氧化剂稳定,比苯环难氧化。
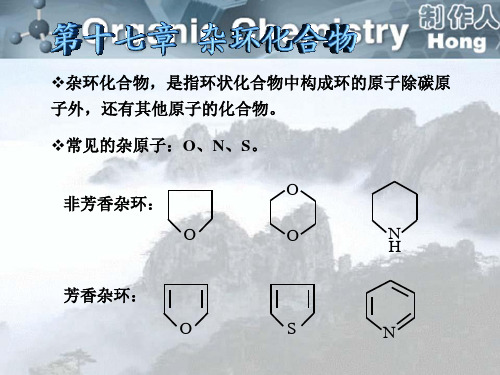
杂环化合物,是指环状化合物中构成环的原子除碳原
子外,还有其他原子的化合物。
常见的杂原子:O、N、S。 非芳香杂环:
O O O N H
芳香杂环:
O
S
N
17-1 分类和命名
一、杂环化合物的分类
单杂环:
{
五元杂环 六元杂环
O
呋喃
N H
吡咯
S
噻吩
N S
噻唑
N N H
咪唑
N
N
吡啶
N
嘧啶
稠杂环:
{
N
1 6 5
N N
3 4
N7
8
N2
2
N9 H
有机化学杂环化合物

呋喃、噻吩和吡咯的原子轨道示意图:
. .. O .. .. S .. . . . . . . .
.
..
O
..
.
..
S
..
.
..
N H
.
..
N H
芳香性大小: 苯>噻吩>吡咯>呋喃
呋喃、噻吩和吡咯的结构
N ..
吡啶中氮原子采取不等性sp2杂化:
p N sp 2 p 结果是: sp 2 N
p轨道与环平面垂 直,相互重叠形 成六个原子在内 的闭合共轭体系
17 杂环化合物
(Heterocyclic Compounds)
基本内容和重点要求
杂环化合物的分类和命名;
杂环化合物的结构和芳香性;
杂环化合物的化学性质;
生物碱
重点要求掌握芳香性;五元、六元杂环化合物 的化学性质,杂环化合物的亲电取代反应的活性及 规律;酸碱性规律。
17 杂环化合物
17.1 杂环化合物的分类和命名
N O SO3 O SO3H
N N H
H2SO4 S 30℃
SO3 N H SO3H
S
SO3H
吡啶与硝基苯相似,亲电取代比苯困难, 并且主要发生在β位上,反应条件要求较高。
¡¡ + Br2
300 C Ò É Ô Ï
¡
Br N
N N N
å ú Á ¤ b-ä ´ ß à
+ H2SO4 + » Ë ì á
. . .
. .
.
N
..
未共用电子对占据 sp2杂化轨道,与 环共平面,不能参 与环系的共轭
吡啶的结构
杂环化合物五元杂环ppt课件

17.2.2 五元杂环化合物的化学性质
A. 亲电取代反应
X
杂原子的+C 效应,增加了杂环的 亲电取代反应的活性。 亲电取代反应活性顺序:
> N H O > S >
X = N H ,O ,S
它们在亲电取代反应中,使用温和的试剂: 1. 硝化
一般采用硝酸乙酰酯 CH3COONO2作硝化剂
2. 磺化 吡咯、呋喃通常采用吡啶与SO3的加合物:
• 核磁共振信号大都出现在较低场(芳香性又一证据)
δ 6.24 δ 6.99 δ 6.22 δ 6.43 δ 6.28
O
δ 7.29
S
δ 7.18
N H
δ 6.68
呋喃、吡咯和噻吩的芳香性:比苯环差
呋喃、噻吩、吡咯及环戊二烯的键长/nm X-C1(单键) C2-C3 C3-C4
X = O ,S , N H ,C H 2
M o r p h i n e b a s e
吗啡碱
H e r o i n
海洛因
C o d e i n e
可待因
17.1 杂环化合物的分类、命名
芳香性杂环 非芳香性杂环: 杂环
非芳香性杂环
O
O O 四氢呋喃 1,4–二氧六环
N N N
四氢吡咯
H
2.2]辛烷)
芳杂环化合物 :
H
sp2 –杂化
呋喃
噻吩
杂原子以未共用电子对参与环的共轭,具有给电子 的共轭效应,使得环上电子云密度比苯环大,称其为富 电子芳杂环。
五元杂环化合物中各原子的电子云密度如下:
1.02 1.08 O 0.90 1.04 1.06 S 0.80 1.06 1.10 N 0.68 H
第17章 杂环--2

-吡啶甲酸 3-吡啶甲酸
§17-1 概 述
二、杂环化合物的结构
1、五员杂环化合物的结构
如吡咯。在吡咯中,成环的五个原子(1个N,4 个C)均为sp2杂化,形成三个键,2p轨道以侧面交 盖形成大键,其环上的电子数符合4n+2,因而具 有芳香性。 • •
H H
C C
•
H N H
吡咯分子中的键
§17-3 杂环化合物的性质
Br2 0℃
Br– Br–
N H
–Br –Br
2,3,4,5-四溴吡咯
CH3COONO2
–NO2 N 2-硝基吡咯 H –SO3H N 2-吡咯磺酸 H –COCH3 N 2-乙酰基吡咯 H
N H
SO3 N·
不能用混酸、 H2SO4直接 (CH3CO)2O 硝化、磺化
§17-3 杂环化合物的性质
E
EE E E AA A A E A
E E
中间体有三个主要共振式 中间体有三个主要共振式 中间体有三个主要共振式 中间体有三个主要共振式 中间体有三个主要共振式 较稳定 较稳定 较稳定 较稳定 较稳定 满足八隅体 贡献大
E E H H
E - H+ A
E+ E+
A A
A
E
A A
中间体有三个主要共振式 较稳定 A A
§17-3 杂环化合物的性质
2、六元杂环化合物
0.95 ① 亲电取代: 0.85 N有吸电子的诱导效应,使杂环上的电子 N 云密度降低,因而比苯难发生亲电取代反应。 吡啶的一元取代总是发生在间位。
+ Br2
N
0.82
浮石催化 300℃
FeBr3 50℃ H2SO4 300℃ H2SO4 50-60℃
第十七章杂环化合物

2004年8月13日
(三) 六元杂环化合物
N N 吡啶 N 嘧啶 H2N N 磺胺嘧啶(SD) SO2 NH N
(1) 碱性与亲核性
由于氮上孤对电子与苯环共面,不参与环体系的共轭 由于氮上孤对电子与苯环共面,不参与环体系的共轭, 所以吡啶有碱性和亲核性,且碱性大于苯胺: 所以吡啶有碱性和亲核性,且碱性大于苯胺:
(
。) b.p81 C
(苯层)
浓 H2SO4 室温 分液 蒸馏
无噻吩苯
S 。 ( b.p84 C) .
S
SO3H (酸层)
2004年8月13日
付氏酰基化: 付氏酰基化:
N H
+(CH3CO)2O
150-200 C 60%
。 N H COCH3
2004年8月13日
(2) 加成
O N H
+ H2 + H2
2004年8月13日
例:
N N N
+ Br2
。 300 C
以上
Br N
β溴代吡啶
+ H2SO4 + 混酸
350 C
。 。 N
SO3H NO2 N
β吡啶磺酸
300 C 24h
β硝基吡啶 (产率很低, 6%) 约
2004年8月13日
(3) 亲核取代
N N
+ NaNH2 + KOH
N NH2 N OH
能与强酸成盐
不能与强酸成盐, 不能与强酸成盐,遇酸分解
2004年8月13日
另一方面,吡咯有弱酸性: 另一方面,吡咯有弱酸性:
N H
+
KOH(S)
H2O
N+ K
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
哒嗪 pyridazine
嘧啶 pyrimidine
吡嗪 pyrazine
稠杂环:
O S N H
苯并呋喃 benzofuran
N N H
苯并噻吩 thionaphthene
N O
吲哚(苯并吡咯) indole
N S N N N H N
苯并咪唑 苯并 唑 benzomidazole benzoxazole
比苯容易进行亲电取代反应; 亲电取代反应首先发生在α位。
• 核磁共振信号大都出现在较低场(芳香性又一证据)
δ 6.24 δ 6.99 δ 6.22 δ 6.68 δ 6.43 δ 6.28
δ 7.29
δ 7.18
O
S
N H
呋喃、吡咯和噻吩的芳香性:比苯环差
呋喃、噻吩、吡咯及环戊二烯的键长/nm X-C1(单键) C2-C3 C3-C4
N H
四氢吡咯
使用特殊催化剂
S
• 噻吩能使常用氢化催化 剂中毒
• C-S键易还原脱硫
• 用Raney Ni催化氢化使噻酚还原脱硫
H2 R S R Raney Ni R R + N iS
O C R S C
O
H2 Raney N i
O C R C
O + R N iS
R
2. Diels-Alder反应(共轭二烯性质)
N H
sp2 –杂化
H
符合休克尔规则,具有芳香性。
呋喃
噻吩
杂原子以未共用电子对参与环的共轭,具有给电子 的共轭效应,使得环上电子云密度比苯环大,称其为富 电子芳杂环。
五元杂环化合物中各原子的电子云密度如下:
1.02 1.08 O 0.90 1.04 1.06 S 0.80 1.06 1.10 N 0.68 H
2. 磺化 吡咯、呋喃通常采用吡啶与SO3的加合物:
N + SO3 N· S O 3
噻吩可直接 用硫酸磺化
+ S
H 2 S O 4 (浓 ) 室 温
S
S O 3H
噻 吩 - 2- 磺 酸 (~ 7 5 % )
煤焦油中提取的苯含0.5% 噻吩。这是制取无噻 吩苯的一种方法.
应用:除去苯或甲苯中的噻吩
N
苯并噻唑 benzothiazole
嘌呤 purine
喹啉 quinoline
N
N
异喹啉 isoquinoline
吖啶 acridine
杂环化合物的命名 杂环化合物的命名一般采用音译的方法,即根据其 英文读音,用同音汉字左边加上“口”字旁表示。
杂环的编号 一般从杂原子开始;当环上有两个或两个以上的杂 原子时,应使杂原子的编号尽可能小;对于不同的杂 原子,按O→S→N的顺序编号。
第17章 杂环化合物
杂环化合物:
构成环的原子除碳原子外还有其它原子的一类环 状化合物 ,常见的杂原子是O,N,S。
O N H
N
四氢呋喃
O NH NH2 O N H H S
哌啶
吡啶
CH CH2 CH3 CH N Fe N N CH3 C H 2C H 2C O O H N CH2
· H 2O CH3 COOH
芳香性:苯 > 噻吩 > 吡咯 > 呋喃
17.2.2 五元杂环化合物的化学性质
A. 亲电取代反应
X
X = N H ,O ,S
N H
杂原子的+C 效应,增加了杂环的 亲电取代反应的活性。 亲电取代反应活性顺序:
> O > S >
它们在亲电取代反应中,使用温和的试剂: 1. 硝化
一般采用硝酸乙酰酯 CH3COONO2作硝化剂
吗啡碱
H e r o in
O R 'O H H NCH3
R ,R ' = H 3 C
C
海洛因
R = C H 3, R ' = H C o d e in e
可待因
17.1 杂环化合物的分类、命名
芳香性杂环 非芳香性杂环:
O
杂环
非芳香性杂环
O O
四氢呋喃 1,4–二氧六环
N H N N
四氢吡咯
六氢吡啶
吡咯、呋喃、噻吩亲电取代反应的定位规律:
4 5 Y 1 3G 2
Y=O, S, N G=邻、对位定位基, 第二个基团进入与G相邻的α位, 即C-2位。
G=间位定位基,
第二个基团进入与G间位的α位, 即C-5位。
COOH S
3 -噻 吩 甲 酸
+ B r2
25 ℃ Br S
COOH
5 -溴 - 3 -噻 吩 甲 酸
H 2S O 4 S r. t.
&
反应快
S
S O 3H
溶解于硫酸中
3. 卤化
采用溶剂稀释、低温
O
O
+ B r2
O 0℃
α –溴 代 呋 喃 (9 0 % )
O
Br
S
+ B r2
A cO H 室温
Br S α –溴 代 噻 吩
4. Friedel–Crafts酰基化
催化剂: SnCl4, BF3等(催化活性较弱)
C. 吡咯的酸碱性
吡咯N的碱性很弱(pKb=13.6)
原因:吡咯氮原子上的未共用电子对参与整个环上 的共轭体系,从而使氮原子上的电子云密度降低, 给电子能力减弱。
吡咯N-H的弱酸性
R N R H N H R O H Ph O H
pKa
~ 35
~15.0
~17
~10
• 吡咯钾盐的生成
K + N H N K H2
5–甲基噻唑
6–甲氧基苯并 唑
稠杂环化合物的编号一般有固定的编号顺序。如:
• 对于含一个杂原子的杂环也可把靠近杂原子的位置叫 做α位,其次为β和γ位。
γ β ' β
α ' N α
17.2 五元单杂环化合物
呋喃、噻吩和吡咯 17.2.1 结构和芳香性
N H
H H
参与大π键生成 H 的p轨道中的电子
X
X = O ,S , N H ,C H 2
呋喃 0.1362(0.143) 噻吩 0.1714(0.182) 吡咯 0.1370(0.147) 环戊二烯 0.1502
C C C C
0.1361 0.1370 0.1382 0.1341
0.1430 0.1423 0.1417 0.1455
键长/nm 0.154 0.134
H 3C
头孢氨苄(先锋霉素IV)
H 3C H O O C C H 2C H 2
血红素(heme)
自然界中的杂环化合物
R = CH3 R N Mg N N O O O N O R= CHO CH3 O Chloropgyll a Chloropgyll b
RO
R ,R ' = H O
M o r p h in e b a s e
基本要求: 1. 掌握五元杂环化合物(呋喃、吡咯、噻吩、糠醛) 的命名、结构和芳香性; 掌握五元杂环化合物的典型 反应(重点); 2. 掌握六元杂环化合物(吡啶、嘧啶)的命名、结构 和芳香性;掌握六元杂环化合物的典型反应(碱性; 亲电取代反应;还原反应;烷基吡啶侧链上的反应) (重点,难点)。 3. 掌握稠杂环化合物(吲哚、喹啉、异喹啉)的命名、 结构和芳香性;掌握稠杂环化合物的典型反应(碱性; 亲电取代反应;亲核取代反应;还原反应;氧化反应) (重点,难点)。 7. 掌握喹啉的合成方法。
吡咯负离子的一些典型反应
-呋喃甲醛(糠醛):
不含α–H的醛,化学性质与苯 甲醛相似。
17.3 五元双杂单环化合物
噁唑
噻唑
咪唑
酸性比吡咯强 碱性比吡咯强 为弱碱 新增加的N原子上的孤对电子不参加共轭。 未共用电子对不参与共轭
亲电反应活泼性比吡咯弱 ( 环上引入了吸电子能 力强的N原子),反应发生在4-位)。
H
奎宁环 (1–氮杂二环[2.2.2]辛烷)
芳杂环化合物 :
五元杂环:
O S
呋喃 furan
N Nቤተ መጻሕፍቲ ባይዱH N H
噻吩 thiophene
N
吡咯 pyrrole
N O S N
N H
吡唑 pyrazole
咪唑 imidazole
唑 oxazole
噻唑 thiazole
N N
六元杂环:
N N N N N
吡啶 pyridine
4 5 O 1
3 2 G
无论G是什么基团, 第二个基团均进入C-5位。
4 5 Y 1
3 2 G
Y=S, N
G=邻、对位定位基,
第二个基团进入C-5位。 G=间位定位基, 第二个基团进入C-4位。
B. 加成反应
1.催化加氢
H2 / Pd O
THF(常用溶剂)
O H2 / Pd
N H H2 / M oS2 S
