滴定分析法定义及几个基本术语(精)
滴定分析法概论
例:Al3+ +
一定过量EDTA标液 剩余EDTA Zn2+标液 EBT
返滴定
n(EDTA)总 - n(EDTA )过量 = n(Al)
( c ·V) (EDTA)总 - (c·V )(Zn) = (c·V )(Al)
例:固体CaCO3 + 一定过量HCl标液
mA 1000 MA
=CBVB
a b
mA VB
1000=CB
MA
a b
T
B/
A
=
CBMA 1000
a b
CB
=
TB/A 1000 MA
ba
例4 试计算0.02023mol/L K2Cr2O7溶液对Fe和 Fe2O3旳滴定度。
解:Cr2O72- + 6Fe2+ +14 H+ =2Cr3+ + 6Fe3+ +7H2O
剩余HCl标液 NaOH原则溶液
返滴定
例 : Cl- + 一定过量AgNO3 原则溶液 剩余AgNO3 原则溶 NH4SCN原则溶液 返滴定 Fe3+ 指示剂
淡红色[Fe(SCN)]2+
(3)间接滴定法 经过另外旳化学反应,以滴定法定量进行。 合用于不能与滴定剂起化学反应旳物质
例:Ca2+
CaC2O4沉淀 H2SO4
VT
VT单位为 L
mA
a t
CT
VT
M
A
/1000
注意:化学反应配平;单位换算 VT单位为 mL
例3 用Na2B4O7·10H2O标定HCl溶液旳浓 度,称取0.4806g硼砂,滴定至终点时消耗
化学滴定基础知识

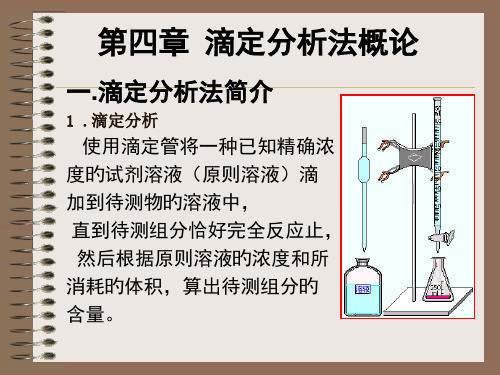
化学滴定基础知识滴定分析法,是一种简便、快速和应用广泛的定量分析方法,是化学分析法的一种,将一种已知其准确浓度的试剂溶液(称为标准溶液)滴加到被测物质的溶液中,直到化学反应完全时为止,然后根据所用试剂溶液的浓度和体积可以求得被测组分的含量,这种方法称为滴定分析法(或称容量分析法)。
一.滴定分析概述(一)滴定分析的优点1. 操作简单;2. 对仪器要求不高;3. 有足够高的准确度误差不高于0.2%;4. 方便,快捷;5. 便于普及与推广。
(二)滴定分析相关术语1. 又称容量分析,它是根据已知准确浓度的溶液(标准溶液)和被测物质完全作用时所消耗的体积计算被测物质含量的方法;2. 滴定:滴定标准溶液的过程;3. 化学计量点(等当点):滴加的标准溶液与待测组分恰好反应完全的这一点,又称滴定终点;4. 滴定终点:依据指示剂的颜色变化确定的等当点;5. 滴定误差:滴定终点与等当点之间存在的误差。
(三)滴定分析的基本条件1. 反应完全:反应必须按方程式定量地完成,通常要求在99.9%以上,不得有副反应,这是定量计算的基础;2. 反应要迅速:必要时需加热或加入催化剂;3. 必须有确定的等当点:要选用合适的指示剂;4. 共存物质不干扰主要反应,或用适当的方法消除其干扰。
(四)滴定分析类型(根据反应的类型可分为四类)1. 酸碱滴定法:建立在酸碱反应基础上的滴定分析方法,本质是酸碱之间的质子传递。
例如:滴定反应,H++OH-→H2O;2. 沉淀滴定法:建立在沉淀反应基础上的滴定分析方法,根据确定终点的方法不同,可分为摩尔法、佛尔哈德法、吸附指示剂法。
例如:银量法:Ag++Cl-→ AgCl↓;3. 配位滴定法:建立在配位反应基础上的滴定分析方法,在配位滴定中,除主反应外,还有各种副反应干扰主反应的进行,反应条件对配伍平衡有很大的影响。
例如,EDTA滴定法:Mn2++H2Y2-→MnY+2H+4. 氧化还原滴定法:建立在氧化还原反应基础上的滴定分析方法,以电子转移为依据,反应条件对平衡有较大影响。
第二章 滴定分析法概述

10
Analytical Chemistry
返滴定法(两个反应,两种标准溶 液)
先准确加入过量标准溶液,使与试液中的待测物质 或固体试样进行反应,待反应完成以后,再用另一
种标准溶液滴定剩余的标准溶液的方法。适用于反
1. 标准溶液的配制:分为直接配制法和间接配制法
⑴基准物质和直接配制法
基准物质 :能用于直接配制或标定标准溶液的 物质,称为基准物质或标准物质。基准物质应符 合下列要求: (1)试剂的组成应与它的化学式完全相符。 (2)试剂的纯度足够高,一般要求其纯度在99.9%以 上。 (3)试剂在一般情况下应该很稳定,在配制和贮存 中不会发生变化。 (4)试剂最好有比较大的摩尔质量。
17
Analytical Chemistry
P29-30 表2-1 常用的基准物有: K2Cr2O7; Na2C2O4; H2C2O4.2H2O ; KHC8H4O4; Na2B4O7.10H2O;Na2CO3 ; CaCO3;NaCl
18
Analytical Chemistry
直接配制法:直接准确称取基准物质或优级纯物质 ,溶解后用容量瓶配制,定容。 直接配制:K2Cr2O7、KBrO3等。
Analytical Chemistry
第二章 滴定分析法概述
主
讲: 孔德贤
1
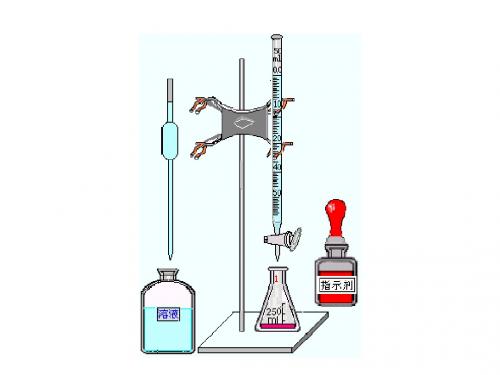
常用滴定分析仪器
量筒
移液管
吸量管
酸式滴定管
容量瓶
容量仪器
2
烧杯
锥形瓶
Analytical Chemistry
2.0 滴定分析基本术语
2.0.1 基本概念
滴定分析

×
酸化
KMnO 4
H2C2O4
2 C 2 O4
CaC2O4↓
标准溶液
一、标准溶液的配制与标定
所谓标准溶液,就是 指已知准确浓度的溶液。 在滴定分析中,不论采取 何种滴定方法,都离不开 标准溶液,否则就无法计 算分析结果。
(一) 标准溶液的配制 1. 直接配制法
(1) 准确称取一定质
量的物质→溶解→定
等物质的量规则
1 1 n( A) n( B) ZA ZB
ZA和ZB分别为A物质和B物质在反应中 的得失质子数或得失电子数。
1 1 分子量:M ( A) M (A) ZA ZA
浓度: c( 1 A) Z c(A) A
ZA
1 n( A) Z A n(A) ZA
MnO4- + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O MnO4-的基本单元:
C Na S O VNa S O 6CK Cr O VK Cr O
2 2 3 2 2 3 2 2 7 2
nNa2 S2O3 6nK2Cr2O7
2 7
C Na S O
2 2 3
6CK Cr O VK Cr O
2 2 7 2
2 7
VNa S O
2 2 3
2.4530 6 294.19 25 0.5 0.0958mol / L 26.12
0.1001 25 .00 26 .12
0.09581 mol/L
例4:
称取不纯的草酸试样0.1500g, 溶于适量水后, 用c(NaOH)为 0.09000mol/L的标准溶液滴定, 共用去 25.00mL, 求试样中 H2C2O4 · 2O的含量。 2H
分析化学 滴定分析法
三、 标准溶液的配制、基准物、基准溶液
标准溶液:已经准确知道浓度的溶液. 配制方法:直接法和间接法 1、 直接配制法 准确称取一定质量的物质,溶解于适量水后移入容量瓶,用 水稀至刻度,然后根据称取物质的质量和容量瓶的体积即可算出该 标准溶液的准确浓度。(这种溶液也称基准溶液) 凡是基准物质(或基准试剂),才可以用来直接配成标准溶液。 哪些物质是“基准物质”(或“基准试剂”)呢? 1.在空气中要稳定。例如加热干燥时不分解,称量时不吸湿, 不吸收空气中的CO2,不被空气氧化等。 2.纯度较高(一般要求纯度在99.9%以上),杂质含量少到可以 忽略(0.01-0.02%)。 3.实际组成应与化学式完全符含。若含结晶水时,如硼砂 Na2B4O7· 10H2O,其结晶水的含量也应与化学式符合。 4.试剂最好具有较大的摩尔质量。因为摩尔质量越大,称取的 量就越多,称量误差就可相应的减少。
2、在置换滴定法或间接滴定法中,被测物的量与滴定 剂的量之间的关系。 根据有关的几个反应,找出几个反应中基准物与被测 物之间的计量关系。
例如:P338的计量关系及例19-2
例2 在稀硫酸溶液中,用0.02012mol/LKMnO4溶液滴定某草 酸钠溶液,如欲两者消耗的体积相等,则草酸钠溶液的浓度 为多少?若需配制该溶液100.0ml,应称取草酸钠多少克? 解:5C2O42- + 2MnO4- +16H+ = 10CO2 +2Mn2+ +8H2O 因此 n(Na2C2O4)=(5/2)n(KMnO4) (cV)(Na2C2O4)=(5/2)(cV)(KMnO4) 根据题意,有V(Na2C2O4)=V(KMnO4),则 c(Na2C2O4)=(5/2)c(KMnO4)=2.5×0.0212 =0.05030 mol/L m(Na2C2O4)=(cVM)(Na2C2O4) =0.05030×100.0×134.00/1000 =0.6740 g
滴定分析概述

2. 返滴定法(back titration) 返滴定法(back
返滴定法:先准确加入过量滴定剂,待反应完 返滴定法 全后,再用另一种标准溶液滴定剩余滴定剂; 根据反应消耗滴定剂的净量就可以算出被测物 质的含量。 使用条件: 反应速率较慢,或反应物 使用条件:当滴定反应速率较慢 反应速率较慢 反应物 是固体,或没有合适的指示剂 没有合适的指示剂时,选用返滴 是固体 没有合适的指示剂 定法。
3.滴定误差 (end point error) 滴定误差 滴定终点与化学计量点不一致,由此所 造成的误差。 4.指示剂 指示剂(indicator) 指示剂 为了能比较准确地掌握化学计量点的 达到,在实际滴定操作时,常在被测物质的 溶液中加入一种辅助剂,借助于它的颜色变 化作为化学计量点到达的信号,这种辅助试 剂称为指示剂。
例如,欲配制 0.01000mol/LK2Cr2O7 溶液1升 时,首先在分析天平上精确称取2.9420 克 K2Cr2O7 置于烧杯中,加入适量水溶解后, 定量转移到1000mL容量瓶中,再定容即得。
2.间接配制法 即先配成近似所需浓度的溶液,再 用基准试剂或另一种物质的标准溶液来 标定,然后计算出它的准确浓度。
nB = n A
二、滴定分析中确定基本单元的原则和步骤 确定基本单元的步骤: 确定基本单元的步骤 (1)写出有关方程式,将其配平。 (2)确定标准溶液的基本单元。 (3)根据计量关系,确定被测物的基本 单元,使之符合等物质的量反应规则。
对于任一滴定反 应 tT +aA
P
T为滴定剂,A为待测物质,P为生成物。
滴定分析法的特点: 滴定分析法的特点: 1)用于常量组分的测定; )用于常量组分的测定 2)仪器简单、操作简便; )仪器简单、操作简便 3)快速准确; )快速准确 4)应用广泛; )应用广泛; 5)与仪器分析法相比,灵敏度较低。 )与仪器分析法相比,灵敏度较低。
滴定分析
※ 标准物质 二级标准物质(工作基准物质) ※ 我国化学试剂中只有滴定分析基准试剂和
pH基准试剂属于标准物质。
第一基准试剂 (一级标准物质)
工作基准试剂 (二级标准物质)
是滴定分析的 计量标准
常用基准物质
此表5-2很实用啊!
名称
化学式 干燥后 干燥条件 标定对象
十水碳酸钠 Na2CO3·10H2O
I2 + 2S2O32- = 2I- + S4O62-
◆沉淀滴定法
以沉淀反应为基础的一种滴定分析方法
Ag+ + Cl- = AgCl (白色)
第五章 滴定分析概述
第二节 滴定方式
◆直接滴定法 : 一种标准溶液完全符合滴定反 应要求的滴定反应.(最基本的方式)
如 HCl 标准溶液 NaOH溶液
第五章 滴定分析概述
第五章 滴定分析概述
二. 滴定分析类型
按滴定时所用化学反应的类型分类 ◆酸碱滴定法
以质子传递反应为基础的一种滴定分析方法
H3O+ + OH- = 2H2O
◆配位滴定法
以配位反应为基础的一种滴定分析方法 Mg2+ +Y4- = MgY2-
第五章 滴定分析概述
◆氧化还原滴定法
以氧化还原反应为基础的一种滴定分析方法 Cr2O72-+6I-+ 14H+ =2Cr3++ 3I2+7H2O
第五章 滴定分析概述
⑦ 指示剂: (indicator)
滴定反应无终点指示时,所必须加入的辅助剂
⑧ 滴定曲线:
滴定过程中,待测组分的浓度的变化用参数记 录而成曲线图
第五章 滴定分析概述
分析化学滴定分析概论
✓主要方式:
直接法:选用适当的标准溶液直接滴定 被测物质。最常用。
➢返滴定法(剩余滴定法) 先准确加入过量标准溶液,使与试液中的 待测物质或固体试样进行反应,待反应完成 以后,再用另一种标准溶液滴定剩余的标准 溶液的方法
✓适用:反应较慢或难溶于水的固体试样
例1:Al3+ +定过量EDTA标液 剩余EDTA Zn2+标液,EBT 返滴定
• 故有 n(A)= a n(B)或 n(B)= b n(A)
b
a
• •
上还可式以中将ba上或式ba写称成为:化1学n(计A)量数1 比n(B。) 1 n(C ) 1 n(D)
a
b
c
d
• 该式就称为物质的量比规则。
• 酸碱滴定:酸给出的质子数等于碱接受的质子数
• 例如: H2SO4 2NaOH Na2SO4 2H2O
d. 试剂参加滴定反应时,应定量进行,无副反 应。
• 常用纯金属和纯化合物,如Ag, Cu, Zn, Cd, Si, Ge, Al, Co, Ni, Fe和 NaCl, K2Cr2O7, Na2CO3, 邻苯二甲酸氢钾,硼砂,As2O3, CaCO3等。
•
• 超纯试剂和光谱纯试剂只是说明其中金属杂质 的含量很低,并不说明其主要成分的含量在 99.9% 以上。
• 以上两个通式所体现的即为等物质的量规则。
• 若采用非直接滴定的方式,则涉及到两个或两个以 上反应,此时应从总的反应中找出实际参加反应的 物质的量之间的关系。
• 例 如 , 在 酸 性 溶 液 中 以 K2Cr2O7 为 基 准 物 标 定 Na2S2O3溶液的浓度时,包括下列两个反应:
• Cr2O72-+6I- +14H+ 2Cr3+ + 3I2 + 7H2O ①
第二章 滴定分析法概述
• 另一方面,反应必须进行完全,要求化学计量点 时,有99.9%以上的完全程度。
• 当A→B时,终点时,
cB 99.9% cA
(二) 反应必须迅速完成
• 如果反应很慢,将无法确定终点,可以通过加
热,加催化剂等方法来提高反应速度。
(三)有合适的确定终点的方法,有适合的指示 剂或仪器分析方法。
2、滴定方式:常见有四类
二、滴定分析法的分类
根据标准溶液与被测物质间所发生的化学反应类型 不同,将滴定分析法分为以下四大类:
(1)酸碱滴定法(又称中和法)
H OH ⇋ H 2O
(2)沉淀滴定法 是利用沉淀反应进行滴定的方法。
Ag x ⇋ Agx
(3)配位滴定法 是利用配位反应进行滴定的一种方法。
M 2 y 4 My 2
• 滴定分析基本过程:
• 进行分析时,先将滴定剂(titrant)配制成浓度为已 知的标准溶液(standard solutions),然后用滴 定管将滴定剂逐渐加到被测物质的溶液中去进行 反应。这个过程称为滴定。
➢ 滴定剂(标准溶液,Titrant ) :浓度准确已知的溶 液。 (4位有效数字)
溶于一定体积(用量筒量取)的溶 剂中,配制成近似所需浓度的溶液。 2.标定(standardization) :用基准物 或另一种已知浓度的标准溶液来测 定其准确浓度。确定浓度的操作称 为标定。
3.计算浓度:由基准物的质量(或另一 种已知浓度的标准溶液体积、浓度), 计算确定之。
标定法:利用基准物质确定溶液准确浓度
• (2)滴定接近等量点时,要半滴半滴地加入。 • (3)指示剂本身是弱酸或弱碱、氧化或还原剂在滴定过程
中会消耗一部分标淮溶液,因此指示剂用量不宜过多。 • (4)某些杂质在滴定过程中可能消耗标准溶液或产生其他
第5章-滴定分析概述,葛
定量生成 I2 Na2S2O3 标液 淀粉指示剂
深蓝色消失 Cr2O72- + 6I-+ 14H+ = 2Cr3+ + 3I2 + 7H2O I2 + 2S2O32- = 2I- + 2S4O62-
间接滴定法 例如:氧化还原滴定测定Ca2+
Ca2+ CaC2O4沉淀
H2SO4 C2O42KMnO4标液 间接测定 16 H 2 Mn 2 10 CO 2 8 H 2 O
待标定溶液滴定。根据滴定结果计算出待标定溶液的准确浓度。 此法不如基准物质标定法精确,但较简便。
三、标准溶液浓度表示方法
1、物质的量浓度: ——单位体积溶液中所含溶质的物质的量。 c=n/V
mB nB ( mol或mmol) MB nB mB CB VB M BVB ( mol / L )或( mmol / L )
配制溶液 标 定
计算浓度
二、标准溶液的配制
1、直接配制法
准确称取一定量的基准物质,溶解后定量转移入容量瓶中, 加蒸馏水稀释至一定刻度,充分混匀。根据称取基准物的质量
和容量瓶的体积,计算其准确浓度。
准确称取 基准物质
溶解
定容
计算准 确浓度
分析天平
烧杯
容量瓶
n B mB / M B cB VB VB
常用基准物质的干燥条件及其应用
二、标准溶液的配制方法
1、直接配制法:
准确称量 溶解定容 计算浓度
例如:0.01667 mol/L K2Cr2O7标准溶液的配制
4.903 g 基准K2Cr2O7 1L容量瓶
2、间接配制法:
先配制成接近所需浓度的溶液,然后再用基准物或另一 种已知浓度的标准溶液滴定的方法确定其准确浓度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
S4O62-+SO42无定量关系
K2Cr2O7 +过量KI
定量生成 I2
Na2S2O3标液 淀粉指示剂
深蓝色消失
ห้องสมุดไป่ตู้
间接法 通过另外的化学反应,以滴定法定量进行
适用:不能与滴定剂起化学反应的物质
例5:Ca2+
CaC2O4沉淀
H2SO4
C2O42-
KMnO4标液
间接测定
第二节 标准溶液与基准物质
1 0.1006 23.50 106.0 Na2CO3% 2 0.1230 1000 100%
99.70%
续滴定分析计算
例6:精密称取CaO试样0.06000 g,以HCL标准溶液滴定
之,已知THCL/CaO=0.005600 g/mL,消耗HCL10 mL, 求CaO的百分含量?
概念 对基准物质的要求 标准溶液的配制方法 标液浓度的表示方法
概念
标准溶液:浓度准确已知的溶液 基准物质:能用于直接配制或标定标准溶液
的物质
对基准物质的要求:
a.试剂的组成与化学式相符 b.具有较大的摩尔质量 c.纯度高,性质稳定
标准溶液的配制方法
1.直接配制法: 基准物质 称量 溶解 定量转移至 容量瓶 稀释至刻度 根据称量的质量 和体积计算标准溶液的准确浓度
3.滴定度T与物质的量浓度C的关系
1)1000毫升标液中,每毫升标液中所含溶质的质量
TA
mA V
mA 1000
!
注:T 单位为[g/mL] A
CA
TA
1000 MA
TA
CA MA 1000
2)每毫升滴定剂溶液相当于待测物质的质量
TT A
mA VT
a mA t CT VT M A / 1000
返滴定法(剩余滴定法) 先准确加入过量标准溶液,使与试液中的 待测物质或固体试样进行反应,待反应完 成以后,再用另一种标准溶液滴定剩余的 标准溶液的方法
适用:反应较慢或难溶于水的固体试样
续返滴定法
例1:Al3+ +定过量EDTA标液 剩余EDTA Zn2+标液,EBT 返滴定
续返滴定法
例2:固体CaCO3 + 定过量HCl标液 剩余HCl标液 NaOH标液 返滴定
TA 指每毫升标准溶液含有溶质的质量
TA
mA V
CAM A V 1000
(g / mL)
TT/A指每毫升滴定剂溶液相当于待测物的质量 (T指标液,A指待测物) (g / mL)或(mg / mL)
练习 例1:THCL= 0.003001 g/mL 表示1 mL HCL标液中含有0.003001 g HCL
解: nHC nNa2CO3 2
CHCL
t THCL Na2CO3 1000
a
MA
2 0.005300 1000 0.1000(mol / L) 106.0
续滴定分析计算
例4:TK2Cr2O7/Fe=0.005000 g/mL,如消耗K2Cr2O7标准溶 液21.50毫升,问被滴定溶液中铁的质量?
1.两种溶液相互作用:
a CA VA t CT VT
t CT VT a CA VA
2.固体和液体之间作用:
mA MA
a t CT
VT
a mA t CT VT M A / 1000
! 注:VT单位为 L ! 注:VT单位为 mL
注意:化学反应配平;单位换算
特点: 简便、快速,适于常量分析 准确度高 应用广泛
方法: 1)酸碱滴定,沉淀滴定, 氧化-还原滴定
络合滴定 2)非水滴定法:水以外的有机溶剂中进行
滴定分析要求及主要方式
要求: a.反应定量、完全 b.反应迅速 c.具有合适的确定终点的方法
主要方式: 直接法:标液滴定待测物(基本) 返滴定法(剩余滴定法) 置换滴定法 间接法
解: nHCL nNa2CO3 2
CHCL
VHCL
2 nNa2CO3
2 mNa2CO3 1000 M Na2CO3
VHCL
2 0.2500 1000 0.2 106.0
24(ml)
续滴定分析计算
例3:若THCL/Na2CO3 = 0.005300 g/mL ,试计算HCL标准 溶液物质量的浓度。
0.1200 200 0.1000(200 V )
V (0.1200 0.1000) 200 40(mL) 0.1000
续滴定分析计算
例2:将0.2500 g Na2CO3基准物溶于适量水中后,用 0.2 mol/L的HCL滴定至终点,问大约消耗此HCL 溶液多少毫升?
CT
t a
TT
A 1000 MA
TT A
mA VT
a CT M A t 1000
4.待测物百分含量的计算:
称取试样 S 克,含待测组分A的质量为mA克, 则待测组分的百分含量为
A% mA 100% S
mA
a t
CT
VT M A 1000
TT A
mA VT
续返滴定法
例3:Cl- + 定过量AgNO3 标液 剩余AgNO3标液 NH4SCN标液 Fe3+ 指示剂 返滴定
淡红色[Fe(SCN)]2+
置换滴定法
先用适当试剂与待测物质反应,定量置换出 另一种物质 ,再用标准溶液去滴定该物质的 方法
适用:无明确定量关系的反应
续置换滴定法
例4: Na2S2O3+K2Cr2O7
解:
0.0056 10
CaO%
100% 93.33%
0.06000
基本术语:
滴定:将滴定剂通过滴管滴入待测溶液中的 过程
滴定剂:浓度准确已知的试样溶液 指示剂:滴定分析中能发生颜色改变而指示
终点的试剂
滴定终点:滴定分析中指示剂发生颜色改变 的那一点(实际)
化学计量点:滴定剂与待测溶液按化学计量 关系反应完全的那一点
(理论)
滴定分析的特点及主要方法
A% a CT VT M A 100% t S 1000
A% TT A VT 100% S
三、滴定分析计算实例
例1:现有0.1200 mol/L 的NaOH标准溶液200 mL,欲使 其浓度稀释到0.1000 mol/L,问要加水多少mL?
解:设应加水的体积为 V mL,根据溶液稀释前后物质 的量相等 的原则,
例2: THCL / NAOH = 0.003001 g/mL 表示每消耗1 mL HCL 标液可与0.003001 g NaOH完全反应
第三节 滴定度计算示例
一、滴定分析计算依据
tT + aA
P
SP时
t nT a nA
a
或 nA t nT
化学计量数之比 物质的量之比
二、滴定分析计算公式
解:
mFe 0.005000 21.50 0.1075(g)
续滴定分析计算
例5:测定药用Na2CO3的含量,称取试样0.1230 g,溶 解后用浓度为0.1006mol/L的HCL标准溶液滴定, 终点时消耗该HCL标液23.50 mL,求试样中Na2CO3 的百分含量。
解: nNa2CO3 nHCL 1 2
第三章 滴定分析法概论
第一节 概述
滴定分析法定义及几个基本术语 滴定分析法的特点及主要方法 滴定分析对化学反应的要求及主要方式
滴定分析法:
将一种已知准确浓度的试剂溶液滴加到 待测物质的溶液中,直到所滴加的试剂 与待测物质按化学计量关系定量反应为 止,然后根据试液的浓度和体积,通过 定量关系计算待测物质含量的方法
2.间接配制法: 标定法:利用基准物质确定溶液准确浓度 比较法:用一种已知浓度的标液来确定另一 种溶液的浓度方法
标准溶液浓度的表示方法
物质量的浓度:单位体积溶液所含物质的量
nB
mB MB
(mol)或(mmol)
CB
nB VB
mB M BVB
(mol / L)或(mmol / L)
滴定度 :
