蛋白酶的分类及酶切位点
gpi蛋白酶切位点

gpi蛋白酶切位点
GPI蛋白酶切位点是指一种特定的蛋白酶切割位点,它与GPI
锚点蛋白的后修饰有关。
GPI锚点蛋白是一类通过糖脂酰肌醇糖脂
锚定到细胞膜表面的蛋白质。
在这类蛋白质的合成过程中,它们的
C末端会发生GPI锚点的后修饰。
这种后修饰是通过GPI蛋白酶酶
解C末端的信号肽,然后将GPI锚点脂质连接到蛋白质上。
GPI蛋白酶切位点通常是一个特定的氨基酸序列,包括丝氨酸、脯氨酸和甘氨酸残基。
这个序列通常被描述为(S/T)N,其中S代表
丝氨酸,T代表脯氨酸,N代表甘氨酸。
当蛋白质合成到达细胞膜上时,GPI蛋白酶会识别这个特定的序列,并切割蛋白质,使其可以
与GPI锚点脂质连接。
另外,GPI蛋白酶切位点的识别和切割还可能受到其他细胞因
子或信号通路的调控。
这些调控因子可能会影响GPI蛋白酶的活性
或与其结合的亚基,进而影响GPI锚点蛋白的后修饰过程。
总的来说,GPI蛋白酶切位点是与GPI锚点蛋白后修饰相关的
特定氨基酸序列,它在蛋白质合成过程中起着重要的作用。
对于这
一过程的深入理解有助于揭示细胞膜蛋白的合成和功能调控机制。
蛋白酶k切割位点

蛋白酶k切割位点
蛋白酶K切割位点是指蛋白酶K能够识别并切割的特定氨基酸序列。
蛋白酶K是一种丝氨酸蛋白酶,它能够切割蛋白质中的丝氨酸残基和苏氨酸残基。
蛋白酶K切割位点的研究对于理解蛋白质的结构和功能具有重要意义。
蛋白酶K切割位点的研究始于20世纪60年代。
当时,科学家们发现蛋白酶K能够切割一些特定的蛋白质,但并不清楚它是如何选择切割位点的。
随着技术的进步,科学家们逐渐发现了蛋白酶K切割位点的规律。
蛋白酶K切割位点通常是由一段特定的氨基酸序列组成。
这段序列通常包含一个丝氨酸残基或苏氨酸残基,以及一些特定的氨基酸。
蛋白酶K能够识别这段序列,并在丝氨酸或苏氨酸残基的侧链上切割。
蛋白酶K切割位点的序列通常被表示为“P1-P1'”,其中P1表示丝氨酸或苏氨酸残基,P1'表示切割位点的下一个氨基酸。
蛋白酶K切割位点的研究对于许多领域都具有重要意义。
例如,在生物技术领域,研究蛋白酶K切割位点可以帮助科学家设计更好的蛋白质表达系统。
在医学领域,研究蛋白酶K切割位点可以帮助科学家理解一些疾病的发生机制,从而开发更有效的治疗方法。
蛋白酶K切割位点是蛋白酶K能够识别并切割的特定氨基酸序列。
研究蛋白酶K切割位点对于理解蛋白质的结构和功能具有重要意义,
也有着广泛的应用前景。
蛋白酶的种类范文

蛋白酶的种类范文蛋白酶是一类能够降解蛋白质的酶类,它们在许多生物过程中起到关键作用。
蛋白酶的种类非常广泛,可以根据不同的分类方法进行分类。
本文将介绍一些常见的蛋白酶种类。
1.消化酶:消化酶是胃和胰腺分泌的一类蛋白酶,主要用于消化食物中的蛋白质。
常见的消化酶包括胃蛋白酶和胰蛋白酶。
-胃蛋白酶:胃蛋白酶是胃中分泌的一类酶,主要用于在胃中降解食物中的蛋白质。
胃蛋白酶主要有胃蛋白酶A、胃蛋白酶B和胃蛋白酶C等几种。
-胰蛋白酶:胰蛋白酶是胰腺中分泌的一类蛋白酶,它们在小肠中发挥主要作用。
胰蛋白酶主要包括胰蛋白酶A、胰蛋白酶B和胰蛋白酶C等几种。
2.按酶的作用机制进行分类:蛋白酶可以按照其作用机制进行分类,常见的分类包括内切酶和外切酶。
-内切酶:内切酶的作用是在一个多肽链的内部切割蛋白质,并生成两个或多个片段。
内切酶可以进一步细分为内切蛋白酶和内切肽酶。
-内切蛋白酶:内切蛋白酶主要是降解具有内部酶解位点的蛋白质,如酶的活性位点和信号肽。
常见的内切蛋白酶包括胰蛋白酶和血细胞凝集素等。
-内切肽酶:内切肽酶主要是在肽链内部的特定位点切割肽链,生成具有生物活性的片段。
常见的内切肽酶包括胰蛋白酶和胃蛋白酶等。
-外切酶:外切酶的作用是从多肽链的末端切割蛋白质。
常见的外切酶包括氨肽酶和羧肽酶。
-氨肽酶:氨肽酶主要切割蛋白质的N-末端肽键,生成具有生物活性的片段。
常见的氨肽酶有氨肽酶A和氨肽酶B等。
-羧肽酶:羧肽酶主要切割蛋白质的C-末端肽键,生成生物活性的片段。
常见的羧肽酶包括羧肽酶A和羧肽酶B等。
3.按酶的底物特异性进行分类:蛋白酶可以根据其底物的特异性进行分类,常见的分类包括内切酶、外切酶和整合酶。
-内切酶:内切酶主要切割具有内酶解位点的蛋白质,例如胰蛋白酶和血细胞凝集素等。
-外切酶:外切酶主要切割蛋白质的末端肽键,例如胰蛋白酶和氨肽酶等。
-整合酶:整合酶具有多种特定底物的酶切位点,例如转氨酶和蛋白酶K等。
蛋白酶具有多样的种类和功能,在生物学研究、医学诊断和制药等领域发挥着重要作用。
蛋白酶及其在生物反应中的作用

蛋白酶及其在生物反应中的作用蛋白酶,即蛋白酶类酶,是一种能够催化蛋白质分子内部的肽键切断的酶。
在生物体内,蛋白酶的作用对于生物反应的发生和调控起到了重要的作用。
一、蛋白酶的种类蛋白酶根据其催化肽键的不同位置,可以分为内切酶、外切酶和内外切酶三类。
根据其催化措施的不同,可分为水解酶和肽基转移酶两大类。
1.内切酶内切酶是一类在蛋白质内部特定位点催化肽键水解的酶,具有高度的特异性。
细胞内内切酶作用于蛋白质降解、转运、信号转导等多个方面。
一些细胞凋亡的过程中,内切酶能够裂解并活化某些细胞因子,会引起细胞死亡。
2.外切酶外切酶主要作用于蛋白质的降解过程中,将大分子蛋白质分解成小分子的片段。
外切酶的作用十分重要,能够清除组织中的老化蛋白质、病变蛋白以及感染病毒等。
外切酶还能够发挥抗肿瘤、抗病毒、免疫增强等多种生物学作用。
3.内外切酶内外切酶既能够切割蛋白质内部肽键,也能够切割蛋白质荷载较少的端部肽键。
这种酶的作用在细胞中非常广泛,影响了蛋白质降解、信号传导和细胞分裂等多个生理过程。
二、蛋白酶在生物反应中的作用1.消化与吸收蛋白酶在消化与吸收方面发挥了关键作用。
胃酸进入到胃中后,能够激活胃蛋白酶、酪蛋白酶和胃蛋白肽酶等消化酶,将蛋白质分解为氨基酸。
肠道内的胰蛋白酶和多肽酶进一步作用,消化成氨基酸,最后通过肠壁透过到血液中吸收。
2.信号传导蛋白酶在多种信号传导途径中发挥了重要作用。
一些激素和细胞因子在细胞表面结合特定的受体,激活相关酶,如蛋白激酶、酪氨酸激酶等,形成信号传递通路。
这些酶直接或间接作用于细胞内的蛋白酶,对其进行激活、抑制或降解,形成复杂的信号传递网络。
3.细胞凋亡细胞凋亡是一种自我调节的细胞死亡过程,在机体内起到了重要作用。
破坏细胞内平衡,如DNA损伤,细胞受到较大压力等因素下,会出现凋亡现象。
在细胞凋亡过程中,蛋白酶作用于具有凋亡活化序列的多种蛋白质,引起其水解裂解,形成各种的亚基和片段,进而触发细胞内部的凋亡级联反应。
蛋白酶水解的作用位点

蛋白酶水解的作用位点引言蛋白质是构成生物体的基本组成部分,它们在生物体内起着各种重要的生理功能。
然而,蛋白质的功能依赖于其三维结构,而生物体需要通过蛋白酶的作用来控制蛋白质的结构和功能。
蛋白酶主要通过水解蛋白质中的特定化学键来改变其结构和功能。
本文将详细介绍蛋白酶水解的作用位点。
1. 什么是蛋白质的作用位点?蛋白酶水解的作用位点指的是蛋白质链上特定的化学键,这些化学键在蛋白酶的作用下被切割或水解,导致蛋白质的结构改变。
2. 水解作用的种类蛋白酶水解的作用位点可以分为多种类型,下面将介绍其中几种常见的作用位点。
2.1 按照酶的位置分为内切位点和外切位点内切位点是指蛋白质链上由酶水解的化学键位于蛋白质的内部,而外切位点则是位于蛋白质的两端。
根据位置的不同,内切位点的水解作用能够改变蛋白质的整体结构,而外切位点的水解则可能导致蛋白质的降解或者调控。
2.2 按照酶的特异性分为专一性位点和非专一性位点蛋白酶水解的作用位点可以根据酶的特异性分为专一性位点和非专一性位点。
专一性位点是指蛋白酶只能识别蛋白质链上的特定序列,并在此处进行水解。
非专一性位点则是指蛋白酶可以在蛋白质的任意位置进行水解。
3. 蛋白质的作用位点识别蛋白质的作用位点识别是蛋白酶水解的关键步骤。
蛋白酶通过与蛋白质的特定部分相互作用,以识别作用位点。
以下是几种常见的蛋白质作用位点识别的方式:3.1 底物的序列特异性识别专一性蛋白酶通过与底物的序列相互作用来识别作用位点。
这种序列特异性识别通常需要底物的特定氨基酸残基在作用位点上暴露出来,并且与蛋白酶的结构域相互作用。
3.2 扩散限制非专一性蛋白酶对作用位点的识别相对较为宽松。
它们可以通过扩散限制的方式,即与蛋白质链上的某个或多个特定氨基酸残基相互作用,将底物定位到正确的位置。
3.3 二级结构蛋白酶还可以通过识别底物的二级结构来确定作用位点。
许多蛋白质的特定二级结构在水解之前会发生改变,这种结构改变可以作为蛋白酶识别作用位点的信号。
常用蛋白酶切割位点

Trypsin Inhibitor-Agarose
TEV protease(烟草蚀纹病毒蛋白酶)
Glu-Asn-Leu-Tyr-Phe-Gln▼Gly
E-N-L-Y–F-Q▼G
Invitrogen – Life Technologies
Ni-NTA (6His recomb. TEV)
KEX2对arg的专一性高,要求最重要。
Arg前为lys效率最高,不切-Arg-lys,Pro影响KEX2切割
羧肽酶
羧肽酶B可以切割C端的Lys或Arg;羧肽酶A可以切割C端除了Lys、Arg、Pro的氨基酸,但如果倒数第二个氨基酸为Pro两种羧肽酶均不能作用
1.胰蛋白酶属肽链内切酶,能把多肽链中Lys和Arg残基中的羧基侧切断。
Qiagen
Ni-NTA (6His recomb. enzyme)
Intein Site(内含肽)
dithiothreitol cleavage(二硫苏糖醇清除)
New England Biolabs
DTT elimination by dialysis(透析)
HRV 3C Protease(3c蛋白酶)
2.胰凝乳蛋白酶(亦称糜蛋白酶)属肽链内切酶,主要切断多肽链中的芳香族氨基酸(Phe、Trp、Tyr)残基的羧基一侧。
3.羧肽酶(分A和B型),一般的题目中没有特别指明的话就是两种类型的功能都具备,可以从羧基端切除氨基酸(若羧基端的第1个或第2个氨基酸为Pro的则不能切除)。
4.溴化氰处理,专一性的切割甲硫氨酸羧基端的肽键。
常用融合蛋白切割位点
PROTEASE
COMPANY
Protease Capture
蛋白酶切位点
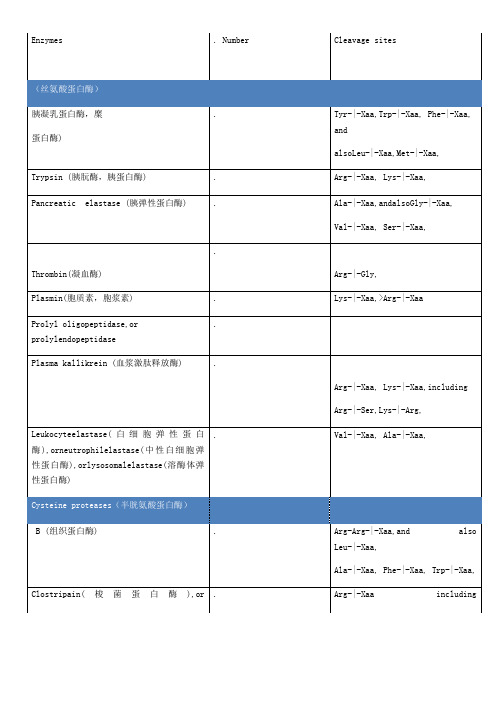
Arg-|-Xaa, Lys-|-Xaa,
AminopeptidaseA,or angiotensinase,or glutamyl-aminopeptidase
.
Glu-|-Xaa>>Asp-|-Xaa,
Dipeptidyl-peptidaseI,or cathepsin(组织蛋白酶)C or J
.
Plasma kallikrein (血浆激肽释放酶)
.
Arg-|-Xaa, Lys-|-Xaa,including
Arg-|-Ser,Lys-|-Arg,
Leukocyteelastase(白细胞弹性蛋白酶),orneutrophilelastase(中性白细胞弹性蛋白酶),orlysosomalelastase(溶酶体弹性蛋白酶)
≠AlaorVal
脑啡肽酶),or enkephalinase(脑啡肽酶),or neutralendopeptidase
.
Xaa-|-Tyr,Xaa-|-Phe, Xaa-|-Trp,and
Xaa-|-Leu,
Thimet oligopeptidase(甲拌磷寡肽 酶),or endo-oligopeptidase A,or endopeptidase(肽链内切 酶),or pz-peptidease(肠促胰 酶素)
.
Xaa-Yaa-|-Zaa,if Xaa≠ArgorLys,or
Yaa ≠Pro,orZaa≠Pro
Dipeptidyl-peptidase IV
.
Preferentially Xaa-Pro-|-Zaa,(but also Xaa-Ala-|-Yaa)withYaa ≠Pro or Hyp
Prolyl tripeptyl-peptidase
蛋白酶切位点
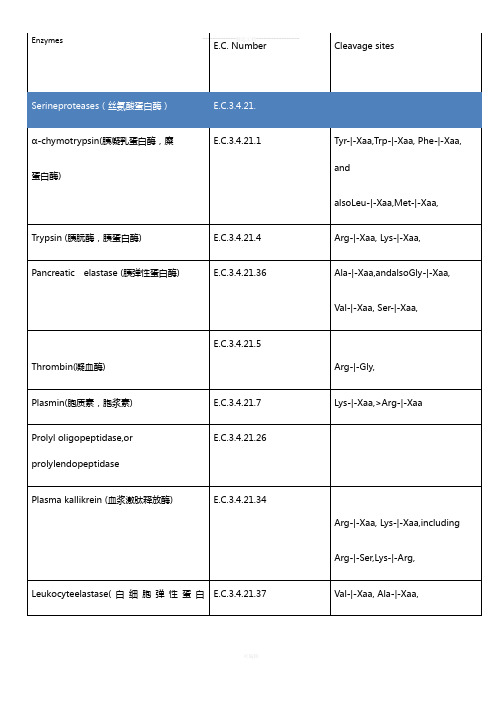
Pancreatic elastase (胰弹性蛋白酶)
E.C.3.4.21.36
Ala-|-Xaa,andalsoGly-|-Xaa,
Val-|-Xaa, Ser-|-Xaa,
Thrombin(凝血酶)
E.C.3.4.21.5
Arg-|-Gly,
Plasmin(胞质素,胞浆素)
Enzymes
E.C. Number
Cleavage sites
α-chymotrypsin(胰凝乳蛋白酶,糜
蛋白酶)
E.C.3.4.21.1
Tyr-|-Xaa,Trp-|-Xaa, Phe-|-Xaa, and
alsoLeu-|-Xaa,Met-|-Xaa,
Trypsin (胰朊酶,胰蛋白酶)
E.C.3.4.21.4
chymotrypsin胰凝乳蛋白酶糜蛋白酶ec34211tyrxaatrpxaaphexaaalsoleuxaametxaatrypsin胰朊酶胰蛋白酶ec34214argxaalysxaapancreaticelastase胰弹性蛋白酶ec342136alaxaaandalsoglyxaavalxaaserxaathrombin凝血酶ec34215argglyplasmin胞质素胞浆素ec34217lysxaaargxaaprolyloligopeptidaseorprolylendopeptidaseec342126proxaaalaxaaplasmakallikrein血浆激肽释放酶ec342134argxaalysxaaincludingargserlysargleukocyteelastase白细胞弹性蛋neutrophilelastase中性白细胞弹性蛋白酶orlysosomalelastase溶酶体弹性蛋白酶ec342137valxaaalaxaacysteineproteasesec3422
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白酶的分类及酶切位点
氨基酸0.ppt
氨基酸的名称与符号
alanine 丙氨酸Ala A
arginine 精氨酸Arg R
asparagine 天冬酰氨Asn Asx N
aspartic acid 天冬氨酸Asp Asx D
cysteine 半胱氨酸Cys C
glutamine 谷氨酰胺Gln Glx Q
glutamic acid 谷氨酸Glu Glx E
glycine 甘氨酸Gly G
histidine 组氨酸His H
isoleucine 异亮氨酸Ile I
leucine 亮氨酸Leu L
lysine 赖氨酸Lys K
methionine 甲硫氨酸Met M
phenylalanine 苯丙氨酸Phe F
proline 脯氨酸Pro P
serine 丝氨酸Ser S
threonine 苏氨酸Thr T
tryptophan 色氨酸Trp W
tyrosine 酪氨酸Tyr Y
valine 缬氨酸Val V
血清终止胰酶消化的原理
血清终止的原理其实是竞争抑制。
就是用过量的牛血清中含有的蛋白来和胰酶结合。
不给胰
酶消化细胞蛋白的机会。
细胞传代时,血清为什么能终止胰酶消化?
胰蛋白酶的酶切位点是肽链的Lys和Arg两个残疾的羧基端肽键,血清的加入可使酶饱和,严格上说不是竞争性抑制,因为血清蛋白不是抑制剂,还是底物!
什么样的细胞不能用胰酶-EDTA消化
植物细胞不能用胰酶-EDTA消化,要用纤维素酶消化。
应该是肿瘤细胞吧。
正常的细胞,貌似都需要用胰酶或者胶原酶消化。
EDTA-胰酶,只不过是在胰酶里加入了EDTA而已。
EDTA是乙二胺四乙酸,一种金属螯合剂。
一般和胰蛋白酶配合使用。
原因在于,钙,镁等金属离子会降低胰酶活力,故在使用胰酶消化液时要配合加入EDTA。
它可以螯合这些离子,消除对胰酶的抑制。
干细胞饲养层制作中,胰酶—EDTA消化成纤维细胞(MEF)时,EDTA的作用是什么?
应该是胰酶分散细胞,EDTA鳌合金属离子使金属酶失活
《军医进修学院学报》1992年02期
加入收藏投稿
正常人血浆蛋白酶解产物对胃癌细胞肺转移抑制作用的研究
焦顺昌赵东海黄昌霞王洪海
【摘要】:本文采用胰凝乳蛋白酶和胃蛋白酶联合消化方法得到正常人血浆(NHP)有限蛋白酶解产物(NHP-EP)。
体外研究发现,NHP的细胞粘附性可达90%;而NHP-EP的细胞粘附
抑制性亦可达90%以上,具有可逆性、竞争性、非细胞毒性等特点。
动物实验发现,NHP-EP 可抑制小鼠胃癌细胞实验性肺转移的形式,抑制率达83.3%;并可延长带瘤小鼠的中位生存期,实验组生存期35天,而对照组为19天。
我们认为,NHP-EP对胃癌血行转移防治可能有较大实用价值。
【作者单位】:
【关键词】:正常人血浆蛋白酶解产物胃肿瘤肺肿瘤癌症肿瘤转移细胞粘连
【正文快照】:
肿瘤转移的各个环节均有赖于癌细胞活跃的游走、与基质的粘附和去粘附等生物学功能田。
体内有多种介导细胞—基质粘附的蛋白质,常见的有纤维连接素(fi bronectin,FN)、层粘素(laminin,LN)、胶原、Vitro-neetin等,它们与肿瘤转移有关(2,’〕。
其中FN与细胞结合位点的氨基酸序
《癌症》1993年02期
加入收藏投稿
纤维连接素酶解产物的生物学特性及其对胃癌细胞血行转移抑制作用的初步研究
焦顺昌赵东海黄昌霞王洪海
【摘要】:本文采用胰凝乳蛋白酶和胃蛋白酶联合降解方法得到正常人血浆纤维连接素有限蛋白酶解产物(FN—EP)。
体外研究发现,纤维连接素的细胞粘附率可达60%以上;而FN—E P的细胞粘附抑制率可达90%,具有可逆性、竞争性、非细胞毒性等特征。
动物实验初步显示,FN—EP可抑制小鼠胃癌细胞实验性肺转移的形成,抑制率达78.6%。
本研究提示,FN—E P在恶性肿瘤血行转移防治中具有应用价值。
【作者单位】:解放军总医院解放军总医院解放军总医院解放军总医院
【关键词】:血浆纤维连接素酶解产物细胞粘附肿瘤转移
【正文快照】:
纤维连接素(Fibroneetin,FN)通过介导癌细月包一胞外基质粘附,在肿瘤转移中发挥重要作用〔’,”〕。
FN与细胞结合位点的氨基酸序列为RGD(即精氨酸一甘氨酸一天门冬氨酸)。
Hum分hr ies〔3,‘〕等用人工合成的含RGD序列的GRGDS多肚成功地抑制了黑色素瘤细胞实验性小鼠肺转移,抑
台研究发现Pif1解旋酶蛋白质杀死癌细胞有转机
2013年09月13日15:32 来源:中国新闻网参与互动(0)中新网9月13日电据台湾东森电视台网站报道,修复受损癌细胞的谜题逐渐解开。
台湾大学生化所发现细胞内一种“Pif1解旋酶”蛋白质,能在癌细胞基因受损时,促进DNA 间的重组,进而修复细胞。
医师指出,无论是正常细胞或是癌细胞都拥有Pif1,未来有机会借由抑制癌细胞中的Pif1,开发抗癌新药物。
台大生化所助理教授冀宏源带领的研究团队3年前开始与美国贝勒医学院、耶鲁大学等知名学校合作,成功从酵母菌中找到细胞里的Pif1解旋酶。
冀宏源表示,DNA受损的形态中,最严重的就是双股DNA断裂,团队利用酵母菌、蛋白质纯化技术,发现Pif1可解开双股DNA结构,帮助它的重组,完成细胞修复。
这项发现成为治疗癌症的重大突破,也登上国际知名期刊《自然》(Nature)。
2年前海外实验更证实,若在乳癌细胞株上注射Pif1抑制剂,降低癌细胞存活率的效果高达10倍。
台大校长杨泮池表示,下一阶段研究重点是透过临床试验,尽快找到对Pif1活性敏感的癌症种类。
标签:癌细胞酵母菌冀宏源解旋酶细胞
阻断细胞内“通讯线路” 抑制肾癌细胞增殖
2013年08月19日08:26 来源:扬子晚报参与互动(0)肾癌又称肾细胞癌,肾腺癌,多起源于肾小管上皮细胞。
早期症状不明显,等到出现“无痛性的血尿、腰部肿块、腰痛”三联症时,肿瘤多已进展到中晚期。
江苏省肿瘤医院冯继锋教授告诉记者,靶向药物是治疗肾癌的最重要手段之一,但实际上肿瘤细胞非常“聪明”,会自我“进化”,用药一段时间后就有耐药的可能,所以不断寻找新的有效的治疗方法,就成了临床及科研人员的研究热点。
冯继锋教授表示,和其他癌症有所不同的是,肾癌对放疗、化疗、免疫或是激素治疗相对不敏感。
而对晚期患者来讲,靶向药物一直是主要的治疗手段。
现代的医学研究表明,基因的变异会左右肿瘤的发展,而这一因果关系的发生需要依靠肿瘤细胞内的信号的传导,有了信号的传递,肿瘤相关的生长因子才会被“激活”。
“哪些基因变异起主要作用?哪些通路是肿瘤的发生、发展、转移的关键因素?科学的研究还有很长的一段路要走,但目前也寻找到了若干可以作用的靶点,由此也诞生了一些靶向药物。
”冯继锋教授告诉记者,用特殊的药物将这个关键的靶点“封掉”,肿瘤细胞内的“通讯线路”就被阻断了,细胞核接收不到信息无法分裂增殖,自然达到了抑制肿瘤的目的。
“不过,肿瘤细胞比我们想的要‘聪明’得多。
”冯继锋教授说,肿瘤内传递信号的通路非常复杂,像网络一样。
而且肿瘤细胞会随着给药时间的延长,肿瘤发生发展的机制也有所改变,比如信号在一条“通讯线路”上走不通,渐渐地就走上了别的“岔道”,继续将信号传递下去。
表现在病人身上就是出现了耐药性,原先有效的药物不再起作用了,病情会进一步进展。
“但是肾癌患者也不必过分灰心。
”即使是产生了耐药性的患者,也可以陆续受益于新的治疗方法。
比如以往接受过舒尼替尼或索拉非尼治疗失败的晚期肾细胞癌的患者,
现在就可以使用靶向药物mTOR抑制剂依维莫司片进行治疗。
肿瘤基础研究和治疗新技术、新药物研发应用的进步,让很多以往失去治疗机会的患者多了选择。
杨彦整理
标签:通讯线路肾癌细胞内肾细胞癌mTOR。
