低钾性周期性麻痹
低钾型周期性麻痹临床特点及血清肌酸激酶异常分析

2020年12月第10卷第23期·临床研究·低钾型周期性麻痹临床特点及血清肌酸激酶异常分析王 勇 杨 静安徽医科大学第三附属医院 合肥市第一人民医院急诊部,安徽合肥 230061 [摘要] 目的 探讨低钾型周期性麻痹(HypoPP)的临床特点及血清肌酸激酶改变。
方法 选取我院急诊科2008年7月~2016年4月收治的低钾型周期性麻痹住院患者53例,分析临床资料,观察其血清肌酸激酶改变及规律。
结果低钾型周期性麻痹多发于中青年男性,表现为肌无力和低血钾,血清肌酸激酶增高占69.8%,血清肌酸激酶升高组病程延长。
结论 HypoPP以肌无力伴低钾血症为其临床特点,血清肌酸激酶增高是低钾型周期性麻痹的重要临床特征之一。
[关键词] 低钾血症;周期性麻痹;肌酸激酶;临床分析[中图分类号] R746.3 [文献标识码] A [文章编号] 2095-0616(2020)23-240-04Clinical features of hypokalemic periodic paralysis and analysis of abnormal serum creatine kinaseWANG Yong YANG JingDepartment of Emergency, the Third Affiliated Hospital of Anhui Medical University, the First People's Hospital of Hefei City, Anhui, Hefei 230061, China[Abstract] Objective To investigate the clinical features of hypokalemic periodic paralysis (HypoPP) and changesof serum creatine kinase. Methods A total of 53 inpatients with HypoPP admitted to the emergency department of our hospital from July 2008 to April 2016 were selected. The clinical data were analyzed. Meanwhile, the changes and regularityof serum creatine kinase were observed. Results HypoPP occurred mostly in young and middle-aged men, manifested asmyasthenia gravis and hypokalemia. The increase of serum creatine kinase accounted for 69.8%, and the course of diseasewas prolonged in the group of elevated serum creatine kinase. Conclusion HypoPP is featured by myasthenia with hypokalemia, and the increase of serum creatine kinase is one of the important clinical features of HypoPP.[Key words] Hypokalemia; Periodic paralysis; Creatine kinase; Clinical analysis低钾型周期性麻痹(hypokalemic periodic paralysis,HypoPP)是以反复发作的骨骼肌迟缓性瘫痪和血清钾含量降低为特点的遗传性钙通道疾病,部分患者伴有血清肌酸激酶(creatine phosphokinase,CK)增高,其发生机制及临床特点尚不十分清楚。
低钾型周期性麻痹的护理常规

第九节低钾型周期性麻痹的护理常规周期性瘫痪是以周期性反复发作的骨骼肌弛缓性瘫痪为特征的一组疾病。
发作时多数与血清钾代谢异常有关。
按发病时的血清钾浓度和症状可分为低血钾型、高血钾型和正常血钾型三型,临床上以低血钾型最常见,其中有部分病例,合并甲状腺功能亢进,称为甲亢性周期性麻痹。
一、护理措施1.发作时应立即急查血钾及心电图,属低钾性周期性瘫痪者立即口服10%氯化钾40~50ml,24小时内再分次口服,总量为10g。
血钾过低者应同时静脉滴注氯化钾2~4克。
2.滴注氯化钾的稀释液以等渗盐水为宜(若需稀释液较多可加用少量5%葡萄糖液),滴速每小时应不超过1克,浓度不超过0.3%。
3.静脉补钾时宜选择粗大血管,因钾盐对血管具有强刺激性。
4.在补钾过程中应密切监测BP、P、尿量、血清钾与心电图的变化,防止发生心律失常及呼吸麻痹。
重症患者应在心电图监护下进行静脉补钾。
5.呼吸困难者应给氧气吸入,必要时辅助人工呼吸。
6.及时复查血钾,根据病情调整补钾量。
补钾宜达有效剂量,不宜过量。
重症缺钾者应在2~3日内补足体内钾。
7.发作期间应卧床休息,发作间期鼓励患者在能耐受的范围内参加适当活动,如有明显的心功能不全时,应限制活动量,以防心肌受损。
8.做好患者心理护理,稳定情绪,使其能以乐观、积极的态度配合各项检查和治疗。
二、出院指导1.平时少吃多餐,限制钠盐的摄入,忌高糖饮食,要多食高钾饮食及饮料,如榨菜、瘦猪肉、鳝鱼、海带、花生、香蕉、桔子水等,多饮茶。
2.免过度疲劳、过饱、受寒、酗酒等诱发因素。
3.发作频繁者可每日口服氯化钾3~6克,或口服乙酰唑胺、安体舒通等预防发作。
4.甲亢性周期性瘫痪患者应积极治疗甲亢,可预防复发。
参考文献:1.王维治.神经病学.北京.人民卫生出版社.2004年7月第5版2.尤黎明.内科护理学.北京.人民卫生出版社.2001年5月第1版3.袁峥.医院神经内科护理常规与临床技术操作工作手册.北京4.杨和平等.疾病护理常规.四川.科学技术出版社.2005年11月第1版。
低钾型周期性瘫痪

低钾型周期性瘫痪市儿童医院智胜, 丹)周期性瘫痪又称周期性麻痹( periodic paralysis)是以反复发作的骨骼肌迟缓性瘫痪为特征的一组少见疾病,发作时大都伴有血清钾浓度的改变。
根据血清钾离子浓度的变化可将周期性瘫痪分为低钾型、正常钾型和高钾型3 种类型,其中以低钾型周期性瘫痪( hypokalemic periodic paral2 ysis, hypoKPP)最为常见。
近年来随着对离子通道结构和功能的了解,发现周期性瘫痪是由肌肉细胞膜离子通道基因突变所致的离子通道病( ion channel disease) 。
周期性瘫痪的原发性缺陷并不是血清钾浓度的改变,而是钾代障碍所致。
周期性瘫痪进一步被分为原发性和继发性,本文主要介绍原发性和继发性hypoKPP,并从离子通道病角度更新对hypoKPP 的认识。
1 原发性低钾型周期性瘫痪1. 1 家族性低钾型周期性瘫痪1863 年Cavare 首先描述hypoKPP, 1885 年Goldflam 认为hypoKPP 与遗传有关,故又称为家族性低钾型周期性瘫痪( familial hypokalemic period2 ic paralysis, FhypoKPP) ,我国以散发性hypoKPP 为多见。
1. 1. 1 与hypoKPP 相关的突变基因FhypoKPP 呈常染色体显性遗传,男性100%外显,女性外显率下降。
70%病例的基础缺陷是编码骨骼肌L2型电压门控钙通道α1亚单位( calcium channel α1 subunit, CACNA1S) 基因发生突变, 定位于染色体1q31232 。
CACNA1S基因错义突变可导致钙通道α1 亚单位结构域ⅣS4片段位点1239 上带正电的精氨酸(Arg) 被弱阳性的组氨酸( His) 或不带电荷的甘氨酸( Gly) 替代(Arg1239His/ G1y) , 也可导致钙通道α1亚单位结构域IIS4 片段位点528 上的Arg被His或Gly 替代(Arg528His/ G1y) ; 其中以Arg1239His 和Arg528His 突变常见,Arg1239His 突变较Arg528His 突变首次发病年龄更早且发作时血清钾水平更低。
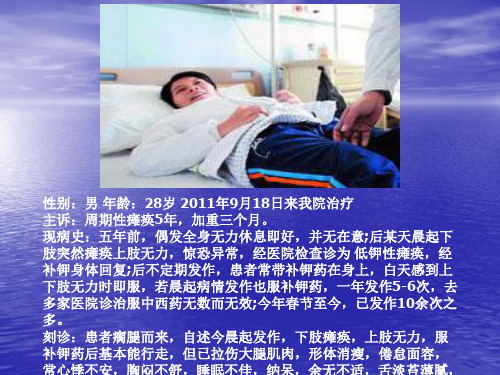
低血钾性周期性麻痹

低血钾型周期性麻痹周期性麻痹又称周期性瘫痪,是一组以与钾离子代谢有关的反复发作的骨伤肌无力或瘫痪为特征的疾病。
按血清钾的水平可将本病分为二种类型:低钾型、高钾型和正钾型周期性瘫痪,以低钾型最常见。
低血钾型周期性麻痹(hypokalemicperiodic paralysis)又称低钾型周期性瘫痪,是以骨骼肌反复发作弛缓性麻痹及发作时血清钾降低为主要特征,临床表现为发作性肌无力、血清钾降低、补钾后能迅速缓解;为周期性瘫痪中最常见的类型。
【病因及发病机制】低钾型周期性瘫痪为常染色体显性遗传性疾病,其致病基因主要位于1号染色体长臂(lq31-32),该基因编码肌细胞二氢吡啶敏感的L型钙离子通道蛋白,是二氢吡啶复合受体的一部分,位于横管系统,通过调节肌质网钙离子的释放而影响肌肉的兴奋-收缩偶联。
肌无力在饱餐后或激烈活动后的休息中最易发作,能促使钾离子转入细胞内的因素如注射胰岛素、肾上腺素或大量葡糖糖也能诱发。
具体发病机制尚不清楚,可能与骨骼肌细胞内膜内、外钾离子浓度的波动有关。
在正常情况下,钾离子浓度在肌膜内高,肌膜外低,当两侧保持正常比例时,肌膜才能维持正常的静息电位,才能为ACh的去极化产生正常的反应。
本病患者的肌细胞膜经常处于轻度去极化状态,较不稳定,电位稍有变化即产生钠离子在膜上的通路受阻,导致电活动的传播障碍。
在疾病发作期间,受累肌肉对一切电刺激均不起反应,处于瘫痪状态。
【病理】主要病理变化为肌肉肌浆网空泡化,空泡内含透明的液体及少数糖原颗粒,单个或多个,位于肌纤维中央甚至占据整个肌纤维,另外可见肌小管聚集。
电镜下可见空泡由肌浆网终末池和横管系统扩张所致。
发作间歇期可恢复,但不完全,故肌纤维间仍可见数目不等的小空泡。
【临床表现】1 .任何年龄均可发病,以20-40岁男性多见,随年龄增长而发作次数减少。
常见的诱因有疲劳、饱餐、寒冷、酗酒、精神刺激等。
2 .发病前可有肢体疼痛、感觉异常、口渴、多汗、少尿、潮红、嗜睡、恶心等。
低血钾周期性麻痹ppt课件
低血钾周期性麻痹
• 低血钾型周期性麻痹(hypokalemicperiodic
paralysis)是以骨骼肌反复发作弛缓性麻痹及发 作时血清钾降低为主要特征。本病系常染色体显 性遗传,有不完全外显率。
临床表现
• 本病是常染色体显性遗传,有不完全外显
率。家族史明显,但散发病例也有报告。 据报道88%病例首次发病在7~21岁,北京 儿童医院曾见一例患儿发病是4岁,与国外 报道相符。男孩多见。发作间歇期患儿多 无任何症状,无肌萎缩。间歇期可自数日 至数年不等。发生麻痹的时间不定,以睡 醒及休息时多见。过食碳水化合物、受凉、 精神紧张、外伤、感染及经期等均为诱发 因素。有时可因肢体浸入冷水而诱发局部
• 麻痹常自四肢近端肌肉开始痹范围大小不一,从几个 肌群乃至全身。轻者仅有全身乏力,尚可行走;重者除颜 面肌,眼肌,与发音和言语有关的肌群、膈肌、括约肌外, 全身的骨骼肌均可受累。麻痹程度可为完全性或不完全性。 如麻痹范围广泛者,有时可致呼吸障碍,心界扩大或心力 衰竭。发作期间腱反射减退或消失感觉正常,知觉及意识 亦无变化。每次发作持续时间短至1~3小时,多则6~24 小时,个别病例可长达1周左右。 1891年Oppenheim首先报道周期性麻痹患者可发生永久 性肌病。可见于儿童,青少年及成年人。北京儿童医院曾 确诊一例,其临床表现为慢性进行性近端肌无力和肌萎缩, 尤以盆带肌,股四头肌无力为著,肩带肌和颈肌相对较轻。 本病轻者多被忽视,重者可波及肢体远端肌群,甚至丧失 肌肉功能,只能坐轮椅或卧床不起。据报道,永久性肌病 与麻痹发作的频数及严重程度无关;但与年龄密切相关, 年龄越大,该病发生率越高,症状更重,由此支持本病实 质为肌肉组织进行性受损的观点。
低价性周期性麻痹

综合分析我国南方三省市892例低钾型周期性瘫痪发病特点摘要:低钾型周期性瘫痪是一组以发作性肌无力、伴血清钾降低、补钾后肌无力能迅速缓解为特点的临床综合征,夏秋季多见,中年男性于长期体力劳动后好发,发作时血清钾低于3.5mmol/L,心电图呈典型低钾表现,静脉或口服补钾后瘫痪迅速缓解,预后良好,不遗留后遗症。
关键词:低钾型周期性瘫痪中年男性血清钾概述:周期性瘫痪(periodic paralyasis)是以反复发作的骨骼肌弛缓性瘫痪为特征的一组肌病。
发作时肌无力可持续数小时或数天,发作间歇期肌力完全正常。
根据发作时血清钾浓度,分为低钾型、高钾型和正常钾型三类,以低钾型多见。
低钾型周期性瘫痪(hypokalemicperiodic paralysis)为周期性瘫痪中最常见的类型,以发作性肌无力、伴血清钾降低、补钾后肌无力能迅速缓解为特征。
该病包括原发性和继发性两种,原发性呈常染色体显性遗传,在同一家族中数代均有发病,故又称为家族性周期性瘫痪,但在我国以散发多见。
继发性多见于甲状腺功能亢进症,继发于干燥综合征患者较罕见[1]。
1.流行病学特点874例患者来自云南、广东、贵州三个省市,其中包括男性患者768人,女性患者125人,男女患病比例约为6:1,发病年龄在18~70岁之间,其中18~30岁发病人数最多[2]。
综合以上情况分析,此病中年男性发病率最高,发病季节以夏季最多,其次为秋季,冬春季发病较少[3]。
考虑原因为云南、佛山、贵州三地均属于热带、亚热带季风气候,高温多雨,夏季出汗较多,排钾增加;另外此三省该病的发病特点与职业有关,农林牧渔劳动者及生产运输工人好发,而轻体力劳动者及脑力劳动者发病率较低,分析其原因可能为本地天气温度高,湿度大,长期户外作业者及重体力劳动者,容易发生劳累、脱水、缺氧等情况,导致机体长期处于应激状态,体内激素水平随之发生改变,对血钾水平也产生影响。
临床有极少数患者为原发性低钾性麻痹,属于常染色体显性遗传,由于血钾浓度较低,导致患者自身电压依赖性钙通道出现功能性障碍,常伴有不同程度的心脏疾病。
低血钾性周期性麻痹护理查房PPT
随访计划及注意事项
随访时间:确定随访时间,以便及时了解患者病情变化
随访内容:了解患者的生活习惯、饮食习惯、运动情况等,为患者提供个性化的健康指导
注意事项:注意保护患者隐私,避免过度干预患者生活,同时也要关注患者的心理状 态,提供必要的心理支持
随访反馈:及时收集患者的反馈意见,以便调整护理方案,提高护理质量
饮食指导:向患者及家属介绍低血钾性周期性麻痹的饮食注意事项,鼓励患者多食用富含钾的 食物,如瘦肉、豆类、蔬菜、水果等
饮食观察:密切观察患者的饮食情况,及时调整饮食计划,确保患者获得足够的营养和能量
饮食记录:详细记录患者的饮食情况,包括食物种类、摄入量、进食时间等,为后续的治疗和 护理提供参考
心理护理
添加标题
建立有效的沟通渠道:医护人员之间应保持密切联系,及时交流患者病情和治疗方案,确保信息 畅通。
添加标题
协作配合:医护人员应相互协作,共同为患者提供优质的医疗服务。医生应及时向护士提供患者 病情变化信息,护士则应积极配合医生的治疗方案,做好患者的护理工作。
添加标题
培训和教育:加强医护沟通与协作需要医护人员具备相应的知识和技能。医院应定期组织培训和 教育活动,提高医护人员的沟通能力和协作意识。
解释疾病原因和治疗方法,增强患 者信心
给予患者关心和支持,减轻其焦虑 和恐惧
添加标题
添加标题
添加标题
添加标题
鼓励患者积极配合治疗,提高治疗 效果
及时解答患者疑问,消除其疑虑和 担忧
运动护理
评估运动能力:根据患者的病情和身体状况,评估其运动能力,制定合适的运动计划。
指导运动方式:指导患者进行适当的运动,如散步、慢跑、太极拳等,以增强肌肉力量和耐 力。
家族性低钾型周期性麻痹家系的基因分析
M
1
2
3
4
5
6
2 . 3 测 序 结 果
见图 5 、 6 。
3 讨 论
近年 来通过 遗 传 学 、 分子 生物 学 和 电生 理 学 的 联合研 究 发现 , 低 钾型 周期 性 麻 痹是 由离 子 通道 基
因突 变所 致 的离 子 通 道病 , 涉 及 的 离 子 通 道 基 因 包 括编 码 骨 骼 肌 电 压 门 控 钙 通 道 a 1 亚 单 位 琏 因 ( C AC NA1 S ) 和 编 码 骨 骼 肌 电 压 门 控 钠 通 道 a亚 单 位基 因 ( S C N4 A) 。1 9 9 4年 , P t d c e k等 州和 J u r k a t —
M: 1 ) I 2 0 0 0从 小 到 大 1 o 0 I ) p 、 2 5 0 b p 、 5 0 0} ) 1 ] 、 7 5 O 1 ) l 】 、 l k b 、 !k h 1 . 规察 暂 1 ; 2观察 g , - 2 . : 3 . 1 观察 并 3 ; 4 . 观 察 卉 ; 5观 察 j . : 6 . 舭 察肯6
2 8 0 C O B CT^COC 1 C C 2 9 0 3 0 0
: 3 10
3 2 0
3 3 0
e CG e G GT^C AC A
C1 GtGe1^C GCI C C 11CCG- f CT GGTACA CA
3 1 0
M: DI 2 0 0 0从 小 到 大 1 0 0 b p 、 2 5 0 b p 、 5 0 0 b p 、 7 5 0 h p 、 1 k b 、 2 k b
R o t t 等几 乎 同 时 报 道 了本 病 是 由于 二 氢 吡 啶 受 体
41例低钾型周期性麻痹临床分析
(34 有反复发作史( 6 .%) 原发性 H P oP组 1 例 ,P 0 TP 组 1 例) 6 。两组 间发病年龄 、 发病时血钾值 比较差 异均 无 统计 学意 义 ( 00 ) 见表 1 P> .5 , 。
表 1 低钾型周期性麻 痹发 病年龄、 血清钾 ( ) 面±
12 方法: 4 例患者资料采用病 例 回顾性分 析 . 对 l 研究 , 回顾分析其年龄 、 性别、 发病诱 因、 临床表现 、
血清 钾 、 电 图 、 清 肌 酶及 治 疗 情 况 , 析 其 临 床 心 血 分 特点 。 13 统 计 学方 法 : 据 采 用 S S 80软 件 包 进 行 . 数 PS1. 处理 , 量 资 料 以 ±S表 示 , 用 t 验 , P < 计 采 检 以 O0 为差 异有 统计 学意 义 。 .5
型周期性麻痹 ( P ) T P 患者 临床资料 , 对其病 因及I 临
床特点分析如下。
1 资料 与方 法 1I 一般 资料 :09年 1月・ 00年 1 宁夏 医 . 20 _2 l 2月
科大学总 医院低钾 型周期性麻 痹住 院患者 4 1例。 其 中原发性 H P 0例( oP2 有家族史 1 , 例 其余 1 9例
是 防止 复发 的关键 。
[ 关键 词] 周期性麻痹 ; 钾血症 ; 低 甲状腺功能亢进
[ 中图分 类号 】 R8 59
[ 文献标识码 】 B
低钾型周期性麻痹( oP 是 以反复发作 的肢 HP ) 体骨骼肌无力伴有 低钾血症 为临床特征 的常见疾 病, 因患者常反复出现低钾麻痹 , 严重者可导致呼吸 肌麻痹和恶性 心律失 常等危及生命 , 故提高对低钾
死 亡 率增 加 。 因此 , 探讨 国产 支架 在 A 患 者 中疗 MI
低钾性周期性麻痹的观察与护理
及血管 壁损 伤 , 应注 意 防止 烫伤 。 如发 现 四 肢 局 但
部肿胀 、 疼痛 , 明 液体 有 外 渗 , 立 即更 换 穿 刺 部 说 应
位, 局部用 5 %的硫 酸镁 湿敷 , O 防止 局部坏 死 。
3. 生 活 护 理 9
急性期 患者 肢体 瘫软 , 活动受 限 , 助其 采取舒 协 适体 位, 身 1 , 1h翻 次 保持 床单元 平整 、 清洁 、 干燥 。 恢复期 肌力 开始恢 复 , 但患者 生 活不能 全部 自理 。 生 活用 品放 在其 伸 手 可及 的地方 , 在 陪护 下适 当活 可
3 例 病人 中经 过 补钾 等 对 症 治 疗 及 精 心 的护 5 理 , ~2d病 人 瘫 痪 症 状 明 显 好 转 , 1 1周 后 痊 愈 出 院 , 死 亡病例 。 无
3 护
3. 1
入院 时都 由家 人 抬入病 房 , 四肢 无 力软 瘫 。3 5例 病 人 中经过 补 钾 等 对症 治 疗 及精 心 护理 , ~2d患 者 1
一
,
低钾 性 周 期 性 麻 痹 是 神 经 内科 常 见 的 急 症 之 病 人突然 夜 间 或晨 醒 起 病 , 下 肢 无 力 , 重 者 双 严
态 , 内有可 能对血 钾产 生 影响 , 体 再加 上有 些患 者高
双侧 四肢 对 称性 软瘫 , 吸 困难 , 呼 有的误 诊 为急性 脑 血管 病 , 如果 不及 时抢 救 可能 危及 生命 。
则 , 免造 成高 钾血 症 , 致心衰 。 避 导
3. 口 服 补 钾 4
是针 头斜 面对 向血管 下壁 , 药物 流 向发 生根 本改 变 ,
相对 远离或 避开 了对 体表 敏感 神经末 梢 的刺激 。血 管下 壁及深 部组 织 敏感 度差 , 痛 的 发 生率 明显 降 疼 低 。也可用 酒精 湿敷 , 有扩 张局 部血管 , 增强 血液 循
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
低钾性周期性麻痹关键词: 低钾性周期性麻痹,离子通道病低钾性麻痹是临床较常见的一组综合征,以发作性肌无力伴血清低钾,补钾后能迅速缓解为特征。
其病因涉及内分泌腺、肾脏和线粒体病变及遗传等。
HOPP的发病机制不明,此类患者无钾摄入或排出异常,因此,推测与钾在细胞内外运转异常有关。
近年来对HOPP肌细胞膜ATP敏感钾通道的研究令人注目。
应用细胞膜片钳技术发现HOPP患者骨骼肌纤维中最丰富的钾通道———A TP敏感钾通道在低钾时处于低活性状态,静息钾电流减少,肌纤维部分去极化,使肌膜静息电位减低,肌收缩力减弱。
即使给予高浓度A TP亦不能逆转ATP敏感钾电流的减少[1,2]。
这一发现从分子生物学水平揭示了HOPP与钾离子通道异常的关系。
我们通过对一组低钾麻痹患者RBC A TP酶活性的检测,发现HOPP患者RBC Na+/K+ATP酶活性显著高于健康对照组(P<0·01),而且不随血钾的升高而改变。
这类患者细胞膜Na+/K+泵的持续高活性状态,可能造成细胞内外钾离子转运异常,导致细胞外过多的钾离子内流,造成细胞外低钾。
研究发现,Na+/K+ATP酶由α和β亚单位组成,只有当α4和β亚单位在细胞中同时表达时,才能诱导Na+/ K+A TP酶活性的改变[3]。
这些多肽表达过度是否系原发性病变或继发于ATP敏感静息钾电流减少而产生的一种代偿性改变,为何RBC Na+/K+ATP酶活性持续增高而低钾麻痹仅偶尔发作尚不清楚,从我们所做的肌肉活检显示,A TP酶活性的改变并非由于细胞线粒体病变所致。
国外已发现HOPP患者有基因编码的改变[4],而从本组HOPP患者均为男性,发病年龄相对较轻的特点,也支持本病可能与基因异常有关的推论。
我们的结果同时显示,不同病因低钾性麻痹患者RBC Na+/K+ATP酶活性相异,说明发生低的机制不同。
肾小管性酸中毒患者RBC Na+/K+ATP酶活性下降可能是尿钾丢失过多的一种代偿性改变,以平衡细胞内外钾离子的分布[5]。
甲亢患者低钾性肌无力的发生可能与细胞内外离子分布异常关系不大,而与尿钾的丢失和细胞膜镁通道的改变有关。
钙、镁在低钾麻痹中的作用已引起人们的关注。
研究发现,肌肉L型钙通道α-亚单位基因编码的改变可引起肌纤维兴奋性的减低,尤其是在血清钾下降时。
当血清游离镁升高时,可因肌质网钙离子释放障碍而导致肌肉收缩无力[6]。
我们在研究中仅发现甲亢患者RBCMg2+ATP酶活性高于对照组,肾小管性酸中毒患者RBC Ca2+ATP酶活性低于对照(P<0·01),但病例数太少,尚待进一步研究。
低钾性周期性麻痹(HypokalemieperiodieparalysisHoPP)是一组相对少见但具有潜在致命性的临床综合征,以低血钾和急性发作的骨胳肌无力为特征大多数病例属于家族性和原发性HOPP,散发病例可由内分泌系统疾病、肾小管疾病、胃肠道病变、代谢性疾病和药物中毒等引起。
过去曾将此类疾病归类于代谢性疾病或肌肉疾病的范畴,由于细胞膜片钳技术及重组DNA技术的发展,使人们认识它们中相当一部分是由于生物膜上离子通道结构和功能的异常造成维持细胞正常膜电位的能力缺陷,在某种因素的刺激下(如高碳水化合物饮食,持续的剧烈运动等)即一友现出钾的异常传递,因此将其归类于为离子通道疾病。
一:钾通道与HOPP骨骼肌的收缩活动是肌细胞兴奋收缩祸联的结果。
当肌细胞兴奋时,动作电位洽横管系统传向肌纤维内部,通过三联体结构处信息的传导,肌质网终池膜对钙的通透改变,引起钙的储存、释放和重摄取,从而产生肌纤维收缩。
这一系列活动的关键环节是细胞膜动作电位的形成和横管肌质网三联体处的兴奋与收缩祸联。
伴随着侮一次兴奋的产生,细胞膜上的离子通道由备用状态转入激活、失活和复活等状态,膜电位将发生规律性的变化。
细胞膜静息电位对维持肌细胞的正常兴奋性是至关重要的其形成主要取决于细胞内外钾的电位差,即钾的平衡电位.。
当体内钾摄入减少时,随着lfI1清钾浓度下降,机体通过肾脏增加钾的分泌和重吸收以减少钾的排出以及调整细胞内钾池对钾的转运来平衡细胞外钾浓度的下降,使由于细胞内外钾比例升高而引起的膜电位超极化减少到最小程度。
骨胳肌拥有体内75%的细胞内钾和独特的细胞膜钠泵亚单位结构,低钾可导致其钠泵的表达减少,同时增强内向整流通达的钾外流,减少膜内阳离子移位而稳定膜电位,避免因去极化致钠通道部份失活而造成动作电位的峰值降低。
因此,低钾时骨胳肌细胞内钾丢失的程度显然高于其它组织(4,5,6,7),这或许是肌肉组织对低钾尤其敏感的原因之一。
二、钙通道与低钾性周期性麻痹对于钙经L型钙通道内流减少与肌纤维去极化和与细胞外低钾性肌无力之间的关系,有学者解释可能是在肌肉活动时,细胞内钙浓度减少通过与钙敏感钾通道的祸联直接控制静息电位,换言之,在动作电位期间,钙经钙通道内流减少可改变钙敏感钾通道的表达分布和调控,从而影响膜电位,间接使肌纤维倾向于去极化并可通过改变与其功能祸联的钙依赖钾通道的分布和调控而间接影响膜电位水平。
这一假说新近被James/和他的同事的实验所证实。
他们在对HOPP患者的肌纤维活检时发现在横管膜上钙通道的位置处能记录到一个较大的钙敏感钾电流,并证实了钙钾通道共存体的存在及重要的生理功能,它们以反馈的方式,间接影响膜电位。
在去极化时,L型钙通道通过提供钙内流来保护膜电位;当钙电流强度下降或兴奋期通道激活的延缓,可能损害钙敏感钾通道,影响肌细胞在动作电位期间的恢复能力,导致肌纤维的去极化和无法再传导(6)。
三:钠通道与低钾性周期性麻痹钠通道与肌无力的关系最早是在高钾性周期性麻痹和肌强直的患者中发现的,应用原位杂交技术和PCR技术对这类患者肌纤维检查,证实存在骨胳肌钠通道编码基因的突变,因此,以往一直认为钠通道的变异仅仅只与高钾性周期性麻痹有关。
但在最近Jurkat·Rott等人在对一组家族性HoPP患者及家庭成员的肌纤维进行基因分析后发现编码骨胳肌电压门控钠通道a亚单位蛋白的基因存在其它两种类型的突变,即在672位点处有一个鸟镖吟与腺嗓吟的转化,致使该处高度保守的精氨酸被组氨酸或甘氨酸取代。
该部位基因被认为是编码与电压传感器有关的蛋白,突变可能干扰细胞膜外层阳离子的分布,改变通道的电压敏感性,使患者的川L纤维在细胞外低钾时处于去极化状态,动作电位的幅度下降,速率减慢,通道的兴奋性降低,导致肌肉收缩无力(7,8)。
展望::最近在分子遗传学方面的进展已经证实低钾型周期性麻痹大部分是由于电压相关离子通道的突变所致。
功能表达研究发现HOKPP中钙通道和钠通道均有功能改变。
但是,这些功能异常如何使膜去极化和肌无力发作期间血清钾降低的机制仍然在研究中。
目前,我国绝大多数医院是根据周期性麻痹患者的临床特征对患者进行疾病分类,制定治疗策略。
随着分子遗传学方面的进展将对HOKPP的发生机制有更深的认识。
遗传病筛查可以提高HOKPP诊断的精确性,提高鉴别疾病能力,合理指导用药。
对怀疑HOKPP的患者进行基因突变筛查,为今后临床诊断提供了新的依据。
参考文献1 Tricarico D, Servidei S, Tonali P, et al·Impariment of skeletal muscleadenosin triphosphate-sensitive K+channels in patientswith hypokalemic periodic paralysis·J Clin Invest,1999,103:675-682·2 Tricarico D,Pierno S,Mallamci R, et al·The biophysical and pharma- cological characteristics of skeletal muscle ATP-sensitive K+channels are modified in K+depleted rat, an animal model of hypokalemic periodic paralysis·Mol Pharmacol, 1998, 54:197-199·3 Blanco G,Melton RJ,Sanchez G, et al·Functional characterization of a tests-specific alpha-subunit isoform of the sodium/potassium adenosine triphosphatase·Biochemistry,1999, 38:13661-13665·3.McDonough AA,ThomPson CB.Role of skeletal muscle sodium Pumps in theAdaptation to Potassium deprivation.Acta Physiol scand l996 Mar:156(3):295一304.4.Blaneo G,Melton RJ,Sanehez G,etal.Funetional charaeterization of a testes specificalPha Subunit isoform of the sodium/Potassium adenosine triphosphatase.Biochemistry 1999Oct12;38(41):13661一136695.Tficarico D,Piemo S,Mallamaci R,et al.The biophysical and Pharmacological Characteristics of skeletal muscle ATP-sensitive K+ channels,are modified in K+ depelete rat,an animal model of hypokalemic period paralysis.Mol phamacol 1998Jul;54(l):197一206.6.James JH,Wagner KR,King JK,et al.Stimulation of both aerobic glycolysis and Na+一K+一ATPase activity in skeletal muscle by epinhrine or amylin.Arn.J Physiol 1999 Jul;277(1Ptl):E176一186.7.Bulman DE,Seoggan KA,Vanoene MD,et al.A novel sedium channel motation,na Family with hypokalemic Periodie Paralysis.Neurology 1999Dec1O;53(9):1932一1936.8:Antes LM,Kujubu DA,Fernandez PC.HyPokalemia and the Pathology of ion transport molecules.Semin NePhrol 1998Jan;18(l):31一45.。
