高三一轮复习:原电池工作原理ppt 人教课标版
合集下载
高考化学一轮复习名师讲解课件新课标通用版课件详解《原电池原理》PPT演示课件

(2)电极反应式的书写 ①一般电极反应式的书写
返回目录
第18讲 原电池原理
❖考 向 互 动 探 究
②复杂电极反应式的书写
较简单一极的 复杂电极反应式 = 总反应式 - 电极反应式
如 CH4 酸性燃料电池中,电极反应式为: CH4+2O2===CO2+2H2O……总反应式 2O2+8H++8e-===4H2O……正极反应式 CH4+2H2O-8e-===CO2+8H+……负极反应式
学腐蚀>有防护措施的腐蚀。
(2)对同一种金属来说,腐蚀的快慢:强电解质溶液>
弱电解质溶液>非电解质溶液。
(3)活泼性不同的两金属,活泼性差别越大,腐蚀越
快。
(4)对同一种电解质溶液来说,电解质溶液浓度越大,
腐蚀越快。
返回目录
第18讲 原电池原理
❖考 向 互 动 探
2.原电池原理的应用 (1)加快氧化还原反应的速率 一个自发进行的氧化还原反应,设计成原电池时反应
负极反应(Fe)
_____2_F_e_-__4e_-_=_=_=_2_F_e2_+______
其他反应
Fe2++2OH-===Fe(OH)2↓
4Fe(OH)2+O2+2H2O===4Fe(OH)3 Fe(OH)3失去部分水转化为铁锈(Fe2O3·xH2O)
联系
两种腐蚀相继发生,吸氧腐蚀更普遍
返回目录
电流方向:“外电路:从正极流向负极;电源内电
路:从负极流向正极。”原电池装置中,外电路电子流向
与电流流向相反,从负极流向正极;电源内电路即电解质
溶液,阳离子流向与电流相同,流向正极,阴离子流向与
电流方向相反,流向负极。
返回目录
第18讲 原电池原理
❖考
届高考化学人教版一轮复习课件:6-2 原电池 化学电源(144张PPT)

3.(2015·天津卷改编)锌铜原电池装置如图所示,其中阳离 子交换膜只允许阳离子和水分子通过。
(1)铜电极上发生________反应。 (2)电池工作一段时间后,甲池的 c(SO42-)________(填“变 大”“变小”或“不变”)。 (3)电池工作一段时间后,乙池溶液的总质量________。 (4)________通过交换膜向正极移动,保持溶液中电荷平衡。
2.(1)观察如图四个装置,回答下列问题:
①装置 a 和 b 中铝电极上的电极反应式分别为___________ _______________、__________________________。
②装置 c 中产生气泡的电极为________(填“铁”或“铜”) 电 极 , 装 置 d 中 铜 电 极 上 的 电 极 反 应 式 为 _________ _______________________________________________________ _____________________________________________________。
3.在如图所示的 8 个装置中,属于原电池的是( )
A.①④ C.④⑧
B.③④⑤ D.②④⑥⑦
【提示】 D 【解析】 根据原电池的构成条件可知:①中只有一个电极, ③中两电极材料相同,⑤中酒精不是电解质,⑧中两电极材料相 同,故①③⑤⑧不能构成原电池。
易错点拨 规避原电池工作原理的 4 个易失分点 (1)只有放热的氧化还原反应才能通过设计成原电池将化学 能转化为电能。 (2)电解质溶液中阴、阳离子的定向移动,与导线中电子的定 向移动共同组成了一个完整的闭合回路。 (3)无论在原电池还是在电解池中,电子均不能通过电解质溶 液。 (4)原电池的负极失去电子的总数等于正极得到电子的总数。
高考化学一轮复习6.2原电池化学电源课件新人教版

解析 答案
基础梳理
考点突破
-11-
例2(2016课标全国甲,11)Mg-AgCl电池是一种以海水为电解质溶
液的水激活电池。下列叙述错误的是( )
A.负极反应式为Mg-2e-==Mg2+
B.正极反应式为Ag++e-==Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O==Mg(OH)2+H2↑
应快。
-7-
基础梳理
考点突破
自主巩固
判断正误,正确的画“√”,错误的画“×”。 (1)原电池可将化学能转化为电能,原电池需外接电源才能工作 ( ×) (2)NaOH溶液与稀硫酸反应是放热反应,此反应可以设计成原电 池( ×) (3)Fe+CuSO4==FeSO4+Cu的反应可以设计成原电池 ( √ ) (4)氧化还原反应2H2O 2H2↑+O2↑可以设计成原电池 ( × ) (5)同种条件下,带有“盐桥”的原电池比不带“盐桥”的原电池电流 持续时间长 ( √ ) (6)在原电池中,发生氧化反应的一极一定是负极 ( √ ) (7)在原电池中,负极材料的活泼性一定比正极材料强 ( × )
-10-
基础梳理
考点突破
例1(2015天津理综,4)锌铜原电池装置如图所示,其中阳离子交换 膜只允许阳离子和水分子通过。下列有关叙述正确的是 ( )
关闭
原电A池.铜反电应极为上Z发n+生C氧uS化O4反应ZnSO4+Cu。Cu 电极作正极,Cu2+在正极得 电子B,.发电生池还工原作反一应段,A时项间错后误,甲;由池于的两c(半池)中减的小阴离子 SO42-不能透过半 透膜C,.故电池c(S工O作42-)一都段不变时,间B 后项,错乙误池;甲溶池液中的由总于质生量成增Z加n2+,而乙池中 Cu2D++.阴2e阳- 离C子u,分则别乙池通中过的交换Cu膜SO向4 部负分极变和为正极Zn移SO动4,导,保致持乙溶池液中中溶电液荷总关闭 C质平量衡变大,C 项正确;阴离子不能透过半透膜,D 项错误。
基础梳理
考点突破
-11-
例2(2016课标全国甲,11)Mg-AgCl电池是一种以海水为电解质溶
液的水激活电池。下列叙述错误的是( )
A.负极反应式为Mg-2e-==Mg2+
B.正极反应式为Ag++e-==Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O==Mg(OH)2+H2↑
应快。
-7-
基础梳理
考点突破
自主巩固
判断正误,正确的画“√”,错误的画“×”。 (1)原电池可将化学能转化为电能,原电池需外接电源才能工作 ( ×) (2)NaOH溶液与稀硫酸反应是放热反应,此反应可以设计成原电 池( ×) (3)Fe+CuSO4==FeSO4+Cu的反应可以设计成原电池 ( √ ) (4)氧化还原反应2H2O 2H2↑+O2↑可以设计成原电池 ( × ) (5)同种条件下,带有“盐桥”的原电池比不带“盐桥”的原电池电流 持续时间长 ( √ ) (6)在原电池中,发生氧化反应的一极一定是负极 ( √ ) (7)在原电池中,负极材料的活泼性一定比正极材料强 ( × )
-10-
基础梳理
考点突破
例1(2015天津理综,4)锌铜原电池装置如图所示,其中阳离子交换 膜只允许阳离子和水分子通过。下列有关叙述正确的是 ( )
关闭
原电A池.铜反电应极为上Z发n+生C氧uS化O4反应ZnSO4+Cu。Cu 电极作正极,Cu2+在正极得 电子B,.发电生池还工原作反一应段,A时项间错后误,甲;由池于的两c(半池)中减的小阴离子 SO42-不能透过半 透膜C,.故电池c(S工O作42-)一都段不变时,间B 后项,错乙误池;甲溶池液中的由总于质生量成增Z加n2+,而乙池中 Cu2D++.阴2e阳- 离C子u,分则别乙池通中过的交换Cu膜SO向4 部负分极变和为正极Zn移SO动4,导,保致持乙溶池液中中溶电液荷总关闭 C质平量衡变大,C 项正确;阴离子不能透过半透膜,D 项错误。
人教课标版 原电池原理及应用PPT
二、 原电池的应用
利用原电池原理 可制作各种电池,如 干电池、铅蓄电池、银锌电池、锂电池、氢 氧燃料电池……。
高中阶段我们应会解决以下问题: 1、设计简单原电池 2、理解各种实用电池
1、设计简单原电池
例1、请同学们根据反应,
Cu+2FeCl3= 2FeCl2+CuCl2
设计一组原电池 (1)画出该原电池的示意图 (2)分析其正、负极材料 (3)写出正、负极电极反应式
稀HNO3
浓HNO3
归纳总结:
原电池电极反应物的确定 方法——
更易与电解质溶液反 应的一极为负极
例3.氢氧燃料电池使用氢气为燃料,电池里发生 氢气和氧气化合生成水的反应,以KOH为电解质溶 液,请分析该电池
总反应方程式: 负极反应式: 正极反应式: H 2O
氢气入口
氧气入口
a极 电解液
b极
总反应方程式:2H2+O2=2H2O 负极反应式: 2H2-4e +4OH = 4H2O 正极反应式: O + 4e + 2H O= 4OH
2(96)实验室用铅蓄电池作电源电解 饱和食盐水制取氯气,已知铅蓄电池放电 时发生如下反应: 负极: Pb+ SO42-= PbSO4+2e-, 正极 PbO2+4H++ SO42-+2e-= PbSO4+2H2O 今若制得Cl20.050摩,这时电池内消耗的 H2SO4的物质的量至少是: C A 0.025摩 B 0.050摩 C 0.10摩 D 0.20摩
Cu(-) C(+)
(1)正极材料:碳棒(或Pt)
正极反应式:
2 Fe3++ 2e-=2Fe2+ (2)负极材料:铜(Cu)
高考化学一轮复习 9.1 原电池 化学电源课件 新人教版

====Co,总反应为
Cd(s)+Co2+(aq)====Co(s)+Cd2+(aq),A正确;乙中Co为负
极,电极反应为Co-2e-====Co2+,Ag电极为正极,电极反应为
完整版ppt
4
(2)电极均插入_电__解__质__溶__液__中。
(3)构成_________(两电极接触或用导线连接)。 闭合回路
(4)能自发地发生氧化还原反应。
完整版ppt
5
3.原电池的工作原理。 原电池的工作原理和电子流向可用下图表示:
完整版ppt
6
二、化学电源
以下分别是锂电池和空气电池,另外日常生活中要用到形形色 色的电池,但不论是哪种电池,其负极都发生_____反应,正极都 发生_____反应,总反应式为氧化还原反应。 氧化
2H2O(l)。
完整版ppt
10
(2)充电时的反应。
①阴极反应:_P _b _S _O _4 _ _s __ _2 _e _ _ _ _ _ _P _b _ _s _ _ _S _O _4 2 _ _( a _q _) __;
②阳极反应:______________________________________
还原
完整版ppt
7
1.一次电池(碱性锌锰干电池)。 碱性锌锰干电池的工作原理如图:
Zn+2OH--2e-====Zn(OH)2
完整版ppt
8
2.二次电池(以铅蓄电池为例)。
完整版ppt
9
(1)放电时的反应。
①负极反应:_P _b _ _s _ __S _O _2 4 _ _a _q _ _ _2 _e _ _ _ _ _ _P __b S _O __4 _( s _) ______;
高三一轮复习原电池原理 课件 通用

从理论上说,任何一个自发的氧化还原反应均 可设计成原电池;
2.电极名称:
相对活泼的电极为负极
原电池
相对不活泼的电极为正极
3.电极反应:
原电池 负极:失电子的氧化反应 正极:得电子的还原反应
4、原电池的形成条件
(1)能自发地发生的氧化还原反应:
①电极和电解质溶液 ②两电极上分别有还原剂和氧化剂(燃料电池)
原电池 普通干电池
手机电池
钮扣电池
笔记本电脑 专用电池
摄像机 专用电池
“神六”用 太阳能电池
问题探究:
1、什么是原电池? 2、原电池的工作原理?
(电子的流向、电流的流向、离子的流向、形 成条件、电极的判断)
把化学能转变为电能的装置叫 原电池
考点一.原电池的工作原理: 1.定义: 化学能转化为电能的装置为原电池。
热敷袋
(2) 碳粉的主要作用是什么?氯 化钠又起了什么作用?
(3) 试写出有关的电极反应式和化学方程式。
(1) 热敷袋使用时,为什么会放出热量? 利用铁被氧气氧化时放热反应所放出的热量。
(2) 碳粉的主要作用是什么?氯化钠又起了什么作 用?碳粉的主要作用是和铁粉、氯化钠溶液一起
构成原电池,加速铁屑的氧化。 氯化钠溶于水,形成了电解质溶液。
(2)电解质溶液 :
参与电极反应或构成内电路
(3)两导体作电极:
①活动性不同的金属(或一种金属和一种非金属导 体石墨),与电解质溶液反应的活泼金属为负极。
②两不活泼的导体-石墨或 Pt等。(燃料电池电极)
(4)形成闭合回路。 (两电极用导线连接,或接触。)
5.定向移动方向:电子、离子
“负极出电子,电子回正极”
? A.纯银器表面在空气中因化学腐蚀渐渐变暗 ? B.当镀锡铁制品的镀层破损时,镶层仍能对铁制品起
2.电极名称:
相对活泼的电极为负极
原电池
相对不活泼的电极为正极
3.电极反应:
原电池 负极:失电子的氧化反应 正极:得电子的还原反应
4、原电池的形成条件
(1)能自发地发生的氧化还原反应:
①电极和电解质溶液 ②两电极上分别有还原剂和氧化剂(燃料电池)
原电池 普通干电池
手机电池
钮扣电池
笔记本电脑 专用电池
摄像机 专用电池
“神六”用 太阳能电池
问题探究:
1、什么是原电池? 2、原电池的工作原理?
(电子的流向、电流的流向、离子的流向、形 成条件、电极的判断)
把化学能转变为电能的装置叫 原电池
考点一.原电池的工作原理: 1.定义: 化学能转化为电能的装置为原电池。
热敷袋
(2) 碳粉的主要作用是什么?氯 化钠又起了什么作用?
(3) 试写出有关的电极反应式和化学方程式。
(1) 热敷袋使用时,为什么会放出热量? 利用铁被氧气氧化时放热反应所放出的热量。
(2) 碳粉的主要作用是什么?氯化钠又起了什么作 用?碳粉的主要作用是和铁粉、氯化钠溶液一起
构成原电池,加速铁屑的氧化。 氯化钠溶于水,形成了电解质溶液。
(2)电解质溶液 :
参与电极反应或构成内电路
(3)两导体作电极:
①活动性不同的金属(或一种金属和一种非金属导 体石墨),与电解质溶液反应的活泼金属为负极。
②两不活泼的导体-石墨或 Pt等。(燃料电池电极)
(4)形成闭合回路。 (两电极用导线连接,或接触。)
5.定向移动方向:电子、离子
“负极出电子,电子回正极”
? A.纯银器表面在空气中因化学腐蚀渐渐变暗 ? B.当镀锡铁制品的镀层破损时,镶层仍能对铁制品起
高三一轮复习公开课:原电池及其应用-PPT
反应速率。
问题讨论5: 如何理解铅蓄电池的正负极反应和总反应?
铅蓄电池(电瓶)——二次电池
Pb‖H2SO4(aq)‖PbO2
PbSO4不溶于水
负极:Pb — 2e- → Pb2+ + SO42-
√负极反应:Pb — 2e- + SO42- === PbSO4 正极:PbO2 + 2e- → Pb2+ + SO42-
分组讨论并展示负极反应式:
第一组:H2酸性
H2-2e-==2H+
第二组:H2碱性
H2-2e-+2OH-==2H2O
第三组:CH3OH酸性 CH3OH-6e-+H2O==CO2+6H+
第四组:CH3OH碱性 CH3OH-6e-+8OH-==CO32-+6H2O
第五组:CH3OCH3酸性 CH3OCH3-12e-+ 3H2O ==2CO2+12H+
电解质溶液:H2SO4(aq)、KOH(aq)
正极
酸性:O2 + 4e- + 4H+ == 2H2O
碱性:O2 + 4e- + 2H2O == 4OH-
-4
燃料:H2、CH4、CH3OH、CH3OCH3、C2H5OH
酸性:CH4 — 8e- + 2H2O ==
→ 负极
CO2 +8H+
负极
总结: 碱性:CH4 — 8e- + 10OH- == CO32- + 7H2O
第六组:CH3OCH3碱性 CH3OCH3-12e-+16OH-==2CO32-+11H2O
问题讨论5: 如何理解铅蓄电池的正负极反应和总反应?
铅蓄电池(电瓶)——二次电池
Pb‖H2SO4(aq)‖PbO2
PbSO4不溶于水
负极:Pb — 2e- → Pb2+ + SO42-
√负极反应:Pb — 2e- + SO42- === PbSO4 正极:PbO2 + 2e- → Pb2+ + SO42-
分组讨论并展示负极反应式:
第一组:H2酸性
H2-2e-==2H+
第二组:H2碱性
H2-2e-+2OH-==2H2O
第三组:CH3OH酸性 CH3OH-6e-+H2O==CO2+6H+
第四组:CH3OH碱性 CH3OH-6e-+8OH-==CO32-+6H2O
第五组:CH3OCH3酸性 CH3OCH3-12e-+ 3H2O ==2CO2+12H+
电解质溶液:H2SO4(aq)、KOH(aq)
正极
酸性:O2 + 4e- + 4H+ == 2H2O
碱性:O2 + 4e- + 2H2O == 4OH-
-4
燃料:H2、CH4、CH3OH、CH3OCH3、C2H5OH
酸性:CH4 — 8e- + 2H2O ==
→ 负极
CO2 +8H+
负极
总结: 碱性:CH4 — 8e- + 10OH- == CO32- + 7H2O
第六组:CH3OCH3碱性 CH3OCH3-12e-+16OH-==2CO32-+11H2O
(人教)高考化学一轮复习6.2原电池 化学电源课件
电子方向和电流方向 电子从负极流出经外电路流入正极;电流从正极流出经外电路流 入负极。 (4)离子的迁移方向 电解质溶液中,阴离子向负极迁移,阳离子向正极迁移。 (5)两种装置的比较 ①装置Ⅰ中还原剂 Zn 与氧化剂 Cu2+直接接触,既有化学能转化 为电能,又有化学能转化为热能,造成能量损耗。 ②装置Ⅱ能避免能量损耗;装置Ⅱ中盐桥的作用是提供离子迁移 通路,导电。Zn 与氧化剂 Cu2+不直接接触,仅有化学能转化为电能, 避免了能量损耗,故电流稳定,持续时间长。 关键点:盐桥原电池中,还原剂在负极区,而氧化剂在正极区。
答案 B
4.各式各样电池的迅速发展是化学对人类的一项重大贡献。下列 有关电池的叙述不正确的是( )
A.手机上用的锂离子电池属于二次电池 B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 C.甲醇燃料电池可把化学能转化为电能 D.锌锰干电池中,锌电极是负电极
解析 锂离子电池可以充电,再次使用,属于二次电池,A 项正 确;铜锌原电池中铜为正极,故电流由铜流向锌,而电子是由锌流向 铜,B 项错误;电池的实质即是化学能转化成电能,C 项正确;Zn 失 去电子生成 Zn2+,作负极,D 项正确。
解析 (1)先分析氧化还原反应,找出正负极反应,即可确定正负 极区电解质溶液。(2)发生氧化反应的电极是负极,I-失电子。(3)反应
达到平衡时,无电子流动,故无电流产生。(4)平衡后向 FeCl3 溶液中 加入少量 FeCl2 固体,平衡逆向移动,此时 FeCl2 溶液失电子,变成负 极。
知识要点速记
2CH3OH+3O2===2CO2+4H2O
步骤 1:确定得失 电子数目
步骤 2:确定对应 产物
步骤 3:配平电极 反应式
负极为 CH3OH-6e- 正极为 O2+4e-
答案 B
4.各式各样电池的迅速发展是化学对人类的一项重大贡献。下列 有关电池的叙述不正确的是( )
A.手机上用的锂离子电池属于二次电池 B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 C.甲醇燃料电池可把化学能转化为电能 D.锌锰干电池中,锌电极是负电极
解析 锂离子电池可以充电,再次使用,属于二次电池,A 项正 确;铜锌原电池中铜为正极,故电流由铜流向锌,而电子是由锌流向 铜,B 项错误;电池的实质即是化学能转化成电能,C 项正确;Zn 失 去电子生成 Zn2+,作负极,D 项正确。
解析 (1)先分析氧化还原反应,找出正负极反应,即可确定正负 极区电解质溶液。(2)发生氧化反应的电极是负极,I-失电子。(3)反应
达到平衡时,无电子流动,故无电流产生。(4)平衡后向 FeCl3 溶液中 加入少量 FeCl2 固体,平衡逆向移动,此时 FeCl2 溶液失电子,变成负 极。
知识要点速记
2CH3OH+3O2===2CO2+4H2O
步骤 1:确定得失 电子数目
步骤 2:确定对应 产物
步骤 3:配平电极 反应式
负极为 CH3OH-6e- 正极为 O2+4e-
高三一轮复习原电池的工作原理课件
详细描述
这道题目要求学生能够区分不同类型的原电池,如干电池、 纽扣电池、燃料电池等,并理解其在日常生活和工业生产 中的应用。
总结词
掌握原电池的工作原理是解决这类题目的核心。
详细描述
这道题目要求学生能够根据原电池的工作原理,分析电池 的输出电压、电流和电阻等参数,并理解这些参数对电池 性能的影响。
习题三:原电池的工作原理实验
通过实验操作,提高学生的实验 技能和观察能力。
实验材料
实验步骤
步骤1
准备实验材料,搭建原电池装置。将铜片和锌片插入稀硫酸中,用导 线连接铜片和锌片,并将电流表接入电路。
步骤2
观察并记录实验现象。观察电流表的读数变化,记录实验过程中的电 子转移和电流形成情况。
步骤3
分析实验结果。根据实验现象,分析原电池的工作原理,理解电子转 移和电流形成的过程,掌握原电池的组成和各部分的作用。
电极反应是指在电极上发生的氧化还 原反应,分为负极反应和正极反应。
电极反应是原电池工作原理的重要组 成部分,决定了电池的输出电压和电 流。
负极反应是电子转移的来源,通常是 金属失去电子被氧化;正极反应则是 电子的接受者,通常是一种氧化剂获 得电子被还原。
CHAPTER
原电池的应用
化学电源
干电池
充电电池
步骤4
总结实验结论。总结原电池的工作原理,理解原电池的能量转化方式, 并能够将实验结论应用到实际生活中。
CHAPTER
原电池的工作原理习题及解 析
习题一:原电池的基本概念
01
总结词
02
详细描述
03
总结词
04
详细描述
习题二:原电池的种类及应用
总结词
高三一轮复习原电池的工作原理PPT课件
•
X电极上发生的电极反应为________。
三、金属的腐蚀与防护
钢铁生锈
Cu2(OH)2CO
3
铜器表面生成铜绿
一、金属的腐蚀:
1. 含义:
金属或合金与周围接触到的气体或液体发生 反应而氧损化耗还的原现象。
2. 本质:
金属单质失电子被氧化成阳离子
M – ne→Mn+
3、金属腐蚀的类型: (1)化学腐蚀
阴离子定向移动到_____极,
由此可见,电池是将氧化还原反应的化学能→电能的装置。
双液电池
盐桥制法: 1)将热的琼胶溶液倒入U形管中,
将冷却后的U形管浸泡在KCl 饱和溶液中即可。 2)将KCl饱和溶液装入U形管, 用棉花堵住管口即可。
盐桥的作用:
1)避免氧化剂和还还剂直接接触 2)连通原电池的内电路 3)平衡溶液中的离子电荷
• 依据氧化还原反应: • 2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s) • 设计的原电池如图所示:
A
盐桥 电流计
X
Ag
• 请回答下列问题: CuSO4溶液
Y
• (1)电极X的材料是________;电解质溶液Y是_______。
• (2)银电极为电池的________;
[交流研讨]
你知道自行车的金属部件采用了什么样的防护措施吗?
烤蓝
烤漆
镀铬
涂机油 涂凡士林
镀锌
写在最后
经常不断地学习,你就什么都知道。你知道得越多,你就越有力量 Study Constantly, And You Will Know Everything. The More
You Know, The More Powerful You Will Be
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、化学电源及其电极反应式
1、碱性锌锰电池 负极 Zn+2OH--2e-→Zn(OH)2 正极 2MnO2+2H2O+2e-=2MnO(OH)+2OH总反应 Zn + 2MnO2 +2H2O= Zn(OH)2+ 2MnO(OH)
干电池(NH4Cl糊状物为电解质) 负极(锌筒):Zn-2e-=Zn2+,
原电池工作原理
考
点
考点一、原电池的工作原理: 考点二、原电池的设计: 考点三、电极的判断及电极反应式的书写 考点四、化学电源 考点五、感悟08高考
考点一.原电池的工作原理: 1.定义: 化学能转化为电能的装置为原电池。 从理论上说,任何一个自发的氧化还原反应均 可设计成原电池;
2.电极名称:
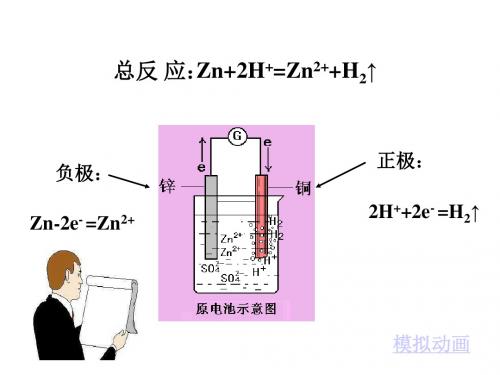
原电池
负极: 2H2 - 4e- →4H+ - +4H+ → 2H O O +4e 正极: 2 2
H2 O H 2O
H2
O2
H2SO4
4、甲烷燃料电池(电解质为KOH)
负极:CH4 + 10OH- - 8e- = CO32- + 7H2O 正极:2O2 + 4H2O +8e- = 8OH-
总反应:CH4 + 2O2 + 2OH- = CO32- + 3H2O
请将氧化还原反应 Cu+2Ag+ =
Cu2++2Ag
设计成一个
能产生持续、稳定电流的原电池装置
Ag Cu
AgNO3
CuSO4
考点三:电极的判断及电极反应式的书写 例1:判断右边原电池的 正、负极,并写出电极反应式。 负极:Cu -2e- →Cu 2+ FeCl3溶液 正极:2Fe3+ +2e -→2Fe2+ (稀硫酸)负极:Mg -2e-→Mg2+ A + + - 正极:2H +2e →H2↑
A
2e
H2O
2e
-
氢气
H2 H+ OH
氧气
-
O2
电解液 H2O
负极 正极
3、氢氧燃料电池
负极: 2H2 +
碱性燃料电池
4OH -4e
→ 4H2O
正极: O2 + 2H2O + 4e- → 4OH总反应式:2H2 + O2 =2H2O
HH 2O 2O H2
O2
KOH
3、氢氧燃料电池
酸性
总反应式:2H2 +O2 = 2H2O
Pb + PbO2 + 2H2SO4 =2PbSO4 + 2H2O
2、铅蓄电池 充电 阳极 PbSO4 + 2H2O - 2e - → PbO2 + 4H+ + SO42阴极 PbSO4 + 2e -→ Pb + SO42总反应
2PbSO4 + 2H2O ==Pb + PbO2 + 2H2SO4
3、氢氧燃料电池
4
C
H 2S O
Fe
4
D √
N a C l溶 液
E √
Zn
C u
C u
Zn
Cu
F
C u 2 S O 44 CuSO
M
酒 精
N a C l溶 液
N
H 2S O 4 H 2S O 4
6.工作原理:
外电路 失e,沿导线传递,有电流产生
氧化反应 还原反应
负极
Zn-2e=Zn2+
阴离子
铜锌原电池 正极
2H++2e- =H2↑
Mg
- Cu
A
+ C
2Al+2OH-+2H2O=2AlO2-+3H2↑ (NaOH溶液) 负极:2Al+8OH- -6e- →2AlO2-+4H2O 稀硫酸溶液 正极:6H2O+6e- →3H2↑+6OHNaOH溶液
Al
考点三:电极的判断及电极反应式的书写
方法一:根据电极材料的性质确定。 1.对于金属—金属电极, 活泼金属是负极,不活泼金属是正极; 2.对于金属—非金属电极, 金属是负极,非金属是正极,如干电池等; 3.对于金属—化合物电极, 金属是负极,化合物是正极。 方法二:根据电极反应的本身确定。 失电子的反应→氧化反应→负极; 得电子的反应→还原反应→正极。
5、锂电池(非水有机溶剂电解液)
负极:2Li - 2e- = 2Li+, 正极:I2 + 2e- = 2I-, 总反应:2Li + I2 = 2LiI
跟相同质量的其它金属作负极相比,使用 寿命延长,高能、质轻、电压高、工作效 率高、储存寿命长。
6、银锌电池(电解质为KOH)
负极:Zn + 2OH- -2e- = Zn(OH)2 正极:Ag2O + H2O + 2e- = 2Ag + 2OH-
相对活泼的电极为负极 相对不活泼的电极为正极 负极:失电子的氧化反应 正极:得电子的还原反应
3.件
(1)能自发地发生的氧化还原反应: ①电极和电解质溶液 ②两电极上分别有还原剂和氧化剂(燃料电池) (2)电解质溶液: 参与电极反应或构成内电路
(3)两导体作电极: ①活动性不同的金属(或一种金属和一种非金属导 体石墨),与电解质溶液反应的活泼金属为负极。 ②两不活泼的导体-石墨或Pt等。(燃料电池电极)
X
盐桥
Ag
Y
练习: 考点二、原电池的设计:
利用反应Zn+2FeCl3=2FeCl2+ZnCl2 ,设 计一个单液原电池,一个双液原电池(使用盐 桥),画出原电池的示意图,并写出电极反应。 参考答案 G
(-)
G
(+)
Zn
Pt
Zn
(-)
盐桥
(+)
C
FeCl3 溶液
ZnCl2溶液
FeCl3溶液
负极(Zn):Zn-2e-=Zn2+(氧化反应) 正极(Pt或C):2Fe3++2e-=2Fe2+(还原反应)
正极(石墨):
2NH4++2MnO2 + 2e-=2NH3↑+Mn2O3+H2O 总反应: Zn+2NH4++2MnO2= Zn2++2NH3↑+Mn2O3+H2O
2、铅蓄电池
放电
负极: Pb + SO42- -2e - → PbSO4 正极
PbO2 + 4H+ + SO42- + 2e - → PbSO4 + 2H2O 总反应式为: 当向外提供0.5mol电子时,消耗硫酸的 物质的量为 0.5mol
阳离子
阳离子 电解质
溶液
盐桥
内电路
电 负极: Zn-2e- =Zn2+ (氧化反应) 极 正极:2H++2e- =H ↑ (还原反应) 2 反 +=Zn2++H ↑ (离子方程式) Zn+2H 总反应: 应 2 Zn+H2SO4=ZnSO4+H2↑ (化学方程式)
7.双液原电池的工作原理(有关概念)
(3)双液原电池的 优点: 能产生持续、稳 定的电流。
(2007年高考海南化学卷) 依据氧化还原反 应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s) 设计的原电池如图所示。 电流计
A
请回答下列问题: 铜 ( 或 Cu) (1)电极X的材料是________; AgNO3溶液; 电解质溶液Y是___________ 正 极, (2)银电极为电池的________ CuSO4溶液 发生的电极反应为_________________ Ag++e- → Ag X电极上发生的电极反应为 Cu -2e- → Cu2+ ____________________________ ; 负(Cu)电极流向 (3)外电路中的电子是从_______ ________ 正 (Ag) 电极。
读一本好书,就是和许多高尚的人谈话。 ---歌德 书籍是人类知识的总结。书籍是全世界的营养品。 ---莎士比亚 书籍是巨大的力量。 ---列宁 好的书籍是最贵重的珍宝。 ---别林斯基 任何时候我也不会满足,越是多读书,就越是深刻地感到不满足,越感到自己知识贫乏。 ---马克思 书籍便是这种改造灵魂的工具。人类所需要的,是富有启发性的养料。而阅读,则正是这种养料。 ---雨果 喜欢读书,就等于把生活中寂寞的辰光换成巨大享受的时刻。 ---孟德斯鸠 如果我阅读得和别人一样多,我就知道得和别人一样少。 ---霍伯斯[英国作家] 读书有三种方法:一种是读而不懂,另一种是既读也懂,还有一种是读而懂得书上所没有的东西。 ---克尼雅日宁[俄国剧作家・诗人] 要学会读书,必须首先读的非常慢,直到最后值得你精读的一本书,还是应该很慢地读。 ---法奇(法国科学家) 了解一页书,胜于匆促地阅读一卷书。 ---麦考利[英国作家] 读书而不回想,犹如食物而不消化。 ---伯克[美国想思家] 读书而不能运用,则所读书等于废纸。 ---华盛顿(美国政治家) 书籍使一些人博学多识,但也使一些食而不化的人疯疯颠颠。 ---彼特拉克[意大利诗人] 生活在我们这个世界里,不读书就完全不可能了解人。 ---高尔基 读书越多,越感到腹中空虚。 ---雪莱(英国诗人) 读书是我唯一的娱乐。我不把时间浪费于酒店、赌博或任何一种恶劣的游戏;而我对于事业的勤劳,仍是按照必要,不倦不厌。 ---富兰克林 书读的越多而不加思索,你就会觉得你知道得很多;但当你读书而思考越多的时候,你就会清楚地看到你知道得很少。 ---伏尔泰(法国哲学家、文学家) 读书破万卷,下笔如有神。---杜甫 读万卷书,行万里路。 ---顾炎武 读书之法无他,惟是笃志虚心,反复详玩,为有功耳。 ---朱熹 读书无嗜好,就能尽其多。不先泛览群书,则会无所适从或失之偏好,广然后深,博然后专。 ---鲁迅 读书之法,在循序渐进,熟读而精思。 ---朱煮 读书务在循序渐进;一书已熟,方读一书,勿得卤莽躐等,虽多无益。 ---胡居仁[明] 读书是学习,摘抄是整理,写作是创造。 ---吴晗 看书不能信仰而无思考,要大胆地提出问题,勤于摘录资料,分析资料,找出其中的相互关系,是做学问的一种方法。---顾颉刚 书犹药也,善读之可以医愚。 ---刘向 读书破万卷,胸中无适主,便如暴富儿,颇为用钱苦。 ---郑板桥 知古不知今,谓之落沉。知今不知古,谓之盲瞽。 ---王充 举一纲而万目张,解一卷而众篇明。 ---郑玄
