原子结构模型 电子排布
原子核外电子层排布

原子核外电子层排布知识精讲:1、原子结构示意图①圆圈内的数字:表示原子的质子数②+:表示原子核的电性③弧线:表示电子层④弧线上的数字:表示该电子层上的电子数2、核外电子排布的规律:①第一层最多容纳2个电子;②第二层最多容纳8个电子;③最外层最多容纳8个电子(若第一层为最外层时,最多容纳2个电子)3、元素周期表与原子结构的关系:①同一周期的元素,原子的电子层数相同,电子层数=周期数②同一族的元素,原子的最外层电子数相同,最外层电子数=主族数4、元素最外层电子数与元素性质的关系金属元素:最外层电子数<4 易失电子非金属元素:最外层电子数≥4 易得电子稀有气体元素:最外层电子数为8(He 为2)不易得失电子最外层电子数为8(若第一层为最外层时,电子数为2)的结构叫相对稳定结构。
5、离子中质子数与电子数的关系:阳离子:质子数>电子数阴离子:质子数<电子数质子数真题讲解:(2017山西)小美从某粒子结构示意图(如图)中,获取了下列信息,其中错误的是A.它有两个电子层B.它的核电荷数为12C.它表示阴离子D.它表示相对稳定结构答案:C解析:从题中所给原子结构示意图中可以看出,该粒子为镁离子,为阳离子,有两个电子层,核电荷数为12,最外层电子数为8,具有相对稳定结构。
(2017河南)右图为钠的原子结构示意图。
下列说法不正确的是A.钠原子的质子数为11 B.图中n的值为10C.钠在反应中易失去电子D.钠元素位于第三周期答案:B解析:由图可知,钠原子有11个质子,所以n=8;最外层一个电子,容易失去一个电子;钠原子有三个电子层,位于第三周期。
故答案选B。
(2017青岛)已知元素周期表中第三周期各元素原子结构示意图如下,下列分析错误的是A.以上原子的核外都有三个电子层B.Na+和Mg2+的核外电子数不相同C.Na与S形成化合物的化学式为Na2S D.在化学反应中氯原子容易得到电子答案:B解析:Na+和Mg2+的核外电子数相同,都是10;故答案选B。
原子结构原子核外电子排布

基 础 盘 点 · 自 测 自 评 要 点 透 析 · 典 例 精 讲 易 错 剖 析 · 误 区 警 示
6.下图为四种粒子的结构示意图,完成以下填空:
经 典 考 题 · 知 能 检 验 实 验 专 项 · 方 法 积 累 模 拟 考 场 · 实 战 演 练
(1)属于阳离子结构的粒子是_________ 。(填字母序号) (2)B粒子的半径________ C粒子的半径(填“大于”、“小
【解析】选C。氢元素中11H就不含中子。
基 础 盘 点 · 自 测 自 评 要 点 透 析 · 典 例 精 讲 易 错 剖 析 · 误 区 警 示
2.(2011·铜川模拟)月球上含有丰富的32He,关于32He的说 法不正确的是( A.是一种核素 C.比42He少一个电子 核外电子数也相同。 ) B.原子核内有1个中子 D.与42He互为同位素
原子结构,不带电;质子数<电子数时为阴离子结构,带负
电荷。因此第(1)小题中阳离子是B,A是阴离子,C、D是原 子;当原子失去最外层电子时,半径减小,得到电子时半 径增大;第(3)小题有难度,首先要判断出R元素的化合价, 因为氧元素的化合价为-2,R元素的化合价为+3,即最外
经 典 考 题 · 知 能 检 验 实 验 专 项 · 方 法 积 累 模 拟 考 场 · 实 战 演 练
基 础 盘 点 · 自 测 自 评 要 点 透 析 · 典 例 精 讲 易 错 剖 析 · 误 区 警 示
经 典 考 题 · 知 能 检 验 实 验 专 项 · 方 法 积 累 模 拟 考 场 · 实 战 演 练
基 础 盘 点 · 自 测 自 评 要 点 透 析 · 典 例 精 讲 易 错 剖 析 · 误 区 警 示
基 础 盘 点 · 自 测 自 评 要 点 透 析 · 典 例 精 讲 易 错 剖 析 · 误 区 警 示
核外电子排布、原子结构示意图、电子式、8电子稳定结构

原子的核外电子排布1.原子结构行星模型告诉我们,核外电子在原子核外的外周运动,那么原子的核外电子是怎样排布在原子核外的呢?下图是1~20号元素核外电子的排布图,仔细观察图像,回答下列问题:注:在圆内标出原子的核电荷数,外面用弧线表示电子层,每层排的电子数目在弧线上标出。
(1)第一层最多排_______个电子,第二层最多排________个电子,第三层最多排______个电子。
规律:第n层最多容纳的电子数为______________(用含n的代数式表示)。
(2)最外层最多排_______个电子。
(3)第二层电子的能量比第一层电子的能量_________(填“大”或“小”,提示:从原子核对电子的作用思考)。
2.电子层的表示方法及能量变化:3.核外电子的排布规律:(1)能量最低原则:核外电子总是先排布在能量______的电子层里,然后再按照由______向______的顺序依次排布在能量逐渐升高的电子层里。
(2)电子分层排布的原则:①第n层最多容纳的电子数为______。
②最外层不超过________个(K层为最外层时,不超过_____个)。
4.原子结构示意图:在圆内标出原子的核电荷数,外面用弧线表示电子层,每层排的电子数目在弧线上标出,如:5.阴阳离子的形成:(1)当原子_________(填“得到”或“失去”)电子时便形成阴离子,如N3-、O2-、F-。
(2)当原子_________(填“得到”或“失去”)电子时便形成阳离子,如Na+、Mg2+、Al3+。
规律:a.当原子的最外层电子数大于4时,原子易______(填“得”或“失”)电子形成_____离子(填“阴”或“阳”)。
b.当原子的最外层电子数小于4时,原子易______(填“得”或“失”)电子形成_____离子(填“阴”或“阳”)。
6.“8e”稳定结构:___________________________________________。
1-1-1原子核外电子排布
解析
(1)该微粒为中性微粒,即核电荷数等于核外
电子数,为18号元素氩。 (2)该微粒能使溴水褪色,即为还原性微粒,且出现 浑浊,即有难溶性的非金属单质。符合条件的为硫 元素。 (3)该微粒得到一个电子可变成原子,故为19号元素 钾。 (4)该微粒失去一个电子可变成原子,故为17号元素 氯。
( A )
C.a=b+m-n D.a=b-m-n 解析 在原子中,核电荷数等于核外电子数;在
阳离子中,核电荷数减去离子所带电荷数等于核 外电子数;在阴离子中,核电荷数加上离子所带 电荷数等于核外电子数。因为Xm+和Yn-具有相同 的核外电子排布,所以,Xm+和Yn-具有相同的核 外电子数,aXm+的核外电子数等于a-m,bYn-的 核外电子数为:b+n,则:a-m=b+n。
3.在下列所表示的微粒中,得电子能力最强的是 ( B )
解析
四个选项的示意图分别表示碳原子、氟原
子、钠离子、铝离子。钠离子和铝离子都形成最外 电子层为8个电子的稳定结构,则它们很难得到电 子。氟原子比碳原子的核电荷数大,最外层电子数 多,原子半径小,原子核对核外电子的吸引力大, 因此氟原子比碳原子更易得电子。
答案
(1)Ar
(2)S2-
(3)K+
(4)Cl-
8.A、B、C三种元素,其中有一种金属元素,A、 B原子的电子层数相同,B、C原子的最外层电子 数相同。又知这三种元素原子的最外层电子数之 和为17,原子核中的质子数之和为31。试通过计 算确定这三种元素的名称。 解析 设元素A、B原子最外层电子数分别为y和x,
碳原子激发态电子排布式

碳原子激发态电子排布式
碳原子激发态电子排布式:
1、碳原子的结构:
碳原子是包含稳定的6个电子的原子。
碳原子的核外电子结构被形容为2s2 2p2,这表示它有两个2s框架电子和两个2p轨道电子。
2s框架电子排布在它的第一层,而2p轨道电子排布在它的第二层。
2、激发态电子排布:
在碳原子激发态下,其电子排布将发生变化。
一旦激发,两个2s框架电子被激发到更高能量的2p轨道上。
这样,激发后的碳原子会变成
4s0 4p,也就是说,激发后会有4个2p轨道电子。
其中,有两个电子是原电子,另外两个电子则是新出现的激发态电子。
3、电子分布:
在此激发态下,电子由远到近排列,由2s轨道开始,再到2p轨道,后来2p轨道再次被激发,激发的电子由3d轨道占位,它们与2p轨道电子无任何分离,交替环绕着核心。
因此,在激发态电子排布中,每个轨道中的电子数为4个。
4、各电子的分布:
排布在2s轨道中的电子有两个,它们是原始结构中的电子,被称为核
心电子。
排布在2p轨道中的电子也有两个,但这两个电子来自于激发状态,称为激发电子。
排布在3d轨道中的电子也有两个,它们也是来自于激发态,称为非核心激发电子。
总之,碳原子的激发态电子排布式为4s0 4p2 3d2,即,每个轨道中的电子数共计4个。
原子核外电子排布

14
7p
能量
6d 7s 6p 5d 6s 5p 5s 4p 4s 3s 2s 1s 3p 2p 7个能级组 个能级组 每个 代表一个原子轨道
15
5f
4f 4d
3d
电 子 在 原 子 轨 道 中 的 排 布 顺 序
16
(2) 电子在原子轨道中的排布顺序 电子排布式: 电子排布式: 原子: 原子 17Cl原子:1s
26
课堂练习
5、写出下列原子的电子排布式 、
13Al 15p 16S
1s22s22p63s23p1 1s22s22p63s23p3 1s22s22p63s23p4
27
3. 洪德 (Hund) 规则
的轨道表示式: 的轨道表示式 6C的轨道表示式: ① ② ③ 1s 2s 2p
28
3. 洪德 (Friedrich Hund) 规则
怎样判断原子轨道能量的高低呢? 怎样判断原子轨道能量的高低呢?
10
(1) 原子轨道的能量主要是由电子层 和电子亚层决定的
1 2
3 4 5 6 7
K L M N O P Q
电子层数越大, 原子轨道能量越高. 例如: 电子层数越大, 原子轨道能量越高. 例如: E1s < E2s < E3s < E4s < E5s < E6s < E7s E2p < E3p < E4p < E5p < E6p E3d< E4d < E5d
原子核外电子的排布
1
电子的运动状态
电子质量小; 电子质量小; 运动空间小; 运动空间小; 运动速度快
1. 电子层 1 K 2 L 3 M 4 N 5 O 6 P 7 Q
原子结构 核外电子排布(结合物质结构)

练习
1. 下列关于核外电子运动状态描述,不正确是: A、核外电子绕核作高速的圆周运动
B、核外电子的运动与行星运动相似
AB
C、现代科技也无法同时测准核外电子的位置和速度 D、核外电子的质量很小,运动速度很快,电子出现 的几率跟区域位置有关
2、原子核外电子的运动特征
电子层 原子轨道 轨道的伸展方向
电子自旋
(1)电子分层排布的依据是什么? (2)在多电子原子中,每一层上的电子能量一样吗? 运动区域的形状一样吗? (3)为什么每个电子层所能容纳的电子数最多为2n2(n为电子层数)? (4) 为什么最外层电子数不超过8个(K为最外层时不超过2个)?
同一电子层的电子能量不一定相同, 处在同一电子层的原子核外电子, 也可以在不同类型的原子轨道上运动
。
几个相对原子质量的计算
Ⅰ.核素的相对原子质量=
一个核素的质量
一个12C的质量×
1 12
Ⅱ.核素的近似相对原子质量(核素的质量数) Ⅲ.元素的相对原子质量
=核素A的相对原子质量×原子百分比a%+核素B的相对原子 质量×原子百分比b% + ……
Ⅳ.元素的近似相对原子质量
=核素A的质量数×原子百分比a%+核素B的质量数×原子 百分比b% + ……
平均
平均 35.485
35Cl核素的相对原子质量
试回答上述各数值的意义: 1. 34.969是表示
。 。 。 。
2 .35.453是表示 氯元素的相对原子质量 3.35是表示 4. 35.485是表示 5. 24.23 %是表示
35Cl的质量数
氯元素的近似相对原子质量
37Cl在自然界中所占的原子百分数
枣糕式模型 葡萄干面包模型
原子结构模型电子排布

03
副族元素原子的价电子数等于 族序数加1。
04 原子结构模型的意义与影 响
对化学键的影响
共价键
01
电子的排布决定了原子间形成共价键的性质,共价键的形成与
电子云的交叠有关。
离子键
02
电子的排布也影响离子键的形成,当电子完全转移时,形成离
子键。
金属键
03
在金属晶体中,电子的流动性决定了金属键的性质,这种流动
量最低原理和泡利原理。
主族元素原子的次外层电子 数不超过18个,次外层电子
数等于族序数加2。
主族元素原子的最外层电子数 等于价电子数,价电子数等于
族序数。
副族元素的电子排布
01
副族元素原子的最外层电子数 不超过2个,次外层电子数不 超过18个。
02
副族元素原子的电子填充顺序 为(n-2)f、(n-1)d、ns等能级 ,遵循能量最低原理和泡利原 理。
原子核位于原子的中心, 由质子和中子组成,集中 了原子的绝大部分质量。
电子
电子围绕原子核运动, 其数量与元素的化学性
质密切相关。
能级
原子内部电子运动的能 量高低不同,这些不同 的能量状态称为能级。
电子云
电子在原子内以一定的 概率分布,这种概率分
布区域称为电子云。
02 电子排布规则
泡利不相容原理
泡利不相容原理是原子结构模型中的基本原 理之一,它指出在任何一个原子中不可能存 在两个或更多的电子具有完全相同的量子状 态。
量子力学模型
量子力学模型是描述微观粒子运 动规律的理论框架,它解决了经
典力学无法解释的微观现象。
量子力学模型中,电子在原子中 的运动状态是由波函数描述的, 而电子排布则由电子云密度分布
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人类对原子结构的认识
核外电子的分层排布
1.在含有多个电子的原子里,由于电子 的能量不同,电子是分层运动的。 2.核外电子的分层运动,又叫核外电子的 分层排布。
3.能量较低的电子,在离核较近的区域运 动;能量较高的电子,在离核较远的区 域运动。
氢原子核外电子排布示意图
+
e
氦原子核外电子排布示意图
原 子 核 最 外 层 电 子 数
+11
2
8
1
电子层 次外层电子数
课堂练习一
某原子的原子结构示意图为+12 2 8 2 该原子的核电荷数为 ,核外有
个电子层,最外层有
个电子。
几种原子的核外电子排布请写 出He Ne Ar H O Mg元素原子 的结构示意图
+2
He Ne
+10
+18
Ar
+1
+8
+12
1.各电子层最多容纳的电子数为2n
2
2.最外层电子数最多为8(第一层为最外层时不 能超2个) 3.次外层电子数不得超过18
4.倒数第三层电子数不得超过 32
5.核外电子总是先排布在能量较低的电子层,然 后由里向外,依次排布在能量逐步升高的电子层
原子结构示意图----表示原子的核外电子排布
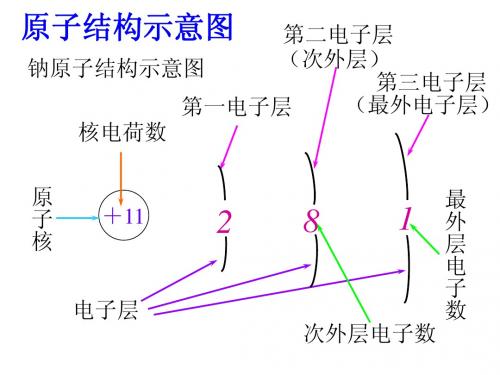
第二电子层 钠原子结构示意图 (次外层) 第三电子层 (最外电子层) 第一电子层 核电荷数
α粒子的散射实验
卢瑟福的结论:
原子内大部分是空的, 所以大多数α粒子得以 穿过金箔。 原子所有的正电荷和 几乎全部质量集中在 一个很小的区域,即 原子核。
实验结果:
1、绝大多数α粒子穿过金箔后仍沿原来的方向前进。 2、少数α粒子发生了较大角度的偏转。 3、极少数α粒子偏转角度超过900,有的甚至被弹回, 偏角几乎达1800。
3.根据下列叙述,写出元素名称并画出原子结构示意图。
(1)A元素原子核外M层电子数是L层电子数的1/2: ________ (2)B元素原子的最外层电子数是次外层电子数的
1.5倍:___ __ (3)C元素的次外层电子数是最外层电子数的1/4: ____________.
答案:(1) 硅 2 8 4 (2) 硼 2 3 (3) 氖 2 8
4.元素化合价与得失电子数目的关系
①金属元素一般为正化合价,失去电子的数目即为 化合价的数值
如Na、K失去最外层1个电子均为+1价,Mg、 Ca失去最外层2个电子均为+2价,Al失去最外层3个 电子均为+3价。 ②非金属元素既可以为正化合价也可以为负化合价, 活泼非金属元素的最低负化合价的数值即为得到电子 的数目,活泼非金属元素的高正化合价?
A.
B.
C.
D.
2.核外电子分层排布的主要原因是( A )
A.电子的能量不同
C.电子的数量不同
B.电子的大小不同
D.电子的质量不同
课堂训练:用下面的结构示意图的字母填空:
A (1)属于金属原子的是_______________; B (2)属于非金属原子的是_____________; C (3)属于离子结构示意图的是_________; C (4)具有稳定结构的是_______________ 。
原子结构模型探究历程
德布罗意——电子的波粒二象性
德布罗意 法国物理学家 Louis Victor de Broglie,1892~1987
原子结构模型探究历程
海森伯量子力学模型
1926年海森伯(玻尔的学生)等提出了 原子的量子力学模型。即用量子力学方法 描述核外电子的运动—电子云模型
德国物理学家 海森伯
原子结构模型探究历程
19世纪初道尔顿实心球原子结构模型
理论内容?
原子是不可再分 的实心小球
存在问题:不能解释电子存在
原子结构模型探究历程
1904年提出了原子结构的“葡萄干面包式”模 型 汤姆生阴极射线实验
英国物理学家 汤姆生 J.J.Thomson,1856~1940 原子是一个平均分布着正电荷的阳极球,其中均匀 镶嵌着许多电子,中和了电荷,从而形成了中性原子。
氪 氙
Ne Ar
Kr Xe
2 2
2 2
8 8
8 8
8 8
18 18 8 18 8
8
8 8
86
氡
Rn
2
2
8
8
18
18
32
32
18
?
8
?
8
各层最多电子 数
电子层 电子层符号 离核距离 电子的能量
1 K 近 低
2 L
3 4 5 M N …… 远 高
18 32 2n2
最多能容纳的电子数 2
8
核外电子的排布规律:
人类对原子结构的认识
一尺之捶,日取其半,万世不竭
——《庄子· 天下篇》
2
感觉上,存在的是 By convention there is color, 缤纷的色彩, By convention sweetness, 浓郁的芬芳, By convention bitterness, 深深的苦痛, But in reality there are 但实际上,存在的 atoms and space. ——德谟克利特 ——Democritus 是原子(不可分割的意思)和空间。
课堂检测:
1、以下是一些科学家为探索原子结构所作出 的重大贡献,请你以连线表示其对应关系。 ①道尔顿 a、提出原子由原子核和电子 构成 ②汤姆生 b、发现原子中存在电子 ③卢瑟福 c、提出原子核外电子在一系 列稳定的轨道上运动 ④玻 尔 d、提出原子学说
课堂练习
1.已知几种元素的原子核外电子排布如下,其中 能够得到电子的原子是( B )
Werner Heisenberg ,1901~来自976原子结构模型探究历程
1926年薛定谔提出了现代原子结构模型 “电子云”模型
奥地利物理学家 薛定谔 E.Schrodinger, 1887~1961
原子结构模型的演变过程给我们的启迪
• 人类对原子结构认识的逐渐深入,都是建立在 实验研究基础上的,实验是揭示原子结构的重 要手段。 • 汤姆生、卢瑟福、玻尔、海森伯四代师生都是 诺贝尔科学奖获得者,他们勇于怀疑科学上的 “定论”,不迷信权威,向自己的恩师挑战, 为科学的发展作出了重要贡献。在他们的身上 闪烁着科学探索精神的光辉!
如: F 、 Cl 易得到 1 个电子,最低化合价均为 -1 价; O、S易得到2个电子,最低化合价均为-2价。 元素化合价跟原子结构中的最外层电子数目关系非常密切
元素的主要化合价与原子的最外层电子数的关系: 1、活泼金属元素的化合价=原子最外层电子数 2、活泼非金属元素的最低负化合价=最外层电子数-8 3、活泼非金属元素的最高正化合价=最外层电子数 非金属元素(H除外): 最高正化合价+ 最低负化合价 = 8 F和O元素一般没有正化合价
e
2 2+
e-
核外电子分层排布:
1、电子按能量高低在核外分层排 布。
1 2 3 4 5 6 7
K
L
M
N
O
P
Q
由内到外,能量逐渐升高
稀有气体元素原子电子层排布:
核 电 荷 数 2 元 素 名 称 氦 元 素 符 号 He 各电子层的电子数 最外层 电子数 2
K
2
L
M
N
O
P
10 18
36 54
氖 氩
H
O
Mg
课本P29:交流和讨论
+8
O 26 得到2个电子, 化合价显-2价
+8
O2-
28
+12
Mg
28 2
失去2个电子, 化合价显+2价
+12 2 8
Mg2+
最外层电子数与元素的分类:
最外层电子数 化学性质 稀有气 8个(He有2个) 体元素 金属元 一般少 素 于4个 非金属 一般多于 元素 或等于4个 结构的稳 定性 稳定 不稳定 不稳定
不易得 失电子 容易失去最 外层电子
容易得 到电子
三、原子结构与性质的关系( P30 )
1.金属元素原子最外层一般有1~3电子,在反应中 易失去电子,形成与稀有气体元素原子相同的 电子层排布的阳离子(稳定结构)。 2.非金属元素原子最外层一般超过4个电子,在反 应中易得到电子,形成与稀有气体元素原子相 同的电子层排布的阴离子(稳定结构)。 3.原子核在反应中不发生变化,原子的最外层电子 数可能发生变化,元素的化学性质取决于原子的 最外层电子。 一般认为,最外层有8个电子(最外层是第一层 时有2个电子)的结构,是一种稳定结构。
原子结构模型探究历程
1911年卢瑟福提出了带核的原子结构模型
原子由原子核和电子构成, 电子在核周围做高速运动,就 像行星围绕太阳运转一样。
英国物理学家 卢瑟福 E.Rutherford,1871~1937
原子结构模型探究历程
1913年玻尔提出了原子核外电子“分层排 布的”模型
氢原子光谱实验
丹麦物理学家 玻尔 N.Bohr, 1885~1962
