噬菌体展示载体的构建
噬菌体展示原理和实践:构架篇(上)

噬菌体展⽰原理和实践:构架篇(上)前⾔前⽂概述了噬菌体展⽰在⽣物技术新药研发领域⼴泛的实践应⽤和价值,此⽂续接前⽂聊聊如何去搭建⼀个噬菌体展⽰平台以满⾜新药研发多⽅⾯应⽤,也就是平台构架的问题。
本⽂以上下两部分简略介绍噬菌体展⽰的平台构建包括⽂库的构建,噬菌体⽂库的扩增展⽰,淘选⽅法和筛选⽅法四个⽅⾯,包含信息原理要素,材料要素和过程要素。
⼀个运转流畅的噬菌体展⽰平台应该是以噬菌体展⽰技术各个⽅⾯的原理地正确理解为指导进⾏实践操作的结果,从⽂库构建到拿到确定有功能的特定的抗体可变区基因为⽌,每个环节都应该有其特定的⽬标,检测⽅法和质量评判标准。
概述噬菌体展⽰平台实践活动包括⽂库的构建,噬菌体的扩增展⽰,淘选⽅法和筛选⽅法四个⽅⾯,这四个⽅⾯是相互关联的,不建议在平台尚未运转流畅的状态下进⾏信息相对隔离的分⼯合作,这样会不利于问题的排查。
其中噬菌体的扩增和展⽰在其他三个⽅⾯均有涉及,此⽂相对于其他⽂献资料将其单列为⼀个⽅⾯的原因是强调其重要性。
⽂库的构建,淘选和筛选可简单的描述为以下三段话⽂库的构建将体外合成或者⼈/动物的多样化的抗体基因整合到噬菌粒载体或者噬菌体基因组中,使得该基因能够在噬菌体上表达,表达的抗体⽚段能够和外被蛋⽩融合得以锚定在噬菌体的表⾯,形成展⽰多样性抗体蛋⽩⽚段的⽂库。
淘选利⽤靶点抗原或者细胞组织和噬菌体⽂库作⽤,淘选出能够和靶点特异性结合或者功能的展⽰噬菌体,洗脱下来扩增,经过两到五轮淘选,富集和扩增阳性噬菌体⽂库。
筛选对阳性噬菌体⽂库进⾏单克隆挑选,通过⾼通量的测序和功能学实验(ELISA)确定单⼀的能够和靶点抗原蛋⽩结合的抗体⽚段的蛋⽩序列和基因序列。
⽂库的构建和噬菌体的扩增展⽰原理现在普遍应⽤的噬菌体展⽰抗体⽚段的体系称之为3+3体系,3为噬菌体的p3外被蛋⽩,3+3代表着p3外被蛋⽩有两个来源,噬菌粒(phagemid)和辅助噬菌体(Helper Phage)。
噬菌粒是⼀种⽐较⼩的质粒载体,在⼤肠杆菌感受态中有较⾼的转化效率,并且能够在⼤肠杆菌中扩增。
第八讲单链噬菌体载体及噬菌粒载体

第八讲单链噬菌体载体及噬菌粒载体吴乃虎中国科学院遗传与发育生物学研究所第八讲单链噬菌体载体及噬菌粒载体一、单链噬菌体的一般生物学1.单链噬菌体的优越性2.M13噬菌体的生物学特性二、M13克隆体系1.M13克隆体系2.M13克隆体系-半乳糖苷酶的显色反应原理3.M13载体系列的发展4.M13载体系列的优点三、噬菌体展示载体1.噬菌体展示载体的构建原理2.噬菌体展示载体3.噬菌体表面展示文库4.应用噬菌体展示载体分离有关蛋白质的实例四、噬菌粒载体1.M13噬菌体载体克隆的若干难点2.噬菌粒3.若干常用的噬菌粒载体4.pBluescript噬菌粒载体5.pUC118和pUC119噬菌粒载体第八讲单链噬菌体载体一、单链噬菌体一般生物学大肠杆菌丝状单链DNA噬菌体有M13噬菌体、f1噬菌体及fd 噬菌体,它们均含有分子量约为6400个核苷酸的单链闭环DNA分子。
1.单链DNA phage的优越性A.具有双链的复制型DNA(RF DNA),可如质粒质粒一样进行遗传操作;RF DNA:Replication Form DNA。
B.RF DNA和ssDNA均可感染感受态的寄主细胞——形成phaque或colony。
C.不受包装的限制。
因为单链DNA phage的大小是受其DNA 多寡制约的。
D.可容易地测出外源DNA的插入取向。
E.可产生大量的含有外源DNA的单链DNA分子,这种单链DNA分子有如下用途(作为模板):*1用作双脱氧链终止法进行DNA测序*2制备单链的放射性标记的杂交用DNA探针*3利用寡核苷酸进行定点突变2.M13 phage的生物学特性A.M13 phage同f1 phage亲缘关系十分密切,例如:①基因组组织形式相同;②病毒颗粒大小、形状相近;③DNA同源性高达98%以上。
B.在M13 phage颗粒中只有(+)链DNA,感染具F性须的大肠杆菌菌株,因此M13噬菌体是雄性E.coli特有的;M13噬菌体的(+)链DNA,又称为感染性单链DNA。
噬菌体载体的应用原理

噬菌体载体的应用原理1. 背景介绍噬菌体(Phage)作为一类侵染细菌的病毒,不仅是微生物学研究的重要对象,还被广泛应用于分子生物学研究和基因工程领域。
噬菌体载体(Phage vector)则是指将噬菌体进行基因改造,使其能够携带外源基因,并在细菌中进行复制和表达的工具。
噬菌体载体具有高度稳定性、高效载带能力以及可控的基因表达特点,因此在基因工程、基因治疗等领域得到了广泛应用。
2. 噬菌体载体的构建噬菌体载体的构建主要包括以下几个步骤:2.1 基因插入首先,需要选择合适的噬菌体作为载体,并在其基因组中选择一个合适的位点进行基因插入。
一般而言,选择的位点应该具有低于正常表达基因的水平,以避免影响载体的稳定性和复制效率。
将目标基因构建为重组DNA片段,并将其连接到载体DNA的适当位点上,通常使用酶切和连接技术。
2.2 载体包装插入目标基因之后,需要将噬菌体载体进行包装,以使其能够感染目标细菌并进行复制。
噬菌体包装一般通过混合目标基因与噬菌体DNA前体,然后加入相应的包装酶,通过体外反应来完成。
这样一来,就可以得到包含目标基因的噬菌体颗粒。
3. 噬菌体载体的应用噬菌体载体的应用可分为以下几个方面:3.1 基因工程研究噬菌体载体在基因工程研究中被广泛用于基因克隆、基因转染和基因表达等方面。
通过将目标基因插入噬菌体载体中,并利用噬菌体的感染和复制能力,可以高效地将外源基因导入到细菌中,并进行大规模扩增和表达。
此外,噬菌体载体还可以用于构建和筛选基因文库,以便进行基因功能的研究和探索。
3.2 基因治疗噬菌体载体作为基因传递工具,被广泛应用于基因治疗领域。
通过将治疗相关基因插入噬菌体载体中,可以使其能够有效地传递到患者的细胞中,并在细胞内进行表达,以达到治疗的目的。
噬菌体载体具有较高的基因载载能力和感染效率,这使得其成为一种理想的基因传递工具,对于遗传性疾病、肿瘤等疾病的治疗具有重要意义。
3.3 基因筛选与定向进化噬菌体载体被广泛用于基因筛选和定向进化等研究领域。
简述噬菌体展示的基本原理和方法

简述噬菌体展示的基本原理和方法噬菌体展示是一种利用噬菌体(即细菌病毒)作为展示载体来展示外源蛋白的方法。
噬菌体是一种寄生在细菌上并以细菌为宿主的病毒,它具有高效的感染能力和高度选择性的感染靶细菌的特性,因此被广泛应用于基因工程、蛋白质工程和生物技术研究领域。
噬菌体展示的基本原理是将目标蛋白的编码基因与噬菌体的外壳蛋白基因相连接,构建成重组噬菌体基因。
在噬菌体感染细菌的过程中,重组噬菌体基因会被细菌细胞内的转录和翻译系统识别并表达出来,从而使目标蛋白与噬菌体的外壳蛋白相连,展示在噬菌体的表面。
噬菌体展示的方法主要有两种:一种是基于基因III的展示系统,另一种是基于基因VIII的展示系统。
基因III是噬菌体表面的主要外壳蛋白,通过将目标蛋白编码基因与基因III基因相连接,并在细菌细胞内进行表达,可以使目标蛋白与噬菌体的外壳蛋白连接在一起。
基因VIII则是噬菌体的次要外壳蛋白,通过将目标蛋白编码基因与基因VIII基因相连接,并在细菌细胞内进行表达,可以使目标蛋白展示在噬菌体的表面。
噬菌体展示的方法在实验室中可以通过以下步骤来进行:首先,将目标蛋白的编码基因与噬菌体的外壳蛋白基因进行连接,构建成重组噬菌体基因;然后,将重组噬菌体基因导入到感染性大肠杆菌等宿主细菌中;接着,通过培养宿主细菌,使重组噬菌体基因在细菌细胞内进行转录和翻译,从而使目标蛋白与噬菌体的外壳蛋白连接在一起;最后,通过离心分离和纯化的方法,获得展示目标蛋白的重组噬菌体。
噬菌体展示的优势在于其高效、高通量和高度选择性的表达特点。
由于噬菌体具有高效的感染能力和短周期的复制时间,可以在短时间内大量表达目标蛋白,并且可以通过筛选和分离的方法选择性地表达和纯化感兴趣的蛋白。
此外,噬菌体展示还可以实现对目标蛋白的定向进化和筛选,使其具有更好的性能和活性。
噬菌体展示在科学研究和应用领域具有广泛的应用价值。
在药物研发领域,噬菌体展示可以用于筛选和鉴定潜在药物靶点,并可以通过定向进化的方法优化药物分子的亲和性和特异性。
噬菌体展示技术的原理和方法

噬菌体展示技术的原理和方法噬菌体展示技术是一种利用噬菌体表面展示特定肽段或蛋白的技术。
这项技术自20世纪80年代问世以来,已在许多领域显示出广阔的应用前景,包括药物研发、疫苗设计、蛋白质相互作用研究等。
本文将详细介绍噬菌体展示技术的原理和方法,并探讨其优缺点和发展趋势。
噬菌体展示技术利用的是噬菌体的特性,噬菌体是一种病毒,专门感染细菌等微生物。
它们由蛋白质外壳和内部遗传物质组成,其中蛋白质外壳又由多个蛋白亚基组成。
噬菌体展示技术利用噬菌体表面展示特定的肽段或蛋白,这些肽段或蛋白可以来自天然蛋白质,也可以是人工合成的。
展示在噬菌体表面的这些肽段或蛋白能够与特异性受体结合,从而实现表面展示的功能。
噬菌体展示技术的关键之一是选择合适的展示载体。
载体通常是一种丝状噬菌体,其基因组可以容纳较小的外源基因片段。
常用的载体包括M filamentous phage等。
这些载体具有一些共同的特性,如对外源蛋白质的容纳能力较强,能在体内和体外环境中稳定存在等。
在噬菌体展示技术中,需要筛选出能感染特定细菌的噬菌体。
这些噬菌体可以是自生的,也可以是通过基因工程改造得到的。
在筛选过程中,可以利用不同细菌的特性,如受体类型、细胞壁结构等,来选择合适的噬菌体。
还需要考虑噬菌体的毒性、繁殖能力等因素。
在噬菌体展示过程中,需要反复感染以积累足够数量的展示肽段或蛋白。
这个过程中,通常需要使用超滤或凝胶过滤等手段对噬菌体进行纯化,以确保得到的展示肽段或蛋白的纯度和浓度。
反复感染的过程不仅可以增加展示肽段或蛋白的数量,还能帮助排除展示过程中可能产生的突变。
克隆选择是噬菌体展示技术的另一个关键步骤。
这个过程中,通过将展示肽段或蛋白与特定配体结合,筛选出能够与配体结合的克隆。
这些克隆可以进一步扩增和纯化,从而获得高亲和力和高特异性的克隆。
噬菌体展示技术的优点在于其能够将蛋白质或多肽特异性与噬菌体的生物学特性相结合,从而实现表面展示的功能。
3-基因工程载体的构建
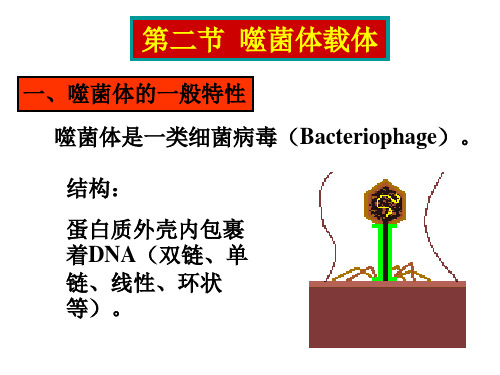
三、单链噬菌体载体
单链环状DNA的丝状大肠杆菌噬菌体: M13、f1、fd 噬菌体
M13 噬菌体
1. 单链DNA噬菌体的特点 (1)+DNA。(ssDNA) (2)复制型(RF)是双链环状DNA。 (3)RF DNA和ssDNA都能转染感受态 大肠杆菌。并产生噬菌斑。
(4)不存在包装限制。
(5)可产生大量的含有外源DNA插入片 段的单链分子,便于作探针或测序。
pUC118/p pUC18/ UC119 pUC19 pBS pUC
M13
M13 f1
M13变异 XS127, XS101 株 M13K07 MV1184
M13K07 XL1-Blue
辅助噬菌体用来复制和包装噬菌粒载体。
(3)pUC118/pUC119
① 构成
1)M13的基因间隔区(IG) 带有M13复制起点。 2)pUC18/pUC19质粒载体: 质粒复制起点 Ampr lacZ’ MCS
包装
辅助M13
外壳蛋白
③ 噬菌粒载体的包装
1)辅助噬菌体:
如M13K07等。
自身的复制起点发生了突变,复制效率 低下,但感染细菌后能表达出外壳蛋白 和复制蛋白,帮助噬菌粒载体复制。 2)包装: 辅助噬菌体 外壳蛋白和 复制蛋白 噬菌体
噬菌粒载体
ssDNA
(4)pBluescript 噬菌粒载体(pBS) Stratagene公司发展的一类噬菌粒载体。 ① 组成 由pUC质粒载体、f1噬菌体的复制起点和 T3、T7噬菌体的启动子组成。 ② 特点 1)定向体外转录
M13
(2)噬菌体展示载体的构建
把外源DNA片段插入基因Ⅲ的序列前端, 并保持两者的阅读框正确,表达出融合 蛋白。 启动子 外源DNA M13基因Ⅲ
噬菌体展示技术的原理及应用

噬菌体展示技术的原理及应用引言:噬菌体展示技术是一种基因工程手段,在生物医学领域得到广泛应用。
它通过利用噬菌体作为载体,将目标蛋白质展示在噬菌体表面,从而实现了某种特定蛋白的高效筛选和研究。
本文将从噬菌体展示技术的原理及应用两个方面进行详细介绍。
第一部分:噬菌体展示技术的原理噬菌体展示技术的核心在于将目标蛋白质与噬菌体连接并展示在噬菌体表面。
这一步骤通常通过融合目标蛋白和噬菌体外壳蛋白的方式实现。
噬菌体外壳蛋白通常包括毒素结合蛋白(pIII)和胶原结合蛋白(pVIII)两种类型。
首先,将目标蛋白的编码序列与噬菌体外壳蛋白的编码序列相连,形成融合蛋白序列。
然后,将融合蛋白序列插入噬菌体基因组中,使其能够在噬菌体感染细胞后被表达。
最后,经过一系列筛选步骤,选择能够正确展示目标蛋白的噬菌体克隆,得到可以继续研究的目标蛋白样品。
噬菌体展示技术的原理其实比较简单,但是其应用范围非常广泛。
接下来,我们将针对几个典型的应用场景进行分析。
第二部分:噬菌体展示技术在药物研发中的应用噬菌体展示技术在药物研发中具有很大的潜力。
通过这一技术,可以筛选出具有特定功能的抗体或蛋白,用于研发新药。
例如,通过对癌细胞表面的特定蛋白进行展示,可以筛选出能够靶向癌细胞的药物。
这种药物在治疗癌症方面具有很大的潜力。
此外,噬菌体展示技术还可以用于筛选其他类型的药物靶点。
例如,许多感染性疾病的病原体表面都存在特定的蛋白结构。
通过将这些蛋白展示在噬菌体表面,可以通过筛选获得能够靶向这些病原体的药物靶点,为抗感染药物的研发提供重要的依据。
第三部分:噬菌体展示技术在生物工程中的应用除了在药物研发领域,噬菌体展示技术还在生物工程领域发挥着重要的作用。
在生物工程中,噬菌体展示技术可以用于筛选和改造特定酶。
通过将目标酶展示在噬菌体表面,可以利用大规模筛选技术快速获得具有特定催化性能的酶。
此外,噬菌体展示技术还可以用于疫苗研发和抗体工程。
通过将疫苗候选抗原或抗体展示在噬菌体表面,可以大大提高其免疫原性和特异性。
噬菌体展示实验步骤及总结

噬菌体展示实验步骤及总结噬菌体展示技术(Phage Display)是一种利用噬菌体(phage)作为载体表达、展示外源蛋白质或肽段的技术。
该技术可以通过体外筛选方式寻找与特定生物分子相互作用的肽段或蛋白质,并在医学、农业、环境科学等多个领域应用广泛。
本文将介绍噬菌体展示实验的步骤及总结。
一、噬菌体展示实验步骤1.分离噬菌体基因组首先需要从所需噬菌体中提取其基因组DNA,进行适当的酶切、纯化、修饰和扩增等操作,以获得高质量的DNA样品。
2.插入外源DNA将需要展示的外源肽段或蛋白质基因克隆到噬菌体基因组中的特定区域(通常是其Capsid蛋白的的N末端),使其与噬菌体基因组融合。
插入操作可采用PCR扩增、克隆或基因合成等方法进行。
3.包装噬菌体将重组噬菌体基因组与一定的病毒包装反应液混合,经过一定的反应时间,使其封装成噬菌体颗粒。
包装操作可在细菌宿主中进行,也可采用体外装配法,将噬菌体基因组与其他组件(例如,在非细菌宿主中回收的Capsid蛋白)进行反应,实现噬菌体的包装。
4.筛选目标配体将噬菌体颗粒通过筛选池,如固体支持物、细胞表面或溶液相应用目标体分别进行生物学或化学实验等。
通过筛选,得到与目标体有特异性、较高亲合力的噬菌体颗粒。
随后将噬菌体提取、扩增等操作,得到一系列具体的孤儿噬菌体(orphan phage)或配体噬菌体。
5.注意事项在实验过程中需注意的一些问题:(1)噬菌体的主要结构是头部和尾部,根据实验需要可对其进行不同的修饰(例如添加标签、调整展示方向等),以增加其展示效率和特异性等。
(2)外源蛋白的表达量、保持稳定性通常受到噬菌体载体、连接方式、插入位置、转化水平等因素的影响,实验中需对其进行合理设计。
(3)噬菌体筛选应选择样品的适当浓度、筛选反应时间等,以保证准确、高效地获得目标配体。
二、噬菌体展示实验总结噬菌体展示技术是一种非常有前景的生物技术,逐渐成为体外筛选的重要手段之一。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
噬菌体展示载体的构建中国药科大学JournalofChinaPharmaceuticalUniversity2002,33(6):529,532529 噬菌体展示载体的构建吴国球,沈子龙.(中国药科大学生物技术中心,南京210009)摘要目的构建适宜噬菌体展示的载体系统.方法利用pCOMB3的LacZ强启动子,Pelb引导序列,包膜蛋白?基因,用NHeI—XbaI双酶切,切除一个克隆位点;同时设计一对引物,用PET一28(a)作模板扩增550bp片段,插入XhoI—SpcI位点之间,扩增质粒后用限制性内切酶,PCR,DNA测序等方法作鉴定.结果切除了272bpNHeI—XbaI片段,插入片段后酶切鉴定显示:XhoI,SpcI单酶切,XbaI,NheI无酶切;所构质粒用Xhol+SpcI双酶切及PCR扩增均可见550bp片段;测序结果正确.结论成功构建了一种高拷贝,稳定,多用途,易于操作的噬菌体展示载体.关键词噬菌体展示;构建;载体中图分类号:Q78文献标识码:A文章编号:1000—5048(2002)06—0529—04 噬菌体展示文库在新药开发领域,尤其在全人源化单克隆抗体方面为扩展生物多样性提供了强大的研究工具[】].它能容纳超过上百万个单个分子的克隆,因此又称全套基因库,可以通过受体与配体,抗原与抗体相结合的特性,从中筛选出目的基因克隆,使目的基因能在很短的时间内(数周)高效克隆,筛选和表达[2].文库的大小是决定生物多样性的关键.因此构建一种高拷贝,稳定,多用途,易于操作的载体具有十分重要的意义.l材料和方法1.1材料pCOMBs质粒,XL1一blue菌株(东南大学基础医学院张建琼博士惠赠),PET一28(a)质粒,JM109菌株(本实验室保存),限制性内切酶NheI,XbaI,SacI,SpeI,XhoI(Mm),T4连接酶,琼脂糖,EDTA, DNA回收试剂盒等(上海生工),LB,SOC按常规方法配制,PCR仪(AmpGene4800),电泳仪(北京六一仪器厂).引物:P1:5'-GGGCCAACTCTAGTATGGCCC一3' 下划线为XhoI酶切位点P2:5'-GG垒!垒!CTAACCAGCAC'ITCAGTGGGAA一3' 下划线为SpcI酶切位点Ck 连宝生物工程公司合成) 1.2方法收稿日期2002—04—17通讯作者Tel:025—3271389 1.2.1pCOMB3的扩增含pCOMB3的XL1一blue 接种于四环素(50mg/L),氨苄青(100mg/L)双抗平板,37?过夜培养,挑单个菌落,接种l0ml的LB 液体增菌培养液,37~C6h,摇至ODeoo为0.36,按常规方法抽提质粒:按每毫升菌液l00lI液(50mmol/LGlucose,25retool/LTris—HC1,l0retool/L EDTA),200l?液(0.24mmol/LNaOHl00l, 5SDSl001),l50l?液(3mmol/LK.Ac,2.5 mmol/LHAc)混匀,12000r/min5min,吸取上清液,等体积酚:氯仿抽提一次,上清液加两倍体积的无水乙醇,4?放置10min,12000r/min离心5min,弃上清,沉淀挥干后,加无菌水20l,一20.C保存备用.1.2.2片段切除及剩余片段的连接pCOMBsl0l, 加l0×buffer4l,去离子水34l,NheI,XbaI各1.0 l,37?酶切2h,回收片段,20l水溶.取5l加l0× ligationll,去离子水3.5l,T4连接酶0.5l,16?连接过夜.1.2.3感受态细胞制备及转化XL1一blue单菌落接种于100mlLB(含氨苄青100mg/L),37?摇至 OD600为0.4,8000r/min2min收集菌液,按每毫升菌液加0.5mol/LCaCI2lOOgd,冰上放置30min,8000r/min20min,弃上清,沉淀用相同浓度CaC1z悬浮菌液,lOOp1分装,加l0甘油,一70?保存.取连接液 5l,加入lOOpl感受态细胞,冰上放置30min,42?530中国药科大学33卷热激90s,加入预热SOClml,37?摇45min,涂布于四环素(50mg/L),氨苄青(100mg/L)双抗平板,同时设阴,阳性对照,37?过夜,随机挑选单菌落扩大培养,抽提质粒,分别用NheI,XbaI,SacI,SpeI,酶切检查,0.8琼脂糖l00v/50mA电泳40rain,EB染色,观察结果.阳性质粒命名为Pa.1.2.4插入片段的制备1.2.4.1插入片段的扩增PET一28(a)质粒抽提后,取ll加l0×buffer3l,P13~1(50pmo1),P23~1(50pmo1),Taq酶0.5l,dNTPll,加D2o至 30l,加一滴矿物油,94?变性5min 后执行94? 变性lmin,45?退火lmin,72?延伸lmin循环程序,25个循环后72?延伸10min,同时设阴,阳性对照.PCR产物用1.2琼脂糖电泳检查,切下 550bp条带.每l00mg琼脂糖加400lBinding buffer,50?放置2min,转移至离心柱,8000r/min lmin,弃废液后加Washsolution450ml,8000r/minlrain,弃废液,重复一次,12000r/min,开盖离心lmin,在柱中央加20lD2O,12000r/min2rain,一20?保存.1.2.4.2酶切取"1.2.3"酶切鉴定阳性质粒及550bpPCR回收片段各l01分别加l0×buffer2 l,D207l,SpeIll,37?酶切4h,65?20min灭活;补加10×buffer2.3l,XhoIll37?继续酶切4h,1.5琼脂糖电泳,按"1.2.4.1"方法回收相应片段.1.2.4.3连接及转化取回收片段各4l加T4liga sell,l0×T4ligationll,16C连接过夜,全量转化XL1一Blue感受态细胞,42?热激后涂布于氨苄,四环素双抗平板,37?过夜.挑单菌落接种于双抗LB,37.C6h,抽提质粒,1.5琼脂糖电泳检查. 1.2.5PCR及酶切位点检查取质粒ll,加引物Pl,P2各3l,Taq酶0.5l,dNTPll,l0×buffer2l, 补加DzO至20l,l滴矿物油,按"1.2.4.1"PCR程序25个循环,1.2琼脂糖电泳观察结果.取PCR 阳性质粒5l,加入l0×bufferll,D2O3l,SpeIll,37?酶切4h,65?20min灭活;补加l0×buffer 1.1l,XhoIll37?继续酶切4h,1.5琼脂糖电泳,EB染色,观察结果.阳性质粒命名为Pa. 1.2.6载体测序测序引物为5一TTACTCGCTGCCCAACCAG一3',引物距XhoI位点尚有20个碱基,采用ABIPRISM377DNA2结果1)第二个克隆位点的切除pCOMB3用NheI+XbaI双酶切,可见272bp条带,切除上述片段后,将剩余大片段回收自连后转化并抽提质粒,分别用NheI,XbaI,Spel,XhoI酶切检查,结果显示:Xbal,NheI无酶切,SpeI,hoI可见单酶切条带,酶切位点正确(图1).3800bp————一272bp————一I,2:Nhel,Xbalseparatelyanalysis;3,4:Spel,Xholseparatelyanalysis;5:Nhel+Xbalanalysis;6:pCOMB3;7:kphageDNA/Hind I+IKbDNAL~der.Fig1.Restrictionenzymeanalysisofplasmid 2)片段插入PET一28(a)作模板PCR扩增后,可见550bp条带,回收片段后与相同酶切的Pa载体连接,转化后筛选阳性质粒,1.5琼脂糖电泳条带出现在Pa之后.随机挑选l0个单菌落进行PCR检查,其中9个出现550bp条带,阳性率90(图2).SpeI+XhoI双酶切检查,可见550bp及3800bp条带(图3).Pa质粒送生工测序,结果与预期序列一致(测序结果略).1,2,4,6,7,8,9:PCRproduct;3:negativeresult;5]kbMa~erFig2.PCRanalysisoftransformants6期吴国球等:噬菌体展示载体的构建53l3800bp——一550bp一1:XphageDNA/HindI/EcoR1;2:PCRproduct;3:pCOMB3;4:pa~;5:Nhel+Xbalanalysisofpositiveplasmid(Pa+);6:PCRanalysisof positiveplasmid(Pa) Fig3.Restrictionenzymeanalysisofplasmid3讨论噬菌体表面呈现技术(Phagedisplagtechnology)使制备全人源化单可隆抗体成为可能.1989年Huse 等口首次用噬菌体建立了小鼠抗体片段的抗体文库,随后又有单链Fv(ScFv)E,Fab片段以及双功能抗体文库的报道.用于抗体表面呈现的噬菌体载体是体现这一技术的关键.目前使用的载体包括Lerner实验室以pBluescrip为背景构建了 pCBAK8,pCOMB3,pCOMB8,Chang,用PUC和PGC1 构建pTACP,Winter实验室以PUC119构建的 pCANTAB等载体,pCOMB3[是许多实验室广泛采用的载体,它拷贝数高(>200拷贝/细胞),容易分离,带有Ap抗性基因用于筛选,目的基因表达在? 基因上游,用于融合及呈现;含有LacZ强启动子, Pelb引导序列,包膜蛋白Ill基因.重链基因克隆位点XhoI—SpeI,轻链基因克隆位点Xball—SacI.但我们在使用过程中发现,克隆基因频繁发生缺失,其原因可能因为此载体含有两个克隆位点,分别用于克隆重链和轻链基因,每个位点含有LacZ启动子,核酶结合位点及Pelb前导序列.限制酶分析显示,缺失发生在两个克隆位点之间,此区域包含两个8lbp 的重复序列,即24—105bp和1037—1118bp之间,质粒在线性化变性后第一个克隆位点的重复序列与第2个克隆位点的重复序列发生退火,从而导制基因缺失.通过切除272bpNHeI—Xbal片段,即切除第 2个克隆位点及其81bp的重复序列,消除了相应的缺失.NheI(G.CTAGA)和XbaI(TCTAGA)是同尾酶,因此用双酶切除272bp片段后,剩余片段可通过T4连结酶自连.另外,在操作过程中,我们还发现由于Spel—XhoI之间仅相差40bp,因此在双酶切后,由于片段大小无法用普通琼脂糖电泳检查酶切是否完全,是单酶切还是双酶切,操作极为不便,因此插入550bp片段,可大大简化酶切消化,克隆及电泳分离等DNA操作步骤.由于切除了第2个克隆位点,因此构建的载体宜用于单链抗体的克隆与表达.本载体是丝状噬菌体的突变株,作为克隆载体,噬菌体在转染细胞后能够自我复制并翻译出目的蛋白,在用辅助噬菌体如VCSM13,M13K07共同感染后,噬菌体能自我组装,形成新的噬菌体.Ill基因是噬菌体的包膜蛋白基因,编码406个氨基酸,其C端(P198一$406)镶嵌在噬菌体外壳上,N端(1一P918)伸出噬菌体的表面特异性地吸附在雄性E.coli的性菌毛上,当用目的基因代替N端时,伸出部分带有目的蛋白,但失去了浸染雄性曰.coli的能力.因此只有用辅助噬菌体超感染提供野生型?基因分子,才能组装成具有另一轮浸染活力的噬菌体颗粒,不用辅助噬菌体,就成了与表达质粒完全相同的表达载体,因此称双相表达载体.参考文献[1]CourtneyBC,WilliamsKC,SchlagerJJ,eta/.Aphagedisplay vectorwithimprovedstability.applieabilityandeaseof manipulation[J].Gene,1995,185:139一l4O.[2]ScottJK.Discoveringpeptideligandsusingepitopelibraries[J].TrendsBioc~m8ci,1992,17:386—390.[3]HuseWD,SastryL,lversonSA,eta/.GenerationofalargecombinatoriallibraryoftheimmunoglobulinrepertoireinphagelambdaEJ'].Sconce,1989,246—275.[4]McCaffertyJ,GriffithsAD,WinterG,eta/.Phageantibodies:filamentousphagedisplayingantibodyvariabledomains[J].Nature,l990,348:552—554.[5]HoogenboomHR.Multi—subunitproteinsonthesurfaceoffilamentousphage:methodologiesfordisplayingantibody(Fab)heavyandlightchainsEJ].Nuc/e/cAck/sRes,1991,19:4133—4137.[63MeGuinnessBT.Phagediabodyrepertoiresforelectionoflarge numbersofbispecificantibodyfragments[J].Nat.Botec/md,1996,14:儿49一ll54.[7]CarlosF,BarbasI,AngrayK,eta/.Assemblyofcombinatorialantibodylibrariesonphagesurfaces:thegeneIsite[J].ProcNailAcadU8A,1991.88:7978—7982.532中国药科大学33卷ConstructionofVectorforPhageDisplayWUGuo-Qiu.SHENZi-LongB/otechno/ogyCenterofChinaPharmaceuticalUniversity,Nanjing210009,Chi naABSTRACTAIMToconstructethevectorforphagedisplay.METHODSByremovingaNheI-XbaIcloningsite,pCOMB3wasremainedtobealacZstrongpromoter,aPelBleadsequenceandac oatproteingene?.Inthemeanwhile,550bpfragmentwhichwasamplifiedbydesignedtwoprimersandusing templetofPET一28(a)wasinsertedintothesitesbetweenXholandSpelI.Thephagemidwasidentifiedbyth emethodsofrestrictiveenzymeanalysis,PCRandDNAsequencingaftermultiplied.RESULTSA272bpfragmentwas deletedbyNheI—XbaI;Restrictiveenzymeanalysisshowedthattheplasmidwascutbymeansofsinglesi teofeitherXhoIorSpeI;therewerenositesofXbaIorNheI;550bpfragmentwasamplifiedbyPCRusingtempletof constructedplasmid;DNAsequencewasinaccordancewiththeexpectedsequence.CONCLUSIONAvectorwith characteristicsofhighcopynumber,applicability,easeofmanipulationforphagedisplaywassuccessfull yconstruction.KEYWORDSConstruction;Vector;Phagedisplay; ?新成果?我国在医药生物技术领域取得系列重大成果在医药生物技术领域,我国已经步入了国际先进国家的行列,具备了一定的国际竞争能力.目前我国在以下领域取得了重大成果:一批基因工程药物和疫苗正在从实验室研究向产业化转化,基因工程制药产业已初具规模;人工血液代用品即将进入临床研究;体细胞克隆和遗传病的基因诊断技术达到国际先进水平;B型血友病,恶性肿瘤,梗塞性外周血管等6个基因治疗方案已进入了临床疗效研究;纳米技术开始应用于医药研究;肿瘤免疫治疗,抗血管治疗,组织工程,生物芯片和干细胞等技术上也取得了一系列突破和重要进展.中国已经开发成功了21种基因工程药物和疫苗,世界上销售额排名前l0位的基因工程药物和疫苗,中国已能生产8种.专家指出,虽然中国医药生物技术发展速度较快,取得一些喜人成就,但也存在着一些不容忽视的问题:中国生物制药企业研究与开发投入太少,使得研发能力很差;上下游技术脱节,成果转化率低等.专家们建议,应发挥社会各方面投资新药的积极性,多渠道增加医药生物技术投入,包括部门和地方政府资金,科技贷款,股票市场,海外基金等.同时还应积极培育风险资本市场,鼓励建立生物技术风险投资基金.(中创网)。
