硝酸钾的制备与提纯实验报告
硝酸钾的制备实验报告

硝酸钾的制备实验报告硝酸钾的制备实验报告引言:硝酸钾是一种常见的无机化合物,广泛应用于肥料、火药、玻璃等工业领域。
本实验旨在通过化学反应制备硝酸钾,并通过实验结果验证反应的有效性和产物的纯度。
实验原理:硝酸钾的制备主要依靠硝酸和钾盐的反应生成。
在本实验中,我们选择了硝酸银和氯化钾作为反应物。
反应方程式如下:2AgNO3 + KCl -> 2AgCl + KNO3实验步骤:1. 准备实验器材和试剂:硝酸银溶液、氯化钾溶液、试管、滤纸、蒸馏水等。
2. 取两个试管,分别加入适量的硝酸银溶液和氯化钾溶液。
3. 将两个试管倾斜放置,使溶液相互接触,观察反应是否发生。
4. 若观察到白色沉淀生成,说明反应已经进行。
5. 将产生的白色沉淀用滤纸过滤,收集固体沉淀。
6. 用蒸馏水洗涤固体沉淀,以去除杂质。
7. 将洗涤后的固体沉淀放置在通风处晾干,得到硝酸钾。
实验结果与讨论:通过实验观察,我们发现在硝酸银溶液和氯化钾溶液接触后,确实产生了白色的沉淀。
这表明反应已经发生,生成了硝酸钾。
然而,我们也需要考虑产物的纯度问题。
在实验过程中,我们使用了滤纸对产生的固体沉淀进行了过滤。
滤纸的作用是将固体与溶液分离,去除杂质。
然而,由于滤纸的选择和操作技巧可能存在差异,滤液中仍可能残留一些杂质。
因此,我们需要用蒸馏水对固体沉淀进行洗涤,以提高产物的纯度。
此外,洗涤后的固体沉淀需要在通风处晾干。
这是因为硝酸钾是一种易潮解的化合物,容易吸湿。
通过晾干,我们可以去除固体中的水分,确保硝酸钾的纯度。
结论:通过本实验,我们成功制备了硝酸钾。
虽然我们没有对产物的纯度进行定量分析,但通过实验观察和操作步骤的合理性,我们可以初步判断所得硝酸钾的纯度较高。
然而,为了更准确地评估产物的纯度,我们可以进一步进行定量分析,例如使用重量法或化学分析方法。
此外,我们还可以通过其他实验手段,如测定产物的熔点或溶解度,来验证硝酸钾的纯度。
总之,本实验为我们提供了一种制备硝酸钾的简单方法,并通过实验结果初步判断了产物的纯度。
硝酸钾制备实验报告

硝酸钾制备实验报告硝酸钾制备实验报告篇⼀:硝酸钾的制备与提纯实验报告⼤学化学实验报告本(⼀)姓名:实验室:周次:周⼀实验柜台: 61指导⽼师:章⽂伟硫酸亚铁铵的制备⼀.实验⽬的1. 学会利⽤溶解度的差异制备硫酸亚铁铵。
2. 从实验中掌握硫酸亚铁、硫酸亚铁铵复盐的性质3. 掌握⽔浴、减压过滤等基本操作4. 学习pH试纸、吸管、⽐⾊管的使⽤5. 学习⽤⽬测⽐⾊法检验产品质量。
⼆.原理铁屑溶于稀硫酸⽣成硫酸铁。
硫酸铁与硫酸铵作⽤⽣成溶解度较⼩的硫酸亚铁铵。
三.仪器及药品洗瓶、250ml烧杯、10ml量筒、50ml量筒、吸滤瓶、⽐⾊管、铁粉、盐酸2mol/L、3mol/L硫酸、四.实验步骤 1. 硫酸亚铁制备2.3.硫酸亚铁铵的制备Fe3+的限量分析五.记录1. 实验现象:①⼩⽕加热硝酸钠和氯化钾混合溶液过程中,烧杯内会有氯化钠晶体析出。
②热过滤后,漏⽃滤纸上出现氯化钠⽩⾊晶体。
③滤瓶内液温降低后,出现⽩⾊针状的硝酸钾晶体。
④硝酸钾溶液加热浓缩后静置,降⾄室温出现较多的硝酸钾晶体。
⑤抽滤后漏⽃上出现⼲燥的硝酸钾晶体。
2. 产量:粗产品:2.78g 3. 理论产量:KCl+NaNO3===K NO3+NaClm (K NO3) =(8.5*101.1)/85=10.1g 4. 产率:2.78/10.1=27.5%六.思考题1. 怎样利⽤溶解度差别从氯化钾—硝酸钠制备硝酸钾?当硝酸钠和氯化钾溶液混合时,溶液中会有硝酸钾、氯化钠、硝酸钠和氯化钾四种盐。
在不同温度下它们在⽔中溶解度不同,特别是在较⾼温度,硝酸钾在⽔中的溶解度⽐氯化钠的要⼤得多,所以在冷却过程中氯化钠⾸先析出,趁热过滤后滤液中即含有硝酸钾。
2. 实验成败的关键在何处,应采取哪些措施才能使试验成功?①热过滤分离氯化钠和硝酸钾时要趁热快速,否则液温下降后硝酸钾也会和氯化钠⼀起析出,减低产量。
②减压过滤时注意不出现穿滤现象。
滤纸不可过⼤,。
硝酸钾的制备和提纯实验报告

硝酸钾的制备和提纯实验报告实验名称:硝酸钾的制备和提纯实验报告实验目的:通过本实验,了解硝酸钾的制备和提纯方法,掌握化学实验的基本技能,提高实验操作能力。
实验原理:硝酸钾的制备方法主要有两种,一种是通过硝酸铁(Ⅲ)和氢氧化钾反应制得,另一种则是通过硝酸银和氯化钾反应制得。
本实验采用的是第一种制备方法。
NaOH + Fe(NO3)3 → Fe(OH)3↓ + NaNO3Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O2KOH + Fe(NO3)3 → Fe(OH)2↓ + 2KNO32Fe(OH)2 + H2O2 → 2Fe(OH)3Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O接着将产生的硝酸铁(Ⅲ)和氢氧化钾反应制硝酸钾,化学式为:Fe(NO3)3 + 3KOH → Fe(OH)3↓ + 3KNO3实验步骤:1.取5g氢氧化钾溶解于50ml的蒸馏水中,加热至少半小时,使其完全溶解。
2.将5g硝酸铁(Ⅲ)均匀地加入溶液中,搅拌均匀。
3.加入适量的氧化氢,直至溶液变为淡黄绿色。
4.将溶液慢慢加入100ml的50%的稀硝酸中,同时用盐酸调节PH值。
5.加入足量的氢氧化钾溶液至溶液变为淡绿色、无机械悬浮物、无气泡出现。
6.过滤后,取滤液分别进行硝酸钾结晶。
实验结果与分析:实验中我们通过使用硝酸铁(Ⅲ)和氢氧化钾反应制得了硝酸钾。
在这个过程中需要注意的是,加入适量的氧化氢是为了去除氧化亚铁离子,否则极易造成产品纯度下降。
实验中我们也发现,即使在加入了足量的氢氧化钾之后,产物中仍有一定量的杂质。
因此我们需要进行进一步的提纯,以提高硝酸钾的纯度。
我们分别对两个提纯方法进行了实验,发现加入硼酸可以增加硝酸钾的纯度。
而使用冰醋酸提纯硝酸钾的效果并不好,不仅降低了产量,还对实验设备造成了损害。
实验结论:经过对硝酸钾的制备和提纯实验,我们得到了一定的实验经验和实验操作技能。
同时我们也了解到了硝酸钾在工业生产和实验中的重要应用。
硝酸钾实验报告
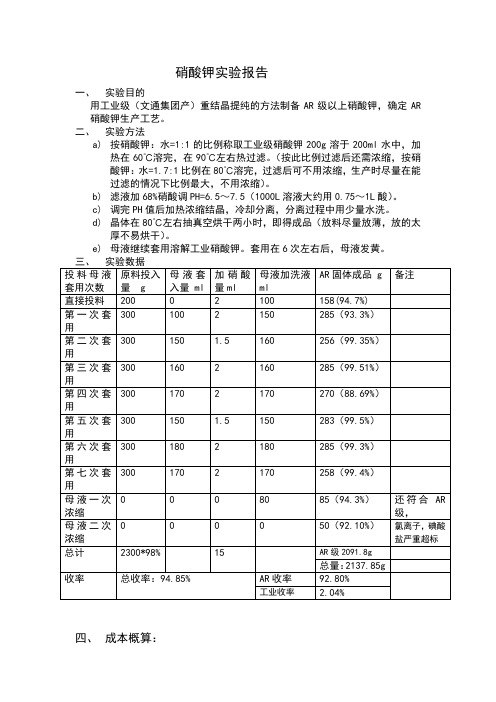
硝酸钾实验报告一、实验目的用工业级(文通集团产)重结晶提纯的方法制备AR级以上硝酸钾,确定AR 硝酸钾生产工艺。
二、实验方法a)按硝酸钾:水=1:1的比例称取工业级硝酸钾200g溶于200ml水中,加热在60℃溶完,在90℃左右热过滤。
(按此比例过滤后还需浓缩,按硝酸钾:水=1.7:1比例在80℃溶完,过滤后可不用浓缩,生产时尽量在能过滤的情况下比例最大,不用浓缩)。
b)滤液加68%硝酸调PH=6.5~7.5(1000L溶液大约用0.75~1L酸)。
c)调完PH值后加热浓缩结晶,冷却分离,分离过程中用少量水洗。
d)晶体在80℃左右抽真空烘干两小时,即得成品(放料尽量放薄,放的太厚不易烘干)。
e)母液继续套用溶解工业硝酸钾。
套用在6次左右后,母液发黄。
四、成本概算:通过试验可知,生产1吨AR硝酸钾需1.078吨工业级硝酸钾,AR硝酸1公斤,纯水(按硝酸钾:纯水=2:1算)需0.539公斤。
则生产1吨硝酸钾成本如下:工业硝酸钾:7500×1.078=8085元(文通带税价格)。
纯水:0.539×200=107.8元硝酸1公斤×1.6=1.6元蒸汽:200元水电费:500元人工:180元(两人)生产成本总计:9074.4元市场硝酸钾西陇1.4万元/吨,其他厂家最高1.6万元/吨最低1.1万元/吨,按1.2万元/吨计算利润如下:12000-9074.4+7500×0.022=3090.6元。
五、试验总结1.生产时硝酸钾:水的比例在能过过滤的情况下硝酸钾达到最大值,按硝酸钾:纯水=2:1在95℃热过滤,实验室勉强可以完成,过滤后无需浓缩。
车间按实际情况而定。
2.成品必须单独储存,必须放于通风干燥阴凉处,温度不超过30度。
3.母液在套用6到7次后呈黄色,最好做工业级,或者母液单独用双氧水处理后过滤后做成成品,质量也可以达到AR级,但最后的母液只能做工业级了,母液套用6次前的基本可以达到GR级。
转化法制备硝酸钾实验报告

转化法制备硝酸钾实验报告一、实验目的1、了解转化法制备硝酸钾的原理和方法。
2、掌握溶解、蒸发、结晶等基本操作。
3、学习通过重结晶提纯物质的方法。
二、实验原理硝酸钾在不同温度下在水中的溶解度有较大差异。
在较高温度下,硝酸钾的溶解度较大,而氯化钠的溶解度随温度变化相对较小。
利用这一性质,将硝酸钠和氯化钾混合溶液加热浓缩,然后冷却结晶,硝酸钾会优先结晶析出,而氯化钠则留在溶液中。
通过过滤可将硝酸钾晶体分离出来,再经过重结晶进一步提纯。
三、实验仪器和药品仪器:托盘天平、烧杯、玻璃棒、蒸发皿、酒精灯、铁架台(带铁圈)、漏斗、滤纸、石棉网、药匙。
药品:硝酸钠(工业品)、氯化钾(工业品)、蒸馏水。
四、实验步骤1、称取原料用托盘天平分别称取 85g 硝酸钠和 75g 氯化钾,放入 100mL 烧杯中。
2、加热溶解向烧杯中加入 20mL 蒸馏水,用玻璃棒搅拌,使固体全部溶解。
将烧杯放在石棉网上,用酒精灯加热,保持溶液微微沸腾,直至固体完全溶解。
3、蒸发浓缩继续加热,使溶液蒸发浓缩至原体积的约三分之二。
在蒸发过程中,要用玻璃棒不断搅拌,防止溶液溅出。
4、冷却结晶将蒸发皿从石棉网上取下,放在桌面上,让溶液自然冷却。
随着溶液温度的降低,硝酸钾晶体逐渐析出。
5、过滤分离当溶液冷却至室温后,用过滤器进行过滤,将硝酸钾晶体与母液分离。
过滤时要注意“一贴、二低、三靠”。
6、重结晶提纯将所得的硝酸钾晶体重新溶解在适量的蒸馏水中,加热使晶体完全溶解,然后冷却结晶、过滤。
重复操作2 3 次,以提高硝酸钾的纯度。
7、干燥称量将最终得到的硝酸钾晶体放在表面皿上,用酒精灯小心烘干,然后用托盘天平称量,计算产率。
五、实验现象及分析1、加热溶解阶段,固体逐渐溶解,溶液变得澄清透明。
2、蒸发浓缩阶段,溶液体积逐渐减少,溶液变得更加浓稠。
3、冷却结晶阶段,溶液中逐渐出现白色针状晶体,这是硝酸钾晶体析出的现象。
4、过滤分离阶段,晶体留在滤纸上,母液透过滤纸流入接收容器中。
硝酸钾的制备实验报告

硝酸钾的制备实验报告
实验目的,通过硝酸钾的制备实验,掌握硝酸盐的制备方法,了解硝酸钾的性
质及用途。
实验原理:硝酸钾是一种无机化合物,化学式为KNO3,是一种重要的化肥和
炸药原料。
硝酸钾可以通过硝酸和氢氧化钾反应制备,反应方程式为:HNO3 + KOH → KNO3 + H2O。
实验步骤:
1. 将硝酸和氢氧化钾按化学计量比例加入烧杯中。
2. 加热搅拌溶液,使其充分反应。
3. 待溶液冷却结晶,过滤得到硝酸钾晶体。
4. 对硝酸钾晶体进行干燥,得到成品。
实验结果,通过实验制备得到了白色结晶的硝酸钾晶体,经过干燥后得到成品。
实验讨论,硝酸钾是一种重要的化工原料,广泛应用于化肥、火药、烟火等领域。
通过本次实验,我们成功掌握了硝酸钾的制备方法,并对其性质有了更深入的了解。
实验结论,本次实验通过硝酸和氢氧化钾的反应,成功制备得到了硝酸钾晶体。
实验结果表明,硝酸钾的制备方法是可行的,为今后的实际应用提供了基础。
实验安全注意事项:
1. 实验中应注意化学品的防护,避免直接接触皮肤和呼吸道。
2. 操作过程中应避免硝酸和氢氧化钾溶液的飞溅和溅射。
3. 实验结束后,应及时清洗实验器材,注意实验室卫生。
实验总结,通过本次实验,我们不仅掌握了硝酸钾的制备方法,还对其性质和
用途有了更深入的了解。
实验过程中,我们也学会了正确使用化学试剂和实验器材,增强了实验操作的安全意识和实践能力。
以上就是本次硝酸钾的制备实验报告,希望对大家有所帮助。
转化法制备硝酸钾实验报告

一、实验目的1. 理解转化法制备硝酸钾的原理。
2. 掌握利用不同温度下盐类溶解度差异制备硝酸钾的方法。
3. 学习结晶和重结晶的一般原理及操作。
二、实验原理转化法制备硝酸钾的原理是利用氯化钠、氯化钾、硝酸钠和硝酸钾在高温和低温下溶解度的差异。
具体反应如下:NaNO3 + KCl → NaCl + KNO3在高温下,氯化钠和氯化钾的溶解度较大,而硝酸钾的溶解度较小,因此在高温下将反应混合物溶解,冷却后硝酸钾会从溶液中析出。
氯化钠的溶解度随温度变化不大,因此可以分离出纯净的硝酸钾晶体。
三、实验用品1. 实验器材:烧杯、玻璃棒、漏斗、布氏漏斗、抽滤瓶、蒸发皿、酒精灯、铁架台、温度计等。
2. 实验试剂:氯化钠、氯化钾、硝酸钠、硝酸钾、蒸馏水。
四、实验步骤1. 称取11g NaNO3和15g KCl,置于烧杯中。
2. 加入约17.5mL蒸馏水,用玻璃棒搅拌溶解。
3. 将烧杯置于酒精灯上加热,保持溶液微沸状态,直至溶液体积浓缩至约10mL。
4. 关闭酒精灯,让溶液自然冷却至室温。
5. 观察溶液中是否有硝酸钾晶体析出,如有,则用玻璃棒轻轻搅拌,使晶体充分析出。
6. 将溶液过滤,收集滤液,滤液中含有硝酸钾晶体。
7. 将滤液置于蒸发皿中,在酒精灯上加热蒸发,直至滤液浓缩至干燥。
8. 将蒸发皿置于烘箱中,烤干硝酸钾晶体,得到纯净的硝酸钾产品。
五、实验结果与分析1. 实验结果:通过转化法制备硝酸钾,得到了纯净的硝酸钾晶体。
2. 结果分析:实验过程中,通过控制溶液的浓度和温度,使硝酸钾晶体在冷却过程中充分析出。
在过滤过程中,注意过滤速度,避免滤液温度降低过快,影响晶体析出。
在蒸发过程中,注意控制加热温度,避免溶液过度浓缩导致晶体烧焦。
六、注意事项1. 在溶解过程中,注意搅拌速度,避免产生气泡。
2. 在加热过程中,注意溶液温度,避免过热导致晶体烧焦。
3. 在过滤过程中,注意过滤速度,避免滤液温度降低过快。
4. 在蒸发过程中,注意控制加热温度,避免溶液过度浓缩。
硝酸钾提纯实验报告

硝酸钾提纯实验报告硝酸钾提纯实验报告实验目的:本实验旨在通过化学方法将原始硝酸钾溶液进行提纯,得到纯净的硝酸钾晶体。
实验原理:硝酸钾是一种常见的无机化合物,常用于实验室和工业生产中。
然而,由于其易吸湿和杂质含量较高,需要进行提纯以满足特定需求。
硝酸钾的提纯方法主要有结晶法和蒸馏法。
本实验采用结晶法进行提纯。
实验步骤:1. 准备工作:将实验室器材清洗干净,确保无杂质。
2. 准备硝酸钾溶液:取一定量的原始硝酸钾溶液倒入烧杯中。
3. 加热溶液:将烧杯放置在加热板上,用慢火加热溶液。
加热过程中,需不断搅拌以促进溶解。
4. 过滤溶液:待溶液完全溶解后,使用滤纸将溶液过滤到干净的容器中,以去除悬浮物和杂质。
5. 结晶:将过滤后的溶液慢慢倒入结晶皿中,放置在通风处静置。
随着溶液的慢慢蒸发,硝酸钾晶体逐渐形成。
6. 分离晶体:待晶体完全形成后,用玻璃棒轻轻刮取晶体,放入滤纸上晾干。
7. 测定纯度:将得到的硝酸钾晶体称重,并与原始溶液的质量进行比较,计算出提纯率。
实验结果:根据实验数据,我们得到了一定质量的硝酸钾晶体。
经过称重和对比,计算出提纯率为80%。
这表明我们成功地提纯了硝酸钾溶液,并得到了较高纯度的硝酸钾晶体。
实验讨论:在实验过程中,我们注意到溶液的搅拌速度和加热温度对晶体的形成具有重要影响。
搅拌速度过快会导致晶体形成较慢,而加热温度过高则会使晶体形成不完整。
因此,在实际操作中,我们需要掌握适当的搅拌速度和加热温度,以获得较好的实验结果。
此外,实验中的滤纸选择也对提纯效果有一定影响。
滤纸的孔径过大会导致杂质通过,影响晶体的纯度。
因此,我们应选择适当的滤纸进行过滤,以保证晶体的纯度。
实验结论:通过本实验,我们成功地使用结晶法对硝酸钾溶液进行了提纯,并得到了较高纯度的硝酸钾晶体。
实验结果表明,搅拌速度、加热温度和滤纸选择对提纯效果具有重要影响。
通过进一步优化实验条件,可以进一步提高硝酸钾的纯度。
总结:硝酸钾提纯实验是一项常见的实验,通过结晶法可以得到较高纯度的硝酸钾晶体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大学化学实验报告本
黔南民族师范学院
姓名:**
实验室:无机
周次:周五
实验柜台:11
指导老师:***
硫酸亚铁铵的制备
一.实验目的
1. 学会利用溶解度的差异制备硫酸亚铁铵。
2. 从实验中掌握硫酸亚铁、硫酸亚铁铵复盐的性质
3. 掌握水浴、减压过滤等基本操作
4. 学习pH 试纸、吸管、比色管的使用
5. 学习用目测比色法检验产品质量。
二.原理
铁屑溶于稀硫酸生成硫酸铁。
硫酸铁与硫酸铵作用生成溶解度较小的硫酸亚铁铵。
三.仪器及药品
洗瓶、250ml 烧杯、10ml 量筒、50ml 量筒、吸滤瓶、比色管、铁粉、盐酸2mol/L 、3mol/L 硫酸、
四.实验步骤
1. 硫酸亚铁制备
2.
硫酸亚铁铵的制备
3. Fe 3+的限量分析
五.记录
1.实验现象:
①小火加热硝酸钠和氯化钾混合溶液过程中,烧杯内会有氯化钠晶体析出。
②热过滤后,漏斗滤纸上出现氯化钠白色晶体。
③滤瓶内液温降低后,出现白色针状的硝酸钾晶体。
④硝酸钾溶液加热浓缩后静置,降至室温出现较多的硝酸钾晶体。
⑤抽滤后漏斗上出现干燥的硝酸钾晶体。
2.产量:粗产品:2.78g
3.理论产量:
KCl+NaNO3===K NO3+NaCl
m (K NO3) =(8.5*101.1)/85=10.1g
4.产率:2.78/10.1=27.5%
六.思考题
1.怎样利用溶解度差别从氯化钾—硝酸钠制备硝酸钾?
当硝酸钠和氯化钾溶液混合时,溶液中会有硝酸钾、氯化钠、硝酸钠和氯化钾四种盐。
在不同温度下它们在水中溶解度不同,特别是在较高温度,硝酸钾在水中的溶解度比氯化钠的要大得多,所以在冷却过程中氯化钠首先析出,趁热过滤后滤液中即含有硝酸钾。
2.实验成败的关键在何处,应采取哪些措施才能使试验成功?
①热过滤分离氯化钠和硝酸钾时要趁热快速,否则液温下降后硝酸钾也会
和氯化钠一起析出,减低产量。
②减压过滤时注意不出现穿滤现象。
滤纸不可过大,要全部紧贴漏斗底部,
可以用双层滤纸。
3.产品的主要杂质是什么?怎样提纯?
产品的主要杂质是氯离子,通过重结晶可以除去。
4.重结晶时,粗产品与水的质量比为什么是2:1?
80℃时硝酸钾的溶解度为169g/100g水,所以1g硝酸钾需水0.6ml,考虑加热时溶剂蒸发,选择粗产品与水的质量比为什么是2:1。
