硝酸钾的制备和提纯
硝酸钾生产工艺流程

硝酸钾生产工艺流程硝酸钾(化学式KNO3),常用于火药、肥料和医药工业中。
下面是硝酸钾的生产工艺流程。
1. 原料准备阶段:从矿石中提取硝酸钙和氯化钾作为原料。
硝酸钙可以通过硝酸镁和氯化钙反应得到。
氯化钾可以通过氯化钠和硝酸钾反应得到。
原料准备结束后,将它们分别粉碎和筛分。
2. 硝酸钾的制备:(1)硝酸钙与氯化钾反应:将粉末状的硝酸钙和氯化钾混合,加入适量的水,搅拌均匀,并通过加热使之反应。
反应结束后,用冷水冲洗反应体,将产生的硝酸钾晶体分离出来。
(2)氯化钠与硝酸钾反应:将粉末状的氯化钠和硝酸钾混合,在适量的水中加热溶解并搅拌均匀。
随着反应的进行,产生的氯化钠水溶液中的硝酸钾会逐渐沉淀下来。
反应结束后,用冷水冲洗反应体,将产生的硝酸钾晶体分离出来。
3. 晶体分离与过滤:将产生的硝酸钾晶体收集起来,并且用热水洗涤,以去除残留的杂质和不纯物质。
然后用过滤器将硝酸钾晶体从溶液中分离出来。
4. 结晶与干燥:将硝酸钾晶体放置在合适的容器中,在适当的温度下进行结晶过程。
随着水分的慢慢蒸发,硝酸钾晶体的数目逐渐增加,同时也会变得越来越大。
最后,将结晶的硝酸钾晶体放在干燥室中,用于将晶体中剩余的水蒸发掉。
5. 包装与存储:将加工好的硝酸钾晶体进行包装。
通常使用塑料袋或玻璃瓶作为包装材料,以防止潮湿和外界物质的污染。
然后将包装好的硝酸钾放置在干燥通风的仓库中,以确保其质量和保存时间。
通过以上的生产工艺流程,硝酸钾可以被有效地制备出来。
这个过程确保了硝酸钾的纯度和质量,提供了一个可靠的原料来源,并为相关领域的应用提供了保证。
同时,工艺流程中的环保措施,如保护环境和节约能源,也应被重视。
硝酸钾的制备和提纯实验报告

硝酸钾的制备和提纯实验报告实验名称:硝酸钾的制备和提纯实验报告实验目的:通过本实验,了解硝酸钾的制备和提纯方法,掌握化学实验的基本技能,提高实验操作能力。
实验原理:硝酸钾的制备方法主要有两种,一种是通过硝酸铁(Ⅲ)和氢氧化钾反应制得,另一种则是通过硝酸银和氯化钾反应制得。
本实验采用的是第一种制备方法。
NaOH + Fe(NO3)3 → Fe(OH)3↓ + NaNO3Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O2KOH + Fe(NO3)3 → Fe(OH)2↓ + 2KNO32Fe(OH)2 + H2O2 → 2Fe(OH)3Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O接着将产生的硝酸铁(Ⅲ)和氢氧化钾反应制硝酸钾,化学式为:Fe(NO3)3 + 3KOH → Fe(OH)3↓ + 3KNO3实验步骤:1.取5g氢氧化钾溶解于50ml的蒸馏水中,加热至少半小时,使其完全溶解。
2.将5g硝酸铁(Ⅲ)均匀地加入溶液中,搅拌均匀。
3.加入适量的氧化氢,直至溶液变为淡黄绿色。
4.将溶液慢慢加入100ml的50%的稀硝酸中,同时用盐酸调节PH值。
5.加入足量的氢氧化钾溶液至溶液变为淡绿色、无机械悬浮物、无气泡出现。
6.过滤后,取滤液分别进行硝酸钾结晶。
实验结果与分析:实验中我们通过使用硝酸铁(Ⅲ)和氢氧化钾反应制得了硝酸钾。
在这个过程中需要注意的是,加入适量的氧化氢是为了去除氧化亚铁离子,否则极易造成产品纯度下降。
实验中我们也发现,即使在加入了足量的氢氧化钾之后,产物中仍有一定量的杂质。
因此我们需要进行进一步的提纯,以提高硝酸钾的纯度。
我们分别对两个提纯方法进行了实验,发现加入硼酸可以增加硝酸钾的纯度。
而使用冰醋酸提纯硝酸钾的效果并不好,不仅降低了产量,还对实验设备造成了损害。
实验结论:经过对硝酸钾的制备和提纯实验,我们得到了一定的实验经验和实验操作技能。
同时我们也了解到了硝酸钾在工业生产和实验中的重要应用。
硝酸钾的制备和提纯 PPT 苏教版

36.6
37.3
38.4
39.8
四、基本流程及所需仪器: 1、固体溶解:天平、烧杯、玻璃棒、酒精灯 2、蒸发、热过滤:铁架台、铜质保温漏斗
3、冷却、减压过滤:吸滤瓶、 安全瓶、抽气泵、布氏漏斗 4、重结晶: 5、称量 6、检验Cl-
五、实验步骤
1、硝酸钾的制备
A、用小烧杯在天平上称取NaNO3 20g,KCl17g,
专题1课题3 一、实验目的
硝酸钾晶体的制备
• 1、观察验证盐类溶解度和温度的关系; • 2、利用物质溶解度随温度变化的差别,学
•
习用转化法制备硝酸钾;
• 3、熟悉溶解、蒸发、结晶、过滤等技术, 学会用重结晶法提纯物质。
二:结晶: 使晶体从溶液中析出的过程 1、常见的结晶方式有哪几种? ①蒸发结晶: 通过蒸发浓缩溶液使溶质析出。 适用于溶解度随温度变化不大的溶质 (1)蒸发过程应不断搅拌 防止液体局部过热而使液滴或晶体飞溅。 (2)出现较多固体时即停止加热,用余热蒸干 ②降温结晶(冷却热饱和溶液) 先蒸发、浓缩溶液,再降温使溶解度随温度变化 较大的溶质析出,此时杂质在溶剂中尚未饱和 如KNO3中含有少量的NaCl
热过滤: 趁热过滤, 得KNO3饱和溶液 (回收NaCl晶体) 称量: 称量得 , 粗KNO3质量
2、KNO3提纯(重结晶) 将所得晶体溶于少量溶剂中,然后进行蒸发 (或冷却)、结晶、过滤,如此反复的操作 称为重结晶。 溶解: 按KNO3∶H2O= 2∶1 加适量水溶解 抽滤: 得KNO3晶体 用饱和KNO3 淋洗 加热: 沸腾 即止 冷却: 有针状 KNO3析出 称重: 精品 KNO3 g
过滤方法有3种 ① 常压过滤:用内衬滤纸的锥形玻璃漏斗过滤, 滤液靠自身的重力透过滤纸流下,实现分离。
硝酸钾提纯实验报告

硝酸钾提纯实验报告实验目的:本实验旨在通过一系列步骤来提纯硝酸钾样品,以获得高纯度的硝酸钾。
实验仪器和材料: 1. 硝酸钾样品 2. 蒸馏水 3. 玻璃烧杯 4. 洗涤瓶 5. 滤纸 6. 铝箔实验步骤:步骤一:准备工作 1. 将玻璃烧杯洗净,并用蒸馏水冲洗干净。
2. 准备滤纸和洗涤瓶。
步骤二:制备硝酸钾溶液 1. 取适量的硝酸钾样品,加入玻璃烧杯中。
2. 加入适量的蒸馏水,并搅拌使硝酸钾溶解。
步骤三:过滤 1. 将硝酸钾溶液倒入洗涤瓶中。
2. 在洗涤瓶的口部放置一张滤纸。
3. 缓慢倒入硝酸钾溶液,让溶液通过滤纸,固体残渣留在滤纸上。
步骤四:结晶 1. 将滤纸上的硝酸钾固体残渣倒入玻璃烧杯中。
2. 加入适量的蒸馏水,使硝酸钾溶解。
3. 将溶液加热,待溶液开始沸腾时,用铝箔将玻璃烧杯盖住,控制温度,使其缓慢沸腾。
步骤五:冷却结晶 1. 关闭加热设备,让溶液冷却至常温。
2. 在冷却过程中,硝酸钾会结晶出来,形成固体。
步骤六:收集结晶 1. 将冷却后的溶液过滤,以分离出硝酸钾晶体。
2. 将硝酸钾晶体放在滤纸上,吸干余留的水分。
步骤七:干燥 1. 将硝酸钾晶体转移到干燥器皿中。
2. 放在通风处,让硝酸钾晶体自然干燥。
步骤八:测定纯度 1. 取少量的干燥后的硝酸钾晶体,称量并记录质量。
2. 将硝酸钾晶体溶解在蒸馏水中,形成溶液。
3. 使用适当的化学方法或仪器,测定溶液的纯度。
实验结果及讨论:通过以上步骤,我们成功地提纯了硝酸钾样品。
经过测定,我们可以得出硝酸钾的纯度数据,并与标准值进行比较。
如果纯度达到了预期要求,我们可以得出实验成功,并得到高纯度的硝酸钾样品。
结论:通过本实验,我们学习了硝酸钾提纯的基本步骤,并成功地获得了高纯度的硝酸钾。
实验结果对于进一步的科学研究和实际应用具有重要意义。
注意事项: 1. 在操作过程中,要注意安全,避免接触皮肤和眼睛。
2. 操作时要小心,避免溶液溅出。
硝酸钾的制备和提纯 ppt课件

1.充分振荡,充分 静止,然后分液; 2.分液时保持漏斗 内与大气压一致; 下层溶液下口出, 上层溶液上口出。
硝酸钾的制备和提纯
蒸馏
注意点:
①实验前在蒸馏烧瓶中 先加入几粒沸石(或碎 瓷片)—防止液体暴沸 ②温度计的水银球处于 `蒸馏烧瓶支管处 ③冷凝水的方向:
下进上出
硝酸钾的制备和提纯
高温下, 达到饱和的NaCl先结 晶分离;然后, 在低温下, KNO3达饱和,得到产品。
溶解
蒸发
热过滤
结晶
硝酸钾的制备和提纯
思考2: 这样得到的晶体是否纯净?若
不纯,应如何提纯?
初次结晶得到的晶体中 常会混有少量NaCl 杂质。将所得晶体溶于少量水中,然后进行 冷却、 结晶、过滤,如此反复的操作。
(3)用少量热水淋洗晶体也是一种除去晶体中少量杂质的方法, 这种方法适用于晶体 _A___(填A或B)
升华
可分离出固体混合物中的易升华物质
层析
分离溶液中的微量物质
硝酸钾的制备和提纯
练习: 用于分离或提纯物质的已学方法有:
A.萃取
B.分液
C.过滤
D.加热分解 E.蒸发
F.蒸馏
下列各组混合物的分离或提纯应选用上述哪种方法最合
适?(把选用方法的标号填入括号内) (1)除去Ca(OH)2溶液中悬浮的Ca(OH)2 颗粒( C ) (2)把饱和食盐水中的食盐提取出来( E ) (3)除去酒精中溶解的微量食盐( F ) (4)把溴水中的溴提取出来 ( A ) (5)用自来水制取医用蒸馏水 ( F ) (6)除去氧化钙中的碳酸钙 ( D ) (7)分离柴油和水的混硝酸合钾的物制备(和提B纯 )
一、减压过滤(也称抽滤或吸滤)
人教版高中化学《硝酸钾制备及提纯实验》学案
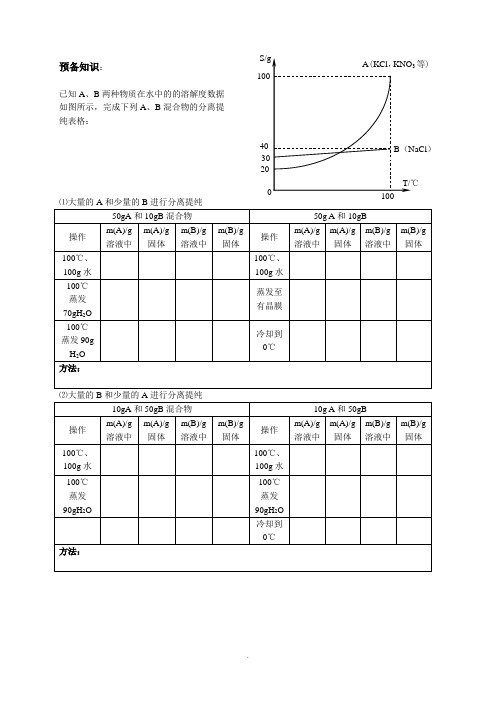
预备知识:已知A 、B 两种物质在水中的的溶解度数据 如图所示,完成下列A 、B 混合物的分离提 纯表格:⑴大量的A 和少量的B 进行分离提纯⑵大量的B 和少量的A 进行分离提纯硝酸钾制备与提纯实验学案实验人:同组人:实验时间:【实验目的】:1. 通过实验加深对复分解反应发生条件的理解,加深对溶解度概念的理解;2. 了解从溶液中获得可溶性固体的常用方法,能根据实际情景正确选择适合的方法,表述相关操作3. 掌握用重结晶法对物质进行分离提纯的实验原理和操作步骤4. 熟悉过滤、结晶、洗涤结晶、干燥结晶等操作5. 初步有通过对比检验物质纯度的意识6.通过习题归纳相关物质分离提纯方法,并能在不同的习题情景中加以运用【实验原理】: 1.硝酸钾的制备原理工业上多以硝酸钠和氯化钾为主要原料生产硝酸钾,副产品为氯化钠,请尝试写出该反应的反应方程式:以下是四种盐在不同温度下的溶解度(g/100g 水)【表1】你能否根据以上数据分析该反应发生的条件?这个反应为什么能够发生?以上反应所得产品KNO 3是否纯净?含什么杂质离子?2.重结晶原理溶解度(S )一定温度下,在饱和溶液中,100g 溶剂(通常是水)所能溶解的溶质的质量 计算公式:溶剂)溶质()(100m m g S 请根据以上计算公式和【表1】中的相关数据,完成下列两个计算:(1)设有10gKNO 3和10gNaCl 的混合物,要在80℃将其溶解,最少需要加入水的体积是多少毫升?将该溶液蒸发浓缩至溶剂体积减半,此时是否有晶体析出?是什么晶体?此时趁热过滤,滤出的溶质是什么?将该滤液冷却至20 ℃,析出的晶体成分又是什么?(2)设混合物样品中含9gA和2gB ,A和B在水中的溶解度都是1g/100mL(20℃)和10g/100mL(100℃),将这个样品用100mL溶剂在100℃下溶解,问:A和B是否能完全溶解?将此时的溶液冷却至20 ℃,会否有结晶析出?析出多少?此时析出物的组成如何?再将得到的析出物依上述方法溶解、冷却,过滤,是否有物质析出?是什么?根据计算,请分析,重结晶的步骤应为:甲、乙两物质的溶解度随温度变化如下,从甲、乙的混合溶液中分离得到甲和乙固体的操作是:【实验用品】:硝酸钠、氯化钾固体、蒸馏水、漏斗、带铁圈的铁架台、滤纸、玻璃棒、烧杯、酒精灯、(热滤漏斗)【实验步骤】:1.分别称取8g硝酸钠、氯化钾固体,溶于约30mL水,如果难以溶解,;2.将溶液蒸发浓缩至,再趁热过滤1;3.将滤液冷却结晶,并用少量乙醇洗涤所得晶体;4.将所得的晶体取少量样品用于检验纯度,其余进行重结晶,再次检验得到的样品纯度。
硝酸钾的制备和提纯.
3
NaCl 35. 35. 36. 36.3 36.6 37.3 38.4 39.8 780
四、实验步骤
1、硝酸钾的制备
用表面皿在台秤上称取NaNO3 21g,KCl18.5g,放 入烧杯中,加入35ml蒸馏水,加热至沸,使固体溶解。 待溶液蒸发至原来体积的2/3时,便可停止加热,趁热 用热滤漏斗进行过滤。
注意事项
1、将NaNO321g,KCl18.5g,放 入烧杯中 ,加入 35ml蒸馏水,使固体刚好全部溶解。
2、待溶液蒸发至原来体积的2/3时,便要停止加热, 并趁热用热滤漏斗进行过滤。
3、重结晶法提纯KNO3中,将粗止。
思考题
1、何谓重结晶?本实验都涉及哪些基本操 作?
3、产品纯度的检验
称取KNO3产品0.5g(剩余产品回收)放入盛有 20ml蒸馏水的小烧杯中,溶解后取得1ml,稀释至 1 0 0 ml, 取 稀 释 液 1 ml 放 在 试 管 中 , 加 1 ~ 2 滴 0.1mol·L-1AgNO3溶液,观察有无AgCl白色沉淀产 生。并与粗产品的纯度作比较。
表1 NaNO3、KCl、NaCl、KNO3在不同温度下的溶解度(g/100g水)
温 度 0 10 20 30 40 60 80 100 (℃ ) KNO3 13. 20. 31. 45.8 63.9 110 169 246
396 KCl 27. 31. 34. 37.0 40.0 45.5 51.1 56.7
2、溶液沸腾后为什么温度高达100℃以上? 3、能否将除去氯化钠后的滤液直接冷却制
取硝酸钾? 4、实验中为何要乘热过滤除去NaCl晶体?
2重结晶法提纯kno将粗产品放在50ml烧杯中留05g粗产品作纯度对比检验用加入计算量的蒸馏水并搅拌之用小火加热直至晶体全部溶解为止
文档硝酸钾设计实验
硝酸钾的制备和提纯探讨课本实验(一)一、实验目的1、观察验证盐类溶解度和温度的关系;2、利用物质溶解度随温度变化的差别,学习用转化法制备硝酸钾;3、熟悉溶解、蒸发、结晶、过滤等技术,学会用重结晶法提纯物质。
二、实验原理复分解法是制备无机盐类的常用方法。
不溶性盐利用复分解法很容易制得容易制得,但是可溶性盐则需要根据温度反应中几种盐类溶解度的不同影响来处理。
本实验用NaNO3和KCl通过复分解来制取KNO3,其反应为:NaNO3 + KCl ===NaCl + KNO3三、基本操作1、玻璃仪器(烧杯、量筒、蒸发皿、表面皿)使用;2、实验室用的纯水;3、化学试剂;4、加热与冷却;5、固、液分离;*(1)6、查物质的溶解度数据表;*(2)7、重结晶;*(3)8、减压过滤;*(4)9、表面皿的洗涤和使用;表一:硝酸钾,氯化钾,硝酸钠,氯化钠在不同温度下的溶解度(g/100g水)温度(°c)0 10 20 30 40 60 80 100 K N O3 13. 3 20.9 31. 6 45.8 63.9 110 169 24 6 K C l 27. 6 31.0 34.0 37.0 40.0 45. 5 51. 1 56.7 NaNO3 7 3 80 88 9 6 10 4 12 4 148 180 N a C l 35.7 35.8 36.0 36. 3 36. 6 37. 3 38. 4 39.8四、实验步骤1、硝酸钾的制备a用表面皿在台秤上称取用表面皿在台秤上称取NaNO3 8.5g,KCl7.5g 放入烧杯中,加入15ml蒸馏加热至沸,使固体溶解.b待溶液蒸发至原来体积的2/3时便可停止加热,趁热用热滤漏斗进行过滤。
c将滤液冷却至室温,滤液中便有晶体析出。
d用减压过滤的方法分离并抽干此晶体,即得粗产品。
e吸干晶体表面的水分后转移到已称重的洁净表面皿中,用台秤称量,计算粗产品的百分产率。
2、重结晶法提纯KNO3将粗产品放在50mL烧杯中(留0.1g粗产品作对比纯度检验用),加入计算量的蒸馏水并搅拌之,用小火加热,直至晶体全部溶解为止。
硝酸钾的制备与提纯(精)
加
加
冷
入
热
却
药
溶
过
品
解
滤
热滤 操作
蒸 发 结
晶?
趁 热 过 滤
?
抽 干 称 量 纯 度 检 验
过
冷
滤
却
洗
结
涤
晶
循环 利用
蒸
重
发
新
浓
溶
缩
解
2. KNO3的提纯
粗
加
自
品
热
然
溶
至
冷
解
沸
却
抽
抽
滤
干
洗
称
涤
量
3. 产品纯度的检验
分
滴
观
作
别
加
察
出
溶
试
现
结
解
剂
象
论
六、思考题
1. 产品的主要杂质是什么? 2. 能否将除去氯化钠后的滤液直接冷却制取硝酸钾? 3. 考虑在母液中留有硝酸钾,粗略计算本实验实际得
硝酸钾的制备 与提纯
一、目的要求 二、实验原理 三、仪器和试剂 四、关键操作 五、实验步骤 六、思考题 七、科技前沿
一、目的要求
1. 学习利用各种易溶盐在不同温度时溶解度的差异来 制备易溶盐的原理和方法。
2. 学习重结晶的原理和方法。 3. 学习掌握热过滤的操作。 4. 进一步巩固蒸发、结晶、过滤等基本操作。
50 0 0
KNO 3
KCl NaNO
3
NaCl
20
40
60
80
100
温度/℃
三、仪器和试剂
循环水泵
仪 器
热滤漏斗
2020年最新硝酸钾制备与提纯实验报告
大学化学实验报告本黔南民族师范学院姓名实验室周次实验柜台指导老师江边无机周五章文伟硫酸亚铁鞍的制备一实验目的1 学会利用溶解度的差异制备硫酸亚铁鞍。
从实验中掌握硫酸亚铁、硫酸亚铁钱复盐的性质掌握水浴、减压过滤等基本操作学习pH试纸、吸管、比色管的使用学习用目测比色法检验产品质量。
二原理铁屑溶于稀硫酸生成硫酸铁。
硫酸铁与硫酸鞍作用生成溶解度较小的硫酸亚铁鞍。
三仪器及药品洗瓶、25ml烧杯、1ml量筒、5ml量筒、吸滤瓶、比色管、铁粉、盐酸2mol/L、3mol/L 硫酸、四实验步骤1 硫酸亚铁制备铁屑ig水浴加热■趁热1H2SO43mol/L5ml■过滤1硫酸亚铁鞍的制备Fe3+的限量分析称1 g于25ml比加2ml3mol/L HCI、15ml不含氧水、振荡、色管加1 ml25%KSCN溶液、加不含氧水至刻度五记录1实验现象小火加热硝酸钠和氯化钾混合溶液过程中,烧杯内会有氯化钠晶体析出热过滤后,漏斗滤纸上出现氯化钠白色晶体。
滤瓶内液温降低后,出现白色针状的硝酸钾晶体。
硝酸钾溶液加热浓缩后静置,降至室温出现较多的硝酸钾晶体。
抽滤后漏斗上出现干燥的硝酸钾晶体。
产量粗产品78g理论产量KCI+NaNO a===K NO 3+NaCIm (K NOs)=(5*11)/85=1.1 g产率278/1.1=25%六思考题 1怎样利用溶解度差别从氯化钾一硝酸钠制备硝酸钾?当硝酸钠和氯化钾溶液混合时,溶液中会有硝酸钾、氯化钠、硝酸钠和氯化钾四种盐。
在不同温度下它们在水中溶解度不同,特别是在较高温度,硝酸钾在水中的溶解度比氯化钠的要大得多,所以在冷却过程中氯化钠首先析出,趁热过滤后滤液中即含有硝酸钾。
实验成败的尖键在何处,应采取哪些措施才能使试验成功①热过滤分离氯化钠和硝酸钾时要趁热快速,否则液温下降后硝酸钾也会和氯化钠一起析出,减低产量。
②减压过滤时注意不出现穿滤现象。
滤纸不可过大,要全部紧贴漏斗底部,可以用双层滤纸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
西北大学基础化学实验
3、产品纯度的检验
称取KNO 产品0 称取 KNO3 产品 0 . 5 g( 剩余产品回收) 放 剩余产品回收 ) 入盛有20 mL蒸馏水的小烧杯中 , 入盛有 20mL 蒸馏水的小烧杯中, 溶解后取得 1mL,稀释至100mL,取稀释液1mL放在试管 mL,稀释至100mL,取稀释液1mL放在试管 中 , 加 1 ~ 2 滴 0 . 1 mol·L-1AgNO3 溶液 , 观察有 溶液, 无AgCl白色沉淀产生。并与粗产品的纯度作比 AgCl白色沉淀产生。 较。
西北大学基础化学实验
思考题
1、何谓重结晶?本实验都涉及哪些基本 操作? 2、溶液沸腾后为什么温度高达100℃以 、溶液沸腾后为什么温度高达100℃ 上? 3、能否将除去氯化钠后的滤液直接冷却 制取硝酸钾? 4、实验中为何要乘热过滤除去NaCl晶体? 、实验中为何要乘热过滤除去NaCl晶体?
西北大学基础化学实验
西北大学基础化学实验二、实 Nhomakorabea原理复分解法是制备无机盐类的常用方法。 复分解法是制备无机盐类的常用方法。不 溶性盐利用复分解法很容易制得, 溶性盐利用复分解法很容易制得,但是可溶性 盐则需要根据温度对反应中几种盐类溶解度的 不同影响来处理。 不同影响来处理。 本实验用N 本实验用NaNO3和KCl通过复分解来制取 KCl通过复分解来制取 KNO3,其反应为: 其反应为: NaNO3 + KCl ===NaCl + KNO3
西北大学基础化学实验
三、基本操作
1、玻璃仪器(烧杯、量筒、蒸发皿、表面皿)使用; 玻璃仪器(烧杯、量筒、蒸发皿、表面皿)使用; 2、实验室用的纯水; 实验室用的纯水; 3、化学试剂; 化学试剂; 4、加热与冷却; 加热与冷却; 5、固、液分离; 液分离; 6、查物质的溶解度数据表; 查物质的溶解度数据表; 7、重结晶; 重结晶; 8、减压过滤; 减压过滤; 9、表面皿的洗涤和使用; 表面皿的洗涤和使用; 10、铜质保温漏斗套的使用。 10、铜质保温漏斗套的使用。
13.3 20.9 31.6 45.8 27.6 31.0 34.0 37.0 73 80 88 96
35.7 35.8 36.0 36.3
西北大学基础化学实验
四、实验步骤
1、硝酸钾的制备
用表面皿在台秤上称取N 用表面皿在台秤上称取NaNO3 21g,KCl18.5g, 21g KCl18.5g, 放入烧杯中,加入35ml蒸馏水 加热至沸, 蒸馏水, 放入烧杯中,加入35ml蒸馏水,加热至沸,使固体溶 解。 待溶液蒸发至原来体积的2/3时 便可停止加热, 待溶液蒸发至原来体积的2/3时,便可停止加热, 趁热用热滤漏斗进行过滤。 趁热用热滤漏斗进行过滤。 将滤液冷却至室温,滤液中便有晶体析出。 将滤液冷却至室温,滤液中便有晶体析出。用减 压过滤的方法分离并抽干此晶体,即得粗产品。 压过滤的方法分离并抽干此晶体,即得粗产品。吸干 晶体表面的水分后转移到已称重的洁净表面皿中, 晶体表面的水分后转移到已称重的洁净表面皿中,用 台秤称量,计算粗产品的百分产率。 台秤称量,计算粗产品的百分产率。
西北大学基础化学实验
表1 NaNO3、KCl、NaCl、KNO3在不同温度下的溶解度 KCl、NaCl、 (g/100g水) g/100g水)
温度 (℃ ) KNO3 KCl NaNO3 NaCl 0 10 20 30 40 63.9 40.0 104 36.6 60 110 45.5 124 37.3 80 169 51.1 148 38.4 100 246 56.7 180 39.8
硝酸钾的制备和提纯
西北大学基础化学实验
一、实验目的
1、观察验证盐类溶解度和温度的关系; 观察验证盐类溶解度和温度的关系; 2、利用物质溶解度随温度变化的差别, 利用物质溶解度随温度变化的差别, 学习用转化法制备硝酸钾; 学习用转化法制备硝酸钾; 3、熟悉溶解、蒸发、结晶、过滤等技术, 熟悉溶解、蒸发、结晶、过滤等技术, 学会用重结晶法提纯物质。 学会用重结晶法提纯物质。
西北大学基础化学实验
注意事项
1 、 将 NaNO321g,KCl18.5g, 放 入 烧 杯 中 , 加 入 21g KCl18. 35mL蒸馏水,使固体刚好全部溶解。 35mL蒸馏水,使固体刚好全部溶解。 2、待溶液蒸发至原来体积的2/3时,便要停止加热, 待溶液蒸发至原来体积的2 便要停止加热, 并趁热用热滤漏斗进行过滤。 并趁热用热滤漏斗进行过滤。 3、重结晶法提纯KNO3中,将粗产品放在烧杯中, 重结晶法提纯KNO 应加入计算量的蒸馏水直至晶体刚好全部溶解为止。
西北大学基础化学实验
2、重结晶法提纯KNO3 、重结晶法提纯KNO
将粗产品放在50mL烧杯中 将粗产品放在50mL烧杯中(留0.5g粗产品作纯 烧杯中( 0.5g 度对比检验用),加入计算量的蒸馏水并搅拌之, ),加入计算量的蒸馏水并搅拌之 度对比检验用),加入计算量的蒸馏水并搅拌之, 用小火加热,直至晶体全部溶解为止。然后冷却溶 用小火加热,直至晶体全部溶解为止。 液至室温,待大量晶体析出后减压过滤, 液至室温,待大量晶体析出后减压过滤,晶体用滤 纸吸干,放在表面皿上称重,并观察其外观。 纸吸干,放在表面皿上称重,并观察其外观。
