基因转化方法和转基因植株鉴定全共36页文档
转基因植物的检测鉴定方法、遗传转化技术及新技术

PCR检测
• PCR是在体外快速特异地扩增目的基因DNA片段 的有效方法。能在几小时内使pg水平的起始物达 到ng水平,扩增产物经琼脂糖凝胶电泳,溴化乙锭 染色后很容易观察,不通过杂交分析就可以鉴定出 基因组中的一些顺序。
• 但由于PCR扩增十分灵敏,有时会出现假阳性扩 增,因而对外源基因是否整合需要进行扩增产物 的Southern杂交。
*已获得专利许可
42
Site-specific recombinasemediated transgene excision
loxP
Cre
Transgene
loxP
loxP
Cre
Transgene
llooxP
loxP
43
外源基因去除(Gene-deletor)
• “外源基因去除”技术的要点之一是在目标植 物中加入了受DNA调空片段启动子控制的特殊基 因,该基因在启动子的作用下,可根据科学家的 意愿,在需要的时间和部位将外源基因和自身从 转基因植物中切掉,从而使转基因作物的花粉、 种子、果实不再含有外来基因,或将外来基因从 人们所需食用的部分(如植物的茎、叶、块茎) 彻底清除掉,达到用转基因作物生产出非转基因 食品的目的,从根本上解决了长期困扰人们的转 基因植物基因扩散问题和转基因食品的安全性问 题。
ATP
dsRNA
siRNA
蛋白复合物
RISC
靶 正义链
40
mRNA
3、无选择标记转化
• 可消除选择标记基因对转基因作物安全性 方面的影响
• 可消除选择标记基因对重复多基因转化叠 加所带来的困难
41
marker-free转基因植株
• 共转化法*(基因枪与农杆菌转化) • 转座元法 • 重组酶法* • MAT(Multi-auto transformation)法* • 替代法*
植物基因转化及转基因植物的分析与鉴定

植物基因转化及转基因植物的分析与鉴定〖实验目的〗1.了解创建烟草突变体库的方法;2.理解每种方法的基本原理;3.掌握农杆菌介导的转基因方法以及转基因产物筛选和鉴定的基本过程..〖实验原理〗随着越来越多植物的全基因组测序工作的完成;在此基础上开展功能基因组的研究是目前的核心研究内容之一..植物插入突变体库的建立是功能基因组研究的一个重要内容;在此基础上也能进行正向遗传学及反向遗传学的研究..在创制突变体的策略上;传统方法是使用物理或化学诱变方法获得;其优点是可在尽可能短的时间内获得饱和突变体..与传统的物理和化学诱变方法相比;生物诱变T-DNA和转座子插人诱变通常可标记突变基因;从而较为容易地分离鉴定靶基因..最近数年;通过农杆菌介导的T-DNA插入突变已成为国际公认的植物功能基因组学的主要研究方法之一..烟草是植物基因组研究的一种模式植物;其突变体库的创建是烟草功能基因组学研究中的重要内容;其目的是通过大规模的突变体库平台快速全方位的了解基因组中各个基因的功能..突变体的创制是遗传学研究的基础;也是分离基因和基因功能鉴定的最要途径..通过诱导培养;使烟草产生愈伤组织;利用土壤农杆菌感染愈伤组织;实现T-DNA标签在烟草愈伤组织基因组中大量随机插人;利用植物细胞的全能性;经过抗性筛选;诱导分化;从抗性愈伤组织获得烟草突变体再生植株;获得各突变体的纯合材料;从而建立烟草突变体的数据库;然后分析突变性状与T-DNA的共分离关系;存在共分离的材料用适当的Tail-PCR克隆技术获得T-DNA的侧翼基因组序列;用其作探针筛选基因文库;获取目标基因或克隆;再进行下一步的分析图实验4-1..T-DNA 载体构建转化植物T1;T-DNA杂合子收获T2种子筛选T2;获突变子;应为3:1分离确定T-DNA与突变型共分离的个体产生纯合后代克隆T-DNA两侧的植物DNATail PCR利用侧翼DNA序列作探针从该植物的cDNA文库中钓取基因基因功能的验证遗传互补测验;分离的野生基因转化突变体;回复功能图实验4-1 T-DNA标签克隆基因的基本流程TAIL-PCR分离法是利用多个嵌套的T-DNA插入序列特异性引物根据T-DNA中靠近右边界处的核苷酸序列设计的引物;Tm值57-62℃和一个短的随机简并引物AD;Tm值44-46℃组合;以突变体基因组DNA为模板;进行多次PCR反应;采取高温特异性扩增与低温随机扩增相间进行的方法;最后获得T-DNA插入侧翼区特异性扩增片段实验图4-2;可作为探针;筛选分离基因.. TAIL-PCR分离法可以降低非侧翼区特异产物的背景;同时它可以产生2个以上嵌套的目的片段;与其它方法相比TAIL-PCR方法具有简便、特异、高效、快速和灵敏等特点;已经在拟南芥和水稻等植物中获得了成功及广泛的应用..实验图4-2 TAIL-PCR反应流程图本实验用含T-DNA载体质粒pCAMBIA1301的LBA4404农杆菌菌株转染烟草愈伤组织;让T-DNA随机插入烟草的基因组中形成T-DNA突变体;通过PCR特异扩增HPT基因片段来鉴定转基因烟草; 以TAIL-PCR法获得转基因烟草突变体的侧翼基因片段;测序后将获得侧翼基因片段的序列与GeneBank中的已知序列对比;获得功能基因的全序列..〖仪器、材料和试剂〗一仪器高速冷冻离心机;PCR仪;超净工作台;恒温摇床;隔水式恒温培养箱;光照培养箱;紫外可见分光光度计;凝胶成象仪或Dark Reader;恒温水浴锅;微孔加热器;电泳仪;水平板电泳槽;天平;酸度计;旋涡混合器..二材料烟草幼苗;含T-DNA载体质粒pMD83rc的LBA4404农杆菌菌株;Ex-taq DNA 聚合酶;DNA 1kb laddeer;GoldView核酸染料..三试剂1. 2×CTAB提取液100mmol/L Tris-HCl pH8.02%w/vCTAB1.4mol/L NaCl40mmol/L b-巯基乙醇20mmol/L EDTA2. TE缓冲液10mmol/L Tris-HCl pH8.01mmol/L EDTA3. 50′TAE电极缓冲液 1000mlTris 54g硼酸 27.5g0.5mol/L EDTA 20ml4. 10%次氯酸钠5. 氯仿:异戊醇V:V;24:16. 70%乙醇7. 溶液I:50 mmol/L葡萄糖;25 mmol/L Tris.HClpH8.0;10 mmol/L EDTApH8.0100ml8. 溶液III:60ml 5mol/L乙酸钾;11.5ml 11.5%冰乙酸;28.5ml无菌水100ml9. 溶液II:分别配制0.4 mol/L NaOH和2%SDS溶液各30ml;用时1:1混合10. LB 液体培养基配制每升培养基;应在950mL 去离子水中加入:胰蛋白胨bacto-typtone 10g酵母提取物bacto-yeast extract 5gNaCl 10g摇动容器直至溶质完全溶解;加入200uL 5mol/L NaOH 调节pH 至7.0;加入去离子水至总体积为1升;121℃高压灭菌20分钟..11. MS 基本培养基大量元素 mg/L 微量元素 mg/L 有机营养 mg/LNH 4NO 3 1650 KI 0.83 甘氨酸2.0KNO 3 1900 H 3BO 3 6.2 烟酸0.5CaCl 2·2H 2O 440 MnSO 4·4H 2O 22.3 盐酸吡哆醇Vb 6 0.5MgSO 4·7H 2O 370 ZnSO 4·7H 2O 8.6 盐酸硫胺素Vb 1 0.lKH 2PO 4 170 NaMoO 4·2H 2O 0.25 肌醇100CoCl2·6H2O 0.025CuSO4·5H2O 0.025FeSO4·7H2O 27.8配制方法母液:大量元素50× 400mL硝酸铵 33g;硝酸钾 38g;磷酸二氢钾 3.4g;七水合硫酸镁 7.4g;铁元素100× 200mL七水合硫酸亚铁 0.556g;七水合EDTA二钠 0.746g;有机营养100× 200mLGly 0.040g;VB1 0.002g;VB6 0.010g;肌醇 2g;烟酸 0.010g;微量元素1000× 200mL碘化钾 166mg;硼酸 1240mg;一水合硫酸锰 3380mg;七水合硫酸锌1720mg;二水合钼酸钠 44mg;五水合硫酸铜 5mg;六水合氯化钴 5mg;氯化钙50× 400mL 氯化钙8.8g12. 愈伤组织诱导与分化培养基:MS基本培养基+ 0.2mg/L 6-BA+0.02mg/L NAA + 3%蔗糖+ 0.6%琼脂其中6-BA 取25mg用少量1M NaOH溶解后定容到50mL;NAA取25mg用少量1M NaOH溶解后定容到50mL;2;4-D取50mg用少量1M NaOH溶解后定容到100mL;以上激素母液均为0.5mg/mL13. 筛选培养基:MS基本培养基+0.2mg/L 6-BA + 0.02mg/L NAA+3%蔗糖+0.6%琼脂+100mg/L羧苄青霉素14. 抗生素母液的配制KANA50mg/mL 1g KANA溶于20mL蒸馏水;RIF50mg/mL 0.25g RIF溶于少量乙醇再定容至50mL;STR30mg/mL 0.6g STA溶于20mL蒸馏水;羧苄青霉素100mg/mL 2g羧苄青霉素溶于20mL蒸馏水..潮霉素B50mg/mL 可以直接购买〖实验步骤〗I 烟草外植体的无菌培养和诱导再生1. 烟草叶片预培养:取烟草完全展开的幼叶;用自来水洗净晾干..在超净工作台中将叶片浸于70%酒精中30秒;然后移入10%的次氯酸钠溶液中5~10分钟消除外植体表面的微生物..无菌水至少洗涤3次消毒液对外植体有很大伤害;必须清洗干净;每次停留3~5min..将无菌叶片剪成0.5cm×0.5cm大小块或用 6mm打孔器凿成圆盘..2. 烟草叶片的诱导再生:自行设计MS培养基中的NAA、6-BA植物激素浓度;诱导烟草叶片生根或生芽;将上述处理过的无菌叶片接种在含有不同浓度植物激素的MS固体培养基中;每周定期观察并更换培养基..II 转基因烟草的培养1. 农杆菌的培养:将含T-DNA载体的农杆菌单菌落接种到20ml LB液体培养基中Kana 50ug/ml、RIF、STR; 27℃;180r/min振摇培养过夜..将2ml菌液转入20ml LB液体培养基中;与上述的相同条件培养6小时左右;使菌液达到OD=0.2~0.5;用来侵染烟草叶片 ..6002. 烟草叶片预培养:取烟草完全展开的幼叶;用自来水洗净晾干..在超净工作台中将叶片浸于70%酒精中30秒;然后移入10%的次氯酸钠溶液中5~10分钟消除外植体表面的微生物..无菌水至少洗涤3次消毒液对外植体有很大伤害;必须清洗干净;每次停留3~5min..将无菌叶片剪成0.5cm×0.5cm大小块或用 6mm打孔器凿成圆盘..3. 愈伤组织转化:在80r/min摇床上旋转浸染5~10分钟..将叶外植体置于无菌滤纸上吸去多余的菌液如果叶片粘附细菌过多;可以在无菌水中漂洗1~2次..4. 共培养:将侵染过菌液的叶片接种在MS愈伤组织诱导和分化培养基上;在26℃黑暗条件下共培养3天..5. 筛选培养与分化:将共培养处理的烟草叶片转移到凝固后的筛选培养基上100ug/L羧苄青霉素和50ug/L潮霉素B;羧苄青霉素起到抑制农杆菌生长的作用..如果农杆菌生长未被抑制;农杆菌将抑制叶外植体的生长..每隔3~4天继代一次;培养条件为;光照2000lx;温度26℃;日照16h..4周后转基因细胞分裂生长形成大量愈伤组织并有根、芽分化..接种烟草叶片于无激素的MS培养基上培养;培养条件同上;同时作为对照实验无愈伤组织生长和器官分化..Ⅲ转基因烟草的检测1. 剪取培养后的转化烟草和前期实验未转基因烟草叶片小片;液氮中研磨至粉末状;加入0.5mL65℃预热CATB抽提液65℃水浴抽提30min;间歇混匀;2. 取上清各加入0.5mL氯仿异戊醇体积比24:1去除蛋白;12000rpm离心10min;3. 取上清加入1体积预冷异丙醇至-20℃出沉淀30~60min;8000rpm离心15min;4. 弃上清;70%乙醇洗涤2次干燥;避光保存;5. 加入15μL蒸馏水溶解并电泳检测0.7%琼脂糖凝胶电泳;6. 提取pMDC83rc质粒:13-5ml过夜菌12000rpm离心1min;弃上清;2加300μL预冷溶液I;颠倒混匀6-8次;3加300μl新鲜不预冷溶液II;颠倒混匀6-8次;4加300μl预冷溶液III;颠倒混匀6-8次;512000 rpm 15min;转移上清液;6加入0.5倍体积的异丙醇;混匀;室温放置3min;如上离心12min;7弃上清;70%乙醇洗沉淀;8空气干燥;20ml 蒸馏水溶解;-20℃贮存..7. 对提出的基因组DNA进行PCR扩增;引物和扩增体系同上述的PCR步骤;GFP引物GFP-F: 5’- GCGGCGATGAGTAAAGGAGAAGAAC-3’;GFP-R: 5’-TTAGTGGTGGTGGTGGTGGTGTTTG-3’1在0.2mlPCR管中;按照下表配制PCR反应体系25μL..2按如下程序对转基因烟草、未转基因烟草和阳性质粒进行PCR扩增..8. 琼脂糖凝胶电泳检验PCR产物9. 配制1%琼脂糖凝胶; PCR产物10μL上样;同时用2μL DNA Marker作为DNA相对分子质量标准..恒压120V电泳20min..在凝胶成像系统下察看结果T-DNA载体质粒含有绿色荧光蛋白GFP基因;扩增产物为GFP 基因的片段;长735bp..10. 剪取相同株烟草小叶片放在紫外灯和荧光显微镜下观察;是否产生绿色荧光..。
转基因植物的鉴定

转录水平上的检测主要方法是Northern 杂交,它是以DNA或RNA为探针,检测 RNA链。 和Southern杂交相同,Northern杂交包括 斑点杂交和印迹杂交。
也可用RT-PCR(reverse transcribed PCR)方 法检测外源DNA在植物体内的转录表达。 其原理是以植物总RNA或mRNA为模板进行 反转录,然后再经PCR扩增。 如果从细胞总RNA提取物中得到特异的cDNA 扩增条带,则表明外源基因实现了转录。 此法简单、快速,但对外源基因转录的最后 决定,还需与Northern杂交的实验结果结合。
ELISA与经典的同位素标记为基础的液 -液抗原-抗体反应体系不同之处在于 建立了固-液抗原抗体反应体系,并采 用酶标记,抗体与抗原的结合通过酶反 应来检测。 由于酶的放大作用,使测定的灵敏度极 高,可检测出1pg的目的物,同时酶反 应还具有很强的特异性。
探针与其互补的核苷酸序列杂交后,杂 交体也就带上了同样标记,可被检测出 来。 这样,以特定的已知核苷酸序列做探针, 就可以在诸多的核苷酸序列中,通过杂 交探测出与其互补的序列,因而分子杂 交是进行核酸序列分析,重组子鉴定及 检测外源基因整合表达的强有力手段。
它具有灵敏性高(可检出10-12g,即1pg DNA样品)、特异性强(可鉴别出20个 碱基对左右的同源序列)的特点,是当 前鉴定外源基因整合及表达的权威方法。 根据杂交时所用的方法,核酸分子杂交 又可分为印迹杂交、斑点(dot)杂交、 狭槽(slot)杂交和细胞原位(in situ) 杂交等。
PCR检测所需的模板量仅为10ng以内, 而且粗提的DNA就可以得到良好的扩增 效果,因而这一技术的出现为外源基因 整合的检测提供了便利条件,尤其是在 转化材料少又需及早检测的时候。 但由于PCR扩增十分灵敏,有时会出现 假阳性扩增,因此检测的只是初步结果。
植物转化及转基因的检测

复杂
复杂
简单
昂贵
昂贵
便宜
低
高
低
可行
广泛
广泛
Agrobacterium tumefaciens
Ti plasmid with the new gene
+
cell’s DNA
Agrobacterium
Plant cell
Transformation
The new gene
Tr2a0n20s/6g/20enic plant
Calli are placed in vacuum chamber, Helium pressure shot DNA into cells
Gene gun
vacuum chamber
Calli remain on the high osmotic media for 2020h2o0u/6r/s20 following shooting.
• 早衰
生长期缩短、早孕早穗等
• 对环境敏感
对水、肥、温度、光照敏感
Transformation is performed by gene gun meia prepare calli for transfomation
2020/6/20
福建省农业遗传工程重点实验室
DNA with desired gene and antibiotic resistance is coated onto the surface of gold particles.
借助标记基因和报告基因的快速筛选和纯合
抗生素抗性基因
新霉素磷酸转移酶基因(nptII)——Kanr,G418r
双氢叶酸脱氢酶基因 潮霉素磷酸转移酶基因(hpt)——hygr 氯霉素乙酰转移酶基因(cat)——Cre
植物转化及转基因的检测

※从重组子中,提取DNA,进一步分析鉴定转化子。
表达载体构建
※将目的基因克隆到表达载体上,使之在新的遗传背景下实现功能表达。
植物基因工程的主要步骤
植物遗传转化
※ 用生物或物理方法将目的基因转入植物受体中
转基因植物的鉴定
※ 分子水平、个体水平、群体水平检测目的基因的遗传、表达及其稳定性
转基因作物的育种利用
从处于分蘖中期的供试转基因抗虫水稻植株上,随 机取三个粗壮分蘖剪取3-4cm长的叶片一片。将叶片 移置长玻璃管6.5cm×1.5cm)内经0.1g/l苯骈咪唑保 鲜液浸渍过的滤纸片上,每管分别接入5头刚孵化的蚁 螟,管口塞紧脱脂棉。自开始接虫后,第二、四、六、 八天分别考察或测定幼虫死亡率。期间向管内增添新 鲜的叶片。
对照
直链淀粉含量 %
9.7 10.9 9.6 9.9 9.2 9.3 9.6 10.4 8.9 8.9 10.8 9.2 12.8
比对照降幅 %
24.51 14.96 25.26 22.66 28.12 27.70 24.65 18.50 30.31 30.31 15.83 28.20
转基因株系的遗传分析及纯合
植物转化及转基因的检测
2021/4/8
福建省农业遗传工程重点实验室
基因工程的概念
利用DNA体外重组或PCR扩增技术从某种 生物基因组中分离感兴趣的基因,或是用人工 合成的方法获取基因,然后经过一系列切割, 加工修饰,连接反应形成重组DNA分子,再将 其转入适当的受体细胞,以期获得基因表达的 过程.
Calli are placed in vacuum chamber, Helium pressure shot DNA into cells
Gene gun
植物基因转化与转基因植株鉴定
3. 目标基因 PCR 扩增 采用 PrimeSTARTM HS DNA Polymerase 高保真酶从玉米 cDNA 中扩增 ZmMKK4 全长编码序列(GenBank 序列号:NM_001158890.1)。 ZmMKK4 扩增引物:F-ZmMKK4,R-ZmMKK4。 25μL 反应体系为:5 μL 5× PrimeSTAR Buffer (Mg2+ Plus),2 μL dNTP Mixture (各 2.5 mM),1μL 上游引物(5μM),1μL 下游引物(5μM),1 μL cDNA,0.25 μL PrimeSTARTM HS DNA Polymerase,加 ddH20 至 25μL。PCR 扩增程序为 98C 98C 58C 72C 72C 1~3 min 10 s 15 s 1.5 min 10 min
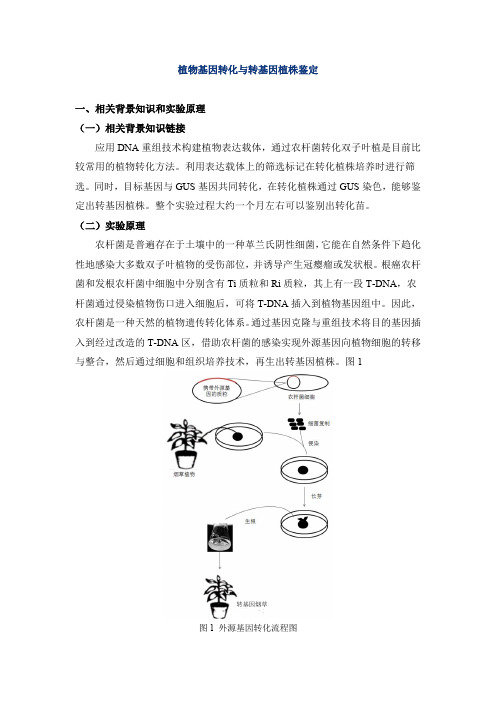
图 1 外源基因转化流程图
三、实验目的和实验要求 目的: 学习和掌握从基因分离克隆到植株转化及转基因植株的筛选整个实验 体系。 要求: 综合利用前面的单个实验环节所掌握的知识, 获得完整的实验理念, 并在实验过程中学会设计、构建适合的载体并将外源基因转化植株。 四、实验材料和方法 (一)实验仪器 PCR 仪, 凝胶成像系统, 台式高速离心机, 台式高速冷冻离心机, DU 640 紫 外分光光度计,UV-2450 分光光度计,精密 pH 计,微量移液器,控温摇床,电 子天平,制冰机,-80C 超低温冰箱,电热恒温水浴锅,自动电热压力蒸汽灭菌 器,超净工作台,光照培养箱等 (二)试剂及配方 Trizol试剂,RevertAid™ First Strand cDNA Synthesis Kit,DNase I,2× PCR Master Mix,FastDigest 限制性内切酶,T4 DNA Ligase,PrimeSTARTM HS DNA Polymerase 高保真酶, pEASY-Blunt C, 质粒提取试剂盒 (E.Z.N.A. Gel Extraction Kit) , 凝胶回收试剂盒 (E.Z.N.A. Plasmid Mini Kit I) , DNA提取试剂盒, Kanamycin (Kan) ,Ampicillin(Amp) ,Carbenicillin(Cb) ,电泳缓冲液,LB培养基、YEB 培养基,烟草培养基如下表1.
植物遗传转化方法和转基因植株的鉴定

植物遗传转化方法和转基因植株的鉴定金万枚 巩振辉 李桂荣 张桂华(西北农业大学 陕西杨陵 712100)提 要 对现有主要植物遗传转化方法和转基因植株的鉴定进行了比较分析,并对它们在植物遗传转化中的前景进行了展望。
关键词 植物;遗传转化方法;转基因植株;转基因植株鉴定 人们可通过有性杂交,物理化学诱变或自然变异来创造新物种和新品种。
但常常存在着杂交不亲和或杂种不育而造成的生殖隔离,也存在诱变的非定向性。
采用遗传转化技术,将所要求的外源目的基因导入受体植株,并通过对转化植株的鉴定选择,从而创造出人类所需要的新品种或新物种。
植物遗传转化方法和转基因植株的鉴定是植物遗传转化的重要环节。
关*国家自然科学基金资助,项目编号39770522。
优质小麦品质的决定性因素;其次要有较强的生活力,保证营养生长健壮。
3.3.2 播种 研究表明,适当晚播和增加密度能在稳定产量的基础上提高小麦品质。
根据我省实际,关中优质专用小麦播量应控制在每亩6~8kg,渭北应控制在9kg。
播期可依据实际情况较当地常规适播期推迟2~3d。
提倡机械以精量半精量播种。
3.4 灌水灌水对小麦品质的影响比较复杂,尤以抽穗至成熟期间影响最大,此期灌水会降低蛋白质含量,对沉淀值等加工品质也不利,但如果氮量充足或灌水与施氮结合则蛋白质含量不下降或下降很慢。
因而施肥上的前氮后移也为后期合理灌水提供了条件。
中国农业大学曾研究出一套节水高产栽培技术,小麦春季可只灌一次,并将灌水时期移至孕穗期;若特别干旱,可在拔节期和开花期分别灌水。
这种灌水制度与前氮后移的施肥方法配合起来,有利于优质专用小麦生产。
3.5 地膜覆盖地膜覆盖栽培能使小麦产量大幅度提高,对品质的影响这方面研究还较少。
陕西省农科院小麦中心的初步研究表明,小麦覆膜后籽粒容重有不同程度提高;蛋白质含量与正常露地播种没有差异;覆膜不影响不同生态类型品种的干、湿面筋值和沉淀值;但不同生态类型品种之间籽粒容重、蛋白质含量、干、湿面筋值和沉淀值存在较大差异。
植物细胞转基因技术PPT课件

第37页/共39页
谢谢!
第38页/共39页
感谢您的观看!
第39页/共39页
第24页/共39页
优点:
➢ 适用范围广,不依赖组织培养人工再生植株;
➢ 可直接获得转基因种子,育种时间短,在鉴
定 时可直接针对目的性状的表现型来进行,简
单快 捷;
➢ 转化速度较快,变异性状稳定较快;
➢ 方法简单,不需要复杂昂贵的仪器设备。
第25页/共39页
缺点:
➢转化受体受植物花期的限制,同时必须充分了
粒和 Ri质粒就成为植物基因转化的理想载体系统。
第5页/共39页
➢T-DNA
T-DNA可以将其携带的外源基因整合到植 物基
因组中,T -DNA 上较重要的是 T 区两端左右 边
界各为 25bp 的重复序列。其中14bp 是中心, 分
10bp 和4bp 两组,是完全保守的。这两个边界 是
T -DNA 转移所必需的。其中尤以右边界最为 重
优点:
➢技术较成熟,转化效率高 ➢操作简单,不需要特殊仪器,培养周期短 ➢外源基因多以单拷贝或低拷贝插入受体细胞,稳
定性好,减少了共抑制等基因沉默现象。
➢可将较大片段DNA完整地转移到植物基因组中
等。
第9页/共39页
缺点:
➢主要转化双子叶植物。 ➢T-DNA可以在植物染色体的任何区域内插入,
有可能导致有益基因的插入失活。
0.5nm),在显微镜下将外源DNA注射入植物细胞 或原生质体中的一种直接而完善的方法。
第30页/共39页
➢该方法是Pena等1987年首创的,在用此方法进
行
基因导入时,通常需要把原生质体或培养的细 胞固
定在琼脂或低熔点的琼脂糖上,或用聚赖氨酸 处理
