甲烷氧化的化学方程式
甲烷的氧化反应方程式

甲烷的氧化反应方程式
甲烷是一种无色、无味的气体,由碳和氢原子构成。
它是一种重要的天然气,广泛应用于供暖、烹饪和工业生产中。
然而,甲烷也是一种强效的温室气体,对全球气候变化产生重要影响。
因此,研究甲烷的氧化反应方程式对于减缓气候变化具有重要意义。
甲烷的氧化反应方程式如下:
CH4 + 2O2 -> CO2 + 2H2O
这个化学方程式描述了甲烷在氧气存在下发生的完全燃烧反应。
在这个反应中,甲烷分解为二氧化碳和水,释放出大量的能量。
这个反应是放热反应,因为它产生了热量和光能。
甲烷的氧化反应是一个重要的氧化反应,在自然界和工业生产中广泛存在。
这个反应在自然界中发生在一些低氧环境中,例如湿地和沼泽地带,这里的微生物可以利用甲烷为能源生长。
在工业生产中,甲烷的氧化反应也是很重要的,例如在天然气的燃烧和工业气体的制备中。
总之,甲烷的氧化反应方程式是一个重要的化学反应方程式,在自然界和工业生产中都具有广泛的应用。
了解它的机理和特性能够帮助我们更好地理解气候变化和可持续发展的挑战。
- 1 -。
(完整版)高中有机化学方程式总结
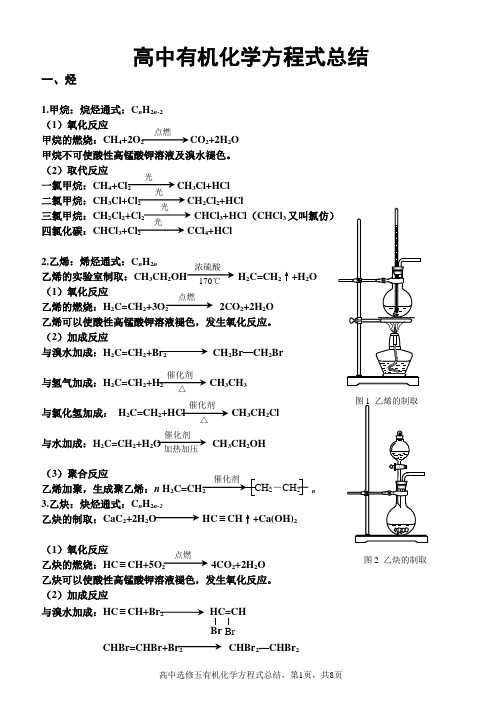
高中有机化学方程式总结一、烃1.甲烷:烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯:烯烃通式:C n H 2n乙烯的实验室制取:CH 3CH 2OH H 2C=CH 2↑+H 2O (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2 n3.乙炔:炔烃通式:C n H 2n-2乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br 2 HC=CHBr点燃光光光光浓硫酸170℃ 点燃催化剂△催化剂加热加压 2-CH 2点燃图2 乙炔的制取Br 催化剂△与氢气加成:HC ≡CH+H 2 H 2C=CH2与氯化氢加成:HC ≡CH+HCl CH2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯:苯的同系物通式:C n H 2n-6(1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
甲烷高温下分解的化学方程式

甲烷高温下分解的化学方程式
甲烷,也被称为潜水气,是一种常见的天然气组分,它的分子由一个碳原子和四个氢原子组成。
甲烷在高温下分解的化学方程式是:CH4(g)=> C(s)+ 2H2 O(g)。
甲烷在高温下分解的过程中,碳原子在高温环境下发生氧化,而氢原子经历完全燃烧,两个过程发生的同时,造成了甲烷分解成一份含氧化物、一份碳和两份水的产物。
甲烷需要高温下分解,这有助于加速反应,减少反应时间。
甲烷分解反应由反应强度决定,如果反应温度不够,反应就会减缓甚至不发生。
因此,通过恰当的调节温度,可以充分减少甲烷分解反应的时间,提高分解效率。
甲烷分解产生的产物碳和水,可用作水泥和水泥的混合物成分,也可以用作天然气的混合物成分,增加燃烧效率。
此外,温度调节也可以提高反应的活性,显著增加反应速率,实现快速分析。
总而言之,甲烷是一种常见的天然气成分,它在高温下进行分解时,会经历氧化、燃烧以及分解产物的混合,它的产物可用于几种不同的应用,可通过恰当的温度调节来实现快速分解。
高中化学方程式(烃、卤代烃、醇、苯、醛)

有机化学方程式总结一、烃1.甲烷烷烃通式:(1)氧化反应甲烷的燃烧:。
甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH4+Cl2。
二氯甲烷:CH3Cl+Cl2。
三氯甲烷:CH2Cl2+Cl2。
四氯化碳:CHCl3+Cl2。
2.乙烯乙烯的制取:。
烯烃通式:(1)氧化反应乙烯的燃烧:乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应(3)聚合反应乙烯加聚,生成聚乙烯:。
3.乙炔乙炔的制取:。
炔烃的通式:。
(1)氧化反应乙炔的燃烧:。
乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应图1 乙烯的制取图2 乙炔的制取与溴水加成:HC CH+Br 2CHBr=CHBr+Br 2与氢气加成:与氯化氢加成:(3)聚合反应氯乙烯加聚,得到聚氯乙烯: 。
乙炔加聚,得到聚乙炔: 。
4.苯苯的同系物通式:(1)氧化反应苯的燃烧: 。
苯不能使溴水和酸性高锰酸钾溶液褪色。
(2)取代反应①苯与溴反应②硝化反应(3)加成反应5.甲苯(1)氧化反应甲苯的燃烧: 。
甲苯不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色。
(2)取代反应(与HNO 3)甲苯硝化反应生成2,4,6-三硝基甲苯,简称 ,又叫 ,是一种 色晶体,不溶于水。
它是一种 ,广泛用于 。
注意:甲苯在光照条件下发生侧链的取代,而在催化剂条件下发生苯环上的取代。
注意:制取乙烯、乙炔均用排水法收集;乙烯、乙炔的加成反应(3)加成反应二、烃的衍生物6.溴乙烷纯净的溴乙烷是 ,沸点 ,密度比水 。
(1)取代反应溴乙烷的水解: 。
(2)消去反应:。
7.乙醇(1)取代反应:①与钠反应 。
②与HBr 反应 。
(2)氧化反应①催化剂催化氧化:②燃烧(3)消去反应C 2H 5OHC 2H 5-OH + OH-C 2H 58.苯酚苯酚是 ,露置在空气中会因 。
苯酚具有 气味,水中溶解度 ,易溶于 。
苯酚有 ,是一种重要的化工原料。
如果苯酚沾到皮肤上,应该用 处理。
甲烷燃烧化学方程

甲烷燃烧化学方程
甲烷是一种无色、无味、易燃的气体,也是天然气的主要成分之一。
它的化学式为CH4,由一个碳原子和四个氢原子组成。
甲烷在空气中可以燃烧,产生二氧化碳和水,释放出大量的热能。
下面是甲烷燃烧的化学方程式:
CH4 + 2O2 → CO2 + 2H2O + 热能
这个方程式告诉我们,当甲烷和氧气在适当的条件下混合并点燃时,它们会发生化学反应,产生二氧化碳和水。
这个反应是一个氧化反应,因为甲烷中的碳原子失去了电子,氧气中的氧原子获得了电子。
这个反应也是一个放热反应,因为它释放出了大量的热能。
甲烷燃烧的化学方程式不仅告诉我们反应的产物和反应类型,还可以帮助我们计算反应的热能变化。
根据热力学定律,反应的热能变化等于反应物的热能减去产物的热能。
在这个反应中,甲烷和氧气的热能是化学键的能量,而二氧化碳和水的热能也是化学键的能量。
因此,我们可以使用这个方程式来计算反应的热能变化,从而了解反应的热效应。
甲烷燃烧的化学方程式不仅在化学实验中有用,也在工业生产和能源利用中有广泛的应用。
例如,在天然气的利用过程中,甲烷燃烧是一种常见的方式,可以产生大量的热能和电能。
此外,甲烷燃烧还可以用于燃气灶、燃气发动机等领域,为人们的生活和工作提供
便利。
甲烷燃烧的化学方程式是化学学习中的重要内容,它不仅可以帮助我们了解化学反应的基本原理,还可以应用于工业生产和能源利用中。
我们应该认真学习和掌握这个方程式,为未来的学习和工作打下坚实的基础。
甲烷和氧气反应

甲烷和氧气反应甲烷和氧气反应目录1. 引言2. 甲烷和氧气的化学性质与结构3. 甲烷和氧气的反应机制4. 甲烷和氧气反应的应用5. 结论1. 引言甲烷和氧气是我们生活中常见的化学物质。
它们在自然界中广泛存在,也被广泛应用于工业和能源领域。
本文将探讨甲烷和氧气的反应机制及其应用。
2. 甲烷和氧气的化学性质与结构甲烷的化学式为CH4,是一种无色、无味的气体。
它是碳的最简单的有机化合物,也是天然气的主要成分之一。
氧气的化学式为O2,是一种无色、无味的气体。
它是空气中的重要成分,占据约20%的体积。
甲烷分子由一个碳原子与四个氢原子组成,呈四面体结构。
氧气分子由两个氧原子组成,呈线性结构。
甲烷和氧气的分子结构决定了它们的化学性质和反应机制。
3. 甲烷和氧气的反应机制甲烷和氧气之间的反应是一种燃烧反应,也称为甲烷氧化反应。
该反应的化学方程式为:CH4 + 2O2 → CO2 + 2H2O在该反应中,甲烷和氧气首先发生活化作用,生成一种称为反应中间体的物质。
这种反应物生成的反应中间体会不断地与其它反应物再次发生反应,最终生成产物二氧化碳和水。
甲烷氧化反应是一个放热反应,释放大量的能量。
这也是为什么甲烷作为燃料被广泛使用的原因之一。
反应中产生的二氧化碳和水是相对无害的产物,不会产生污染。
4. 甲烷和氧气反应的应用甲烷和氧气反应的应用十分广泛。
以下是一些常见的应用:4.1 能源和燃料甲烷是一种重要的能源和燃料。
它广泛应用于家庭供暖、炉灶燃烧和发电厂等领域。
通过甲烷和氧气的燃烧反应,可以产生大量的热能,用于提供能源。
4.2 化工工业甲烷和氧气反应也被应用于化工工业。
例如,在制造甲醇和甲醛等有机化合物的过程中,甲烷和氧气反应被用作重要的合成反应。
这些有机化合物又可作为化工原料用于制造其他化学品。
4.3 环境控制甲烷是一种温室气体,对于地球的温室效应和气候变化具有重要影响。
通过甲烷和氧气的反应,将甲烷氧化为二氧化碳和水可以减少大气中甲烷的浓度,从而减缓温室效应。
甲烷方程式

甲烷方程式
甲烷的化学方程式有两个。
当甲烷完全燃烧时,其化学方程式为:
CH4+2O2=CO2+2H2O;当甲烷不完全燃烧时,其化学方程式为:
2CH4+3O2=2CO+4H2O。
甲烷是一种有机化合物,分子式是CH₄,分子量为16.043。
甲烷是最简单的有机物,也是含碳量最小(含氢量最大)的烃。
甲烷在自然界的分布很广,可用来作为燃料及制造氢气、炭黑、一氧化碳、乙炔、氢氰酸及甲醛等物质的原料。
甲烷是天然气,沼气,坑气等的主要成分,俗称瓦斯。
甲烷也是天然气、沼气、油田气及煤矿坑道气的主要成分。
甲烷主要是作为燃料,如天然气和煤气,广泛应用于民用和工业中。
作为化工原料,可以用来生产乙炔、氢气、合成氨、碳黑、硝氯基甲烷、二硫化碳、一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和氢氰酸等。
甲烷在氧气中燃烧化学方程式

甲烷在氧气中燃烧化学方程式
当氧气少量时:2ch4+3o2→2co+4h2o,条件为点燃。
当氧气过量时:
ch4+2o2→co2+2h2o,条件为点燃。
甲烷是一种有机化合物,化学式是ch4,分子量为16,常温下是一种无色无味的气体,是天然气的主要成分。
甲烷在氧气中燃烧产生明亮的蓝色火焰,火焰上方的烧杯中有水珠出现,同时生成能
使澄清石灰水变浑浊的气体。
注意事项:
密闭操作,全面通风。
操作人员必须经过专门培训,严格遵守操作规程。
远离火种、热源,工作场所严禁吸烟。
使用防爆型的通风系统和设备。
避免气体外泄至工作场所空气中。
防止与氧化剂碰触。
在传输过程中,钢瓶和容器必
须中剧和跨接,避免产生静电。
运送时轻装重滚,避免钢瓶及附件损坏。
搭载适当品种和
数量的消防器材及外泄应急处置设备。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甲烷氧化的化学方程式
甲烷的氧化反应在空气中燃烧实验现象为剧烈燃烧,产生较明亮的淡蓝色火焰,并有水产生。
化学方程式有两种,一种是完全燃烧,一种是不完全燃烧。
(1)CH₄+2O₂=点燃=CO₂+2H₂O(完全燃烧)
(2)2CH₄+3O₂=点燃=2CO+4H₂O(不完全燃烧)
在标准状态下甲烷是一无色无味气体。
一些有机物在缺氧情况下分解时所产生的沼气其实就是甲烷。
扩展资料:
通常情况下,甲烷比较稳定,与高锰酸钾等强氧化剂不反应,与强酸、强碱也不反应。
但是在特定条件下,甲烷也会发生某些反应。
在室温有光作用下能发生反应;用光引发反应,吸收一个光子就能产生几千个氯甲烷分子;如有氧或有一些能捕捉自由基的杂质存在,反应有一个诱导期,诱导期时间长短与存在这些杂质多少有关。
点燃纯净的甲烷,在火焰的上方罩一个干燥的烧杯,很快就可以看到有水蒸气在烧杯壁上凝结。
倒转烧杯,加入少量澄清石灰水,振荡,石灰水变浑浊。
说明甲烷燃烧生成水和二氧化碳。
