分析化学3.3.1.3 配位滴定曲线
Y078-分析化学-第五章 配位滴定法 [兼容模式]
![Y078-分析化学-第五章 配位滴定法 [兼容模式]](https://img.taocdn.com/s3/m/fd1e3deecc22bcd127ff0c50.png)
F-:Al3+、Fe3+ Cl-:Ag+、 Hg2+
乙二胺四乙酸:EDTA
ethylene diamine tetraacetic acid
乙二胺四乙酸简称EDTA或EDTA酸,用H4Y表示
HOOCCH2 HOOCCH2
N-CH2-CH2-N
CH2COOH CH2COOH
Zn
2
4CN
Zn(CN)
2 4
显色剂 例如,邻二氮菲显色分光光度法测定铁:
Fe2+ + 3
NN
邻二氮菲
2+ NN 3
Fe
桔红色 max
滴定剂 例如:EDTA 络合滴定法测定水的硬度所 形成的Ca2+-EDTA络合物。
分析化学中的络合物
简单配体络合物
螯合物
多核络合物
Cu(NH
3
)
2 4
O
C H2C O CH2
(二) 配位反应的副反应及副反应系数
EDTA的副反应
酸效应 共存离子(干扰离子)效应
EDTA的副反应系数αY
酸效应系数αY(H) 共存离子(干扰离子)效应系数αY(N) Y的总副反应系数
1. 配位剂的副反应系数αY
Y
[Y'] [Y]
[Y']——未与M配位的EDTA总浓度(各种型体)
[Y]—— 能与M配位的游离的[Y4-]
(二) 配位反应的副反应及副反应系数
主反应: 副反应:
M
+
Y
L
OH - H +
N
MY
配位滴定曲线的名词解释

配位滴定曲线的名词解释配位滴定曲线,也称为配位滴定曲线分析,是化学分析中常用的一种方法。
它通过量化样品中特定化合物与滴定试剂之间的配位反应,来确定样品中所含物质的组成和浓度。
配位滴定曲线以滴定剂的体积为横坐标,反应的指标(例如溶液的pH值或溶液中反应物的浓度变化)为纵坐标,画出的曲线可以提供有关滴定反应的定量信息。
在配位滴定曲线分析中,常用的滴定剂包括酸碱、络合剂和氧化还原剂。
滴定剂经过稀释以一定速率滴定到待测溶液中,滴定过程中记录滴定剂的体积和反应指标的变化。
在滴定剂体积逐渐增加的过程中,滴定反应会发生,反应的指标会发生明显的变化。
当滴定反应达到了终点时,反应指标的变化会急剧改变,称为滴定终点。
配位滴定曲线的形状和特点与滴定反应的性质和滴定剂的性质有关。
因此,不同的滴定剂和滴定反应对应着不同类型的配位滴定曲线。
常见的配位滴定曲线类型包括酸碱滴定曲线、络合滴定曲线和氧化还原滴定曲线。
酸碱滴定曲线通常以酸碱指示剂的颜色变化作为反应指标。
酸滴定曲线一般呈现S型,如硫酸与氢氧化钠的滴定反应,当滴定剂的体积较小时,pH值变化不明显,然后在一定体积范围内pH值迅速改变,最后再次趋于变化较小。
而碱滴定曲线则相反,呈倒S型。
络合滴定曲线是用络合试剂滴定金属离子的化学反应得到的。
络合滴定曲线的特点是在某一维度上的数值波动较大,而其他维度上基本保持平稳,如铁离子与亚硫酸钠络合反应。
氧化还原滴定曲线以电位作为反应指标。
它可以通过记录滴定过程中氧化还原电位的变化来确定待测溶液中所含物质的浓度,例如硼氢化钠滴定碘酸钾溶液。
配位滴定曲线分析在实际应用中具有广泛的用途。
通过绘制与滴定剂体积和反应指标变化相关的曲线,可以确定待测溶液中所含物质的浓度。
此外,配位滴定曲线还可以用于确定滴定过程中出现的滴定误差,并根据曲线的形状和特征进行定量判断和分析。
需要注意的是,在进行配位滴定曲线分析时,应根据具体的实验条件和需求选择合适的滴定剂和反应指标,并严格控制实验过程中的操作技术和条件,以确保测试结果的准确性和可靠性。
分析化学智慧树知到答案章节测试2023年安徽中医药大学

第一章测试1.分析化学的任务有()A:形态分析B:结构分析C:定量分析D:定性分析答案:ABCD2.下列属于常量分析的是()A:大气中某污染物浓度为5.6 ppmB:测定某样品的含量为35.67%C:量取的体积为15.26 mlD:称取的质量为0.5823 g答案:BCD3.下列属于化学分析法的是()A:电化学分析法B:滴定分析法C:光谱分析法D:重量分析法答案:BD4.分析化学是研究物质的组成、含量、结构和形态等化学信息的分析方法及相关理论的一门科学。
()A:对B:错答案:A5.以物质的化学反应及其计量关系为基础的分析方法称为化学分析法。
()A:对B:错答案:A第二章测试1.指出下列各种误差中不属于系统误差的是()A:滴定时不慎从锥形瓶中溅出一滴溶液B:法码受腐蚀C:试剂不纯D:容量瓶与移液管未经过校准答案:A2.在滴定分析中滴定管未经校正属()A:仪器误差B:操作误差C:方法误差D:试剂误差答案:A3.在以下各项措施中,可以消除分析测试中的系统误差的是()A:进行仪器校正B:增大滴定消耗体积C:增加平行测定次数D:增加称样量答案:A4.不管什么物质,称量的绝对误差相等时,它们的相对误差也相同。
()A:错B:对答案:A5.偶然误差和系统误差均无法消除,但可通过反复多次测量减小这两种误差。
()A:错B:对答案:A6.准确度与精密度的关系是()A:精密度是保证准确度的充分条件B:准确度高要求精密度一定高C:精密度高,准确度一定高D:准确度高,精密度不一定高答案:B7.从精密度好就可以断定分析结果可靠的前提是()A:相对偏差小B:系统误差小C:平均偏差小D:偶然误差小答案:B8.分析天平每次读数误差为±0.0001 g,在一次称量中需读数2次,为使称量的相对误差要求≤0.1%,则称取的质量至少为()A:1.0000 gB:0.2000 gC:0.0200 gD:0.1000 g答案:B9.精密度是指相同条件下,平行测量的各测量值之间相互接近的程度。
第十讲-配位滴定法3

M+ Y
=
H+
N
HnY Y(H)
NY Y(N)
L H+
MY NLn N(L)
HnL L(H)
Y(N)=1+KNY[N] ≈KNY cN/ N(L)
Y(H)>Y(N) lgKMY=lgKMY-lgY(H) N被完全掩蔽
Y(N) > Y(H) lgKMY=lgKMY-lg Y(N)
0
0
50
100
150
200
T/ %
13
不同稳定性旳络合体系旳滴定
14
pM'
12 c = 0.020 mol/L
10 8 6 4 2
浓度一定 时,
K 增大10
倍, 突跃增 长 1 个pM 单位.
0
0
50
100
150
200
T/ %
14
二、 金属离子指示剂 a 指示剂旳作用原理
HIn+M
MIn + M
In(H)=1+[H+]/Ka2+[H+]2/Ka1Ka2
例7 计算pH=10.0 时EBT旳(pMg)t
已知: lgK(MgIn) = 7.0
EBT: 1=1011.6 2=1017.9
αIn(H) = 1 + 10-10.0+11.6 + 10-20.0+17.9 = 101.6
(pMg)t = lgK(MgIn) = lgK(MgIn) – lgαIn(H) = 7.0 – 1.6 = 5.4
MY + HIn
色A
色B
EDTA
配位滴定曲线
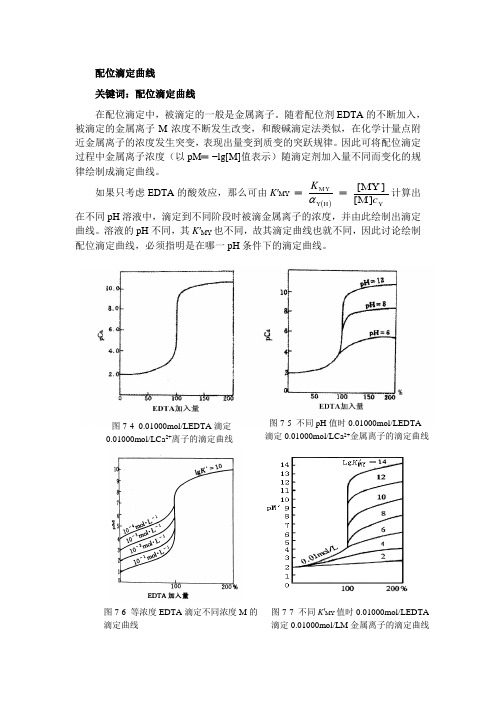
配位滴定曲线关键词:配位滴定曲线在配位滴定中,被滴定的一般是金属离子。
随着配位剂EDTA 的不断加入,被滴定的金属离子M 浓度不断发生改变,和酸碱滴定法类似,在化学计量点附近金属离子的浓度发生突变,表现出量变到质变的突跃规律。
因此可将配位滴定过程中金属离子浓度(以pM ═ −lg[M]值表示)随滴定剂加入量不同而变化的规律绘制成滴定曲线。
如果只考虑EDTA 的酸效应,那么可由K ′MY ═ ()H Y MY αK ═ ][][Y M MY c 计算出在不同pH 溶液中,滴定到不同阶段时被滴金属离子的浓度,并由此绘制出滴定曲线。
溶液的pH 不同,其K ′MY 也不同,故其滴定曲线也就不同,因此讨论绘制配位滴定曲线,必须指明是在哪一pH 条件下的滴定曲线。
图7-4 0.01000mol/LEDTA 滴定0.01000mol/LCa 2+离子的滴定曲线 图7-5 不同pH 值时0.01000mol/LEDTA 滴定0.01000mol/LCa 2+金属离子的滴定曲线 图7-6 等浓度EDTA 滴定不同浓度M 的 滴定曲线图7-7 不同K ′MY 值时0.01000mol/LEDTA滴定0.01000mol/LM 金属离子的滴定曲线图7-4是pH═12时,用0.01000mol/L EDTA标准滴定溶液滴定20.00mL 0.01000mol/L Ca2+溶液的滴定曲线。
0.01000 mol/L EDTA在不同pH时滴定0.01000 mol/L Ca2+的滴定曲线如图7-5所示。
对于等浓度的EDTA标准滴定溶液滴定不同浓度的金属离子M的滴定曲线如图7-6所示。
当条件一定时,MY配合物的K′MY值不同,滴定突跃也不同,如图7-7所示。
由滴定曲线可以看出,用EDTA滴定某离子M(如Ca2+)时,配合物的条件稳定常数和被滴金属离子的浓度是影响配位滴定pM突跃的主要因素:①对同一金属离子,在滴定允许的酸度范围内,pH值越大,配合物的条件稳定常数K′MY越大,化学计量点附近滴定的pM突跃越大(图7-5)。
分析化学第六章配位滴定法

第一节 概述
➢ 配位滴定法: 又称络合滴定法
以生成配位化合物为基础的滴定分析方法
➢ 滴定条件:
定量、完全、迅速、且有指示终点的方法
➢ 配位剂种类:
无机配位剂:形成分级络合物,简单、不稳定 有机配位剂:形成低络合比的螯合物,复杂而稳定 ➢ 常用有机氨羧配位剂 ——乙二胺四乙酸
乙二胺四乙酸:EDTA
➢ 结论:pH, [H] Y(H), [Y4] 副反应越严 pH Y( H) ; pH12Y(H) 1,配合物
练习
例:计算pH5时,EDTA的酸效应系数及对数值,若 此时EDTA各种型体总浓度为0.02mol/L,求[Y4 -]
解:
Y(H )1111 0 0 5 .3 04 1 1 0 1.3 0 0 1 4 60 .2
✓ 注:[Y’] ——EDTA 与 N 配合物平衡浓度 和参与配位的Y4-平衡浓度之和
[Y] ——参与配位反应的Y4-的平衡浓度
➢ 结论: Y(N) ,[Y]副反应越严重
3. Y的总副反应系数[同时考虑酸效应和共存离子效应]
Y[[Y Y ']][H 6Y2][H 5Y[ Y ] 4 ][Y4][N]Y
p H 1 1 lg Z ( 0 H n ) 5 .4 , Z ( O n ) H 2 .5 1 50
Z n Z(N n3 )H Z(O n) H 1 5 .6 150
(三)配合物MY的副反应系数
MHY
KMHY MY H
M(OH)Y KM(OH)Y MYOH
M Y (H ) M M Y Y ' M Y M Y M H Y 1 K M H YH
四、指示剂的封闭、僵化现象及消除方法
❖ 指示剂的封闭现象:化学计量点时不见指示剂变色
配位滴定法 滴定曲线
• 具有配位剂的性质和作用 • 与金属离子的配合物的颜色和游离色不同 • 是多元弱酸或多元弱碱,能随溶液 pH 变化而显 示不同的颜色
下叶
上叶
配位滴定法 /金属指示剂
• 金属指示剂的性质和作用原理
• 铬黑 T
KEDTA--M 〉K铬黑 T--M
下叶
上叶
配位滴定法 /金属指示剂
• 结论:
△ lgK ≥ 5
• 可通过控制酸度,依次测出各组分的含量
下叶
上叶
配位滴定法 /混合离子的分别滴定
• 例:考虑当溶液中 Bi3 + , Pb2+浓度皆为 0 . 01 mol ·L时, 用 EDTA 滴,定Bi3 +有无可能? • lgKBIY = 27 . 94 • lgKPbY = 15 . 04 • △ lgK = 27 . 94 一 18 . 04 = 9 . 9 • 可以选择滴定Bi3 + 而 Pb2+不干扰。 • 由酸效应曲线可查得滴定 Bi “ +的最低 pH 约为 0 . 7 , 但滴定时 pH 也不能太大,在 pH≈ 2 时, Bi3 +将开始水 解析出沉淀。因此滴定 Bi3 +的适宜 pH 范围为 0 . 7 一 2 。 通常选取 pH = 1 时进行滴定,以保证滴定时不会析出秘 的水解产物
上叶
配位滴定法 /滴定曲线
配位滴定中,随着配位剂的不断加人,被滴 定的金属离子[ M 」不断减少,其变化情 况和酸碱滴定类似,在化学计量点附近 pM 发生突跃
pM =- lg[M] 滴定曲线 pM----EDTA加入量
下叶
上叶
配位滴定法 / 滴定曲线
计算----由KMY根据平衡方程式计算
分析化学《配位滴定》课件
EDTA 水溶性稍差 (溶解度 0.2 gL-1),故分析中使用
EDTA 二钠盐 Na2H2Y (溶解度 110 gL-1)
EDTA
EDTA 与大多数金属离子在室温下快
速反应,生成 1:1 螯合物 (chelate)
Mn+ + H4Y = MY(n-4)+ + 4H+
第四章 配位滴定
配位反应和滴定分析
配位反应非常多,但可用于滴定分析的很少
“汞量法”配位滴定:Hg 2+ + Cl− ⇌ HgCl2 ,
或者Hg 2+ + 2SCN− ⇌ Hg(SCN)2
+
−
“氰量法”配位滴定:Ag + 2CN ⇌
−
AgCN2
或者Ni2+ + 4CN − ⇌ NiCN42−
究 M-EDTA 配位体系。
参与主反应,浓度 [MY]
金属离子 M 去向
未参与主反应,浓度[M]
物料平衡:cM = [MY] + [M]
对比
物料平衡:cM = [MY] + [M] + [ML] + [ML2] + …
基础概念
第四章第一节
1. 表观浓度使定量表达式简洁
无论发生何种副反应、无论有多少副反应
副反应系数
条件稳定常数 (代替稳定常数)
′
计算:M、Y、MY
有时需要近似处理才能得到
第四章第一节
基础概念
配位平衡体系的精确解析策略
等式:物料平衡式
概念: Y ′′ = [Y]Y(H)
′′
=
Y(H)
分析化学课件-配位滴定法
例2 计算pH = 11, [NH3] = 0.1 时的lgZn
解
Zn2+ + Y
ZnY
Zn(NH3)42+ 的lg 1~lg4分
OH-
NH3
别为2.27, 4.61, 7.01, 9.06
Zn(OH) Zn(NH3 )
Zn(NH3) 1 i[NH3]i
Zn
Zn(NH3) 1 102.271.0 104.612.0 107.013.0 109.064.0
(一)配位剂的副反应系数αY
配位剂的副反应系数αY是αY=[Y’]/[Y] 它表示未与M离子配位的配位剂各型体的总浓度[Y’]是游离 配位剂[Y]的多少倍。
1. 滴定剂的副反应系数- Y(H)
Y(H)
[Y] [Y]
[Y]
[HY]
[H2Y] [Y]
[H6Y]
[Y] [Y][H ]1 [Y][H ]2 2 [Y][H ]6 6
KHMHY=[MHY]/[MY][H] KHMHY是MY和H+形成MHY的稳定常数,副反应系数 αMY(H)=([MY]+[MHY])/[MY]=1+[H] KHMHY
(四)配合物的条件稳定常数
当有副反应发生时,应用条件常数K’MY来衡量配合物 的稳定性,即
5.2 配合物的稳定性
K’MY = [(MY)’]/[M’][Y’] = KMY( αMY / αM αY )
Zn(NH3 ) 105.10
查附录五表:pH = 11.0
lg Zn(OH) 5.4
Zn Zn(NH 3 ) Zn(OH) 1 105.10 105.40
105.6
lgZn 5.6
5.2 配合物的稳定性
分析化学3.2.1.3 分布系数与分布曲线
δ2 =
[H+]2 Ka1 [H+]3+[H+]2 Ka1+[H+]Ka1 Ka2+Ka1Ka2 Ka3
δ1 =
[H+] Ka1Ka2 [H+]3+[H+]2 Ka1+[H+]Ka1 Ka2+Ka1Ka2 Ka3
δ0 =
Ka1Ka2 Ka3 [H+]3+[H+]2 Ka1+[H+]Ka1 Ka2+Ka1Ka2 Ka3
2019/11/4
H3PO4分布曲线的讨论:
( pKa1=2.12;pKa2=7.20;pKa3=12.36)
(1)三个pKa相差较大, 共存 现象不明显; (2)pH = 4.7 时,
δ2 =0.994 δ3 =δ1 = 0.003 (3)pH = 9.8 时, δ1= 0.994 δ0 =δ2 = 0.003
第三章 滴定分析法
第二节 化学平 衡与滴定分析
3.2.1 酸碱平衡与分布 曲线
3.2.2 配位滴定中的副 反应及条件稳定常数
3.2.3 氧化还原反应与 条件电极电位
3.2.4 沉淀的溶解平衡
2019/11/4
3.分布系数和分布曲线
定义(分布系数): 平衡时溶液中某物种的浓度占总浓度的分数(用δ表示) δi = ci / c 不同pH值溶液中酸碱存在形式的分布——分布曲线。
δ1 = [H+]Ka1 /{ [H+]2+[H+]Ka1+Ka1Ka2 } δ0 = Ka1Ka2 /{ [H+]2+[H+]Ka1+Ka1Ka2 } (动画)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
EDTA溶液过量0.02mL [Y] = 0.01000 0.02 / (20.00 + 20.02) = 5 10-6 mol·L-1
由稳定常数表达式,得:pCa = 7.69
稳定常数决定滴定曲线上限。
2019/11/3
(2) 溶液pH小于12时滴定
当溶液pH小于12时,存在酸效应; 由式:lgK’MY = lgKMY -lgY(H) 将滴定pH所对应的酸效应系数查表, 代入上式,
以被测金属离子浓度的pM对应滴定剂加入体积V作图 ,可得配位滴定曲线。
计算方法与沉淀滴定曲线的计算方法相似,但计算时 需要用条件平衡常数。
例题
2019/11/3
例题: 计算0.01000 mol·L-1 EDTA 溶液滴定20 mL 0.01000
mol·L-1 Ca2+ 溶液的滴定曲线。 (1) 在溶液pH>12时进行滴定时
求出K’MY后计算。
2019/11/3
内容选择:
3.1 滴定分析概述 3.2 化学平衡 3.3 滴定分析原理
3.4 滴定分析应用
2019/11/3
结束
= 510-6 mol·L-1 , pCa = 5.3
2019/11/3
c. 化学计量点
此时 Ca2+几乎全部与EDTA络合, [CaY] = 0.01 / 2 =0.005 mol·L-1 ; [Ca2+] = [Y] ; KMY = 1010.69
由稳定常数表达式,得: 0.005/X2 = 1010.69 ; [Ca2+] = 3.2 10-7 mol·L-1 ; pCa = 6.49
酸效应系数 lgαY(H) 0;KMY’ = KMY a. 滴定前,溶液中Ca2+离子浓度:
[Ca2+] = 0.01 mol·L-1 pCa = -lg[Ca2+] = -lg0.01 = 2.00,pCa = 2.0 b. 已加入19.98mL EDTA(剩余0.02mL钙溶液) [Ca2+] = 0.010000.02 / (定分析原理
3.3.1 滴定曲线的计算 及绘制
3.3.2 影响滴定曲线突 跃范围的因素
3.3.3 滴定终点的确定 方法
3.3.4 终点误差与直接 滴定的条件
2019/11/3
3. 配位滴定曲线
配位滴定通常用于测定金属离子,当溶液中金属离子 浓度较小时,通常用金属离子浓度的负对数pM来表示。
