有机反应机理第六章二
有机化学第六章烯烃

CH3
CH2CH3
CC
H
H
顺-2-戊烯
H
CH2CH3
CC
CH3
H
反-2-戊烯
Z式:双键碳原子上两个较优基团或原子处于双键同侧。
E式:双键碳原子上两个较优基团或原子处于双键异侧。
(优)CH3 C
H
CH2CH3(优)
CH3
C
C
CH3
(优)CH3CH2
CH(CH3)2(优) C
CH2CH2CH3
(Z)- 3-甲基-2-戊烯 (E)- 3-甲基-4-异丙基-3-庚烯
68% 17%
Br + C6H5CH CHCH3
-Br 环正离子
C6H5CH=CHCH3 Cl2
+ Cl C6H5CH CHCH3 Cl-
*
碳正离子
Cl- Cl
+
C6H5CH CHCH3
离子对
一般情况,加溴通过环正离子中间体 进行。
加氯通过环正离子中间体、碳正离子 或离子对进行。
立体选择性反应(stereoselective reaction)
0.33 0 /10-30 c.m 4oC -138.9oC
反式异构体对称性较高,熔点高于顺式异构体。 顺式异构体极性较强,沸点高于反式异构体。
第五节 化学反应
(一)催化氢化 (二)亲电加成反应 (三)自由基加成反应 (四)硼氢化反应 (五)氧化反应 (六) -氢卤代反应 (七) 聚合反应
(一) 催化氢化
顺式烯烃
H
H
C C Br2
CH3
CH3
H
H
Br
CH3
a Br-
CH3 b
Br
有机反应机理第六章(二)

6.5 有机自由基 自由基是指有一个未成对电子的原子或分子 自由基是缺电子的中间体,但不带电荷,其性质与 正碳离子和卡宾等缺电子的中间体差别较大
有机反应机理
6.5.1 自由基的结构和稳定性 烷基自由基具有7电子结构,因而是缺电子的
烷基自由基的中心碳原子杂化态处于sp2与sp3之间, 近似于sp2杂化,具有扁平的角锥型结构
自由基夺取氢的反应则相反, Me3C-H的氢容易 被自由基夺取, RO-H的氢则难以被自由基夺取, 因为RO-H键的BDE高于Me3C-H键的BDE
有机反应机理
由于上述原因,自由基反应常选择甲醇,水和苯作 溶剂
如果用乙醚,THF,CH2Cl2,丙酮或氯仿作溶剂, 常会发生自由基夺取溶剂分子中的氢的副反应
有机反应机理
O O O O
O 2 O
CH3 C CH3 N N
CH3 C CH3
hv
CH3 N2 + 2 C CH3
有机反应机理
通过键离解能可以判断化学键均裂的难易
H H BDE/kj/mol 435
Br Br 192
不难看出,Br-Br键易断裂,H-H键不易断裂
有机反应机理
一些键在光照下可使电子激发到*轨道上,形成 双自由基
The formation of cyclic amines from N-halogenated amines via an intramolecular 1,5-hydrogen atom transfer to a nitrogen radical is known as the Hofmann-Loffler-Freytag reaction (HLF reaction)
有机反应机理
第六七章有机化学反应机理的案例

利用反应中焓变和自由能变化或热变化,可以计 算达到平衡时的温度。 如△G=△H-T△S;知道了自由能△G变化,还 可以计算平衡常数K的大小, △G=-RTlnK。 通常△G为正值,得出K值很小,说明对反应不利, △G为负值,得到的K值较大,表明对反应有利。 熵值△S的研究,可以提供反应类型的信息。
研究有机反应机理的目的是认识参加反应化合物 的原子或基团的结合,在位置、次序和结合方式 在反应过程中所发生的变化,以及这些变化的动 力是出于哪些因素。 有机反应机理是有机化学理论的组成部分,它能 帮助我们把许多看来无关的反应联系在一起,找 出它们的共同规律,用以指导反应条件的选择, 达到提高产率的目的,并可作为新的合成反应的 依据。 反应按何种历程进行,取决于反应物和试剂的性 质,以及反应的条件,如温度、压力、催化剂和 溶剂等。
CH3
CH3
C + + OHCH3
快
CH3
CH3
CH3
C
CH3 (D)
OH
CH3
C
CH3 (E)
OH
(C)
活性中间体
过渡态 I I
SN1反应的能量变化过程:
Ü Á Ä ¿
(B) (D) (C) E1 (A) H E2
(E)
´ Ó · ¦ ½ ø ³ Ì
SN1的特点:
①分步进行;
②决速步骤为C-X解离,单分子反应,有v=k[RX]; ③有C+中间体,构型保持与构型转化机率相同;产物 外消旋化.
(2)在紧密的离子对阶段,溶剂分子或其它亲 核试剂进攻R+,由于溶剂或其它亲核试剂尚未进 入R+和L-之间,且由于L-的屏蔽作用,溶剂分子 或其它亲核试剂只能从L-的背面进攻R+,故产生 产物构型的倒转,相当于SN2历程。 (3)溶剂分子或其它亲核试剂进攻R+,发生在 溶剂介入的离子对阶段,则溶剂或其它亲核试剂 很可能从前后两面进攻,导致外消旋化,但从正 面进攻R+时,或多或少受到L-的屏蔽作用,故仍 以背面进攻为主,产物除主要得到外消旋产物外, 尚有部分构型倒转产物。
机理习题及答案

第六章 有机反应机理和测定方法6-1 利用稳定态近似原理指导下列反应生成C 的速度公式:解:k 2× k 1k 2+k -16-2 从观察到的实验现象提出符合这些现象的反应历程。
1)下列两个反应有相等的反应速度并遵循相同的动力学方程:-O H2)hOHH-反应在重水中进行时若在反应完成前回收原料有氘代原料产生。
CH 2C H 2N H 2CH 2C H 2O H CH 2C H 2OH H 2SO 4***CD 2CH 2O HH O CDCH 2CD 2CH 2BrCDCH2CH 3O Na CH 3O H+5) HOCl 和CH 2=CHCH 2*Cl 得到三种产物1 ,2 , 3 ,若用CH 2=C (CH 3)CH 2*Cl 反应,则标记*Cl 重排的产物比例要小得多。
ClClCl O HClCl O HClCl O H *+***+H OCl6)铬酸氧化(CH 3)2CD(OH)的速度为(CH 3)2CH (O D)的六分之一。
7)化合物1进行S N 1反应比2快,3进行S N 2反应比4慢。
8)顺 1,2-环己二醇与HIO 4反应比反式异构体快。
9) 2R ,3S -3-氯-2-丁醇在NaOH/C 2H 5OH 溶液中反应得光活性的环氧化物,再用KOH/H 2O 处理得内消旋2,3-丁二醇。
10)CH 3O1 进行酸性水解生成无18O 的乙酸,CH 3O2在同样条件下生成带18O 的乙酸。
解: 1)两个反应决速步骤都是O HH-2)P hHP h-CH2CH2N H2CH2CH2O HCH2CH2O HCH2CH2N2CH2CH2****+*+CD2CH2O HCD CH2CD2CH2O H2CD2CH2++决速步骤为生成碳正离子,未牵涉C-D键断裂。
CD2CH2Br CDCH2CH3OCH3OD本反应是E1cb反应, 决速步骤为生成碳负离子,牵涉C-D键断裂。
5)次氯酸HOCl和同位素标记了的烯丙基氯H2C=CHCH2*Cl反应生成三种产物:ClCH2CH(OH)CH2*Cl、HOCH2CHClCH2*Cl和HOCH2CH*ClCH2Cl 。
第六章 有机反应活性中间体

RC
CR'
RX + R'2CuLi
R-R' + R'Cu + LiX
23
(3)羧基化和脱羧反应
羧化:
O O
RMgI+ O
C
O
H
OMgI
R
R
OH
O
O
CH3Li + O C O
物质量的比 1 : 1
H
OLi
H3C
R
OH
脱羧:
CH3COONa
-CO2 NaOH 400℃
CH3 + CO2 H+ CH4
当羧基的邻位 有拉电子基时, 可以在较低温 度下脱羧.
稳定的 自由基
O
( iii) 键的离解能 自由基是由共价键均裂产生的, 键 的离解能越大, 产生的自由基越不稳定,容易二聚生 成原来化合物。键的裂解能小的键如含有-O-O-, C-N=N-C 等弱键的化合物, 所产生的自由基比较 稳定。
30
常见自由基按稳定性排序:
(C6H5)3C > (C6H5)2CH > C6H5CH2 > CH2=C H CH2 > (CH3)3C > CH3 CHCH2CH3 >
- OH -
+ N2
(5)质子或其他带正电的原子团与不饱和键加成。
+ R+ (CH 3)3C=CH 2 + H+
CH 3
R (CH 3)3C+-CH 3 CH3CH-CH 2CH3
13
+ H+
6. 碳正离子的反应
1. 与带有电子的亲核体结合:取代反应(SN1) R+ + Nu- RNu
有机合成化学:第六章 缩合反应
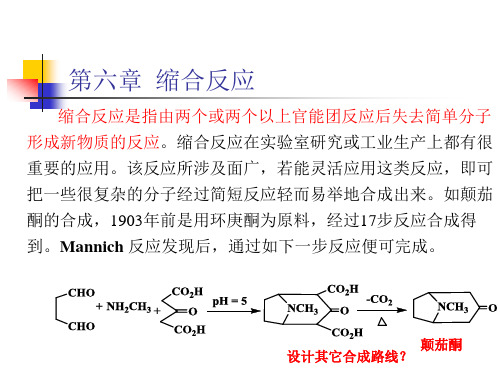
第六章 缩合反应
上例是由于选择不同的起始原料,而选择不同的合成路线,使 产品成本大大降低。如果没有很好的路线选择时,可以通过优化 反应条件,提高产物的收率,降低成本。从产品收率上讲,能提 高1-5%。我们可能认为没什么意义,可对企业讲,产品成本会降 低2-8%左右。如果一个产品产值上亿时,可估算一下其价值了。 所以,一个化工产品刚上市时价格较高,随着生产时间延长,价 格逐渐降低,很大可能是由于生产工艺和生产条件的改变所致。
-CO2
CH3CH CH2CO2H
H3C
O O O
60~76%
CH3NO2 + H3CCH
C H
CO2C2H5
NaOC2H5 CH3CH CH2CO2C2H5
55%
CH2NO2
第六章 缩合反应 CH3
CN
PhCH CO2C2H5 + H2C
C H
CN
KOH 83%
CN
PhC CH2CH2CN CO2C2H5
LDA
H3C
CH3
第六章 缩合反应
羰基化合物烷基化最大负反应是O-烷基化产物。如:
副产物
第六章 缩合反应
LDA CH3(CH2)3CO2CH3 BrCH2CH
CH2
CH3CH2CH2CH CO2CH3 CH2CH CH2
LDA
CH2CH3
C2H5Br CH3CH2Байду номын сангаас CO2CH3
可以分步引入
90%
5. Knoevenagel反应:
这类反应的特点是一个亚甲基上连接两个吸电子基团,使
得其氢活性明显提高,反应较易进行。一般使用弱碱 (有机胺)
有机化学 06第六章 卤代烃2
离去基团的影响:
R-Cl
R-Br
R-I
反应速度增大
6.3.2 消除反应 E (Elimination reaction)
βα
醇
R CH CH 2 + NaOH △
HX
RCH=CH 2 + NaX + H 2O
从分子中脱去一个简单小分子,如HX、H2O等,同时 产生不饱和键的反应称为消除反应。
反应中除α碳脱去X外,在β碳上脱去H,故称为β-消 除反应。
C2H5O- + CH3
CH3 C CH3
Br
[C2H5O-
进攻-H
] H
CH3
CH2 C CH3
Br
CH 3 CH3 C =CH2 + C2H5OH + Br-
SN2反应机理
HO- + CH3Br
[ ] H H HO C Br
进攻-C H
CH3OH + Br-
试剂碱性强,升高温度有利于E2反应。
四、亲核取代反应与消除反应的关系
醇溶液
胺RNH2 + HX
RONO2 + Ag X
硝酸酯
亲核取代反应通式:
RCδ+H2 Xδ- + Nu -
RCH2Nu + X -
反应底物
亲核试剂
产物
离去基团
卤代烷
HO- 、CN- 、 OR-、NH3 ONO-2等
醇、腈、 醚、胺 硝酸酯等
卤素离子
由试剂的负离子部分或未共用电子对去进攻而引
发反应,进攻试剂都有较大的电子云密度,能提供一
写出下列反应的主要产物
CH3
Br NaOH ,C2H5OH
高等有机 第六章 羰基化合物的反应
子效应。 子效应。如: (3) 应用: 应用:
O 2N
CHO >
CHO > CH3
CHO
羰基与HCN加成,不仅是增加一个碳原子的增长碳 羰基与 加成, 加成 链方法,而且其加成产物 羟基腈又是一类较为活泼的 链方法,而且其加成产物α-羟基腈又是一类较为活泼的 化合物,在有机合成上有着重要的用处。 化合物,在有机合成上有着重要的用处。如:
R (R)H C =O R + HCN (R)H C CN OH
α - 羟基腈(又称氰醇) 又
实 验 事实 : 2 min 完成反应
一滴 OH
HCN
H
+
H
+
+ CN
3~4 h 原料的50%起反应 起
加 H+,反应 υ↓, 大量 加 H+ 则难反应 , 12
实验事实证明:该加成反应起决定性作用的是 实验事实证明:该加成反应起决定性作用的是CN , CN ↑,有利于反应的进行。 ,有利于反应的进行。 (1) 反应机理: 反应机理:
CH3 C CX3 OH
CH3 C O 缩合反应: 1. 自身缩合: R RCH2CH =O + H CHCH=O
dil. OH
=
CH3 C OH + CX3 O + CHX3 卤仿
OH R RCH2CH CHCH=O R
△ H2O
=
O
O
O
β -羟基醛 羟
RCH2CH =CCH =O
α,β-不饱和醛 不
① NaBH4 或 LiAlH4 ② H3O +
RCH=CH (R')H
OH C H
B. Al[OCH(CH3)2]3 / (CH3)2CHOH还原法 还 RCH=CH (R')H (3) 金属还原法:
有机化学第六章卤代烃
第六章卤代烃卤代烃是一种简单的烃的衍生物,它是烃分子中的一个或多个氢原子被卤原子(F, CL, Br, I)取代而生成的化合物。
一般可以用R-X表示,X代表卤原子。
由于卤代烃的化学性质主要有卤原子决定,因而X是卤代烃的官能团。
根据卤代烃分子中烃基的不同,可以将卤代烃分为卤代烷烃、卤代烯烃、卤代炔烃和卤代芳烃等。
第一节卤代烷烃一. 卤代烷烃的分类和命名(一) 卤代烷烃的分类1. 根据卤代烷烃分子中所含卤原子的种类,卤代烷烃分为:氟代烷:如CH3-F氯代烷:如:CH3-CL溴代烷:如:CH3-Br碘代烷:如:CH3-I2. 根据卤代烷烃分子中所好卤原子的数目的多少,卤代烷烃分为:一卤代烷:如:CH3CL, CH3-CH2-Br二卤代烷:如:CH2CL2,多卤代烷:CHCL33. 根据卤代烷烃分子中与卤原子直接相连的碳原子的类型的不同,卤代烷烃可以分为:伯卤代烷(一级卤代烷)R-CH2-Br仲卤代烷(二级卤代烷)叔卤代烷(三级卤代烷)(二)卤代烷烃的命名1. 普通命名使用范围:结构比较简单的卤代烷常采用普通命名法命名:原则:根据卤原子的种类和与卤原子直接相连的烷基命名为“某烷”,或按照烷烃的取代物命名为“卤某烷”。
如:CH 3CL甲基氯(氯甲烷)CH 3CH2Br乙基溴(溴乙烷)CH 3CH2CH 2CH2I正丁基碘(正碘丁烷)CH 3BrCH 3I1H 3 C -------- CH -------- CH CL1H 3 C -------- CH --------- CH 2CH 3H3C-—C------------- CL11CH 3异丁基氯仲丁基溴叔丁基氯(异氯丁烷)(仲溴丁烷)(叔氯丁烷)2.系统命名法范围:复杂的卤代烷烃一般采用系统命名法原则:将卤原子作为取代基,按照烷烃的命名原则来R进行命名。
方法:1) 选择连有卤原子的最长碳链为主链,并根据主链 所含碳原子的数目命名为“某烷”作为母体;2)将支链和卤原子均作为取代基;3) 对于主链不带支链的卤代烷烃,主链编号从距离 卤原子最近的一端开始;4) 对于主链带支链的卤代烷烃,主链的编号应遵循 “最低系列规则”;5)把取代基和卤原子的名称按“次序规则”依次写 在“某烷”之前(次序按先后顺序写),即得该卤代烷 烃的名称。
高等有机第六章---芳烃的亲核取代反应
第六章 芳烃的亲核取代反应同烯烃一样,芳烃也可进行亲电取代和亲核取代,其中芳烃的结构起着十分重要的作用。
第一节 芳烃的亲电取代反应 一、机理:σ络合物E +++HE E基团离去的难易程度(1)亲电取代是个平衡可逆过程如磺基、硝基及其它基团之间的互换,此性质也可用于芳烃中位置的保护。
(2)正常的亲电取代是基于芳烃体系的稳定性,但如果出现的一个体系的稳定性更大于芳烃体系,可能就停留在中间状态。
E +++GHEGE H+OHOE H(3)亲电取代中定位效应第一类取代基团:以邻、对位为主不是以绝对来确定因此总伴有产物,运用可逆和各个位置均有分布的理论可以合成一些独特的化合物,如三异丙苯长时间二、碳正离子的来源和类型1、卤素(催化剂)—— 略(除F 2) 苯环正离子,* 另一种方法是重氮法2、氧正离子:CH 3C O O +24CH 3COO +OC OCH 3运用于苯环特别特别活泼的场合,因为过氧酸受热不稳定,只能低温反应,那么对苯环的要求就较高3、氮型正离子(i )+NO 2 硝基正离子 +NO 亚硝基正离子亚硝酸酯RO NONH 2OONH 2NO 2(ii )重氮离子 N ≡N +C l适用于苯环特别活泼的场合,理由同上+OHN N OH 偶合N N +Cl4、碳型正离子 两种形式: CH 2+(烷基化) +C=O (酰化) (i )不饱和体系在酸的催化下:(质子催化)H +CH 3C NCH 3C NH CH 3CH O H+CH 3C HOHOH +OHCH 2例:酚醛树脂的合成OHCH 2OHCH 2CH 2OH又例:氯甲基化:HCHO ,ZnCl 2,HCl其实经历了一取代过程(ii )羟基化合物的脱水,在酸性条件下OH H +(iii )卤代烷烃在路易斯酸催化 (iv )CO 2OHCH2OHOH CO2KOHOHOHCOOH起保护作用的OHOHBrOHOH5、其它正离子SOOOH磺酸型P ClCl磷型6、相互取代反应CH3OCH3CH3OCH3NO2+CH3OCH3NO2NO2第二节 芳香族的亲核取代 一、SN 2历程一般条件下,芳香族上的任何基团都稳定不易取代 此情况同烯烃但当邻、对位有强吸电子基团时,该官能团可被取代。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机反应机理
三-(五氯苯基)甲基自由基在溶液中可保存数天, 固态时可稳定存在,并能耐热至300℃
Cl Cl Cl Cl Cl Cl Cl C Cl Cl Cl Cl ClCl Cl Cl
有机反应机理
这是由于与自由基中心碳原子相连的芳基可以通过 共轭作用很好地稳定自由基
同时,体积较大的芳基自由基通过位阻作用使得 自由基之间较难反应,进一步稳定了自由基
相邻原子上的未共用电子对,键,键都能稳定 自由基,稳定性顺序: 叔碳自由基 > 仲碳自由基 > 伯碳自由基
有机反应机理
自由基与碳正离子稳定性的差别 自由基中心碳原子价壳层电子数为7,缺电子性不 如碳正离子严重,较相应碳正离子稳定
例如,伯碳正离子很难形成,而伯碳自由基则通常 可作为反应中间体
有机反应机理
深蓝色的二苯甲酮羰游基在用钠干燥溶剂时用作脱 氧剂
有机反应机理
6.5.3 自由基的反应
有关自由基的反应包括
与键的加成,裂解,夺取氢,复合,重排等
有机反应机理
与键的加成
例如溴自由基对双键的加成和自由基环化
有机反应机理
硝酮(nitrone)与自由基加成生成稳定的氮氧自由基, 常用作自由基捕集剂
有机反应机理
对于杂原子自由基,由于自由基是缺电子的,自由 电子所在原子电负性越大,相应自由基越不稳定 稳定性:
CR3
I
>
> Br
NR2
>
Cl
OR
F
>
>
HO· 和H· 极不稳定,通常不能作为反应中间体存在
有机反应机理
氮氧自由基是非常稳定的自由基,例如TEMPO
O H3C N CH3 CH3 H3C H3C
自由基夺取氢的反应则相反, Me3C-H的氢容易 被自由基夺取, RO-H的氢则难以被自由基夺取, 因为RO-H键的BDE高于Me3C-H键的BDE
有机反应机理
由于上述原因,自由基反应常选择甲醇,水和苯作 溶剂
如果用乙醚,THF,CH2Cl2,丙酮或氯仿作溶剂, 常会发生自由基夺取溶剂分子中的氢的副反应
自由基与碳正离子稳定性的差别(续) 相邻原子上的未共用电子对,键和键对自由基 的稳定化作用不如对碳正离子的稳定化作用强 这是因为自由基 的这些共轭作用 是占有轨道与占 有轨道间的作用, 有一个电子进入 反键轨道
有机反应机理
而碳正离子的这些共轭作用是占有轨道与空轨道间 的作用,电子都进入成键轨道
反式亚胺被转运到肝脏,在酶和ATP(腺苷三磷酸) 的作用下转变成顺式再送回视网膜
有机反应机理
氧化还原反应也是产生自由基的简便方法 单电子转移过程先生成阳离子自由基(氧化)或阴离 子自由基(还原),再分解成自由基和离子,例如:
人,称作羰 游基(ketyl)。
有机反应机理
自由基的复合和歧化 两分子自由基利用各自的自由电子所在轨道形成新 的键的反应称为自由基复合
有机反应机理
自由基夺取另一自由基分子中的氢,形成两分子八 隅体结构产物的反应称作自由基歧化,例如
有机反应机理
自由基重排
与碳正离子不同,自由基的同面协同的1,2-迁移 重排是对称性不允许的反应,但某些自由基可以 通过加成-裂解的途径发生1,2-迁移重排,例如
有机反应机理
O O O O
O 2 O
CH3 C CH3 N N
CH3 C CH3
hv
CH3 N2 + 2 C CH3
有机反应机理
通过键离解能可以判断化学键均裂的难易
H H BDE/kj/mol 435
Br Br 192
不难看出,Br-Br键易断裂,H-H键不易断裂
有机反应机理
一些键在光照下可使电子激发到*轨道上,形成 双自由基
O N CH3 CH3 H3C H3C
O N CH3 CH3
H3C
TEMPO, a stable nitroxyl
有机反应机理
6.5.2 自由基的产生
键的均裂 键的激发
单电子还原或氧化
有机反应机理
有机过氧化物和偶氮化合物分子中的氧-氧键和 碳-氮键的键能很低,很容易均裂为自由基, 常用来作为自由基反应的引发剂
有机反应机理
夺取氢
夺取氢也是自由基的基本反应,例如
有机反应机理
夺取卤素
自由基也可夺取反应物分子中的卤素,与夺取氢 是同一类反应
有机反应机理
自由基通常不能夺取反应物分子中的烷基,氰基等 基团,例如
有机反应机理
注意:自由基夺取氢的难易与离子型反应中脱质 子的难易是完全不同的
例如,碱性条件下RO-H很容易异裂成RO-和H+, 但Me3C-H键很难断裂
6.5.1 自由基的结构和稳定性 烷基自由基具有7电子结构,因而是缺电子的
烷基自由基的中心碳原子杂化态处于sp2与sp3之间, 近似于sp2杂化,具有扁平的角锥型结构
有机反应机理
自由基的扁平角锥结构很容易翻转
自由基翻转的能垒很低,只有2.5kJ/mol
自由基的快速翻转使得一些具有光学活性的 反应物经自由基机理反应后得到的是外消旋产物
有机反应机理
解释以下自由基重排的机理
有机反应机理
链反应和非链反应 自由基引发剂作用下的反应通常为链反应
使用化学计算量的氧化剂或还原剂所进行的反应不 是链反应 光化学反应中,单分子重排或消除通常不是链反 应,而加成,取代反应通常为链反应
有机反应机理
6.5.4 自由基反应实例
Hofmann-Loffler-Freytag反应(远程官能化反应)
The formation of cyclic amines from N-halogenated amines via an intramolecular 1,5-hydrogen atom transfer to a nitrogen radical is known as the Hofmann-Loffler-Freytag reaction (HLF reaction)
O R R
O R R
hv
双自由基可以发生自由基的各种反应
有机反应机理
某些顺式烯烃的双键在光照下异构成反式,可 能经过双自由基机理
H Ph Ph H hv Ph
H H Ph H Ph H Ph Ph
H Ph H
有机反应机理
动物的视网膜中存在具有顺式双键的亚胺11-cisretinal(视黄醛)imine,当光线照到眼睛时,异构 成反式,产生电脉冲,通过视神经传递给大脑
有机反应机理
例如光学活性的1-氯-2-甲基丁烷的氯化反应, 得到的产物是外消旋体
H ClH2C C C2H5
ClH2C C CH3 C2H5
ClH2C C
CH3 C2H5
CH3
Cl
Cl2
ClH2C
C
CH3 C2H5
+
ClH2C
CH3 C Cl C2H5
有机反应机理
自由基的稳定性 自由基与碳正离子一样,是缺电子的,任何稳定 碳正离子的因素也能稳定自由基
