金属-有机配位体配合物的稳定常数
配合物的稳定常数

4—1、配合物的稳定常数 、 1.稳定常数 ------K f 稳定常数
Ag
+
θ
NH3H2O
Ag2O (黑褐色)
Cl -
这一实验结果 说明溶液中存在游 NH3H 离的Ag . 离的2O +Ag(NH3)2+
无 A gC l
+
I-
AgI
H 2S
Ag 2 S
既存在 Ag
[CN − ] = x = 3.47 × 10 −3 (mol ⋅ dm −3 )
2.50 × 0.40 = x2
解得: 解得: 显然AgI可以很好地 溶解在 溶解在KCN溶液中。 溶液中。 显然 溶液中 6.配位平衡与氧化还原平衡 配位平衡 ——计算形成配合物 ——计算形成配合物的衍生电极电势 [例9—12] 计算 例
0. 1 = 2 x
解得: 解得:
[Cu 2+ ] = 1.29 × 10 −10 (mol ⋅ dm −3 )
同理解得
0.10mol ⋅ dm −3Cu (en) 2+ 2
[Cu 2+ ] = 8.5 × 10 −8 mol ⋅ dm −3
显然稳定性: 显然稳定性
Cu(EDTA)2-﹥ Cu(en)22+
0.0591
因此
而K =
3+ 3 )6
3+ 2+ 3 ) 6 / Co ( NH 3 ) 6
= 0.056(V )
(2)假设 )假设Co(NH3)6 中与空气中的O 发生如下反应: 中与空气中的 2发生如下反应:
3、配位平衡 与电离平衡 、 θ θ − − − K θ 与K a 或K θ 与K b之间的关系 f f
配位化合物的稳定性

一、配合平衡与酸碱电离平衡 1、 酸效应
Cu2+ + 4NH3 + 4H+ 4NH4+ [Cu(NH3)4]2+
当溶液酸度增加时,配体L与H+结合生成相应的共轭酸而使
配合平衡向解离方向移动,导致配合物稳定性下降的现象,
称为配体的酸效应。
2、水解效应
Fe3+
Fe3+
+
+
6SCN
H2O H2O
ቤተ መጻሕፍቲ ባይዱ
-
[Fe(SCN)6]3Fe (OH) Fe (OH)2+
2+
+ +
H+ H+
Fe (OH)
2+
+
当溶液的酸度降低时,金属离子发生水解而使配合平衡向
解离方向移动,导致配合物稳定性下降的现象,称为金属离
子的水解效应。
二、配合平衡与沉淀-溶解平衡
AgBr + 2 NH3
[Ag(NH3)2]+ +
Br-
K=
?
AgBr Ag+ + 2NH3
Ag+
+
Br[Ag(NH3)2]+
Na2S
三、配合平衡与氧化还原平衡
2Fe
3+
+ 2I
-
2Fe
2+
+ I2
2Fe +
3+
+
2I
-
2Fe2+
+
I2
6F-
[FeF6]
3-
+
I-
四、配合物的取代反应
P204反萃除铁的研究进展

在湿法冶金中,铁通常以 Fe2+、Fe3+ 形式与有价金属一 同进入溶液中。当溶液中铁浓度比较高时(大于 1g/l),一般 采用针铁矿法、赤铁矿法、黄钾铁矾法等方法进行除铁 ;当 铁浓度比较低时(小于 1g/l),一般采用中和法进行除铁。但 是,由于化学沉淀法的分离效果较差,一般除铁后液中还含 有少量的 Fe3+。
较弱。还原反萃是根据 P204 对不同价态铁离子萃取能力不
2022年 5月下 世界有色金属 1
表 1 Fe3+– 无机配位体配合物的稳定常数
序号 1
配位体 Cl-
配位体数 n 2
lgβn 9.8
2
CN-
6
42.0
3
F-
1,2,3
5.28,9.30,12.06
4
I-
1
1.88
5
OH-
1,2,3
者通过蒸发结晶产出粗氯化钠。该工艺的主要缺点是反萃过
程中盐酸浓度高,酸雾大,操作条件差。但是,该工艺比较
简单、易于连续操作,可以在萃取箱中进行,在工业上得到
了广泛应用。
2.2.2 草酸反萃 蒋长俊等 [1] 采用草酸反萃 P204 中的 Fe3+,在室温、草
酸浓度为 70g/L、相比 2:1、振荡时间 20min 的条件下,铁 的反萃率超过 96%。经两级反萃,有机相中的 Fe3+ 可以降
2.3.1 铁粉还原 肖纯等 [7] 采用铁粉为还原剂,稀硫酸为反萃剂,在机械
搅拌和强保护气氛下,对 P204 进行反萃除铁。在负载有机 相中 Fe3+ 含量为 10.0g/L,铁粉加入量为理论量的 2.4 倍, 还原反萃时间为 6h,还原反萃温度为 40℃的条件下,Fe3+ 的反萃率达到 73%,反铁后液中 Fe2+ 的浓度为 61.8g/L,可
2013-第五章--配合物的稳定性

解:[NH3] = [Ag(NH3)2+] = 1 mol·L-1时
Ag+ + 2NH3
Ag(NH3)2+
Kf = —[AA—gg+—(]N[N—HH3—)32]+—2 = —[A1—g+]= 1.7×107 [Ag+]= 5.9×10-8 mol·L-1
所以 [Ag(NH3)2+] + e
Ag + 2NH3
冠醚
穴醚
大环效应导致的高稳定性极大地扩展了碱金属配 位化学和配位化合物的研究范围。
§5-3 中心与配体的关系(软硬酸碱原理 )
(Hard and Soft Acids and Bases,HSAB)
1. 酸碱的软硬分类 在路易斯酸碱的基础上,进行酸碱的软硬分类 。
软(酸或碱): 指离子半径大、电荷低、易变形、容易被极化的物种。 硬(酸或碱): 指离子半径小、电荷高、不易变形、不易被极化的物种
第一章 配位化学基础知识 第二章 配合物的结构及异构现象 第三章 配合物的化学键理论 第四章 配合物的电子光谱 第五章 配合物在溶液中的稳定性 第六章 配合物反应动力学 第七章 新型配合物
第五章 配合物在溶液中的稳定性
§5-1 配合物的稳定常数 §5-2 影响配合物稳定性的因素 §5-3 中心与配体的关系 §5-4 配合物的应用
[Zn(NH3)4]2+ [Cu(NH3)4]2+ [HgCl4]2[Zn(CN)4]2[HgI4]2[Hg(CN)4]2[Co(NH3)6]2+ [Cd(NH3)6]2+ [Ni(NH3)6]2+ [AlF6]3[Fe(CN)6]4[Co(NH3)6]3+ [Fe(CN)6]3-
配位滴定法习题

第7章 配位滴定法一、考试大纲要求(一)掌握1.掌握EDTA 滴定法的基本原理,能正确选择滴定条件。
2.掌握指示剂变色原理。
3.掌握EDTA 标准溶液的配制、标定。
(二)熟悉1、熟悉常用金属指示剂变色范围和使用条件。
2、熟悉Ca 2+、Mg 2+、Zn 2+、Al 3+等离子的测定。
(三)了解了解滴定终点误差。
二、重点与难点(一)重点1.配合物的条件稳定常数:条件稳定常数的计算和应用。
2.配位滴定法滴定曲线:滴定曲线的计算、突跃范围、化学计量点pM /值。
3.金属指示剂:变色原理、应用条件、应用对象。
4.标准溶液的配制与标定:基准物、标定条件。
5.滴定方式:滴定方式的选择、条件控制和应用范围。
(二)难点1.配位反应的副反应及副反应系数:副反应类型、副反应系数的计算。
2.滴定条件的选择:滴定终点误差、酸度的选择、掩蔽剂的选择。
三、主要公式1.金属-EDTA 配合物的稳定常数 ]][[][Y M MY K MY =2.累积稳定常数 nn n n L M ML K K K L M ML K K L M ML K ]][[][]][[][]][[][212221211======βββ3.各级配合物的浓度与游离金属离子浓度[M]和游离配合剂浓度[L]的关系nn n L M ML L M ML L M ML ]][[][]][[][]][[][2221βββ===4.副反应系数 ][][Y Y Y '=α 5.弱酸的酸效应系数6656546543654326543212345(H)6[H ][H ][H ][H ][H ]1[H ]Y a a a a a a a a a a a a a a a a a a a a a K K K K K K K K K K K K K K K K K K K K K α++++++=++++++6.共存离子效应系数 NY N Y K N ][1)(+=α7.滴定体系中同时发生酸效应和共存离子效应,则总的副反应系数 1)()(-+=NY Y H Y Y ααα 8.单一金属离子M 的副反应系数 n n L M L L L ][][][1221)(βββα++++= 9.多种金属离子的总副反应系数 )1()()(21P L M L M M -+++= ααα10.条件稳定常数:]][[][Y M Y M K MY'''=' MY Y M MY MYK K αααlg lg lg lg lg +--=' 11.化学计量点时金属离子的浓度 )lg (21][)()(MYsp M MYsp M sp K pC M p K C M '+=''=' 12.终点时金属离子的浓度 ()p lg lg t MIn In H M K α=- 13.林邦(Ringbom )误差公式 %1001010)(//⨯'-=∆-∆MYsp M pMpM K C TE四、例题详解1.在pH =10.0的缓冲介质中,以0.01000mol/L 的EDTA 滴定50.00mL 同浓度金属离子M 2+溶液,已知在此条件下配位反应进行完全,当加入EDTA 溶液从49.95mL 到50.05mL 时,计量点前后的pM 改变了2个单位,计算配位化合物MY 2—的稳定常数K MY 为若干。
作为金属离子与EDTA生成的配合物稳定常数

第一节概 述
课堂互动 请您回答: EDTA与Al2(SO4)3的配位比是
多少?Biblioteka 15第二节配位平衡第二节 配位平衡
一、EDTA配合物的稳定常数
M+Y
MY
反应的平衡常数为:
KMY =
MY MY
KMY为金属与EDTA生成的配合物稳定常数,各 种配合物都有其一定的稳定常数,又称绝对稳
8
第一节概 述
一、乙二胺四乙酸的性质
1.乙二胺四乙酸的结构与性质
乙二胺四乙酸的结构
HOOCH2C N
HOOCH2C
CH2 CH2
CH2COOH N
CH2COOH
从结构式所知, EDTA为四元有机弱酸。用H4Y表示其化学式。EDTA为白 色粉末状结晶,微溶于水,由于溶解度太小,不宜作滴定液。利用EDTA难 溶于酸和一般有机溶剂,易溶于氨水和氢氧化钠等碱性溶液等性质,常制
◆学习目的
通过配位滴定法的学习,掌握EDTA的性质、 EDTA配位反应的特点、配位滴定的原理和金属指 示剂变色原理及条件,理解配位滴定中副反应对 主反应的影响,能够正确选择配位滴定条件和合 适的指示剂,熟练掌握常见金属离子的含量测定 方法。通过本章学习,为药物分析中含金属离子 类药物的含量测定奠定基础。
pKa1 =0.9 pKa2 =1.6 pKa3 =2.0 pKa4 =2.67 pKa5 =6.16 pKa6 =10.26
11
第一节概 述
在 水 溶 液 中 , EDTA 同 时 以 H6Y2+ 、 H5Y+ 、 H4Y 、 H3Y- 、 H2Y2-、HY3-和Y4- 7种型体存在,在不同的酸度下,溶液中 EDTA主要存在的型体不同,如表6-1所示。
《分析化学(下)》习题答案详解(第五版)

分析化学第五版习题答案详解(下)第五章配位滴定法思考题答案1.EDTA与金属离子的配合物有哪些特点?答:(1)EDTA与多数金属离子形成1?1配合物;(2)多数EDTA-金属离子配合物稳定性较强(可形成五个五原子环); (3)EDTA与金属配合物大多数带有电荷,水溶性好,反应速率快;(4)EDTA与无色金属离子形成的配合物仍为无色,与有色金属离子形成的配合物颜色加深。
2.配合物的稳定常数与条件稳定常数有何不同?为什么要引用条件稳定常数?答:配合物的稳定常数只与温度有关,不受其它反应条件如介质浓度、溶液pH值等的影响;条件稳定常数是以各物质总浓度表示的稳定常数,受具体反应条件的影响,其大小反映了金属离子,配位体和产物等发生副反应因素对配合物实际稳定程度的影响。
3.在配位滴定中控制适当的酸度有什么重要意义?实际应用时应如何全面考虑选择滴定时的pH?答:在配位滴定中控制适当的酸度可以有效消除干扰离子的影响,防止被测离子水解,提高滴定准确度。
具体控制溶液pH值范围时主要考虑两点:(1)溶液酸度应足够强以消去干扰离子的影响,并能准确滴定的最低pH值;(2)pH值不能太大以防被滴定离子产生沉淀的最高pH值。
4.金属指示剂的作用原理如何?它应该具备那些条件?答:金属指示剂是一类有机配位剂,能与金属形成有色配合物,当被EDTA等滴定剂置换出来时,颜色发生变化,指示终点。
金属指示剂应具备如下条件:(1)在滴定的pH范围内,指示剂游离状态的颜色与配位状态的颜色有较明显的区别;(2)指示剂与金属离子配合物的稳定性适中,既要有一定的稳定性K’MIn>104,又要容易被滴定剂置换出来,要求K’MY/K’MIn ≥104(个别102);(3)指示剂与金属离子生成的配合物应易溶于水;(4)指示剂与金属离子的显色反应要灵敏、迅速,有良好的可逆性。
5.为什么使用金属指示剂时要限定适宜的pH?为什么同一种指示剂用于不同金属离子滴定时,适宜的pH条件不一定相同?答:金属指示剂是一类有机弱酸碱,存在着酸效应,不同pH时指示剂颜色可能不同,K’MIn不同,所以需要控制一定的pH值范围。
金属-有机配位体配合物的稳定常数
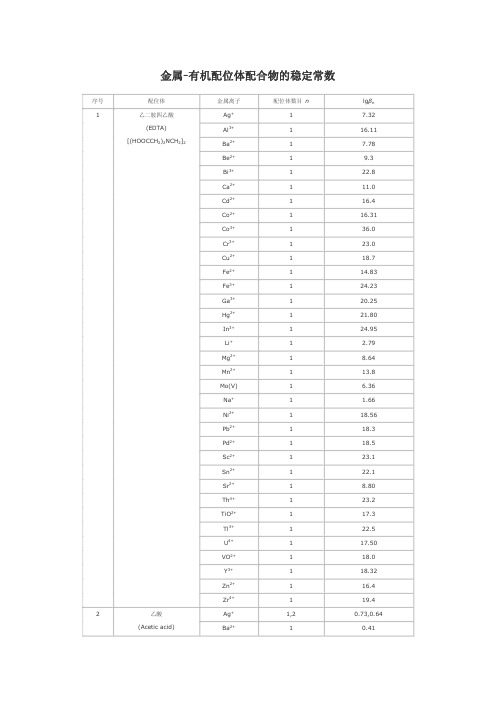
金属有机配位体配合物的稳定常数序号 配位体 金属离子配位体数目 nlg βn Ag + 1 7.32 Al 3+ 1 16.11 Ba 2+ 1 7.78 Be 2+ 1 9.3 Bi 3+ 1 22.8 Ca 2+ 1 11.0 Cd 2+ 1 16.4 Co 2+ 1 16.31 Co 3+ 1 36.0 Cr 3+ 1 23.0 Cu 2+ 1 18.7 Fe 2+ 1 14.83 Fe 3+ 1 24.23 Ga 3+ 1 20.25 Hg 2+ 1 21.80 In 3+ 1 24.95 Li + 1 2.79 Mg 2+ 1 8.64 Mn2+ 1 13.8 Mo(V)1 6.36 Na + 1 1.66 Ni 2+ 1 18.56 Pb 2+ 1 18.3 Pd 2+ 1 18.5 Sc 2+ 1 23.1 Sn 2+ 1 22.1 Sr 2+ 1 8.80 Th 4+ 1 23.2 TiO 2+ 1 17.3 Tl 3+ 1 22.5 U 4+ 1 17.50 VO 2+ 1 18.0 Y 3+ 1 18.32 Zn 2+ 1 16.4 1乙二胺四乙酸 (EDTA)[(HOOCCH 2)2NCH 2]2Zr4+ 1 19.4 Ag + 1,2 0.73,0.64 2 乙酸 (Acetic acid)Ba2+ 10.41Ca 2+ 1 0.6 Cd 2+ 1,2,3 1.5,2.3,2.4 Ce 3+ 1,2,3,4 1.68,2.69,3.13,3.18Co 2+ 1,2 1.5,1.9 Cr 3+ 1,2,3 4.63,7.08,9.60 Cu 2+ (20℃)1,2 2.16,3.20 In 3+1,2,3,4 3.50,5.95,7.90,9.08Mn 2+ 1,2 9.84,2.06 Ni 2+ 1,2 1.12,1.81 Pb 2+ 1,2,3,4 2.52,4.0,6.4,8.5 Sn 2+ 1,2,3 3.3,6.0,7.3 Tl 3+ 1,2,3,46.17,11.28,15.10,18.3Zn2+ 1 1.5 Al 3+ (30℃) 1,2 8.6,15.5 Cd 2+1,2 3.84,6.66 Co 2+ 1,2 5.40,9.54 Cr 2+ 1,2 5.96,11.7 Cu 2+ 1,2 8.27,16.34 Fe 2+ 1,2 5.07,8.67 Fe 3+ 1,2,3 11.4,22.1,26.7Hg 2+ 2 21.5 Mg 2+ 1,2 3.65,6.27 Mn 2+ 1,2 4.24,7.35 Mn 3+ 3 3.86Ni 2+ (20℃) 1,2,3 6.06,10.77,13.09Pb 2+2 6.32 Pd 2+ (30℃)1,2 16.2,27.1 Th 4+1,2,3,4 8.8,16.2,22.5,26.7 Ti 3+ 1,2,3 10.43,18.82,24.90 V 2+ 1,2,3 5.4,10.2,14.7 Zn 2+ (30℃)1,2 4.98,8.81 3 乙酰丙酮 (Acetyl acetone) CH 3COCH 2CH 3Zr4+1,2,3,48.4,16.0,23.2,30.1Ag + 1 2.41 Al 3+ 1,2,3 7.26,13.0,16.3Ba 2+ 1 2.31 Ca 2+ 1 3.0 Cd 2+ 1,2 3.52,5.77 Co 2+ 1,2,3 4.79,6.7,9.7 Cu 2+ 1,2 6.23,10.27 4 草酸 (Oxalic acid) HOOCCOOHFe2+ 1,2,32.9,4.52,5.22Fe 3+ 1,2,3 9.4,16.2,20.2Hg 2+ 1 9.66 Hg 2 2+ 2 6.98 Mg 2+ 1,2 3.43,4.38 Mn 2+ 1,2 3.97,5.80 Mn 3+ 1,2,3 9.98,16.57,19.42 Ni 2+ 1,2,3 5.3,7.64,~8.5 Pb 2+ 1,2 4.91,6.76Sc 3+ 1,2,3,46.86,11.31,14.32,16.70Th 4+ 4 24.48 Zn 2+ 1,2,3 4.89,7.60,8.15 Zr4+ 1,2,3,49.80,17.14,20.86,21.15Ba 2+ 1 0.64 Ca 2+ 1 1.42 Cd 2+ 1 1.70 Co 2+ 1 1.90 Cu 2+ 1,2 3.02,4.85Fe 3+ 1 7.1 Mg 2+ 1 1.37 Mn 2+ 1 1.43 Ni 2+ 1 2.22 Pb 2+ 1,2 2.40,3.80Sc 2+ 1 5.2 Th 4+ 1 5.5 5 乳酸 (Lactic acid) CH 3CHOHCOOHZn2+ 1,2 2.20,3.75 Al 3+ 1 14.11 Cd 2+ 1 5.55 Co 2+ 1,2 6.72,11.42 Cr 2+ 1,2 8.4,15.3 Cu 2+ 1,2 10.60,18.45 Fe 2+ 1,2 6.55,11.25 Mn 2+ 1,2 5.90,9.80 Ni 2+ 1,2 6.95,11.75 Th 4+ 1,2,3,44.25,7.60,10.05,11.60TiO 2+ 1 6.09 V 2+ 1 6.3 6 水杨酸 (Salicylic acid) C 6H 4(OH)COOHZn2+ 1 6.85Al 3+ (0.1mol/L) 1,2,3 13.20,22.83,28.89Be 2+ (0.1mol/L) 1,2 11.71,20.81 7 磺基水杨酸 (5sulfosalicylicacid)Cd 2+ (0.1mol/L)1,216.68,29.08Co 2+ (0.1mol/L) 1,2 6.13,9.82 Cr 3+ (0.1mol/L) 1 9.56 Cu 2+ (0.1mol/L) 1,2 9.52,16.45 Fe 2+ (0.1mol/L) 1,2 5.9,9.9 Fe 3+ (0.1mol/L) 1,2,3 14.64,25.18,32.12Mn 2+ (0.1mol/L) 1,2 5.24,8.24 Ni 2+ (0.1mol/L) 1,2 6.42,10.24 Zn 2+ (0.1mol/L)1,2 6.05,10.65Ba 2+2 1.62 Bi 3+3 8.30 Ca 2+ 1,2 2.98,9.01Cd 2+ 1 2.8 Co 2+ 1 2.1Cu 2+ 1,2,3,43.2,5.11,4.78,6.51Fe 3+ 1 7.49 Hg 2+ 1 7.0 Mg 2+ 2 1.36 Mn 2+ 1 2.49 Ni 2+ 1 2.06 Pb 2+ 1,3 3.78,4.7 Sn 2+ 1 5.2 8 酒石酸 (Tartaric acid) (HOOCCHOH)2Zn2+ 1,2 2.68,8.32 Ba 2+ 1 2.08 Be 2+ 1 3.08 Ca 2+ 1 2.0 Cd 2+ 1 2.2 Co 2+ 1 2.22 Cu 2+ 1 3.33 Fe 3+ 1 7.49 Hg 2+ 2 7.28 Mg 2+ 1 1.20 Mn 2+ 1 2.26 Ni 2+ 1 2.36 Pb 2+ 1 2.8 9 丁二酸(Butanedioic acid) HOOCCH 2CH 2COOHZn2+ 1 1.6 Ag + 1,2 7.4,13.1 Bi 3+ 6 11.9 Cd 2+ 1,2,3,4 0.6,1.6,2.6,4.6 Cu + 3,4 13.0,15.4 10 硫脲 (Thiourea) H 2NC(═S)NH 2Hg2+ 2,3,422.1,24.7,26.8Ag + 1,2 4.70,7.70 Cd 2+ (20℃)1,2,3 5.47,10.09,12.09 Co 2+1,2,3 5.91,10.64,13.94 Co 3+ 1,2,3 18.7,34.9,48.69Cr 2+ 1,2 5.15,9.19 Cu + 2 10.8 Cu 2+ 1,2,3 10.67,20.0,21.0 Fe 2+ 1,2,3 4.34,7.65,9.70 Hg 2+ 1,2 14.3,23.3 Mg 2+ 1 0.37 Mn 2+ 1,2,3 2.73,4.79,5.67 Ni 2+ 1,2,3 7.52,13.84,18.33Pd 2+ 2 26.90 V 2+ 1,2 4.6,7.5 11 乙二胺(Ethyoenediamine) H 2NCH 2CH 2NH 2Zn2+ 1,2,3 5.77,10.83,14.11Ag + 1,2 1.97,4.35 Cd 2+ 1,2,3,4 1.40,1.95,2.27,2.50Co 2+ 1,2 1.14,1.54 Cu 2+ 1,2,3,42.59,4.33,5.93,6.54Fe 2+ 1 0.71 Hg 2+ 1,2,3 5.1,10.0,10.4 Mn 2+ 1,2,3,4 1.92,2.77,3.37,3.50 12 吡啶 (Pyridine) C 5H 5NZn2+ 1,2,3,4 1.41,1.11,1.61,1.93Ag + 1,2 3.41,6.89 Ba 2+ 1 0.77 Ca 2+ 1 1.38 Cd 2+ 1,2 4.74,8.60 Co 2+ 1,2,3 5.23,9.25,10.76 Cu 2+ 1,2,3 8.60,15.54,16.27Fe 2+ (20℃) 1,2 4.3,7.8 Hg 2+1,2 10.3,19.2 Mg 2+ 1,2 3.44,6.46 Mn 2+ 1,2 3.6,6.6 Ni 2+ 1,2,3 6.18,11.14,15.0Pb 2+ 1,2 5.47,8.92 Pd 2+ 1,2 9.12,17.55 13 甘氨酸 (Glycin) H 2NCH 2COOHZn2+ 1,2 5.52,9.96 Cd 2+ 1,2,3 9.00,9.00,16.6014 2甲基8羟基喹啉 (50%二噁烷)Ce3+ 17.71Cu 2+ 1,2 12.48,24.00 Fe 2+ 1,2 8.75,17.10 Mg 2+ 1,2 5.24,9.64 Mn 2+ 1,2 7.44,13.99 Ni 2+ 1,2 9.41,17.76 Pb 2+ 1,2 10.30,18.50 UO2 2+ 1,2 9.4,17.0 Zn 2+ 1,2 9.82,18.72。
