最新氯水成分探究教案
最新必修1高一化学氯水成分的探究说课教案名师优秀教案

必修1高一化学氯水成分的探究说课教案----------专专最好文~专专专服专~急所急~供所需档你你你-------------文下专最佳的地方档广学专省专山市第二中必修1高一化专水成分的探究专专案学教一、专材教1、材分析教本专专专自高中《化学1》必修第四章第二专《富集在海水中的元素专》中的第二专专。
—《富集在海水中的元素专》中的专是我专中专段第一次接到的~通专上一专专的探究专—气学触学~知道专不专可以金专专反专~而且专可以非金专专反专~专出专的强化性~专些知专都气与属与属体气氧专本专专的提供了知专基专。
教学本专专的多角度引专生专专专专、分析专专和解专专~而专以后二化硫、二化教学将从学决从氧氧氮等的专奠定一定的理专和专基专。
学践2、三专目专知专目专,1.掌握新制专水的成分2.掌握专水的消毒和漂白原理3.化专原反专的角度分析专水的反专从氧气与能力目专,1.培专生专察专专和操作专专的能力学2.培专小专探究专的能力学情感目专,1.掌握专专探究的一般原理和方法~专生通专专专探究专取知专~而感受到合作学从和专的专趣学2. 培专生的专保专念~增强专保意专学3、重点和专点教学重点,新制专水的成分的探究教学从氧气与专点,化专原反专角度分析专水的反专。
4、材专理教本专专着重专化专容的专用性~专生在知专的基专上~面专新专专专~能主专专专着专化体学学内学旧从学运学决从学学的角度用所知专和方法~专求解专专的策略~而培专生专化的专用意专。
我在专专专一专专,通专大量的生活信息激起生的专专趣~通专建专水的成分专知专主专~学学构条专生愉快地专活专。
专了使生形成自己的思专方式~专展生的探究能力和提高专生自学参与践学学学身的专合素专~根据专本的容~专生在专的指专下~专行内学教小专专专和专专探究~专专不专专专了生的学专性~使重专点易于突破~极而且专专了专的专手、专专能力~及互助合作的能力。
学二、专法教本专专专根据本校高一专生的化知专特点~巧妙用多媒专助~化专专易。
《氯水成分的探究》说课稿

《氯水成分的探究》教案化学科唐丽梅一、教材分析:本节课选自人民教育出版社出版的全日制普通高中课程标准实验教科书《化学1(必修)》第四章第二节《富集在海水中的元素氯》的第二课时。
这部分内容在教材中是学生学习了Cl2与金属、Cl2与H2反应的基础,对Cl2性质的进一步探究。
对氯气性质进行比较全面、细致的学习和研究,不仅是下一步学习卤素性质的需要,也是以后学习和研究同族元素性质变化规律的需要。
本节采用“实验探究:的学习方法对以后研究其它非金属及其分合物具有指导意义。
二、学情分析(1)、学生学习基础分析高一学生在初中阶段已经学过HCl 、NaCl 与AgNO3溶液的反应,在前面的学习中已经掌握了氧化还原反应、离子反应、强电解质、弱电解质的知识,因此有较好的知识基础。
在探究氯水的成分实验中,能根据实验现象推断出氯水中含有的粒子。
(2)、学生学习能力分析通过初中和高中阶段的训练,学生也具备了一定的分析和归纳问题的能力,用轻松愉快的实验观察和探究来描述本节内容,在学生原有的认知能力和分析能力的基础上深入浅出,培养学生的分析能力和解决问题的能力。
(3)、学生学习心理分析对高一学生来说认知水平的提高,是从形象到抽象过渡思维能力的提高,高一是个转折期,激发学生的好胜心,好奇心,进取心是高中学习的关键。
教学中应注意源于初中又高于初中,给学生以“山外有山,天外有天”的感觉,使学生站在更高的角度上学习。
三、教学目标在化学新课程理念的指导下,使“知识与技能”、“过程与方法”、“情感态度与价值观”三维目标有效融合和落实,我设计的教学目标为:1、知识与技能(1)能设计实验探究氯水的成分并认识和掌握次氯酸的漂白性;(2)能完成氯气与水的化学反应及分析新制氯水的成分。
2、过程与方法(1)通过对氯水成分的探究,培养学生科学的学习方法(2)通过观察化学现象和反应事实,学会善于从实验中发现问题、分析问题、解决问题。
3、情感态度与价值观(1)通过自主实验探究,感受化学探究的乐趣,掌握实验探究的一般原理和方法,在获取知识的同时激发学习化学的兴趣,学会大胆猜想、主动思考、分析推理的学习方法,培养善于发现、实事求是、严谨科学的学习态度。
课题2氯水成分的实验探究(1)
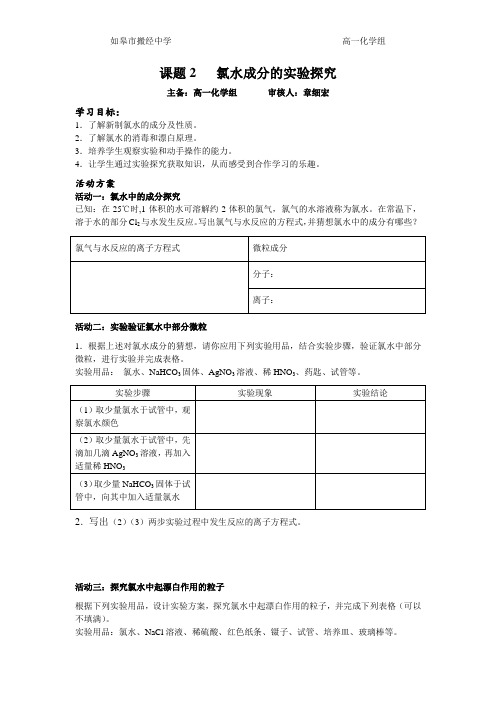
课题2 氯水成分的实验探究主备:高一化学组审核人:章细宏学习目标:1.了解新制氯水的成分及性质。
2.了解氯水的消毒和漂白原理。
3.培养学生观察实验和动手操作的能力。
4.让学生通过实验探究获取知识,从而感受到合作学习的乐趣。
活动方案活动一:氯水中的成分探究已知:在25℃时,1体积的水可溶解约2体积的氯气,氯气的水溶液称为氯水。
在常温下,溶于水的部分Cl2与水发生反应。
写出氯气与水反应的方程式,并猜想氯水中的成分有哪些?活动二:实验验证氯水中部分微粒1.根据上述对氯水成分的猜想,请你应用下列实验用品,结合实验步骤,验证氯水中部分微粒,进行实验并完成表格。
实验用品:氯水、NaHCO3固体、AgNO3溶液、稀HNO3、药匙、试管等。
2.写出(2)(3)两步实验过程中发生反应的离子方程式。
活动三:探究氯水中起漂白作用的粒子根据下列实验用品,设计实验方案,探究氯水中起漂白作用的粒子,并完成下列表格(可以不填满)。
实验用品:氯水、NaCl溶液、稀硫酸、红色纸条、镊子、试管、培养皿、玻璃棒等。
提示:结合活动一、二所得结论,设计对比实验,探究氯水中具有漂白作用的粒子。
2.思考:氯水具有漂白性,为什么漂白剂却常用次氯酸盐?活动四:实验探究久置氯水中溶质成分的变化1.根据氯水所体现出的性质,大胆猜测久置氯水中的溶质成分。
2.设计实验方案,选择合适的实验用品,验证你的猜想。
3.家庭养鱼通常都会将自来水在阳光下曝晒一段时间,结合本堂课所学知识进行解释。
课堂反馈1.下列物质中能使干燥的有色布条褪色的是A.Cl2B.氯水C.NaCl溶液D.HClO2.在氯水中存在多种分子和离子,可通过实验的方法加以确定。
下列说法错误的是A.加入含有酚酞的NaOH溶液,红色褪去,说明有H+存在B.加入有色布条后,有色布条褪色,说明HClO分子的存在C.氯水呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在D.加入硝酸酸化的硝酸银溶液,产生白色沉淀,说明有Cl-离子的存在3.自来水是用氯气杀菌消毒的,不法商贩用自来水冒充纯净水出售。
《氯水性质的探究》-教学设计

氯水性质的探究【教学目标】1、理解氯气与水反应的过程;2、了解氯水中存在的各种微粒(三分子、四离子);3、通过课堂实验设计与检验,进一步理解氯水中的各种微粒成分的化学性质。
培养小组合作的意识及小组合作开展探究实验的能力。
【重难点】氯水中存在的各种微粒(三分子、四离子)及其的化学性质。
【教学过程】1.氯水中的反应氯气与水反应:Cl 2+H 2OHCl +HClO ; 光照条件下:2HClO=====光照2HCl +O 2↑。
2.氯水的成分(1)新制氯水中含有盐酸、次氯酸和氯气。
(2)新制氯水中含有的微粒①三种分子:Cl 2、HClO 、H 2O ;②四种离子:H +、Cl -、ClO -、OH -。
3.实验探究氯水的成分下面是某化学课外活动小组探究氯水成分及性质的活动记录: 观察氯气的颜色:黄绿色;氯水的颜色:浅黄绿色。
预测氯水中含有氯气分子。
实验操作1用两根玻璃棒分别蘸取盐酸和氯水,各滴在一片pH 试纸上。
实验现象滴有盐酸的试纸变红,滴有氯水的试纸中间变为白色,外圈变红。
分析与结论氯水呈浅黄绿色,说明氯水中有氯气分子。
滴有氯水的pH 试纸外圈变红,说明氯水中有能使试纸变红的酸,中间变为白色,说明氯水中有能够使有色物质褪色的物质。
实验操作2向2 mL 新制氯水中滴加AgNO 3溶液反应。
实验现象产生白色沉淀。
分析与结论新制氯水中含有Cl -。
化学方程式:AgNO 3+HCl===AgCl ↓+HNO 3。
综合分析得结论(1)氯水中所含的分子有_______________________________________________________。
(2)氯水中所含的离子有________,使pH 试纸变红的离子为__________。
答案 (1)Cl 2、H 2O 、HClO(2)Cl -、H +、ClO -、OH -(极少量) H +【强化训练】1.在氯水中存在多种分子和离子,可通过实验的方法加以确定。
氯水的成分探究教案

氯水的成分探究教案教案概述本教案旨在帮助学生探究氯水的成分及相关实验操作,并通过实验培养学生的观察能力和实验设计能力。
通过本教案,学生将能够理解氯水的成分以及其在实际应用中的作用。
教学目标1.了解氯水的成分及相关实验操作;2.学会使用适当的实验设备和实验方法来探究氯水的成分;3.培养学生的观察能力和实验设计能力;4.学会正确记录实验结果并分析实验数据;5.培养学生的团队合作能力和解决问题的能力。
教学步骤步骤一:导入•引出氯水的应用背景,如漂白剂、消毒剂等,引起学生的兴趣;•提问:你知道氯水的成分是什么吗?步骤二:理论讲解•讲解氯水的成分及其作用机理;•引导学生了解氯水在漂白和消毒过程中的应用。
步骤三:实验操作•分组进行实验操作,每组2-3人;•实验材料准备:氯化钠溶液、盐酸溶液、酸性高锰酸钾溶液、纸巾、试管、试管架、酒精灯等;•实验步骤:–将氯化钠溶液倒入一个试管中;–使用滴管向试管中加入盐酸溶液,观察实验现象;–使用酒精灯加热试管,观察实验现象。
步骤四:数据分析•让学生记录实验现象,并理解实验过程中所发生的化学反应;•通过讨论和分析实验数据,引导学生总结实验结果。
步骤五:实验总结•引导学生回答问题:通过今天的实验,我们可以得出什么结论?•讨论氯水的独特性质和应用场景。
课堂互动与扩展•学生分组讨论实验结果,分享彼此的发现;•提供更多关于氯水的实验案例,鼓励学生进行实验设计并分享结果;•引导学生思考如何合理利用氯水及其相关知识保护环境。
课后作业•要求学生根据实验结果撰写实验报告,包括实验目的、实验步骤、实验结果和结论;•要求学生查找相关资料了解氯水的各种应用场景,并写一份小论文。
小结通过本教案,学生将能够了解氯水的成分及其在实际应用中的作用。
通过实验操作,学生将培养观察能力和实验设计能力,同时也能够学会正确记录实验结果并分析实验数据。
此外,本教案还将培养学生的团队合作能力和解决问题的能力。
氯水成分的探究教学设计

★★★★★《氯水成分的探究》教学设计潮州市金山中学化学组黄洁玲一、教学目标:1、知识技能⑴探究氯水中存在的成分⑵了解次氯酸的性质及应用(自来水加氯消毒、次氯酸漂白性的应用、漂白粉的制备与使用等)2、能力培养⑴通过边讲边实验,培养学生的实验操作能力、观察能力和思维能力⑵通过探究、讨论、分析,培养学生的分析归纳能力和探究能力3、情感目标:通过介绍“自来水加氯消毒”、“次氯酸漂白性的应用”、“漂白粉的制备与使用”等生活实例,培养学生理论联系实际的能力,提高学生的学习兴趣,激发学生热爱科学、探索真理的热情。
二、教学重、难点:探究氯水中存在的成分三、讲课类型:实验探究课四、教学手段:计算机辅助教学、边讲边实验五、教学方法:启发式教学法、实验法、归纳法六、教学用具:⑴实验仪器:试管、胶头滴管、试管架、药匙、镊子、集气瓶⑵实验药品:氯水、硝酸银溶液、稀硝酸、水、氯气、碳酸氢钠固体⑶实验用品:红纸⑷教学设备:多媒体计算机、实物投影仪七、教学过程设计:附:板书设计(主要框架)氯水成分的探究一、氯水中含有的粒子:H2O、Cl2、H+、Cl-、HClO、ClO-、少量OH-二、漂白粉的制备、使用与保存(1)、制备:漂白粉2Ca(OH) 2 + 2Cl2=CaCl2 + Ca(ClO)2 + 2H2O(有效成分)(2)、使用:工业上:Ca(ClO)2 + 2HCl =CaCl2+ 2H ClO生活中:Ca(ClO)2+ H2O + CO2=CaCO3↓+ 2H ClO (3)、保存:密闭、避光、保持干燥小结: “氯水”粒子小结氯水微粒集群贤,水分氯气次氯酸,次氯酸根氯离子,“氢氧”“氢离”喜谈天。
《氯水的成分探究》教学设计

《氯水的成分探究》教学设计、教材分析.地位和作用《富集在海水中的元素一一氯》来自人教版必修1第四章第二节,共安排三个课时进行学习,其中氯水的成分探究作为第二课时教学内容。
氯作为典型的非金属元素,与前一节中的硅在性质上体现了极大的差异。
在第一课时中学习了氯气能与金属及还原性较强的非金属单质反应后,本堂课主要学习氯气和水的反应,重点研究氯水的成分。
氯的学习过程与方法既能为随后学习硫和氮提供学法指导,也给将来学习元素周期律打下基础。
3. 教学目标(1 )指导学生通过观察和理论分析预测新制氯水的成分,培养学生的探索精神。
(2) 通过引导学生设计实验方案以检验氯水的成分,培养学生的合作精神和动手能力。
(3) 通过制造认知冲突加深学生对氯气漂白性的认识,培养学生的质疑精神。
(4) 通过整节课的教学,能让学生熟练掌握氯气与水反应的化学方程式,掌握本节课的重点:氯水的性质及其对应的成分。
4. 教学重点和难点教学重点:氯水的成分分析、氯气的漂白原理教学难点:开展探究实验的一般方法二、学法分析1 •学情分析高一学生在学习了金属及其化合物的相矢知识后,对元素化合物的学习形成了一定的共识,即通过化学实验去认识和硏究物质的性质。
结合以往的教学实践,学生在书写氯气与水反应、氯气与碱反应的化学方程式时经常错写或漏写,根源在于学生对反应的原理认识不2.学法指导为了弥补学生的认知短板,本节课一方面注重创设问题情境,激发学生的探索欲,引导学生积极思考,另一方面让学生设计并实验获得感观印象, 让学生在理论与实跋的双重体验中牢固掌握这一知识。
三、教法分析通过“实验验证”得出最终结论。
在思考、观察、实验及交流与合作中,自主建构知识,培养和提高化学学习能力。
实验用品:氯气、蒸馆水、紫色石蕊试液、硝酸AgNO 溶液、NaQO 溶液、无水硫酸铜、红纸条、烧杯、小试管、胶头滴管 四、教学流程深刻。
1.“交流讨论”得出“实验方案”通过“问题驱动”激发学生形成“合理猜想”,通过2.酸化的教师活动 学 生活动 设 计意 图【引入】幻灯片展示:食盐、海水的图片,显示 字幕富集在海水屮的兀素一氯”。
氯水成分的教案

“氯水的成分”教学设计襄樊市一中高一化学组一、教学内容本节课讲的是高中化学人教版第四章第一节“氯气”中的第二个课时“氯气与水的反应”。
通过探究式实验教学的方法,用实验检验氯水中可能存在的粒子,从而揭示氯气与水反应的实质及其产物的相关性质。
二、学生情况首先,学生在第二章的学习中,已经理解了氧化还原反应的实质,并且在本节的第一课时中也学习了氯气相关的物理和部分化学性质,从而可以为本次课中相关的实验验证方案(如Cl2)的设计,提供一定的理论基础。
另外,第二章关于金属及其化合物的学习,学生从中掌握了物质研究的一般思路(从物性到化性),有助于学生对氯水研究方式的理解。
再次,在前面一年多对化学这门课程的学习中,学生本身知道一些常见离子,如Cl-、H+等的检验方式,也具备一定的设计实验方案的能力。
三、教学目标1、知识与技能(1)通过实验,了解氯水的成分,并掌握氯气与水反应的实质及产物。
(2)根据次氯酸的性质,知道次氯酸在生产及生活中的应用。
2、过程与方法(1)学生在老师的引导下作出猜想,学习用实验的方法验证假设。
(2)通过对实验结果的分析推理,培养逻辑思维的能力。
(3)通过观察化学现象和反应事实,学会善于从实验中发现问题、分析问题、解决问题的方法。
3、情感态度与价值观学生通过探究实验,掌握实验探究的一般原理和方法,在获取知识的同时激发学习化学的兴趣,学会大胆猜想、主动思考、分析推理的学习方法,培养善于发现、实事求是、严谨科学的学习态度。
四、教学方法本节课采用探究式实验教学的方法,通过“提出问题-形成猜想-制定方案-实验检验-分析推理-发现新问题-分析新问题-解决新问题-得出结论”的科学探究过程,学生在老师的引导下充分发挥主体性,积极思考、大胆猜想,从实验中掌握化学知识。
五、教学重点、难点重点:氯气和水的反应。
难点:氯水成分的探究及从理论角度分析该反应。
六、教学准备多媒体教学设备、ppt课件、多媒体视频(上课前让学生合上教科书,为他们创设一个未知的环境,避免学生直接看教材获得结论而减少了思考的空间)七、教学流程八、教学过程九、板书设计(不包括副板书部分)一、1、新制氯水的成分:三分子:Cl2、H2O、HClO四离子:Cl-、H+、ClO-、OH-2、氯气与水的反应:Cl2+H2O =HCl + HClO(弱酸)3、次氯酸的性质(强氧化性)杀菌、消毒(自来水消毒),漂白性(漂白剂)二、久制氯水的成分H+、Cl-、H2O、OH-(稀盐酸)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
接下来我们来研究一下氯气溶于水后有什么变化。
思考1:氯气能否与"0反应?
假设一:氯气与水不反应,则成分为什么?、
假设二:氯气与水会反应,则可能成分为什么?学生讨论后回答 氯气与水不反应,则成分为:Cl2、HO
精品文档
氯气与水会反应,则可能成分为:Cl2、H2O、HCl(Cl-、H+)
我在黑板上写出次氯酸见光易分解的化学方程式2HCI0=======2HCI+ 02T
[问]:应怎样设计实验来验证?
[学生回答]:可通过检验是否有Cl和H来验证。
分组实验实验一:检验是否有Cl-和H+
1.氯水中有 无Cl-方案:氯水与硝酸银(酸化)溶液反应 现象:有白色沉淀生成 结论:氯气与水反应且氯水中有Cl-,且应该有H+。
2.氯水中有 无H+
方案:用沾有氯水的玻璃棒点在蓝色石蕊试纸上。 观察颜色的变化。(并与盐 酸沾在试纸上的现象对比)
结论: 具有漂白作用是氯气与水反应生成的另一物质 思考4:根据化合价分析这种物质可能是什么?[师生共同分析]有HCl生成,则有氯元素的化合价降低则一定有元素化合价升 高,不可能是H+也不可能有氧气生成(因为溶液有漂白性),则应是另外一种物 质---HClO
接下来写出氯气与水反应的化学方程式:Cl2+H2O==HCl+HClO
精品文档
富集在海水中的元素大纲解析高一学生的学习情况,我力求实现以下目标:
1知识目标:a.使学生掌握氯气的化学性质
b.使学生了解氯气的物理性质
2能力目标:a.通过实验探究培养学生观察能力、归纳能力、推理能力、和独 立思考能力。
b.通过对氯气的学习掌握学习非金属性质的一般规律。
信息:
次氯酸是一元弱酸, 其酸性比碳酸还 弱,具有很强氧化性, 能杀死水里的病菌, 具有杀菌消毒作用,且能使某些染料 和有机色素褪色,可用作棉、纸张等的漂 白剂,次氯酸不稳定,且见光分解放出氧气。
请学生阅读材料归纳总结次氯酸性质
弱酸性、具有漂白性、强氧化性、 见光分解(可用于自来水的 消毒、杀菌)。
现象:沾有氯水的试纸中心褪色,四周变红。 思考2:氯水有H+, 为什么试纸中心会褪色呢? 结论: 氯水具有漂白性。
分组实验二:将品红滴入氯水中,观察现象。
现象: 品红褪色
结论: 氯水中有一种成分具有漂白性
思考3:氯水中有哪些成分?又是哪一种成分具有漂白性?
Cl2、H2O、HCl
实验三: 用干燥和湿润的有色纸条放入干燥Cl2中,看是否褪色。(播放视频) 现象: 湿润的有色纸条在氯气中会褪色。
3情感目标:a.通过实验探究培养学生在学习过程中敢于质疑敢于探究的良好 品质。
b.通过氯气的毒性讲解,增强学生的环保意识,以及用辩证的思维 去看待事物。
教学重点、难点
重点:氯气化学性质
难点:氯气与水的反应
教学方法
阅读资料——归纳总结物理性质
分析结构一一推导化学性质
提出问题一一实验探究氯气与水的反应
教学资源
图片、视频、课件、实验器材等。
教学过程
[导入]视频氯气可以给自来水水消毒,引入氯气。
[过度]首先来了解一下氯气的物理性质
通过展示一则新闻图片,通过阅读新文图片并引导学生从颜色、气味、状态、 密度、毒性等方面学生总结氯气的物理性质。
得出氯气的物理性质:氯气是一种黄绿色、有刺激性气味的有毒气体,密度比空 气大,可溶于水,熔沸点低,易液化。
