0049《中级无机化学》西南大学网络教育20年春季作业参考答案
19秋西南大学[0049]《中级无机化学》作业复习资料答案
![19秋西南大学[0049]《中级无机化学》作业复习资料答案](https://img.taocdn.com/s3/m/e4a6a86e79563c1ec5da7184.png)
西南大学网络与继续教育学院
课程名称:《中级无机化学》课程代码:0049 学年学季:20192
单项选择题
1、B4H10属于()分子。
闭式
巢式
网式/【正确】
链式
2、估算配合物中自旋对磁矩的贡献最大的是()。
[Co (NH3)6]3+
[Fe (H2O)6]2+/【正确】
[Fe (CN)6]3-
[Cr(NH3)6]3+
3、Pr的磷酸盐为Pr3(PO4)4,其最高氧化态氧化物的化学式是()
Pr2O3
Pr2O
PrO2/【正确】
Pr3O4
4、下列不是π-配体的是()。
CH2=CH2
CO/【正确】
5H5-
5、B12H122-的名称为()。
闭式-十二硼烷阴离子(2-)/【正确】
十二硼烷阴离子(2-)
十二硼烷阴离子(-2)
闭式-十二硼烷阴离子(-2)
6、在单质金属中,导电性最好的是(),熔点最高的是()。
Cs, W
Hg; Cr
Os, Mo。
Ag,W/【正确】
7、金属羰基配合物的特点有()。
一氧化碳与金属能形成很强的化学键
中心原子总是呈现出较低的氧化态。
0069]《化工基础》 20年春季西南大学作业答案
![0069]《化工基础》 20年春季西南大学作业答案](https://img.taocdn.com/s3/m/11e4d5712f60ddccdb38a00d.png)
西南大学网络与继续教育学院课程代码: 0069 学年学季:20201单项选择题1、泵实际安装高度必须()允许安装高度,才不发生气蚀。
.无所谓.等于.低于.高于2、许多化学反应中采用催化剂在化学反应中催化剂在化学反应中催化剂所起到的作用是()。
.改变化学平衡.增加正反应速度.降低逆反应速度.降低反应活化能,增大正、逆反应速度3、计算液体无相变时在圆直管内对流传热系数,若可采用公式,式中指数n为()。
.被加热时为0.4,被冷却时为0.3.被加热时为0.3,被冷却时0.4.0.4.0.34、多层平壁定态导热时,以下选项说法不正确的是()。
. A. 传热速率具有加和性.推动力具有加和性.传热阻力具有加和性.热通量不具有加和性5、再沸器的作用是提供一定量的()流。
.上升产品.上升蒸气.上升组分.上升物料6、在二元混合液中,沸点低的组分称为()组分。
.难挥发.不挥发.易挥发.可挥发7、对于一定的分离任务来说,当全回流时R=(),所需理论板数为最少;而R=()时,所需理论板数为∞。
.∞、0.0、Rmin.∞、Rmin.0、∞8、气体在直径不变的圆形管道内作等温定态流动,则各截面上的()。
.速度逐渐减小.体积流量相等.质量流量相等.速度相等9、某液体在内径为d0的水平管路中稳定流动,其平均流速为u0,当它以相同的体积流量通过等长的内径为d2(d2=d0/2)的管子时,则其流速为原来的()。
.2倍.4倍.16倍.8倍10、用120℃饱和蒸汽加热原油,蒸汽冷凝成同温度的冷凝水,此时两流体的平均温度差的大小关系为。
.大于.小于.等于.无法确定11、理想排挤模型的特点是( )。
.空间混合为零,反混为无穷大.空间混合为零,反混为零.空间混合无穷大,反混为零.空间混合无穷大,反混为无穷大12、流体在圆形直管内作定态流动,雷诺准数Re=1500,则其摩擦系数应为()。
.0.0267.无法确定.0.0427.0.03213、返混会导致反应器内()。
奥鹏20年春福师《中级无机化学专题》在线作业一(答案参考)非免费答案

拿答案:11447,66066【奥鹏】-[福建师范大学]福师《中级无机化学专题》在线作业一试卷总分:100 得分:100第1题,下列说法不正确的是()A、金属原子的活泼性是指金属原子失去电子的能力B、I1【1为下标】越小,单个气态原子失去一个电子所需能量越小,越容易失电子,金属原子的活泼性就越高C、金属单质的热力学活泼性是指金属单质在水溶液中形成最低稳定价态离子的倾向D、金属的活泼性与金属原子的活泼性不一定完全一致正确答案:第2题,关于二茂铁的说法不正确的是A、二茂铁为一稳定的橙黄色晶体B、溶于苯等有机溶剂C、易溶于水D、是最早合成并确证的金属夹心型配合物正确答案:第3题,关于玻璃态材料说法不正确的是A、广义的玻璃态材料,还包括一些金属材料B、由正常的液态形式冷却而形成的一种材料称为玻璃态材料C、它是随着粘度的增加而逐渐固化D、玻璃态与晶体的初始状态类似正确答案:第4题,下列属于非桥式结构的是【其中数字为下标】A、Fe3(CO)12B、Fe2(CO)9C、Co2(CO)8D、Os2(CO)12正确答案:第5题,关于金属酶得说法,错误的是( )A、金属离子作为辅助因子,都是直接参与催化活性部位的构成B、通常金属-酶蛋白配合物的结合常数可达107~108L?mol-1C、参与金属酶组成的主要为D、过渡金属离子Fe、Zn、Cu、Mn、Co、Mo、Ni等E、金属酶一般含有化学计量的金属离子作为辅因子正确答案:第6题,下列物质中碱性最强的是()A、R4NOHB、R3NHOHC、R2NH2OHD、NH3(aq)正确答案:第7题,下列不属于常用轰击粒子的是A、质子B、电子C、α粒子D、中子正确答案:第8题,Ca2+ 的生物功能不包括()A、稳定蛋白质的构象B、形成各种生物体的固体骨架物质C、具有引发某些生理活动的功能D、有减缓血液凝固和调节心律的功能正确答案:第9题,下列分析不正确的是()A、PH-E(Na+/Na)关系曲线是一条平行于pH轴的直线,截距为-2.7109,它表示的数值与溶液的pH值无关。
0049《中级无机化学》西南大学网络教育20年春季作业参考答案
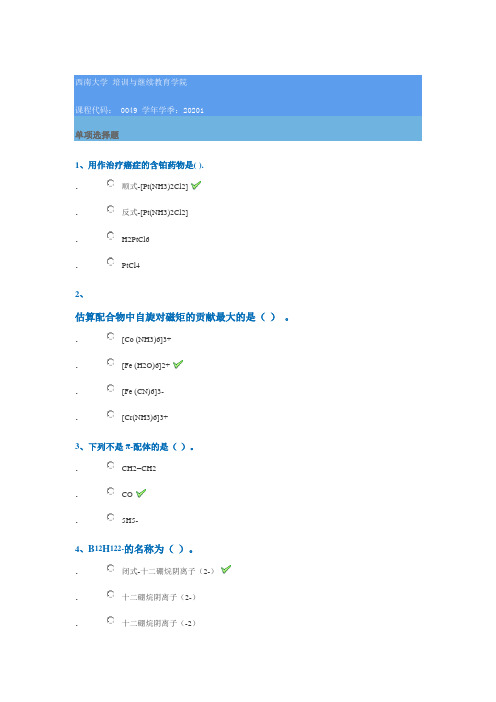
0049 20201单项选择题1、用作治疗癌症的含铂药物是( )..顺式-[Pt(NH3)2Cl2]. 反式-[Pt(NH3)2Cl2]. H2PtCl6 .PtCl42、估算配合物中自旋对磁矩的贡献最大的是( ) 。
. [Co (NH3)6]3+ . [Fe (H2O)6]2+. [Fe (CN)6]3- .[Cr(NH3)6]3+3、下列不是π-配体的是( )。
. CH2=CH2 . CO.5H5-4、B 12H 122-的名称为( )。
. 闭式-十二硼烷阴离子(2-). 十二硼烷阴离子(2-) .十二硼烷阴离子(-2).闭式-十二硼烷阴离子(-2)5、在单质金属中,导电性最好的是(),熔点最高的是()。
.Cs,W.Hg;Cr.Os,Mo。
.Ag,W6、估计Os3(CO)12中共有()个M—M键. 1. 2. 3. 47、在晶体场理论中,在八面体场中Oh场作用下d轨道分裂为()和()。
.e,t2g.eg,tg.e,t2;.eg,t2g8、硼酸H3BO3是一种()。
.一元中强酸.一元弱酸.三元弱酸.三元中强酸9、HOCl、HOBr、HOI的酸性最强的为()。
.HOCl.HOBr.HOI10、HCO3-的共轭酸为()。
.CO32-.H2CO3.没有共轭碱11、下列配合物中,没有反馈π键的是( )。
.[Pt(PPh3)4]2+.[Pt(C2H4)Cl3]-.[Co(CN)6]4-.[FeF6]3-12、人体血液中,负责输送氧气的金属蛋白是()。
.血红蛋白.细胞色素.铁贮存蛋白.肌红蛋白13、[Pt(NH3)4][PtCl6]和[Pt(NH3)4Cl2][PtCl4]互为()。
.电离异构体.键合异构体.配位异构体14、BF3、B6H6、Al2Cl6都是稳定的化合物,BH3、AlCl3则相对不稳定,其原因是()。
.前者形成大键,后者缺电子.前者通过大π键、多中心键、配位键补偿了缺电子,后者缺电子.前者缺电子,后者有多中心键.前者有配位键,后者缺电子15、下列配位体不属于π-配位体的是()。
西南大学网络考试答案.docx

第一批次(填空题)1、合成氨的生产过程主要包括(造气)、(净化)、(压缩和合成)等三个步骤2、典型的合成氨原料有(煤)、(焦碳)和(天然气)。
3、合成氨原料气中水蒸气对甲烷的摩尔比称为(水碳比)。
4、甲烷蒸气转化过程受压力、(温度)、原料配料中的水碳比及空间速度等因素影响。
5、铜氨液洗涤法、甲烷化法和液氮洗涤法都是常用的合成氨原料气中残余(一氧化碳)的脱除方法。
6、对合成氨原料气的净化目的是除去其中的(硫化物)、(一氧化碳)和二氧化碳等杂质气体,而得到纯净的氢气和氮气。
7、在合成氨生产中,从反应物系的相态看,氨合成是(气固相)反应,合成塔是(固定床)反应器。
,8、氨合成反应是中等放热的可逆、体积缩小的气固相催化反应,(提高)压力、(降低)温度有利,合成塔是固定床反应器。
常用的微量元素9、肥料有(硼肥)、(锌肥)、(锰肥)、(钼肥)。
10、尿素生产过程中主要有(尿素缩合反应)和(尿素水解反应)两类副反应。
11、在(润湿)或(晶型转变)时,硝铵有结块现象。
12、磷酸溶液中硫酸钙结晶可以以(二水物)、(半水物)、(无水物)三种水合物形式存在。
13、(硫铁矿)和(硫磺)是接触法生产硫酸的主要原料14、硝酸生产的尾气治理方法主要有(催化还原法)、(溶液吸收法)和(固体吸附法)。
吸附剂可以是分子筛、硅胶、活性炭及离子交换树脂等。
15、用于生产硫酸的原料主要有(硫铁矿)、(硫磺)、冶炼烟道气和石膏等硫酸盐。
16、通常的硫酸生产工艺流程是以炉气的净化方法来命名的,常见的有(水洗法)、干洗法和(酸洗)三种制酸流程。
17、硫酸生产中采用的二转二吸流程之优点是提高了二氧化硫的(最终转化率),既提高了硫的利用率又减少了(环境污染),该工艺既适合二氧化硫浓度高的炉气,也适用于二氧化硫浓度低的炉气。
18、氨氧化工艺条件主要考虑温度、压力、接触时间及(混合气体组成)。
19、电解制碱时,最影响电极过电位的因素是(电极材料)20、隔膜法电解制碱可以用来抑制副反应的措施包括选用性能良好的隔膜、采用较高的温度、采用饱和精制食盐水以及控制(电解液流速)。
西南大学2020年春季分析化学【0067】课程考试大作业参考答案

1、
解 :Na2B4O7+5H2O=2NaH2BO3+2H3BO3
Na3PO4+3RH=3RNa+H3PO4
NaH2BO3+RH=H3BO3+RNa
因此 1Na3PO4~1H3PO4~H2PO4-~1NaOH(甲基红变色)
Na3PO4的百分含量为0.1000×30.00×164.0/(1.000×1000)×100=49.20%
A.H3PO4—H2PO4-B.HPO42 –—PO43 -
C.HPO42 –D.H2PO4-
5.H3AsO4的pKa1—pKa3分别为2.20,7.00,11.50。pH=7.00时,[H3AsO4] / [AsO43-]比值是( B )
A.100.4B.10-0.3C.1020.6D.10-20.6
1.简述碘量法的主要误差来源和测定条件。
2.如何提高分析方法的准确度?
3.什么是标准溶液?标准溶液配制的方法有几种?
四、计算题(每小题10分,共2小题,总20分)。
1.称取含Na3PO4—Na2B4O7·H2O(A)试样1.000克,溶解后,通过氢型酸性阳离子交换数值RH收集流出液,以甲基红为指示剂,用0.1000 mol/L的NaOH滴定,耗去30.00毫升。随后加入足量甘露醇,以百里酚酞为指示剂,继续用NaOH滴定,耗去40.00毫升。求原混合试样中Na3PO4%(M = 164)和Na2B4O7·H2O%(M = 381)问为何用甲基红作指示剂?
B.偶然误差具有随机性
C.精密度表示分析结果间相互接近的程度
D.准确度表示分析结果与真值接近的程度
3.根据分析天平的称量误差( 0.0002g)和相对测量的相对误差(0.1%),下列
西南大学网考中级无机化学答案参考

8:[单选题]下列元素第一电离能最大的是()。
A:BB:CC:ND:O参考答案:C9:[单选题]下列离子中,离子半径最小的是()。
A:Cl-B:Ca2+C:Sc3+D:Ti4+参考答案:D 10:[单选题]性质最相似的两个元素是()。
A:Zr 和HfB:Ru 和RhC:Mn 和MgD:Cu 和Cr 参考答案:A11:[多选题]下列性质相似的元素是()。
A:Al和BeB:B和AlC:B和SiD:Al和Ca参考答案:AC12:[单选题]估计Ru3(CO)12中共有()个M―M键A:1B:2C:3D:4参考答案:C1:[判断题]判断方程式B2H6 + 2N(CH3)3=2BH3N(CH3)3是否正确。
参考答案:正确2:[判断题]判断方程式SOCl2 +Cs2SO3=2CsCl+2SO2是否正确。
参考答案:正确3:[判断题]判断方程式SbF5 + KF= KSbF6 是否正确。
参考答案:正确4:[判断题]判断方程式Cr(CO)6 + C6H6=Cr(C6H6)(CO)3 + 3CO是否正确。
参考答案:正确5:[判断题] 判断方程式Mn2(CO)10 + Br2=2Mn(CO)5Br是否正确。
参考答案:正确6:[判断题]. 判断方程式Fe(CO)5 + 3KOH=K[Fe(CO)4H] + K2CO3 + H2O 是否正确。
参考答案:正确7:[判断题]判断方程式CrCl3 + 3Na + 6CO=3NaCl + Cr(CO)6是否正确。
参考答案:正确8:[判断题]判断方程式2CoCO3 + 8CO + 2H2=Co2(CO)8 + 2CO2 + 2H2O是否正确。
参考答案:正确9:[判断题]判断方程式Fe + 5CO=Fe(CO)5是否正确。
参考答案:正确10:[判断题]判断方程式BF3NMe3 + BCl3 = Cl3BNMe3 + BF3是否正确。
参考答案:正确11:[判断题].判断方程式F4SiNMe3 + BF3 = F3BNMe3 + SiF4 是否正确。
中级无机化学习题(含答案)

(B) 对 B(CH3)3 的碱性较强:(1) Me3N,Et3N;(2) (2-CH3)C5H4N,(4-CH3)C5H4N;(Bu
丁基;C5H4N 吡啶) 答:(A) (1) BBr3;(2) BCl3;(3) B(n-Bu)3;(B) (1) Me3N;(2) (4-CH3)C5H4N 6. 解释酸性变化规律 HOI < HOBr < HOCl。
9. 比较下列每组两个化合物与乙醇形成氢键的能力:
2
(1) (H3Si)2O 和(H3CH2C)2O;(2) (H3Si)3N 和(H3C)3N 答:对同一种 H 给体(如乙醇)而言,Lewis 碱性越强形成的氢键也越强。因为 O 和 N 上
的电子可扩充到 Si 的空 d 轨道上,因此与 Si 结合的 O 和 N 较与 C 结合的 O 和 N 的
Lewis 碱性低,因而可以预期(1)中的乙醚和(2)中的三甲胺形成的氢键更强些。
10.比较 HCF3 与 HCH2NO2 的酸性强弱,叙述理由。 答:HCF3 酸性较弱。按照诱导效应似应是前者的酸性强,因为 3 个电负性很大的 F 使 C
原子上带很高的正电荷。然而 HCF3 失去质子形成的 CF3-基团 C 上的负电荷离域化程 度并不高,而在 HCH2NO2 失去质子形成的 CH2NO2-基团 C 上的负电荷可以向 NO2 基 团的*轨道离域而稳定。所以后者的酸性较强。
子是
,与 BF3 相结合的原子是
。
答:P,N
4. 按照质子亲和势增加的顺序将下列各碱 HS,F,I,NH2-排序为。 答: I- < F- < HS- < NH25 . 在下述各组化合物中按题目要求进行选择。
(A) 最强的 Lewis 酸:(1) BF3,BCl3,BBr3;(2) BeCl2,BCl3;(3) B(n-Bu)3,B(t-Bu)3;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
0049 20201单项选择题1、用作治疗癌症的含铂药物是( )..顺式-[Pt(NH3)2Cl2]. 反式-[Pt(NH3)2Cl2]. H2PtCl6 .PtCl42、估算配合物中自旋对磁矩的贡献最大的是( ) 。
. [Co (NH3)6]3+ . [Fe (H2O)6]2+. [Fe (CN)6]3- .[Cr(NH3)6]3+3、下列不是π-配体的是( )。
. CH2=CH2 . CO.5H5-4、B 12H 122-的名称为( )。
. 闭式-十二硼烷阴离子(2-). 十二硼烷阴离子(2-) .十二硼烷阴离子(-2).闭式-十二硼烷阴离子(-2)5、在单质金属中,导电性最好的是(),熔点最高的是()。
.Cs,W.Hg;Cr.Os,Mo。
.Ag,W6、估计Os3(CO)12中共有()个M—M键. 1. 2. 3. 47、在晶体场理论中,在八面体场中Oh场作用下d轨道分裂为()和()。
.e,t2g.eg,tg.e,t2;.eg,t2g8、硼酸H3BO3是一种()。
.一元中强酸.一元弱酸.三元弱酸.三元中强酸9、HOCl、HOBr、HOI的酸性最强的为()。
.HOCl.HOBr.HOI10、HCO3-的共轭酸为()。
.CO32-.H2CO3.没有共轭碱11、下列配合物中,没有反馈π键的是( )。
.[Pt(PPh3)4]2+.[Pt(C2H4)Cl3]-.[Co(CN)6]4-.[FeF6]3-12、人体血液中,负责输送氧气的金属蛋白是()。
.血红蛋白.细胞色素.铁贮存蛋白.肌红蛋白13、[Pt(NH3)4][PtCl6]和[Pt(NH3)4Cl2][PtCl4]互为()。
.电离异构体.键合异构体.配位异构体14、BF3、B6H6、Al2Cl6都是稳定的化合物,BH3、AlCl3则相对不稳定,其原因是()。
.前者形成大键,后者缺电子.前者通过大π键、多中心键、配位键补偿了缺电子,后者缺电子.前者缺电子,后者有多中心键.前者有配位键,后者缺电子15、下列配位体不属于π-配位体的是()。
.C6H6.C5H5-.C4H6.PR316、在下列有机金属化合物中,不符合18电子规则的有()。
.Fe(CO)5.HCo(CO)4.V(CO)6.(η5— C5H5)2Fe17、下列氢氧化物溶解度最小的是()。
.Ba(OH)2.La(OH)3.Lu(OH)3.Ce(OH)418、已知配合离子[Co(en)3]3+的空间构型为八面体,它的几何异构体数目为()。
(en为乙二胺).1. 2. 3. 519、配合物K2[Pt(NH3)2(OH)2 Cl2]中Pt的氧化数为()。
.+1.+2.+3.+420、[{(C6H5)3P}2Pd(SCN)2]和[{(C6H5)3P}2Pd(NCS)2]互为()。
.键合异构体.配位异构体.水合异构体21、下列氯的含氧酸中氧化性最强的是()。
.HOCl.HClO2.HClO3.HClO422、下列化合物水溶液的酸强度最小的是()。
.H2O.H2S.H2Se.H2Te23、在反应中,NH3为()。
.Arrhenius碱..Bronsted酸.Lewis碱.Lewis酸24、根据夹心配合物的分类(C5H5)2Fe是属于()。
.混合夹心式.多层夹心式.半夹心式.对称夹心式25、下列气态二元氢化物中酸强度最小的是()。
.HI.HBr.HCl.HF26、预测Ir4(CO)12 骨架的几何构型()。
.平面三角形.平面四边形.四面体.直线型27、下列酸中属于超酸的是()。
.HCl.HNO3.HClO.HSO3CF328、下列是π-酸配体的是()。
.H2O.NO.乙二胺.NH329、下列元素中,可形成多酸的是()。
.Na.W.Fe.Ag30、估计Fe3(CO)12 中Fe—Fe键的总数为()。
. 1. 2. 3. 431、晶体场理论中,在八面体场作用下d轨道分裂为()。
.t2g和e.t2和e.e g和t2.e g和t2g32、已知配合物[Pt(NH3)2(NO2) Cl]的空间构型为平面正方形,它的几何异构体数目为()。
. 1. 2. 3. 533、在[Co(NH3)4Cl2]中,Co的氧化数为()。
.0.+1.+2.+334、[Co(en)2(NCS)2]Cl和[Co(en)2(NCS)Cl]NCS互为()。
.水合异构体.电离异构体.配位异构体.键合异构体35、下列氯的含氧酸中酸性最强的是()。
.HOCl.HClO2.HClO 3.HClO 436、下列化合物中属于金属有机化合物的是()。
.[Mg(EDTA)]2-.[Pt(en)Cl2].K[PtCl3(C2H4)].K4[Fe(CN)6]37、估计Ru3(CO)12 中Re—Re键的总数为()。
. 1. 2. 3. 6判断题38、判断方程式B2H6 + 2N(CH3)3=2BH3N(CH3)3是否正确。
. A.√. B.×39、判断方程式SOCl2 +Cs2SO3=2CsCl+2SO2是否正确。
. A.√. B.×40、判断方程式SbF5 + KF= KSbF6是否正确。
. A.√. B.×41、判断方程式Mn2(CO)10 + Cl2=2Mn(CO)5Cl是否正确。
. A.√. B.×42、判断方程式Fe(CO)5 + 3KOH=K[Fe(CO)4H] + K2CO3 + H2O 是否正确。
. A.√. B.×43、判断方程式Fe(CO)5+PPh3=Fe(CO)4PPh3+CO是否正确。
. A.√. B.×44、镧系元素的特征价态是+3价。
. A.√. B.×主观题45、碘化钾溶液中滴加氯水的反应。
参考答案:Cl2 + 2I-=2Cl- + I246、B2H6+NaH→参考答案:B2H6+2NaH →2NaBH447、参考答案:48、用反应方程式说明Zn2+在液氨中的两性。
参考答案:在液氨中:Zn2+ +2NH2- = Zn(NH2)2↓Zn(NH2)2↓+2 NH2- = Zn(NH2)42-49、B6H12+P(CH3)3→参考答案:B6H12+P(CH3)3→BH3P(CH3)3+B5H950、Co2(CO)8+NO →参考答案:Co2(CO)8+2NO → 2Co(CO)3(NO) + 2CO51、Fe3++Eu2+=参考答案:Fe3++Eu2+=Fe2++Eu3+52、B10H14+NaH →参考答案:B10H14+NaH→Na[B10H13]+H2(Na[B10H13]+NaH→Na2[B10H12]+H2)53、参考答案:(C5H5)Fe(C5H4 CH2NCH3)2 + H2O54、参考答案:55、在BrF3中,SbF5与KF的反应方程式。
参考答案:SbF5+KF = KSbF656、由于P(d5)>P(d4)>P(d7)>P(d6),故d6离子常为()自旋的。
参考答案:低57、PbO2的氧化性比SnO2的氧化性()。
(填强、弱、相等)参考答案:强58、稀土元素:是15个镧系元素加上()共计17个元素。
参考答案:钪(Sc)和钇(Y)59、[Fe(CN)6]3-中Fe3+采用的杂化态为()。
参考答案:d2sp360、命名配合物[Cr(Py)2(H2O)Cl3] (Py 为吡啶)()。
参考答案:三氯.水.二吡啶合铬(III)61、根据鲍林规则,估计HNO3的p K a 值为()。
参考答案:= –362、Ag+的电子排布为4d10,则[Ag(NH3)2]+ 溶液颜色为()。
参考答案:无色63、金属酶是能执行催化功能的()蛋白。
参考答案:金属64、造成第三过渡元素原子半径和第二过渡元素原子半径相接近的原因是()。
参考答案:镧系收缩65、K4[Fe(CN)6]为低自旋配合物,根据晶体场理论,中心离子的电子排布为()。
参考答案:t2g6 e g066、配合物四氢合铝(III)酸锂的化学式为()。
参考答案:Li(AlH4)67、超酸是哈密特酸度函数Ho()-11.93的酸。
参考答案:< (或“小于”)68、分析乙硼烷的化学键。
参考答案:每个B原子以sp3杂化得4个sp3杂化轨道,每个B原子用2个sp3杂化轨道与2个H原子的1s轨道形成2个B-H σ键,每个B原子利用剩余的2个sp3杂化轨道分别与H原子的1s轨道形成三中心2电子(3c-2e)键。
69、试用价键(VB)法解释[PtCl3(C2H4)]-配离子中的化学成键。
参考答案:Pt2+为d8电子构型,其5dx2-y2、6s、6p y和6p x轨道组成4个dsp2杂化轨道。
3个杂化轨道接受3个Cl-配体的3对孤对电子,形成3个σ–键。
第4个杂化轨道接受C2H4配体的π–电子形成第4个σ–键,同时Pt2+的dxz电子向C=C键的π*轨道反馈,形成1个反馈π–键。
70、解释天然铜矿多为硫化物而不是氧化物。
参考答案:根据硬软酸碱理论,Cu(I,II)—S2-为软酸—软碱结合,而Cu(I,II)—O2-为软酸—硬碱结合。
所以天然铜矿多以较稳定的硫化物而不是以较不稳定的氧化物形式存在。
71、解释为什么CF3COOH的酸性比CH3COOH的酸性强。
参考答案:因为F是电负性最高的元素,F原子的极强的吸电子能力以及羰基的诱导作用,使CF3COOH分子中羰基O原子的正电性增强,从而对H原子的吸引减弱而使其易于解离。
当H原子解离后,生成的阴离子CF3COO–中形成离域π34,大大增加了该阴离子的稳定性。
因此CF3COOH具有很强的酸性。
72、试从Jahn-Teller效应解释二价铜的化合物结构常常为4个短键,2个长键,为拉长八面体结构。
参考答案:假设eg轨道采取的结构,即dx2-y2轨道上短缺一个电子,那么在x-y平面上的电子云密度小于z轴上的电子云密度,中心离子对x-y平面上的4个配位体的吸引力大于对z轴上的两个配位体的吸引。
则x-y轴方向上的键比z轴方向上的键短。
正八面体变成了拉长的八面体或四角双锥体。
畸变结果体系获得一个分裂参数β的稳定化能。
因为这时两个电子降低了β能量,一个电子能量升高了β。
因此六配位的Cu2+配合物具有两个较其它4个为长的键,其结构为拉长八面体。
