盐酸莫西沙星理化性质及质量指标
盐酸莫西沙星理化性质与质量指标

盐酸莫西沙星理化性质与质量指标1.1 盐酸莫西沙星的概况盐酸莫西沙星通用名:盐酸莫西沙星片;商品名:拜复乐(Avelox);其他名:Bay-12-8039、Avelox®、Avalox®、Actira®、Octegra®、Proflox;英文名:Moxifloxacin Hydrochloride Tablets;Moxifloxacin Hydrochloride;(1'S,6'S )-1-Cyclopropyl-7-(2,8-diazabicyclo[4.3.0]non-8-y1)-6-fluoro-8-methoxy-4-oxo-1,4 -dihydroquinoline-3-carboxylic acid hydrochloride;化学名:1-环丙基-7-{S,S-2,8-重氮-二环[4.3.0] non-8-yl}-6-氟-8-甲氧-1,4-二氢-4-氧-3-喹啉羧酸氢氯化物;(1'S,6'S)-1-环丙基-7-(2,8-二氮杂双环[4.3.0]壬烷-8基)-6-氟-8-甲氧基-4-氧代-二氢喹啉-3-羧酸盐酸盐;分子式:C21H24FN3O4·HCl;分子量:437.9;CAS:186826-86-8;图1.1 盐酸莫西沙星结构式盐酸莫西沙星是广谱和具有抗菌活性的8-甲氧基氟喹诺酮类抗菌药。
用于治疗社区获得性肺炎、慢性支气管炎急性发作、泌尿生殖系感染、急性鼻窦炎。
疗效显着,不良反应小。
适应症为治疗患有上呼吸道和下呼吸道感染的成人。
盐酸莫西沙星是德国拜耳公司研制的超广谱喹诺酮类药物,商品名为“拜复乐”,1999年9月在德国上市,同年12月在美国获 FDA批准上市。
2002年销售额达到3.33亿美元,进入了2002年世界十大畅销抗生素药物,列第8位。
德国拜耳公司和美国先灵葆雅公司的产品在2006年的世界市场销售额高达8.22 亿美元,在全球畅销处方药排名第129位;2007年世界市场销售额高达 10.34亿美元,比上年增长 25.8%;2008年上半年为5.75亿美元。
盐酸莫西沙星注射液的质量分析

. 225 .文章编号:1001-8689(2021)03-0225-07收稿日期:2020-12-03基金项目:国家科技重大专项-重大新药创制“药物一致性评价关键技术与标准研究”课题(No. 2017ZX09101001)作者简介:周小华,女,生于1982年,硕士,副主任药师,研究方向:计算药物分析,E-mail:*************** #并列第一作者:陈瑶,男,生于1995年,在读硕士研究生,研究方向:药物分析,E-mail:*****************通讯作者,袁耀佐,E-mail:**********************;柳文媛,E-mail:**********************第一作者:周小华,女,2008年毕业于中国药科大学计算药物分析专业,现就职于江苏省食品药品监督检验研究院化学二室,副主任药师。
主要从事抗生素药品检验、质量标准起草和复核工作以及药品的快速检验研究工作。
通讯作者:袁耀佐,男,博士,主任药师。
江苏省食品药品监督检验研究院检院化学二室主任。
中国药科大学、南京中医药大学和南京师范大学硕导,江苏省产业教授,USP(BIO4)委员,中国药学会药分及抗生素专业委员会委员等。
共同第一作者:陈瑶,男,在读硕士研究生,就读于中国药科大学药学院药学专业。
参与2019年国家药品评价性抽验工作。
通讯作者:柳文媛,女,博士,教授,博士生导师。
从事药物仪器分析研究。
主持国家自然科学基金项目两项,入选江苏省六大人才高峰计划。
近年来以通讯作者在Analytical Chemical , Journal of Chromatography A , Biomaterials 等发表SCI 论文60余篇。
盐酸莫西沙星注射液的质量分析周小华1,2 陈瑶1,4 ,# 赵恂1,2 庞庆林1,2 张玫1,2 胡昌勤3 袁耀佐1,2,* 柳文媛4,*(1 江苏省食品药品监督检验研究院,南京 210019;2 国家药品监督管理局化学药物杂质谱研究重点实验室,南京 210019;3 中国食品药品检定研究院,北京 102629;4 中国药科大学药物分析系,南京 210009)摘要:目的 评价盐酸莫西沙星注射液的质量现状。
盐酸莫西沙星片 说明书

【 药品名称 】 通用名:盐酸莫西沙星片 商品名:拜复乐 英文名:Moxifloxacin Hydrochloride Tablets 汉语拼音:Yansuan Moxishaxing Pian 本品主要成份:盐酸莫西沙星,化学名为1-环丙基-7-{S,S-2,8-重氮二环[4.3.0] non-8-yl}-6-氟-8-甲氧-1,4-二氢-4-氧-3-喹啉羧酸氢氯化物 结构式为: 厌氧卟啉单胞菌 不解糖卟啉单胞菌 magnus卟啉单胞菌 普雷沃菌属 疮疱丙酸杆菌 产气荚膜梭菌 多枝梭菌 敏 感 中 度 敏 感 其他 肺炎衣原体* 肺炎支原体* 嗜肺军团菌 伯氏柯克斯体 * 已经证实对敏感菌导致的临床适应症有效 耐 药
对于任何细菌的获得性耐药可能随地理和时间而改变,但目前莫西沙星尚 无这方面的资料. 局部耐药是可能出现的,特别是治疗严重感染时.上述体外敏感试验结果 可用来指导判断微生物是否对莫西沙星敏感. 分子式:C21H24FN3O4HCl 分子量:437.9 【 性状 】 本品为暗红色薄膜衣片. 【 药理毒理 】 1,药理作用 (1)作用机制 莫西沙星是广谱和具有抗菌活性的8-甲氧基氟喹诺酮类抗菌药.莫西沙星 在体外显示出对革兰阳性菌,革兰阴性菌,厌氧菌,抗酸菌,和非典型微生物 如支原体,衣原体和军团菌有广谱抗菌活性. 抗菌作用机制为干扰Ⅱ,Ⅳ拓扑异构酶.拓扑异构酶是控制DNA拓扑和在 DNA复制,修复和转录中的关键酶. 其杀菌曲线表明,莫西沙星是具有浓度依赖性的杀菌活性.最低杀菌浓度和 最低抑菌浓度基本一致. 莫西沙星对β-内酰胺类和大环内酯类抗生素耐药的细菌亦有效.通过感染 的实验动物模型证实,莫西沙星体内活性高. (2)耐药 导致对青霉素类,头孢菌素类,糖肽类,大环内酯类和四环素类耐药的耐药 机制不影响莫西沙星的抗菌活性.莫西沙星和这些抗菌药无交叉耐药性.至今未 发现质粒介导的耐药性的出现. 莫西沙星的8-甲氧基部分与8-氢部分相比具有对革兰阳性菌高活性和耐药突 变的低选择性.7位的二氮杂环取代能阻止活性流出,该活性流出为氟喹诺酮耐药 机制.体外试验显示经过多步变异才能缓慢的出现对莫西沙星的耐药性.总之其 耐药率很低(10-7-10-10).序列的将细菌暴露在低于莫西沙星MIC浓度时只能使MIC 值有少量的增加.其它喹诺酮类之间存在交叉耐药.但是,一些对其它喹诺酮类 耐药的革兰阳性菌和厌氧菌对莫西沙星敏感. (3)对人类肠道菌群的作用 通过对两名志愿者服用莫西沙星后的研究观察到下列变化:大肠杆菌,芽孢 杆菌,普通拟杆菌,肠球菌,克雷白杆菌和厌氧菌如:双歧杆菌,真杆菌和消化 链球菌等减少.这些变化在两周内可以恢复正常,未发现艰难梭菌毒素. (4)体外试验敏感数据 敏 感 中 度 敏 感 耐 药 革兰阳性菌 肺炎球菌(包括青霉素和 大环内酯类耐药菌株)* A组化脓链球菌* 米氏链球菌 轻型链球菌 无乳链球菌 停乳链球菌 金黄色葡萄球菌(包括 金黄色葡萄球菌(甲氧西林/氧氟沙星 甲氧西林敏感菌)* 耐药菌株)+ 科氏葡萄球菌 表皮葡萄球菌(包括 表皮葡萄球菌(甲氧西林/氧氟沙星 甲氧西林敏感菌株) 耐药菌株)+ 溶血葡萄球菌 人葡萄球菌 腐生葡萄球菌 模仿葡萄球菌 白喉棒状杆菌 * 已经证实对敏感菌导致的临床适应症有效 + 莫西沙星对除了由MecA基因介导的以外的甲氧西林耐药葡萄球菌的体外MIC 值在其敏感范围内,因此,如果发现MecA基因介导的甲氧西林耐药菌不应使用 莫西沙星. 敏 感 革兰阴性菌 流感嗜血杆菌(包括产生和不 产生β-内酰胺酶的菌株)* 副流感嗜血杆菌* 卡他莫拉菌(包括产生和不产 生β-内酰胺酶的菌株)* 百日咳博德特氏菌 大肠埃希氏杆菌* 肺炎克雷白菌* 产酸克雷白杆菌 产气肠杆菌 聚团肠杆菌 阴沟肠杆菌* 中间肠杆菌 阪崎肠杆菌 中 度 敏 感 耐 药 单剂量静脉和口服给予400mg莫西沙星的PK/PD比较.需住院病人的 AUC/MIC90值大于125并Cmax/MIC90为8-10为临床有效治疗期望值. 门诊病人的参数值通常要低,AUC/MIC90大于30-40. 下表为单剂量静脉和口服给予400mg莫西沙星的PK/PD的计算值比较: 给药方式 静 脉 口 服 a) 参数(中数) AUIC[h] Cmax/MIC90 AUIC[h] Cmax/MIC90 MIC90 0.125mg/L 313 32.5 279 23.6 156 16.2 140 11.8 MIC90 0.25mg/L MIC90 0.5mg/L 78 8.1 70 5.9 a) 1h输液 2,毒理 致癌,致突变 虽然有关莫西沙星致癌作用的常规长期研究尚未完成,但该药进行了基因 毒性体内和体外试验. 此外,在大鼠身上进行了对于人类的致癌作用加速试验(诱发和促进测定).5 株Ames试验中4次为阴性,中国苍鼠卵巢HPRT的突变试验和大鼠原发肝细胞的 UDS试验也均为阴性,而其它喹诺酮类TA102的Ames试验为阳性.体外试验显示 大剂量(33mg/ml)的其它喹诺酮类药物可致中国苍鼠的V79细胞出现染色体异常, 然而,小鼠体内试验核仁测定为阴性结果.此外,体内试验测定其对小鼠的显 性致死测定为阴性.总之,体内试验的结果充分反映了其体内的基因毒性.在 大鼠的诱导和促进测定中未发现莫西沙星致癌的证据. 光毒性 莫西沙星对光稳定且潜在光毒性很低.体外试验和动物试验显示莫西沙星 的光毒性较其它喹诺酮类药物小.让小鼠口服一些喹诺酮类药物并同时照射紫 外线,显示出可增加紫外线的光致癌作用. 莫西沙星的光致癌作用的研究尚未进行,在志愿者的Ⅰ期试验中证实莫西 沙星的光毒性较小. 心电图 高浓度的莫西沙星对延迟调整心脏钾离子流有抑制作用,因此导致QT间期延 长.给狗口服大于90mg/kg莫西沙星进行毒理研究,导致血药浓度大于16mg/L, 引起QT间期延长,但未发现有心律失常出现.但是累积静脉给药高于50倍人的 给药剂量(>300mg/kg),可导致血药浓度≥200mg/L(高于静脉给药治疗浓度的 30倍),并观察到可逆转,非严重的室性心律失常. 关节毒性 众所周知,喹诺酮类可以造成未成年试验动物的承重关节软骨的病变.可 造成幼年狗的关节毒性的最小口服莫西沙星剂量是推荐最大治疗剂量(400mg/50kg 人体重)的4倍,其血药浓度为推荐治疗剂量时血药浓度的2-3倍. 生殖毒性 用大鼠,兔和猴子进行的生殖研究表明,莫西沙星可以通过胎盘.对大鼠 (os和iv)和猴子(os)的试验表明,给予莫西沙星后没有致畸作用和对生殖力的影响 证据.兔静脉给药200mg/kg可观察到骨骼畸形.该研究结果与已知的喹诺酮对 骨骼发育的影响一致.血浆药物浓度在治疗浓度范围内,猴子和兔的流产发生 率增多.在大鼠身上,当口服剂量为按千克体重计算使血药浓度在人治疗剂量 范围内所推荐的最大药物剂量的63倍时,会出现幼鼠体重减少,出生前体重减轻 增加,轻度延长孕期和增加一些雌性和雄性大鼠的生殖能力等现象.
盐酸莫西沙星的溶解度曲线

盐酸莫西沙星的溶解度曲线摘要:1.盐酸莫西沙星的概述2.盐酸莫西沙星的溶解度曲线3.盐酸莫西沙星的副作用及使用注意事项正文:1.盐酸莫西沙星的概述盐酸莫西沙星是一种广谱抗生素,属于氟喹诺酮类药物。
它主要用于治疗呼吸道、泌尿道、胃肠道等感染病症。
盐酸莫西沙星具有抗菌活性强、口服吸收好、副作用较小等特点,因此在临床应用中备受欢迎。
2.盐酸莫西沙星的溶解度曲线盐酸莫西沙星的溶解度曲线可以通过实验测量得到。
通常,我们会将一定量的盐酸莫西沙星加入到不同温度的去离子水中,然后测量其在各个温度下的溶解度。
将这些数据绘制成图表,便得到了盐酸莫西沙星的溶解度曲线。
盐酸莫西沙星的溶解度曲线呈现出一个随着温度升高而逐渐上升的趋势。
这是因为随着温度的升高,溶剂分子的热运动增强,使得盐酸莫西沙星分子更容易与溶剂分子相互作用,从而增加其在溶剂中的溶解度。
3.盐酸莫西沙星的副作用及使用注意事项虽然盐酸莫西沙星的副作用较小,但仍有可能出现头晕、反胃、恶心等症状。
在使用过程中,如果出现不良反应,应立即停药并就医。
此外,在使用盐酸莫西沙星时,还需注意以下几点:(1)遵医嘱:盐酸莫西沙星是一种处方药,患者在使用前需遵循医生的建议,不可擅自购买和使用。
(2)注意药物相互作用:盐酸莫西沙星与其他药物可能存在相互作用,使用前应向医生咨询,避免药物相互作用导致不良后果。
(3)不要随意停药:在使用盐酸莫西沙星治疗感染病症时,患者应按照医生的建议,完成整个疗程,不可擅自停药。
否则可能导致感染复发或耐药。
总之,盐酸莫西沙星是一种具有较高抗菌活性、较小副作用和良好口服吸收特性的抗生素。
在使用过程中,患者需遵医嘱,注意药物相互作用,并按照医生建议完成整个疗程。
盐酸莫西沙星片说明书

盐酸莫西沙星片说明书【药品名称】【通用名】盐酸莫西沙星片【英文名】Moxifloxacin Hydrochloride Tablets【汉语拼音】Yansuan Moxishaxing Pian【成份】本品主要成份:盐酸莫西沙星,化学名为1-环丙基-7-(S,S-2,8-重氮-二环[4.3.0] non-8-yl)-6-氟-8-甲氧-1,4-二氢-4-氧-3-喹啉羧酸氢氯化物。
分子式:C21H24FN3O4•HCI,分子量:437.9。
【性状】本品为暗红色薄膜衣片。
【药理作用】作用机制莫西沙星是广谱和具有抗菌活性的8-甲氧基氟喹诺酮类抗菌药。
莫西沙星在体外显示出对革兰阳性细菌,革兰阴性菌,厌氧菌、抗酸菌和非典型微生物如支原体、衣原体和军团菌有广谱抗菌活性。
抗菌作用机制为干扰II、IV拓扑异构酶。
拓扑异构酶是控制DNA拓扑和在DNA复制、修复和转录中关键的酶。
其杀菌曲线表明,莫西沙星具有浓度依赖性的杀菌活性。
最低杀菌浓度和最低抑菌浓度基本一致。
莫西沙星对β-内酰胺类和大环内酯类抗生素耐药的细菌亦有效。
通过感染的实验动物模型证实,莫西沙星体内活性高。
耐药:导致对青霉素类、头孢菌素类、糖肽类、大环内酯类和四环素类耐药的耐药机制不影响莫西沙星的抗菌活性。
莫西沙星和这些抗菌药无交叉耐药性。
至今未发现质粒介导的耐药性的出现。
莫西沙星的8-甲氧基部分与8-氢部分相比具有对革兰阳性菌高活性和耐药突变的低选择性。
7位的二氮杂环取代能阻止活性流出,该活性流出为氟喹诺酮耐药机制。
体外试验显示经过多步变异才能缓慢的出现对莫西沙星的耐药性。
总之其耐药率很低(10-7-10-10)。
序列地将细菌暴露在低于莫西沙星MIC浓度时只能使MIC值有少量的增加。
与其他喹诺酮类之间存在部分交叉耐药。
但是,一些对其他喹诺酮类耐药的革兰阳性菌和厌氧菌对莫西沙星仍然敏感。
对人类肠道菌群的作用:通过对两名志愿者服用莫西沙星后的研究观察到下列的变化:大肠杆菌、芽孢杆菌、普通拟杆菌、肠球菌、克雷白杆菌和厌氧菌如:双歧杆菌、真杆菌和消化链球菌等的减少。
莫西沙星原料药质量标准(20140429译)
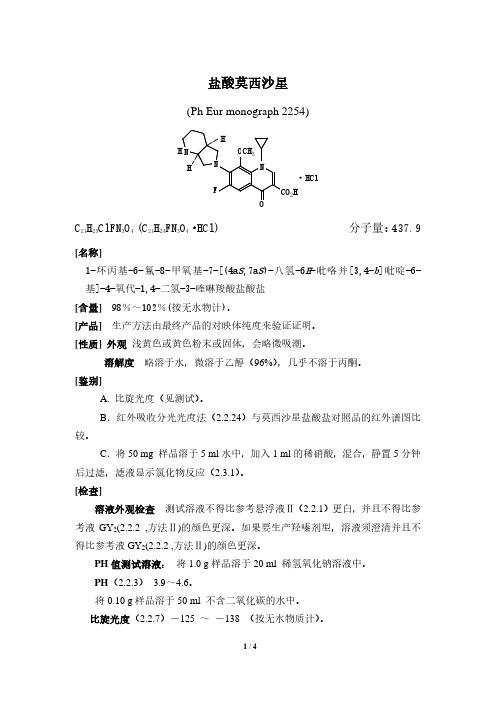
盐酸莫西沙星(Ph Eur monograph 2254) NHH F2CO HNH HCl ·N O O 3CHC 21H 25ClFN 3O 4(C 21H 24FN 3O 4·HCl) 分子量:437.9 [名称]1-环丙基-6-氟-8-甲氧基-7-[(4a S ,7a S )-八氢-6H -吡咯并[3,4-b ]吡啶-6-基]-4-氧代-1,4-二氢-3-喹啉羧酸盐酸盐[含量] 98%~102%(按无水物计)。
[产品] 生产方法由最终产品的对映体纯度来验证证明。
[性质] 外观 浅黄色或黄色粉末或固体,会略微吸潮。
溶解度 略溶于水,微溶于乙醇(96%),几乎不溶于丙酮。
[鉴别]A. 比旋光度(见测试)。
B .红外吸收分光光度法(2.2.24)与莫西沙星盐酸盐对照品的红外谱图比较。
C .将50 mg 样品溶于5 ml 水中,加入1 ml 的稀硝酸,混合,静置5分钟后过滤,滤液显示氯化物反应(2.3.1)。
[检查]溶液外观检查 测试溶液不得比参考悬浮液Ⅱ(2.2.1)更白,并且不得比参考液GY 2(2.2.2 ,方法Ⅱ)的颜色更深。
如果要生产羟嗪剂型,溶液须澄清并且不得比参考液GY 2(2.2.2 ,方法Ⅱ)的颜色更深。
PH 值测试溶液: 将1.0 g 样品溶于20 ml 稀氢氧化钠溶液中。
PH (2.2.3) 3.9~4.6。
将0.10 g 样品溶于50 ml 不含二氧化碳的水中。
比旋光度(2.2.7)-125 ~ -138 (按无水物质计)。
将0.200 g样品溶于20.0 ml 乙腈与水的混合溶液(体积相等)中。
有关物质液相色谱法(2.2.29),避光测试。
溶液A:将0.50 g四丁基硫酸氢铵和1.0 g、磷酸氢二钾溶于500ml水中,再加2ml磷酸和0.050g无水亚硫酸钠,然后用水稀释至1000ml。
供试溶液(a):精确称取50.0mg样品溶于溶液A中,并用溶液A稀释至50ml。
-莫西沙星

莫西沙星莫西沙星是人工合成抗菌药的一种,是由德国Bayer公司研制的第四代氟喹诺酮类广谱抗菌药物,为DNA拓扑异构酶抑制剂;本文主要从产品简介、药理学特点和临床应用研究进展、以及市场分析等方面来做介绍:一、简介1、发展历程莫西沙星为人工合成抗菌药喹诺酮类(喹诺酮类,又称吡酮酸类或吡啶酮酸类,是一类较新的合成抗菌药。
喹诺酮类以细菌的脱氧核糖核酸(DNA)为靶。
妨碍DNA回旋酶,进一步造成细菌DNA的不可逆损害,达到抗菌效果。
本类药物与许多抗菌药物间无交叉耐药性,是理想的抗菌药)的一种,具体发展如下:第一代: 1962年萘啶酸(nalidixic acid),抗菌谱窄,对大多数G-菌有效,但对铜绿假单胞菌无效,抗菌力弱,口服吸收差,血药浓度低,AR多,现已淘汰;第二代:1974年吡哌酸(pipemidic acid),抗菌活性>萘啶酸, 抗菌谱由G-菌扩大到部分G+菌,对铜绿假单胞菌有效,但血药浓度低,主要用于尿道或肠道感染;第三代:1979年诺氟沙星(norfloxacin)、环丙沙星等口服易吸收,血药浓度大为提高,分布广,扩大和增强了抗菌活性:G+球菌、衣原体、支原体、军团菌及分枝杆菌;第四代:1999年莫西沙星(moxifloxacin),加替沙星等吸收快,体内分布广,抗菌作用进一步增强:既保留了钱三代抗G-菌的活性,又明显增强了G+菌的活性,特别是增加了对厌氧菌的抗菌活性;临床既用于需氧菌感染,也用于厌氧菌感染,还可用于混合感染,对绝大多数致病菌的综合临床疗效已经达到或超过了β-内酰胺类抗生素;2、基本情况(莫西沙星)通用名:Moxifloxacin商品名:Actira(Bayer)CAS登录号:151096-09-2CAS登录号(盐酸盐):186826-86-8化学名:1-环丙基-6-氟-1,4-二氢-8-甲氧基-7-[(4a S,7a S)-八氢-6H-吡咯并[3,4-b]吡啶-6-基]-4-氧代-3-喹啉羧酸1-Cyclopropyl-6-fluoro-1,4-dihydro-8-methoxy-7-[(4a S,7a S)-octahydro-6H-pyrrolo[3,4-b]pyridin-6-yl]-4-oxo-3-quinolinecarboxylic acid结构式:分子式(相对分子量):C21H24FN3O4(401.43)理化性质(盐酸盐):白色至淡黄色结晶性粉末,熔点324-325℃上市情况:1999年在德国首次上市,同年12月在美国上市;2002年在我国上市;适应症:细菌感染用法与用量:拜复乐片,一日1次,每次400mg。
盐酸莫西沙星滴眼液中文版

0.5%的盐酸莫西沙星滴眼液说明书概述:0.5%的盐酸莫西沙星是无菌滴眼液,它是8 - 甲氧基氟喹诺酮类局部眼科使用的抗菌药。
主要组成成分化学结构式:分子式:C21H24FN3O4·HCl分子量:437.9化学名:1-环丙基-7-{S,S-2,8-重氮-二环[4.3.0] non-8-yl}-6-氟-8-甲氧-1,4-二氢-4-氧-3-喹啉羧酸氢氯化物。
盐酸莫西沙星是一种微黄色或黄色结晶性粉末。
每毫升溶液中含有5.45毫克莫西沙星,相当于5毫克莫西沙星盐酸盐。
包括:主药:莫西沙星0.5%(5毫克/毫升);辅料:硼酸,氯化钠,和纯净水。
也可能包含盐酸/氢氧化钠调节pH值约6.8。
盐酸莫西沙星滴眼液是具有约290 mOsm/kg渗透压浓度的等渗溶液。
临床药理学:药代动力学:健康成年男性和女性受试者通过双眼局部使用盐酸莫西沙星滴眼液,测定其血浆浓度,求得每天3次的用药方案。
平均稳态血药浓度C max (2.7 ng/mL), 药物暴露的药时曲线下面积AUC (45 ng·hr/mL),每天预计1000和1600次,要低于400毫克剂量口服莫西沙星治疗后所得的C max和AUC值。
莫西沙星的血浆半衰期估计为13小时。
微生物学:莫西沙星是具有抗菌活性的8-甲氧基氟喹诺酮类抗菌药,7位的二氮杂环取代能阻止活性流出。
莫西沙星抑制拓扑异构酶II(DNA促旋酶)和拓扑异构酶IV。
DNA促旋酶是人体必需的涉及复制,转录和修复细菌DNA的酶。
拓扑异构酶IV是在细菌细胞分裂中染色体DNA的分区过程中发挥关键作用的已知酶。
莫西沙星在体外显示出对病原体具有抗菌活性。
导致对糖肽类、大环酯类和四环素类耐药的耐药机制不影响莫西沙星的抗菌活性。
莫西沙星和这些抗菌药无交叉耐药性。
至今未发现质粒介导的耐药性的出现。
莫西沙星具有对革兰阳性菌高活性和耐药突变的低选择性。
其耐药率很低1.8 x 10-9- 1 x 10-11 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
盐酸莫西沙星理化性质与质量指标1.1 盐酸莫西沙星的概况盐酸莫西沙星通用名:盐酸莫西沙星片;商品名:拜复乐(Avelox);其他名:Bay-12-8039、Avelox®、Avalox®、Actira®、Octegra®、Proflox;英文名:Moxifloxacin Hydrochloride Tablets;Moxifloxacin Hydrochloride;(1'S,6'S )-1-Cyclopropyl-7-(2,8-diazabicyclo[4.3.0]non-8-y1)-6-fluoro-8-methoxy-4-oxo-1,4 -dihydroquinoline-3-carboxylic acid hydrochloride;化学名:1-环丙基-7-{S,S-2,8-重氮-二环[4.3.0] non-8-yl}-6-氟-8-甲氧-1,4-二氢-4-氧-3-喹啉羧酸氢氯化物;(1'S,6'S)-1-环丙基-7-(2,8-二氮杂双环[4.3.0]壬烷-8基)-6-氟-8-甲氧基-4-氧代-二氢喹啉-3-羧酸盐酸盐;分子式:C21H24FN3O4·HCl;分子量:437.9;CAS:186826-86-8;图1.1 盐酸莫西沙星结构式盐酸莫西沙星是广谱和具有抗菌活性的8-甲氧基氟喹诺酮类抗菌药。
用于治疗社区获得性肺炎、慢性支气管炎急性发作、泌尿生殖系感染、急性鼻窦炎。
疗效显着,不良反应小。
适应症为治疗患有上呼吸道和下呼吸道感染的成人。
盐酸莫西沙星是德国拜耳公司研制的超广谱喹诺酮类药物,商品名为“拜复乐”,1999年9月在德国上市,同年12月在美国获 FDA批准上市。
2002年销售额达到3.33亿美元,进入了2002年世界十大畅销抗生素药物,列第8位。
德国拜耳公司和美国先灵葆雅公司的产品在2006年的世界市场销售额高达8.22 亿美元,在全球畅销处方药排名第129位;2007年世界市场销售额高达 10.34亿美元,比上年增长 25.8%;2008年上半年为5.75亿美元。
2002年下半年,莫西沙星在我国上市,由拜耳及北京拜耳医药保健有限公司进行销售,重点市场是我国大中城市的主要医院。
该药 2004年进入国家医保目录后,连续3年出现惊人的增长率:2003年到 2007年的复合增长率为116%, 2007年城市样本医院购药金额为2.16亿元,比上年增长了75.1%;2008 年上半年为1.62亿元。
1.2 盐酸莫西沙星的药理作用(1)作用机制莫西沙星是广谱和具有抗菌活性的8-甲氧基氟喹诺酮类抗菌药。
莫西沙星在体外显示出对革兰阳性菌,革兰阴性菌,厌氧菌,抗酸菌,和非典型微生物如支原体,衣原体和军团菌有广谱抗菌活性。
抗菌作用机制为干扰Ⅱ、Ⅳ拓扑异构酶。
拓扑异构酶是控制DNA拓扑和在DNA复制、修复和转录中的关键酶。
其杀菌曲线表明,莫西沙星是具有浓度依赖性的杀菌活性。
最低杀菌浓度和最低抑菌浓度基本一致。
莫西沙星对β-内酰胺类和大环内酯类抗生素耐药的细菌亦有效。
通过感染的实验动物模型证实,莫西沙星体内活性高。
(2)耐药导致对青霉素类、头孢菌素类、糖肽类、大环内酯类和四环素类耐药的耐药机制不影响莫西沙星的抗菌活性。
莫西沙星和这些抗菌药无交叉耐药性。
至今未发现质粒介导的耐药性的出现。
莫西沙星的8-甲氧基部分与8-氢部分相比具有对革兰阳性菌高活性和耐药突变的低选择性。
7位的二氮杂环取代能阻止活性流出,该活性流出为氟喹诺酮耐药机制。
体外试验显示经过多步变异才能缓慢的出现对莫西沙星的耐药性。
总之其耐药率很低(10-7-10-10)。
序列的将细菌暴露在低于莫西沙星MIC浓度时只能使MIC值有少量的增加。
其它喹诺酮类之间存在交叉耐药。
但是,一些对其它喹诺酮类耐药的革兰阳性菌和厌氧菌对莫西沙星敏感。
(3)对人类肠道菌群的作用通过对两名志愿者服用莫西沙星后的研究观察到下列变化:大肠杆菌,芽孢杆菌,普通拟杆菌,肠球菌,克雷白杆菌和厌氧菌如:双歧杆菌,真杆菌和消化链球菌等减少。
这些变化在两周内可以恢复正常,未发现艰难梭菌毒素。
1.3 盐酸莫西沙星的毒理作用(1)致癌、致突变虽然有关莫西沙星致癌作用的常规长期研究尚未完成,但该药进行了基因毒性体内和体外试验。
此外,在大鼠身上进行了对于人类的致癌作用加速试验(诱发和促进测定)。
5株Ames试验中4次为阴性,中国苍鼠卵巢HPRT的突变试验和大鼠原发肝细胞的UDS试验也均为阴性,而其它喹诺酮类TA102的Ames试验为阳性。
体外试验显示大剂量(33mg/ml)的其它喹诺酮类药物可致中国苍鼠的V79细胞出现染色体异常,然而,小鼠体内试验核仁测定为阴性结果。
此外,体内试验测定其对小鼠的显性致死测定为阴性。
总之,体内试验的结果充分反映了其体内的基因毒性。
在大鼠的诱导和促进测定中未发现莫西沙星致癌的证据。
(2)光毒性莫西沙星对光稳定且潜在光毒性很低。
体外试验和动物试验显示莫西沙星的光毒性较其它喹诺酮类药物小。
让小鼠口服一些喹诺酮类药物并同时照射紫外线,显示出可增加紫外线的光致癌作用。
莫西沙星的光致癌作用的研究尚未进行,在志愿者的Ⅰ期试验中证实莫西沙星的光毒性较小。
(3)心电图高浓度的莫西沙星对延迟调整心脏钾离子流有抑制作用,因此导致QT间期延长。
给狗口服大于90mg/kg莫西沙星进行毒理研究,导致血药浓度大于16mg/L,引起QT间期延长,但未发现有心律失常出现。
但是累积静脉给药高于50倍人的给药剂量(>300mg/kg),可导致血药浓度≥200mg/L(高于静脉给药治疗浓度的30倍),并观察到可逆转、非严重的室性心律失常。
(4)关节毒性众所周知,喹诺酮类可以造成未成年试验动物的承重关节软骨的病变。
可造成幼年狗的关节毒性的最小口服莫西沙星剂量是推荐最大治疗剂量(400mg/50kg 人体重)的4倍,其血药浓度为推荐治疗剂量时血药浓度的2~3倍。
(5)生殖毒性用大鼠、兔和猴子进行的生殖研究表明,莫西沙星可以通过胎盘。
对大鼠(os 和iv)和猴子(os)的试验表明,给予莫西沙星后没有致畸作用和对生殖力的影响证据。
兔静脉给药200mg/kg可观察到骨骼畸形。
该研究结果与已知的喹诺酮对骨骼发育的影响一致。
血浆药物浓度在治疗浓度范围内,猴子和兔的流产发生率增多。
在大鼠身上,当口服剂量为按千克体重计算使血药浓度在人治疗剂量范围内所推荐的最大药物剂量的63倍时,会出现幼鼠体重减少、出生前体重减轻增加、轻度延长孕期和增加一些雌性和雄性大鼠的生殖能力等现象。
1.4 盐酸莫西沙星的药代动力学莫西沙星口服后可以很快被几乎完全吸收。
绝对生物利用度总计约91%。
在50~1200mg单次剂量和每日600mg连服10天的药代动力学显示出呈线性关系。
3天内达稳态。
口服400mg后0.5~4小时达到峰值3.1mg/L。
每日一次400mg 口服后达到稳态时其峰浓度和谷浓度分别为3.2mg/L和0.6mg/L。
给予莫西沙星同时进食能稍延长达峰时间约2小时并减少峰浓度约16%。
吸收范围不变。
由于AUC/MIC主要是预测喹诺酮的抗菌效果,该影响与临床无关,因此,莫西沙星给药不受进食影响。
单剂量静脉给药400mg,1小时后血药浓度达峰约为4.1mg/L,与口服相比平均增加26%。
药物暴露的药时曲线下面积约为39mgh/L,与绝对生物利用度约为91%的口服(35mgh/L)相比略高。
多剂量静脉给药(1小时输液),每日400mg给药稳态波峰波谷浓度分别为4.1至5.9及0.43至0.84mg/L。
在给药间隔内稳态药物暴露比首剂约高30%。
输液1小时后观测到病人稳态浓度为4.4mg/L。
(1)分布莫西沙星可以很快分布到血管外间隙。
该药的药时曲线下面积(AUC)高(6mgh/L),稳态时表观分布容积Vss接近21/kg。
唾液中药物浓度比血药浓度高。
在0.02-2mg/L范围的体外和体内试验表明,无论药物浓度如何,蛋白结合率约为45%,莫西沙星主要与血浆白蛋白结合,由于蛋白结合率低,游离峰浓度>10倍MIC。
莫西沙星在下列组织中达到高浓度:如肺(肺泡液,肺泡巨噬细胞,支气管组织),窦(筛窦,上颌窦,鼻息肉)和炎症损伤(斑蝥疱疹液),其药物浓度超过血药浓度。
组织间液的有很高的游离药物浓度(唾液、肌肉内、皮下)。
(2)代谢莫西沙星经过第二阶段的生物转化后通过肾脏和胆汁/粪便以原形和硫化物(M1)和葡萄糖醛酸盐(M2)的形式排出。
M1和M2只是在人体内的相关代谢产物,均无微生物活性。
在体外试验及I期临床试验中显示,莫西沙星在第一阶段生物转化包括细胞色素P450酶的代谢产物与其它药物无相互作用。
代谢产物M1和M2的血浆浓度比母药低,并与给药途径无关。
对代谢物进行了充分的临床前研究,排除了代谢物与安全、耐受的关系。
(3)排出莫西沙星从血浆和唾液中被排出的平均半衰期为12小时。
口服400mg药物后的平均总体表现清除率为179~246ml/min。
肾清除率为24~53ml/min,提示肾脏通过肾小管能部分重吸收该药。
同时服用雷尼替丁和普鲁苯辛不影响药物通过肾脏排泄。
莫西沙星的原形和第二阶段的代谢产物在达到平衡后几乎能完全回收,回收率为96~98%,且与给药途径无关,没有发生氧化代谢的迹象。
(4)老年莫西沙星的药代动力学不受年龄影响。
(5)性别男性和女性受试者莫西沙星的药代动力学参数(AUC,Cmax)相差33%。
该AUC 及Cmax的差别可归因于体重不同而不是性别。
因此药物吸收不受性别影响,该差别无临床意义。
(6)种族差异对高加索人种、日本人、黑人及其它种族进行了可能存在的种族差异实验。
药代动力学实验表明无临床相关的各族差异。
(7)儿童未对儿童患者进行莫西沙星药代动力学研究。
(8)肾损害肾功能受损的病人的莫西沙星药代动力学无明显改变(包括肌酐清除率<30ml/min/1.73m2),尚无肾透析病人的经验。
(9)肝损害肝功能受损的病人(Child Pugh A to C)与健康志愿者或肝功能正常的患者血浆药物浓度在临床上无明显差别。
1.5 盐酸莫西沙星的适应症与用法用量莫西沙星的适应症为治疗患有上呼吸道和下呼吸道感染的成人(≥18岁),如:急性窦炎、慢性支气管炎急性发作、社区获得性肺炎,以及皮肤和软组织感染。
剂量范围:任何适应症均推荐一次400mg(1片),一日1次。
(1)成年人服用方法片剂用一杯水送下,服用时间不受饮食影响。
治疗时间:治疗时间应根据症状的严重程度或临床反应决定。
治疗上呼吸道和下呼吸道感染时可按照下列方法:慢性气管炎急性发作:5天;社区获得性肺炎:10天;急性窦炎:7天;治疗皮肤和软组织感染的推荐治疗时间为7天。
