欧洲药典6.0和7.0盐酸莫西沙星检测项对比
盐酸莫西沙星注射液的质量分析

. 225 .文章编号:1001-8689(2021)03-0225-07收稿日期:2020-12-03基金项目:国家科技重大专项-重大新药创制“药物一致性评价关键技术与标准研究”课题(No. 2017ZX09101001)作者简介:周小华,女,生于1982年,硕士,副主任药师,研究方向:计算药物分析,E-mail:*************** #并列第一作者:陈瑶,男,生于1995年,在读硕士研究生,研究方向:药物分析,E-mail:*****************通讯作者,袁耀佐,E-mail:**********************;柳文媛,E-mail:**********************第一作者:周小华,女,2008年毕业于中国药科大学计算药物分析专业,现就职于江苏省食品药品监督检验研究院化学二室,副主任药师。
主要从事抗生素药品检验、质量标准起草和复核工作以及药品的快速检验研究工作。
通讯作者:袁耀佐,男,博士,主任药师。
江苏省食品药品监督检验研究院检院化学二室主任。
中国药科大学、南京中医药大学和南京师范大学硕导,江苏省产业教授,USP(BIO4)委员,中国药学会药分及抗生素专业委员会委员等。
共同第一作者:陈瑶,男,在读硕士研究生,就读于中国药科大学药学院药学专业。
参与2019年国家药品评价性抽验工作。
通讯作者:柳文媛,女,博士,教授,博士生导师。
从事药物仪器分析研究。
主持国家自然科学基金项目两项,入选江苏省六大人才高峰计划。
近年来以通讯作者在Analytical Chemical , Journal of Chromatography A , Biomaterials 等发表SCI 论文60余篇。
盐酸莫西沙星注射液的质量分析周小华1,2 陈瑶1,4 ,# 赵恂1,2 庞庆林1,2 张玫1,2 胡昌勤3 袁耀佐1,2,* 柳文媛4,*(1 江苏省食品药品监督检验研究院,南京 210019;2 国家药品监督管理局化学药物杂质谱研究重点实验室,南京 210019;3 中国食品药品检定研究院,北京 102629;4 中国药科大学药物分析系,南京 210009)摘要:目的 评价盐酸莫西沙星注射液的质量现状。
盐酸莫西沙星片微生物限度检查方法的验证

Ke y Wo r ds : Mo x i lo f x a c i n Hy d r o c h l o r i d e T a b l e t s ; mi c r o bi a l l i mi t t e s t ; va l i da t i o n; n e u t r a l i z a t i o n me t h o d
4 0
食 品与药 品
F o o d a n d Dr u g
2 0 1 5 年第 1 7 卷第 1 期
盐酸莫西沙星片微生物 限度检 查方法 的验证
董 芳 ,王 嘉 南 ,于 风平 ,王 彦 厚
( 1 . 淄博市食品药 品检验所 ,山东 淄博 2 5 5 0 8 6 :2 . 北京师范大学生命科学学院,北京 1 0 0 8 7 5 )
r e c o v e r i e s f o r b a c t e r i a c o u n t o f i f ve t e s t o r g a n i s ms we r e mo r e t h a n 7 0%. me e t i n g t h e r e q ui r e me n t o f t h e g u i d a nc e o f
Me t ho ds Th e me mb r a n e il f t r a t i o n c o mbi n e d wi t h t h e n e u t r a l i z a t i o n me t h o d wa s a d o pt e d i n t h e ba c t e r i a l c o u n t i n g
e fe c t i v e l y e l i mi n a t e t h e a n t i mi c r o bi a l a c t i v i t y o f Mo x i io f x a c i n Hy d r o c h l o r i d e Ta b l e t s a n d c a n b e u s e d or f mi c r o b i a l l i mi t t e s t or f t hi s d r u g .
HPLC法测定盐酸莫西沙星注射液杂质含量及其稳定性

HPLC法测定盐酸莫西沙星注射液杂质含量及其稳定性刘怀新;周东丽;句宝龙【期刊名称】《山西大同大学学报(自然科学版)》【年(卷),期】2014(030)003【摘要】采用HPLC法检测盐酸莫西沙星注射液杂质含量,色谱柱是苯基硅烷键和硅胶色谱柱,以V甲醇∶V混合液=28∶72为流动相,检测流速是1.3 mL/min,波长是293 nm,柱温是45℃.混合液为0.5g/L四丁基硫酸氢铵,1.0g/L磷酸二氢钾和3.4g/L磷酸等体积混合.在已建立的色谱状况中,当所含杂质浓度处在0.6,0.8,1.0,1.2,1.4 μg/mL的范围时,其分别和对应峰面积可以保持良好的线性关系.对于1 μg/L的杂质溶液,在室温下放置8h,稳定性良好,满足盐酸莫西沙星注射液对杂质的稳定性要求.建立起的方法易操作,能够满足莫西沙星供试样测定使用.【总页数】4页(P41-43,46)【作者】刘怀新;周东丽;句宝龙【作者单位】山西大同大学化学与环境工程学院,山西大同037009;山西大学商务学院外语系,山西太原030031;山西大同大学化学与环境工程学院,山西大同037009【正文语种】中文【中图分类】R917【相关文献】1.HPLC法测定盐酸莫西沙星氯化钠注射液中r脱羧莫西沙星的含量 [J], 王鹏;于黎鑫;刘玉玉2.HPLC法测定盐酸莫西沙星氯化钠注射液中N-甲基莫西沙星含量 [J], 郑家晴;于黎鑫;王艳敏;郭丽娟3.RP-HPLC法测定盐酸莫西沙星葡萄糖注射液中依地酸钙钠的含量 [J], 伍熹4.HPLC法测定盐酸莫西沙星葡萄糖注射液中有关物质的含量 [J], 苏敏;章志强;谭亚亚;章武强;马东卫5.HPLC法测定盐酸莫西沙星氯化钠注射液中脱羧莫西沙星的含量 [J], 王鹏;于黎鑫;刘玉玉因版权原因,仅展示原文概要,查看原文内容请购买。
盐酸莫西沙星微生物限度检查方法验证研究

2 0 1 5年 1月第 1期 第 2 8卷 总 第 3 2 5期 M d i 。 i  ̄ - p e o p l J y 2 0 1 5 v 。 l u m e 2 8 N O . 1
1 1 5
切 口, 无明显效果 , 仍 有 不 同 程 度 的 脑 脊 液 渗 出 。随 后 我 们 进一 步 采 取 持 续 腰 大 池 引 流 量 。 流术 , 腰大池引流方法 为: 病室 内, 取侧卧位 , 消毒 , 铺孔 巾, 局麻 , 选 L 3 ~4 , 或 L 4— 5 参 考 文 献 间隙作为穿刺点 , 穿 刺 成 功后 拔 出 管 芯 , 置 人 硬 膜 外 导 管 至 腰池 , 拔 出穿 刺 针 , 穿 刺 点 [ 1 ] 赵继宗. 神经外科手术精要与并发症. 北京: 北 京 大 学 出版 社 , 2 0 0 4 . 7 无菌包扎处理 , 并 固 定 引 流 管 。引 流 管 后 端 通 过 调 节 阀 门 连 接 引 流 瓶 , 头高 2 0 。 , 引 [ 2 ] 任洪雷[ 1 ] ; 张立文[ 2 ] . 早期腰大池持续引流 治疗外伤性蛛 网膜下腔 出血 的体会. 流瓶高度与腋 中线相平 , 维 持 每 天 l 流量 1 5 0— 3 5 0 ml “ 。 7 —1 0天 后 , 4例 病 人 脑 医 学信 息 : 上 旬刊 . 2 0 0 8 . 1 6 1 9 —1 6 2 0 r 3 ] 韩 拥 胜 ; 赵伍 兵 ; 高薇 ; 孙 雪 波 . 腰 大 池 持 续 引流 在 神 经 外 科 的 应 用 体 会 . 海 南 医 学. 脊 液 切 口漏 治 愈 , 避 免 了 颅 内 感 染 等 危 险 。闭 管 观 察 2 4小 时 , 切 口仍 无 渗 液 , 拔 除 腰 2o lo . 7 3— 75 大池引流。 [ 4 ] 李跃继[ 1 ] ; 苏晨 芳 [ 2 ] . 腰 大 池 持 续 引 流 治 疗 伤 口脑 脊 液 漏 . 中华神 经外科 杂志. 2讨 论 01 . 1 61— 1 61 腰 大 池 引 流 在 治 疗 脑 脊 液 切 口漏 的 过 程 中 可 I 挥重要 的作用 , 是 优 良 的 治 疗 20 [ 5 ]肖 阳[ 1 ] ; 成 惠林 [ 2 ] ; 吴 伟 [ 2 ]; 张 大 平 [ 1 ]; 裴 荣 权 [ 1 ]; 孟 令 文 [ 1 ] ; 张 永 明 [ 1 ] . 腰 手段口 一 ] 。但 是 如 果 此 术 应 用 不 当 , 也 可 以 引 起 逆 行 感 染 及 过 度 引 流 脑 脊 液 所 致 的 中国l 临 床 医生 . 2 0 1 0 . 3 5 —3 6 低 颅 压 ] 。故 操 作 过 程 中应 该 严格 无 菌 操 作 , 调 整 引 流 瓶 高 度 计 控 制 好 脑 脊 液 的 引 大 池 引 流 加 鞘 内注 射 治 疗 术 后 颅 内感鉴 别 比较 方 法 探 讨
莫西沙星原料药质量标准(20140429译)
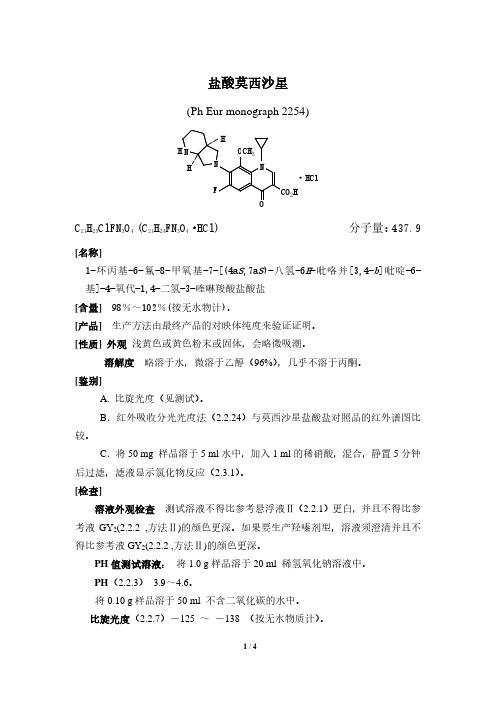
盐酸莫西沙星(Ph Eur monograph 2254) NHH F2CO HNH HCl ·N O O 3CHC 21H 25ClFN 3O 4(C 21H 24FN 3O 4·HCl) 分子量:437.9 [名称]1-环丙基-6-氟-8-甲氧基-7-[(4a S ,7a S )-八氢-6H -吡咯并[3,4-b ]吡啶-6-基]-4-氧代-1,4-二氢-3-喹啉羧酸盐酸盐[含量] 98%~102%(按无水物计)。
[产品] 生产方法由最终产品的对映体纯度来验证证明。
[性质] 外观 浅黄色或黄色粉末或固体,会略微吸潮。
溶解度 略溶于水,微溶于乙醇(96%),几乎不溶于丙酮。
[鉴别]A. 比旋光度(见测试)。
B .红外吸收分光光度法(2.2.24)与莫西沙星盐酸盐对照品的红外谱图比较。
C .将50 mg 样品溶于5 ml 水中,加入1 ml 的稀硝酸,混合,静置5分钟后过滤,滤液显示氯化物反应(2.3.1)。
[检查]溶液外观检查 测试溶液不得比参考悬浮液Ⅱ(2.2.1)更白,并且不得比参考液GY 2(2.2.2 ,方法Ⅱ)的颜色更深。
如果要生产羟嗪剂型,溶液须澄清并且不得比参考液GY 2(2.2.2 ,方法Ⅱ)的颜色更深。
PH 值测试溶液: 将1.0 g 样品溶于20 ml 稀氢氧化钠溶液中。
PH (2.2.3) 3.9~4.6。
将0.10 g 样品溶于50 ml 不含二氧化碳的水中。
比旋光度(2.2.7)-125 ~ -138 (按无水物质计)。
将0.200 g样品溶于20.0 ml 乙腈与水的混合溶液(体积相等)中。
有关物质液相色谱法(2.2.29),避光测试。
溶液A:将0.50 g四丁基硫酸氢铵和1.0 g、磷酸氢二钾溶于500ml水中,再加2ml磷酸和0.050g无水亚硫酸钠,然后用水稀释至1000ml。
供试溶液(a):精确称取50.0mg样品溶于溶液A中,并用溶液A稀释至50ml。
高效液相色谱法测定盐酸莫西沙星含量及其有关物质

高效液相色谱法测定盐酸莫西沙星含量及其有关物质作者:高宏伟来源:《科技创新与应用》2014年第10期摘要:采用高效液相色谱法对盐酸莫西沙星含量及其有关物质进行检测,苯甲硅烷基键和硅胶色谱柱(250mm×4.0mm,5μm),流动相为甲醇-四丁基硫酸氢铵磷酸盐缓冲液(34∶66),检测波长为293nm,柱温为45℃,流速为1.0mL/min。
结果表明,所建立的方法专属性、精密度、准确度、耐用性均较好,可用于盐酸莫西沙星含量及其有关物质的测定。
关键词:高效液相色谱法;盐酸莫西沙星;检测1 材料1.1 仪器高效液相色谱仪(Hitachi Chromaster-5430检测器,Hitachi Chromaster-5310 柱温箱,Hitachi Chromaster-5110 泵),Chromaster色谱工作站,日本Hitachi公司;Intersil ph(250mm×4.0mm,5μm)色谱柱; AR1140电子天平。
1.2 试剂盐酸莫西沙星对照品、盐酸莫西沙星峰位对照品(美国药典中杂质对照品,含有杂质A~E)、盐酸莫西沙星杂质对照品,德国Bayer公司;盐酸莫西沙星片(规格: 400mg),德国Bayer公司;甲醇为色谱纯试剂;其余试剂为市售分析纯试剂。
水为纯净水。
Moxifloxacin hydrochloride R1=F R2=OCH3Impurity A:6,8-fluor-moxifloxacin R1=F R2=FImpurity B:6,8-dimethoxy-moxifloxacin R1=OCH3 R2=OCH3Impurity C:8-ethoxy-moxifloxacin R1=F R2=OC2H5Impurity D:6-methoxy-8-fluor-moxifloxacin R1=OCH3 R2=FImpurity E:8-hydroxy-moxifloacin R1=F R2=OHFig.1 Structure of moxifloxacin hydrochloride and its related substances2 方法2.1 色谱条件与系统适应性色谱柱:Intersil ph(250mm×4.0mm,5μm);流动相:四丁基硫酸氢铵磷酸盐缓冲液(取磷酸二氢钾1.0g与四丁基硫酸氢铵0.50g,加水溶解并稀释成1000ml,用磷酸调节pH至2.5)甲醇(66:34);流速:1.0ml/min;柱温:40℃;检测波长:293nm;进样量:20μl。
HPLC法测定盐酸莫西沙星含量及其有关物质

HPLC法测定盐酸莫西沙星含量及其有关物质马好斌【摘要】通过HPLC法检测盐酸莫西沙星的含量与和它有关的物质,色谱柱是Sepax BR-C18 (250 mm × 4.6 mm,5 μm),流动相是甲醇-四丁基硫酸氢铵磷酸缓冲液(28:72),检测流速是1.3 ml/min,波长是293 nm,柱温是45℃.在已建立的色谱状况中,盐酸莫西沙星能很好的和各杂质分离开来,当盐酸莫西沙星的浓度处在38.55~57.82μg/ml的范围里时,其和峰面积可以保持一个良好的线性关系(r=0.9998),检测的最低限是0.006 25μg/ml,定量限是0.025 μg/ml.经研究发现,建立起的方法有较好的专属性,极易操作,能够在测定盐酸莫西沙星的含量和相关物质含量时使用.【期刊名称】《中国现代药物应用》【年(卷),期】2012(006)023【总页数】2页(P119-120)【关键词】HPLC法测定;盐酸莫西沙星;物质【作者】马好斌【作者单位】454000,焦作煤业(集团)有限责任公司中央医院【正文语种】中文莫西沙星(moxifloxacin)是德国的拜耳公司研发出来的第四代的氟喹诺酮类超广谱抗生素,第三代的抗革兰阴性菌的活性被它保留了下来,它的8-甲氧基部分使抗革兰阳性菌的活性得到了显著提高,尤其是使对厌氧菌的抗菌活性得到了改善[1]。
在1999年的时候德国首次上市,在2002年的时候在我国得以上市,拜复乐是其商品名[2]。
因为其能快速吸收,且在体内的分布非常的广,较之于β-内酰胺类抗生素,在临床上治疗相当一部分的致病菌时莫西沙星的的疗效要更好一些[3]。
2009年被英国药典收载的关于莫西沙星的质量标准里需要逐一的控制多个相关物质,结构图详见下图1,一般使用的是HPLC的分析方法,然而根据其标准借助于苯基硅烷键合硅胶柱来测定,在对峰定位对照品里的五个杂质进行分离时,分离度并不理想,所以笔者构建了通过常用的十八烷基硅烷键合硅胶作填充剂的HPLC的分析方法,该方法有较好的专属性,极易操作,能够在测定盐酸莫西沙星的含量和相关物质含量时使用[4]。
盐酸莫西沙星氯化钠注射液有关物质检查方法研究

盐酸莫西沙星氯化钠注射液有关物质检查方法研究张锡霞;李永贵;王晶【摘要】目的建立盐酸莫西沙星氯化钠注射液有关物质检查的方法。
方法采用苯基柱(4.6 mm×150 mm,5μm),流动相为乙腈-盐溶液(30∶70),检测波长为293 nm,流速为1.30 m L·min-1,柱温为30℃。
结果莫西沙星与各已知杂质及降解产物均分离良好,系统适用性良好,杂质A、B、C、D、E线性良好。
杂质B、杂质E 校正因子分别为1.42、3.40。
结论本方法检查盐酸莫西沙星氯化钠注射液有关物质专属性强、灵敏度高、准确可靠、重现性好。
【期刊名称】《药学研究》【年(卷),期】2016(035)009【总页数】4页(P529-531,555)【关键词】莫西沙星;有关物质;校正因子【作者】张锡霞;李永贵;王晶【作者单位】山东省药学科学院,山东省化学药物重点实验室,山东济南250101【正文语种】中文【中图分类】R927.1盐酸莫西沙星为浅黄色至黄色粉末或结晶、微有吸湿性,在水中略溶,乙醇(96%)中微溶,丙酮中几乎不溶。
结构式如图1所示[1]。
盐酸莫西沙星氯化钠注射液由德国拜耳(Bayer Vital GmbH)研制开发,1999年9月在德国上市,1999年12月10日通过美国食品药品监督管理局(FDA)审批,商品名:拜复尔 Avelox[1]。
规格250 mL:莫西沙星0.4 g与氯化钠2.0 g,上市品为黄色澄明液体,包装为250 mL玻璃瓶[2]。
盐酸莫西沙星是广谱和具有抗菌活性的8-甲氧基氟喹诺酮类抗菌药[3-4],由于其吸收快,体内分布广,临床上对绝大多数致病菌的综合疗效已达到或超过β-内酰胺类抗生素[5]。
盐酸莫西沙星用于治疗上呼吸道和下呼吸道感染(如:急性鼻窦炎、慢性支气管炎急性发作、社区获得性肺炎以及皮肤和软组织感染)[6]。
高效液相色谱仪(岛津,SIL-20AHT,LC-20AT,SPD-10Avp);紫外分光光度计(岛津,UV-2501PC);BT125D电子天平(赛多利斯公司);磷酸二氢钾(国药集团化学试剂有限公司,批号:20120612);磷酸(天津市富宇精细化工有限公司,批号:100801);四丁基硫酸氢铵(天津市光复精细化工研究所,批号:20111216);无水亚硫酸钠(莱阳市康德化工有限公司,批号:2012042802);甲醇(山东禹王实业有限公司化学分公司,色谱纯);乙腈(天津赛孚瑞科技有限公司,色谱纯);盐酸莫西沙星氯化钠注射液(样品自制,批号:130201、130202、130203);盐酸莫西沙星对照品(批号:MX40080030,纯度:95.21%);杂质对照品,杂质A、B、C、D、E均购自TRC公司,纯度均98%以上。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
最大4.5%,测定0.200g 最大0.1%,在铂坩埚中测定1.0g
对比盐酸莫西沙星CRS 溶解50mg在5mL水中,加入1mL稀硝酸,混匀5min,过滤,滤液与氯化物反应 溶解1.0g于20mL稀NaOH溶液中 3.9到4.6,溶解0.1g于50mL不含二氧化碳的水中 -125到-138(干燥品)溶解0.200g于20.0mL乙腈:水中(1:1) LC检测,避光测定,溶剂A:溶解0.50g四丁基硫酸氢铵、1.0gKH2PO4、2mL磷酸和 0.50g无水亚硫酸钠,用水定容到1L。测定溶液a:溶解50.0mg有关物质于溶剂A中,并 用A定容到50.0mL。测定溶液b:取2.0mL溶液a用溶剂A定容到20.0mL。对照溶液a:溶 解50.0mg盐酸莫西沙星CRS于溶剂A中,并用A稀释到50mL,取2.0mL用A稀释到20mL。 对照溶液b:溶解5mg盐酸莫西沙星进行峰鉴别CPS(包括杂质ABCDE)于溶剂A中,并用 A定容到5.0mL。参比溶液c:稀释1.0mL测定溶液a,用溶剂A定容到100.0mL,稀释 1.0mL此溶液,用溶剂A定容到10mL。色谱柱:柱长0.25m, 内径4.6mm;固定相:封端苯 基柱(粒径5μm)。流动相:28:72(甲醇:溶剂A)。流速:1.3mL/min。检测波长: 293nm。进样:10μL检测溶液a和对照溶液b。运行时间:2.5倍的莫西沙星的保留时间 。 用莫西沙星的色谱图鉴别CPS峰,用对照溶液b的色谱峰来鉴别杂质A、B、C、D、E。 莫西沙星的保留时间大约14min,杂质A大约1.1;杂质B大约1.3;杂质C大约1.4;杂质 D大约1.6;杂质E大约1.7) 对照溶液b:分离度:莫西沙星和杂质A之间最小1.5 下面的杂质峰面积与相应的校正因子的乘积:杂质B=1.4;杂质E=3.5 由对照溶液c的色谱得到,每个杂质峰的峰面积不能大于主峰(0.1%) 由对照溶液c的色谱得到,每个杂质峰的峰面积不能大于主峰(0.10%) 总面积不能超过主峰面积的3倍(0.3%) 由对照溶液c的色谱得到,0.5倍的主峰峰面积
检测项
外观 性状 溶解性质 旋光度 红外 氯化物 鉴别 溶液的外观 PH值 旋光度
有关物质
杂质鉴别
系统适应 性
分离度 校正因子 杂质ABCDE
限度
非特定杂质 总量 报告限度
水分 硫酸灰分
欧洲药典6 欧洲药典6.0和7.亮黄或黄色粉末或晶体、难吸湿性 略溶于水中、在乙醇中微溶(96%)、几乎不溶于丙酮
