物质的分类、胶体50页PPT
合集下载
【人教版】化学必修一物质的分类胶体上课用ppt

【人教版】化学必修一物质的分类胶 体上课 用ppt优 秀课件 (实用 教材)
【人教版】化学必修一物质的分类胶 体上课 用ppt优 秀课件 (实用 教材)
用特殊方法把固体物质加工到纳米级
(1nm~100nm)的超细粉末粒子,然后制得纳米材
料.下列分散系中的分散质粒子的大小和这种
纳米粒子大小具有相同的数量级的是( C )
分离胶体和浊 液用什么方法呢?
10-7nm 方法—过滤 仪器—滤纸
分离胶体与浊液用滤纸,胶体粒子可以透过滤纸;
➢科学探究:
[实验一] 泥水的过滤 [实验二] (固液分离) 是一种提纯胶体方法
泥沙 淀粉胶体 氯化钠溶液
泥沙
过滤
滤液 渗析
(淀粉胶体、 半透膜
氯化钠溶液)
半透膜
胶体 水
(淀粉胶体)
溶液
(氯化钠)溶液
均一稳定 离子
<1nm
几种分散系的比较(2)
分散系 溶液
胶体
悬(乳)浊液
分散质 分子或离子
分子集合体 或高分子
固体颗粒 液体珠粒
微粒直径 < 10-9m
10-9m ~10-7m
> 10-7m
外观 均匀、透明 稳定性 稳定 滤纸 透过 半透膜 透过
光线照射 透过
较均匀、透明 不均匀、浑浊
比较稳定 沉淀或分层
分散系
分散质 微粒直
径
溶液
<10-9m
(< 1nm)
胶体
浊液
10-9m-10-7m >10-7m
(1 ~100 nm)(>100 nm)
一、胶体
1. 定义:
分散质微粒的直径大小在1nm-100nm (10-9-10-7m )之间的分散系叫做胶体
【人教版】化学必修一物质的分类胶 体上课 用ppt优 秀课件 (实用 教材)
用特殊方法把固体物质加工到纳米级
(1nm~100nm)的超细粉末粒子,然后制得纳米材
料.下列分散系中的分散质粒子的大小和这种
纳米粒子大小具有相同的数量级的是( C )
分离胶体和浊 液用什么方法呢?
10-7nm 方法—过滤 仪器—滤纸
分离胶体与浊液用滤纸,胶体粒子可以透过滤纸;
➢科学探究:
[实验一] 泥水的过滤 [实验二] (固液分离) 是一种提纯胶体方法
泥沙 淀粉胶体 氯化钠溶液
泥沙
过滤
滤液 渗析
(淀粉胶体、 半透膜
氯化钠溶液)
半透膜
胶体 水
(淀粉胶体)
溶液
(氯化钠)溶液
均一稳定 离子
<1nm
几种分散系的比较(2)
分散系 溶液
胶体
悬(乳)浊液
分散质 分子或离子
分子集合体 或高分子
固体颗粒 液体珠粒
微粒直径 < 10-9m
10-9m ~10-7m
> 10-7m
外观 均匀、透明 稳定性 稳定 滤纸 透过 半透膜 透过
光线照射 透过
较均匀、透明 不均匀、浑浊
比较稳定 沉淀或分层
分散系
分散质 微粒直
径
溶液
<10-9m
(< 1nm)
胶体
浊液
10-9m-10-7m >10-7m
(1 ~100 nm)(>100 nm)
一、胶体
1. 定义:
分散质微粒的直径大小在1nm-100nm (10-9-10-7m )之间的分散系叫做胶体
物质的分类及胶体的性质ppt课件

光束照射时的现象
原因分析
Fe(OH)3胶体
形成一条光亮的通路
胶体的直径在1~100nm之 间,能使光波发生散射
CuSO4溶液 无现象产生
溶液中粒子的直径小于 1nm,散射极其微弱
27
丁达尔现象(丁达尔效应)
光束通过胶体时 形成一条光亮的 通路。
溶液
胶体
当一束强光透过胶体时,可以看到一条光亮的通路,这种现 象叫做丁达尔现象(或丁达尔效应)。
是 (c)
A、溶液 B、悬浊液 C、胶体 D、乳浊液
35
二、胶体的制备和性质 1.概念:分散质粒子大小在10-9~10-7m之间的分散 系。 2.氢氧化铁胶体的制备 (1)制备原理 氯化铁在沸水中可与水反应生成氢氧化铁,控制反应条 件,可以得到氢氧化铁胶体。化学方程式为
FeCl3+3H2O==△===Fe(OH)3(胶体)+3HCl。 (2)实验步骤
取一只烧杯,加入50 mL蒸馏水,加热至沸腾,然后向 沸水中滴加饱和FeCl3溶液。继续煮沸,待溶液变成红褐色后, 停止加热。
(3)实验现象 烧杯中液体呈红褐色。氢氧化铁胶体制备实验.wmv
36
三、胶体的性质
1、丁达尔现象(光学性质)丁达尔效应实验.mp4
实验:光束分别通过AgI胶体和CuSO4溶液,观察现象。 现象:一束光通过胶体时,从侧面可观察到胶体里 产生一条光亮的“通路”。
实例:①用明矾、氯化铁等净水;②不同种类的 墨水混合使用时有沉淀产生,使墨水失效。
40
(3)加热
温度升高,胶粒的吸附能力减弱,减少了胶粒所 吸引的阴离子或阳离子数量,胶粒所带的电荷数 减少,胶粒间的斥力作用减弱,使得胶粒在碰撞 时容易结合成大颗粒,形成沉淀或凝胶。
物质的分类胶体.ppt

分类角度多样 交叉分 类法 特点:物 质类别间 有相交叉 的部分
树状分 类法 分类标准唯一
特点:同 层次中各 类别间相 互独立
• 作业:P25 • 实践活动:3
二、分散系及其分类
1、分散系的概念 把 一种(或多种)物质分散在另一种(或多种)物质中 所得 到的体系,叫做分散系。前者属于被分散的物质 ,称 作 分散质 ,后者起 容纳分散质 的作用,称作 分散剂。其实, 初中我们学过的溶液就是一种分散系,其中溶质属 于 分散质 ,溶剂属于 分散剂 。初中我们还学过悬浊液和乳 浊液,它们也是分散系。例如泥水中的水是分散剂,泥土 小颗粒是 分散质 。
2、把盛有CuSO4溶液和Fe(OH)3胶体的烧杯置于暗处, 分别用激光笔照射杯中的液体,在光束垂直的方向 观察,记录实验现象。 光束照射时的现象 Fe(OH)3 产生光亮的通路 不产生光亮的通路 是否产生丁达尔 效应 是 否
CuSO4
探究:如何区别溶液与胶体?
用丁达尔效应
丁达尔效应:由于胶体粒子对光线散射形成的光亮的通路
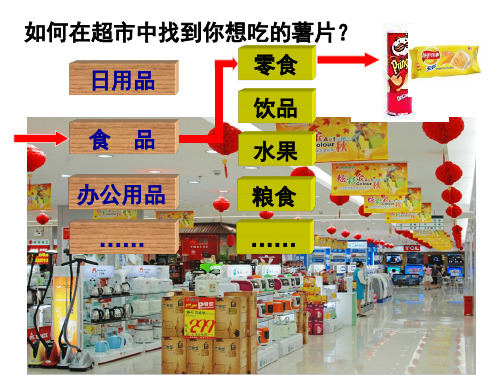
为 什 么 你 能 迅 速 找 到 你 需 要 的 物 品 ?
超 市 里 有 琳 琅 满 目 的 商 品 ,
为 什 么 你 能 很 快 找 到 你 需 要 的 书 ?
图 书 馆 里 有 五 花 八 门 的 书
这是人们将这些物品按照一定 的标准事先对它们进行了分类
• 这种方法,对于我们研究纷繁 复杂、数量众多化学物质和化 学反应有不可取代的作用。 • 一、简单分类法及其应用
分散系 分散质粒子 的直径 分散质粒子 实例 外观 稳定性 能否透过滤 纸
溶液 <10-9m
单个小分子 或离子
浊液 >10-7m
巨大数目分子 集合体
树状分 类法 分类标准唯一
特点:同 层次中各 类别间相 互独立
• 作业:P25 • 实践活动:3
二、分散系及其分类
1、分散系的概念 把 一种(或多种)物质分散在另一种(或多种)物质中 所得 到的体系,叫做分散系。前者属于被分散的物质 ,称 作 分散质 ,后者起 容纳分散质 的作用,称作 分散剂。其实, 初中我们学过的溶液就是一种分散系,其中溶质属 于 分散质 ,溶剂属于 分散剂 。初中我们还学过悬浊液和乳 浊液,它们也是分散系。例如泥水中的水是分散剂,泥土 小颗粒是 分散质 。
2、把盛有CuSO4溶液和Fe(OH)3胶体的烧杯置于暗处, 分别用激光笔照射杯中的液体,在光束垂直的方向 观察,记录实验现象。 光束照射时的现象 Fe(OH)3 产生光亮的通路 不产生光亮的通路 是否产生丁达尔 效应 是 否
CuSO4
探究:如何区别溶液与胶体?
用丁达尔效应
丁达尔效应:由于胶体粒子对光线散射形成的光亮的通路
为 什 么 你 能 迅 速 找 到 你 需 要 的 物 品 ?
超 市 里 有 琳 琅 满 目 的 商 品 ,
为 什 么 你 能 很 快 找 到 你 需 要 的 书 ?
图 书 馆 里 有 五 花 八 门 的 书
这是人们将这些物品按照一定 的标准事先对它们进行了分类
• 这种方法,对于我们研究纷繁 复杂、数量众多化学物质和化 学反应有不可取代的作用。 • 一、简单分类法及其应用
分散系 分散质粒子 的直径 分散质粒子 实例 外观 稳定性 能否透过滤 纸
溶液 <10-9m
单个小分子 或离子
浊液 >10-7m
巨大数目分子 集合体
人教版必修物质的分类胶体PPT课件

原理
胶体的提纯—渗析
视频
胶体中的胶体微粒不能透过半透膜,而离子和小 分子能透过半透膜。 Cl- + Ag+ = AgCl↓ 单质 碘与淀粉接触变成蓝色。
思考:取半透膜中的液体少许,加入硝酸酸化的 硝酸银溶液,发现也有白色沉淀生成,说明氯离 子能够透过半透膜,但是不能全部转移到水中, 思考:采取什么措施使半透膜中的钠离子和氯离子 完全透过半透膜,从而提纯淀粉胶体?
Fe(OH)3(胶体)+3HCl
• 科学探究
将Fe(OH)3胶体和泥水分别进行过滤, 观察并记录实验现象:
过滤后的现象
Fe(OH)3胶体
没得到滤渣,滤液还是红 褐色。
泥水
在滤纸上得到泥沙,滤液 澄清、透明。
结论:胶体溶液能过透过滤纸,而浊液不能透 过滤纸,说明胶体粒子的直径较小。
科学探究 人教版必修物质的分类胶体PPT课件
2.歌手那英在歌曲中唱道“雾里看花,水中 望月”,其中雾属于下列分散系中的 ( D )
A.溶液 B.悬浊液 C.乳浊液 D.胶体
问题引导下再学习
如何制备氢氧化铁胶体?
①用烧杯盛约25mL蒸馏水,加热到沸腾; ②然后逐滴加入5-6滴饱和氯化铁溶液; ③直至溶液变成红褐色,即得氢氧化铁胶体。
沸水
FeCl3+3H2O
应用:胶体的鉴别。
只要是胶体都有丁达尔现象。
人 教 版 必 修 物质的 分类胶 体PPT课 件
3、胶体的结构:以氯化铁制的氢氧化铁胶体为例。 人教版必修物质的分类胶体PPT课件 很多个Fe(OH)3分子凝聚到一起,形成致密的胶 核 有很强的吸附作用(因此胶体有很强吸附)
吸附中心离子(Fe3+),形成胶粒,胶体带电是指 胶粒带电。胶粒间相互排斥,使胶体稳定存在
胶体的提纯—渗析
视频
胶体中的胶体微粒不能透过半透膜,而离子和小 分子能透过半透膜。 Cl- + Ag+ = AgCl↓ 单质 碘与淀粉接触变成蓝色。
思考:取半透膜中的液体少许,加入硝酸酸化的 硝酸银溶液,发现也有白色沉淀生成,说明氯离 子能够透过半透膜,但是不能全部转移到水中, 思考:采取什么措施使半透膜中的钠离子和氯离子 完全透过半透膜,从而提纯淀粉胶体?
Fe(OH)3(胶体)+3HCl
• 科学探究
将Fe(OH)3胶体和泥水分别进行过滤, 观察并记录实验现象:
过滤后的现象
Fe(OH)3胶体
没得到滤渣,滤液还是红 褐色。
泥水
在滤纸上得到泥沙,滤液 澄清、透明。
结论:胶体溶液能过透过滤纸,而浊液不能透 过滤纸,说明胶体粒子的直径较小。
科学探究 人教版必修物质的分类胶体PPT课件
2.歌手那英在歌曲中唱道“雾里看花,水中 望月”,其中雾属于下列分散系中的 ( D )
A.溶液 B.悬浊液 C.乳浊液 D.胶体
问题引导下再学习
如何制备氢氧化铁胶体?
①用烧杯盛约25mL蒸馏水,加热到沸腾; ②然后逐滴加入5-6滴饱和氯化铁溶液; ③直至溶液变成红褐色,即得氢氧化铁胶体。
沸水
FeCl3+3H2O
应用:胶体的鉴别。
只要是胶体都有丁达尔现象。
人 教 版 必 修 物质的 分类胶 体PPT课 件
3、胶体的结构:以氯化铁制的氢氧化铁胶体为例。 人教版必修物质的分类胶体PPT课件 很多个Fe(OH)3分子凝聚到一起,形成致密的胶 核 有很强的吸附作用(因此胶体有很强吸附)
吸附中心离子(Fe3+),形成胶粒,胶体带电是指 胶粒带电。胶粒间相互排斥,使胶体稳定存在
物质分类和胶体PPT课件
布朗运动
胶体粒子在分散系中不断地作无规则的运动— 布朗运动
原因:分散剂分子对胶 粒无休止的随机撞击
注意:并不是胶体粒子本身固有的性质!
小结:溶液、胶体与浊液三类分散系的比较
分散系
溶液
胶体
浊液
粒子的直 径
特征
能否透过 滤纸
<1nm
1nm~100nm >100nm
均一、透明、 均一、透明 不均一、不透
溶解性
易溶: KOH、NaOH、Ba(OH)2 微溶: Ca(OH)2 难溶:Al(OH)3、Fe(OH)3
正盐:
酸式盐: 组成 碱式盐:
复盐: 盐
溶解性 易溶: 微溶:
难溶:
判断正误: 1.酸性氧化物一定是非金属氧化物 Mn2O7 2.非金属氧化物一定是酸性氧化物 NO、CO 3.金属氧化物一定是碱性氧化物 Mn2O7 4.碱性氧化物一定是金属氧化物 下列哪些物质为纯净物: 液氯、明矾、、HNO3、纯碱、酒精、澄清石
(2)树状分类法:对同类事物按照某种属性进行再分类
化学反应分类
化合反应A+B=AB
按产物种类、 分解反应AB=A+B
类别分类
置换反应A+BC=AC+B
复分解反应AB+CD=AD+CB
化学反应
氧化还原反应
按是否有氧得失 非氧化还原反应
一、物质的分类
金属
单质 非金属
纯净物
氧化物 无机化合物
非金属氧化物
分散质: 分散成粒子均的一物、质稳定的混合物
分散剂: 起容纳分散质作用的物质
常见的分散系
分散系 食盐水
糖水 淀粉试液
碘酒
分散质 食盐 糖 淀粉 碘
专题一 第1讲 物质的组成、分类和胶体.ppt

@《创新设计》
8
考点一
考点二
考点三
一元酸:HCl、HNO3等
按电离出的H+数二元酸:H2SO4、H2S等
三元酸:H3PO4等
无机化合物酸
按酸根是否含氧无含氧氧酸酸::HHCCll、O4H、2SH等2SO4等
按酸性强弱强弱酸酸::HCHCl3、COHO2SHO、4、HHF等NO3等
@《创新设计》
第1讲 物质的组成、分类和胶体
1
考点一
考点二
考点三
@《创新设计》
【2020·备考】 最新考纲:1.理解物理变化与化学变化的区别和联系。2.掌握物质分类的常用方法, 理解常见不同类型物质间的相互联系和转化关系。3.知道胶体是常见的分散系,了 解胶体与溶液的简单鉴别方法和胶体在生产、生活中的应用(胶体的渗析、凝聚、 布朗运动和电泳等性质不作要求)。 新课标要求:认识元素可以组成不同种类的物质,根据物质的组成和性质可以对 物质进行分类;同类物质具有相似的性质,一定条件下各类物质可以相互转化。 认识胶体是一种常见的分散系。 最新考情:本讲主要包括物质的组成与分类、物质的变化、胶体,在江苏高考中 单独考查的机会不多,主要在选择题中某选项中或填空题某空中出现。预测2020 高考将延续这一命题特点。
22
考点一
考点二
考点三
@《创新设计》
23
考点一
考点二
考点三
[题组诊断]
物质的变化 1.下列过程没有发生化学反应的是( )
A.用活性炭去除冰箱中的异味 B.用热碱水清除炊具上残留的油污 C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果 D.用含硅胶、铁粉的透气小袋与食品一起密封包装
@《创新设计》
24
考点一
19
高一化学胶体课件

达到提纯的目的。
胶体制备与提纯的注意事项
注意安全
在制备和提纯过程中,应避免使用有 毒有害的试剂,并确保操作安全。
控制条件
制备和提纯过程中,应控制好温度、 压力、浓度等条件,以保证实验结果 的准确性和可靠性。
实验操作规范
在实验过程中,应遵循实验操作规范 ,避免污染和交叉污染。
实验后处理
实验结束后,应对废液进行妥善处理 ,避免对环境和人体造成危害。
胶体在医学中的应用
胶体在医学中也有着重要的应 用,如医用胶、血液透析等。
医用胶是一种常用的外科手术 材料,具有快速止血、促进伤 口愈合等作用,广泛应用于手 术和创伤治疗中。
血液透析则是利用胶体的渗透 作用,将血液中的毒素和多余 水分滤出,以治疗肾功能衰竭 等疾病。
胶体在其他领域的应用
除了化学工业和医学领域,胶体 在其他领域也有着广泛的应用。
如胶体在环保领域中可以用于污 水处理、土壤修复等;在农业领 域中可以用于农药和肥料的缓释
剂等。
此外,胶体还在化妆品、食品、 墨水等领域中有着广泛的应用, 如隐形眼镜护理液、墨水等产品
中都含有胶体成分。
05
胶体的实验研究
胶体实验的目的与原理
目的
通过实验了解胶体的性质和特点,加深对胶体概念的理解。
原理
胶体是一种分散质粒子直径在1nm-100nm之间的分散系,具有介稳性、丁达 尔效应等特点。实验通过观察胶体的电泳、聚沉等性质,探究胶体的本质。
实验步骤与操作方法
步骤一
制备胶体。将一定量的Fe(OH)3固体溶解在沸水中,得到Fe(OH)3胶体。
步骤二
进行电泳实验。将胶体置于电场中,观察胶体粒子在电场中的移动情况。
氧化铝等。
胶体制备与提纯的注意事项
注意安全
在制备和提纯过程中,应避免使用有 毒有害的试剂,并确保操作安全。
控制条件
制备和提纯过程中,应控制好温度、 压力、浓度等条件,以保证实验结果 的准确性和可靠性。
实验操作规范
在实验过程中,应遵循实验操作规范 ,避免污染和交叉污染。
实验后处理
实验结束后,应对废液进行妥善处理 ,避免对环境和人体造成危害。
胶体在医学中的应用
胶体在医学中也有着重要的应 用,如医用胶、血液透析等。
医用胶是一种常用的外科手术 材料,具有快速止血、促进伤 口愈合等作用,广泛应用于手 术和创伤治疗中。
血液透析则是利用胶体的渗透 作用,将血液中的毒素和多余 水分滤出,以治疗肾功能衰竭 等疾病。
胶体在其他领域的应用
除了化学工业和医学领域,胶体 在其他领域也有着广泛的应用。
如胶体在环保领域中可以用于污 水处理、土壤修复等;在农业领 域中可以用于农药和肥料的缓释
剂等。
此外,胶体还在化妆品、食品、 墨水等领域中有着广泛的应用, 如隐形眼镜护理液、墨水等产品
中都含有胶体成分。
05
胶体的实验研究
胶体实验的目的与原理
目的
通过实验了解胶体的性质和特点,加深对胶体概念的理解。
原理
胶体是一种分散质粒子直径在1nm-100nm之间的分散系,具有介稳性、丁达 尔效应等特点。实验通过观察胶体的电泳、聚沉等性质,探究胶体的本质。
实验步骤与操作方法
步骤一
制备胶体。将一定量的Fe(OH)3固体溶解在沸水中,得到Fe(OH)3胶体。
步骤二
进行电泳实验。将胶体置于电场中,观察胶体粒子在电场中的移动情况。
氧化铝等。
第二章 物质的分类(与“胶体”有关优秀PPT)

2、分类:(1)、按照分散质或分散剂所处 凝聚法:利用复分解反应或水解反应,控制难溶物形成的条件,使之达到胶体微粒粒度范围,如:Fe(OH)3胶体的制备
盐碱地里土壤保肥能力差 2、下列有关分散系属于胶体的是( )
的 状态,可以有九种组合方式。 据统计,目前人类发现和合成的化学物质以超过2000万种,面对如此多的化学物质和如此丰富的化学变化,人们是怎样认识和研究的呢?
分散法:将难溶固体加工研磨成超细粉末,使之达到胶体分散质微粒粒度范围,加入分散剂中混匀即可。 概念:由一种物质或几种物质以粒子形式分散到另一种物质里所形成的混合物。
一种物质叫做分散剂。 一束平行光照射蛋白质溶液时,从侧面可以看到一条光亮的通路
一、简单分类法及其应用 在豆浆里加入盐卤做豆腐 胶体具有与溶液和浊液不同的性质是由分散质微粒的大小决定的。
(4)聚沉:加入强电解质、加热、加入胶
粒带相反电荷的胶体,主要是中和胶粒 所带电荷,减弱胶体的稳定性。
第5页,共10页。
4、胶体具有介稳性的原因
主要是因为胶体粒子可以通过吸附而
带电荷。同种胶体粒子的电性相同,在 通常情况下,它们之间的相互排斥阻碍 了胶体粒子变大,使它们不容易聚集。 胶体粒子所作的布朗运动也使得它们不 容易聚集成质量教大的颗粒而沉降下来。
之达到胶体分散质微粒粒度范围,加入分散剂中 在实验室里可以利用丁达尔效应鉴别胶体和溶液。
(3)电泳:胶粒细小而具有较大的表面积,能选择性地吸附胶体中的某种离子带有一定的电荷。 一束平行光照射蛋白质溶液时,从侧面可以看到一条光亮的通路
混匀即可。如:碳素墨水的制得。 概念:由一种物质或几种物质以粒子形式分散到另一种物质里所形成的混合物。
第2页,共10页。
二、分散系及其分类
盐碱地里土壤保肥能力差 2、下列有关分散系属于胶体的是( )
的 状态,可以有九种组合方式。 据统计,目前人类发现和合成的化学物质以超过2000万种,面对如此多的化学物质和如此丰富的化学变化,人们是怎样认识和研究的呢?
分散法:将难溶固体加工研磨成超细粉末,使之达到胶体分散质微粒粒度范围,加入分散剂中混匀即可。 概念:由一种物质或几种物质以粒子形式分散到另一种物质里所形成的混合物。
一种物质叫做分散剂。 一束平行光照射蛋白质溶液时,从侧面可以看到一条光亮的通路
一、简单分类法及其应用 在豆浆里加入盐卤做豆腐 胶体具有与溶液和浊液不同的性质是由分散质微粒的大小决定的。
(4)聚沉:加入强电解质、加热、加入胶
粒带相反电荷的胶体,主要是中和胶粒 所带电荷,减弱胶体的稳定性。
第5页,共10页。
4、胶体具有介稳性的原因
主要是因为胶体粒子可以通过吸附而
带电荷。同种胶体粒子的电性相同,在 通常情况下,它们之间的相互排斥阻碍 了胶体粒子变大,使它们不容易聚集。 胶体粒子所作的布朗运动也使得它们不 容易聚集成质量教大的颗粒而沉降下来。
之达到胶体分散质微粒粒度范围,加入分散剂中 在实验室里可以利用丁达尔效应鉴别胶体和溶液。
(3)电泳:胶粒细小而具有较大的表面积,能选择性地吸附胶体中的某种离子带有一定的电荷。 一束平行光照射蛋白质溶液时,从侧面可以看到一条光亮的通路
混匀即可。如:碳素墨水的制得。 概念:由一种物质或几种物质以粒子形式分散到另一种物质里所形成的混合物。
第2页,共10页。
二、分散系及其分类
