优效性样本量计算
从临床试验实例看优效、等效和非劣效试验[1]
![从临床试验实例看优效、等效和非劣效试验[1]](https://img.taocdn.com/s3/m/965c07f6c8d376eeaeaa3170.png)
从临床试验实例看优效、等效和非劣效试验-结合一些临床试验的例子对优效、等效和非劣效试验再做一点阐述,权当加深理解吧。
让我们先看一个简单的例子(J Am Acad Dermatol 2003;48:535-41):为了证实地氯雷他定对慢性荨麻疹的疗效和安全性,研究者设计了一项地氯雷他定对比安慰剂治疗慢性荨麻疹的随机对照双盲试验。
本试验选择的主要终点是与基线相比搔痒评分的变化。
假设标准差为 1.0分,每组需要100例病人在0.05的显著性水平上有90%的把握能检验出两组0.5分或更多的差别。
最后结果地氯雷他定与基线相比搔痒评分的变化为 1.05,安慰剂组为0.52,p<0.001. 结论地氯雷他定可以有效治疗慢性荨麻疹。
以上这个例子就是一个最经典的优效性试验的例子,即通过安慰剂对照试验显示试验药物优于安慰剂,从而证实试验药物的疗效。
这种安慰对照的优效性试验在临床试验的发展进程中起到了鼻祖的作用,以前对于某种疾病还没有治疗药物的时候,一种新药物的出现,往往会选择安慰剂对照来证实疗效,当然随着越来越多标准药物的出现,以及出于伦理等方面的考虑,现在安慰剂对照的试验也开始变少,但它在药物研发中的地位是决不能抹杀的。
随着医学的发展,现在各个疾病基本上都有自己有效的治疗药物,这时我们推出一种新药,往往在选择对照时,不得不选择那些已有的有效治疗药物,所以相比较安慰剂对照试验,阳性对照试验越来越多,而阳性对照试验最理想的情况是,你的药物优于阳性对照药物,这和上文中提及的安慰剂对照试验一样,是证实你的药物的疗效的最好的也是最有力的方法。
这种阳性对照的优效性试验在现在我们的临床试验中发挥了很重要的作用,怎么说呢,一种新药的出现,如果它有突破性的进展,最大的证明就是你的疗效优于现在这种疾病的标准治疗药物,而此时阳性对照的优效性试验就是你证明你疗效的最理想的选择。
给大家介绍一个药物研发历史上一个很著名的阳性对照优效性试验的例子-EVIDENCE研究。
临床实验样本量计算器
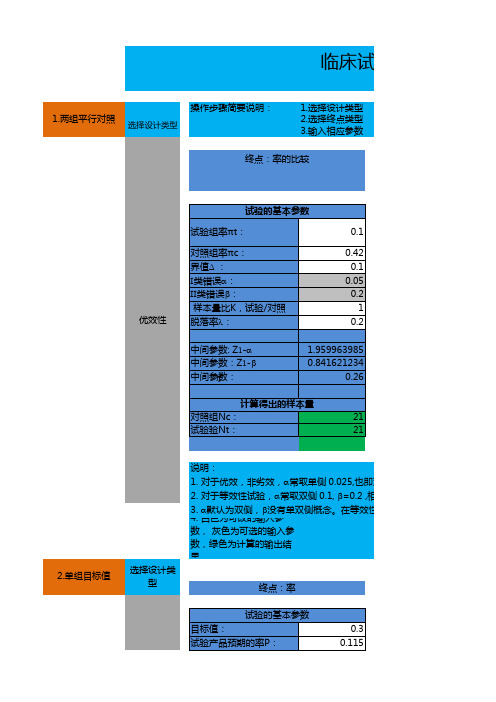
终点:率 试验的基本参数 目标值: 试验产品预期的率P: I类错误a II类错误b 0.3 0.115 0.05 0.2
优效性
优效性
脱落率l: 中间参数计算Z1-a/2: 中间参数计算Z1-b/2:
终点:均数 试验的基本参数 目标值: 试验组观察均数μ : 试验组观察标准差σ : I类错误a II类错误b 0.4 0.3 0.165 0.05 0.2
脱落率l: 中间参数计算Z1-a/2: 中间参数计算Z1-b/2:
0.2 1.959963985 0.841621234
计算得出的样本量 试验组N: 27
0.3 1.959963985 0.841621234
计算得出的样本量 试验组N: 说明: 1.单组目标值法一般为优效性设计 2.a常取单侧 0.025,也即双侧0.05, b =0.2 3.诊断试验 选择设计类型 57
终点:率 试验的基本参数 预期灵敏度P1: 预期特异度P2: 灵敏度允许误差D1 : 特异度允许误差D2: I类错误a 脱落率l: 中间参数计算Z1-a/2 0.9 0.9 0.08 0.08 0.05 0.2 1.959963985
优效性
计算得出的样本量 对照组Nc: 试验验Nt: 21 21
说明:
1. 对于优效,非劣效,a常取单侧 0.025,也即双侧0.05, b =0.2 , 相应的界值 2. 对于等效性试验,a常取双侧 0.1, b =0.2 ,相应的界值为1.645,1.282 3. a默认为双侧,b 没有单双侧概念。在等效性试验中,以b/2来估算样本量,
临床试验样本量计算器
更新说明: 1.两组平行率比较采用精切公式 2.增加修正对脱落率的考虑 3.联系guhonggqiu#
iData_两均数比较的优效性临床试验样本量估计_吴兴

4 邓 伟 ,贺 佳 ,主 编 .临 床 试 验 设 计 与 统 计 分 析 .北 京 :人 民 卫 生 出 版 社 ,2012:141~145.
于:试验药比对照 药 优 于 某 一 具 有 临 床 意 义 的 数 值 时 才 认 为 是优效。某一具有临床意义的 数 值 常 用 Δ 表 示,又 称 为 优 效 性界值。当 Δ=0时,临床优效性检验即为统计优效性检验。
Hale Waihona Puke 对于两均数比 较 的 优 效 性 试 验,若 评 价 的 指 标 为 高 优 指 标,即均数越大表明疗效越好如 生 存 时 间,其 相 应 的 检 验 假 设 为:
5 李 婵 娟 ,蒋 志 伟 ,王 锐 ,夏 结 来 .随 机 对 照 药 物 临 床 试 验 样 本 量 估 计.中国临床药理学与治疗学,2011,16 (10):1132~1136.
把 握 度 ,临 床 试 验 结 果 很 难 让 读 者 判 断 其 真 实 性 和 可 靠 性 。
Sample Size Estimation in Superiority Clinical Trials for Two Means Comparison
2 两 均 数 比 较 的 样 本 量 估 计 公 式
两均数比较的优效性临床试验样本量大小与两组均数、
标准差、优效性界值、Ⅰ类错误和 Ⅱ 类 错 误 大 小 以 及 两 组 例 数 分配比例均有关。两组均数相 差 越 小,所 需 要 的 样 本 量 越 大;
中医针灸类治疗仪器临床试验规范

中医针灸类治疗仪器临床试验规范(2009版)根据《医疗器械注册管理办法》(国家食品药品监督管理局令第16号)和《医疗器械临床试验规定》(国家食品药品监督管理局令第5号)(以下简称《规定》)的要求并结合中医针灸类治疗产品的特点,为指导该类产品临床试验方案的制定和规范技术审查工作,特制定本规范一、规范适用范围本规范适用于管理类别为Ⅱ-6827的中医针灸类治疗仪器。
凡有附带功能的仪器(如:附带处方功能),其附带部分另行规定。
二、中医针灸类治疗仪器的定义中医针灸类治疗仪器是以中医针灸经络理论为基础,结合现代科学技术,对人体经络穴位进行探测或通过刺激产生相应的生物效应,有助于临床治疗的仪器设备的统称。
注:自创穴位、经络等不符合中医传统理论的应提供充分科学证据。
三、仪器命名仪器名称应体现该仪器的技术特征,作用方法和途径,命名规范为:仪器名称=技术特征+途径/方法+“治疗仪”/“针刺仪”。
如“激光穴位治疗仪”、“电热针穴位治疗仪”、“红外炙(治)疗仪”等。
四、临床试验设计(一)不同分类的临床试验要求1.利用针灸原理开发的新的针灸类器械或在原针灸治疗仪器基础上扩大适应症:应证明其对特定疾病、证候或症状的治疗优于传统针灸治疗,或非劣于传统针灸治疗,但同时具有临床使用价值的优势。
2.在原针灸治疗仪器基础上,以提高疗效或安全性为目的改进的针灸类器械:应证明其疗效或安全性能优于改进前的器械。
3.开发和已上市仪器功能主治相同的仪器:应通过临床试验验证该仪器非劣于已上市的仪器或具有同样的安全性、有效性。
(二)关于临床试验方案的设计1.应在以中医针灸经络理论为基础的指导下进行科学设计,能够说明仪器疗效和安全性,试验设计应有充分的科学依据。
2.试验开始前,申请人和研究者共同制定临床试验方案,该方案应由研究者和申请人共同商定并签字,经伦理委员会审批后方可实施。
3.临床试验方案应包括:⑴临床试验应当在两家以上(含两家)临床试验机构中进行,同一研究方案的研究机构不少于两家(含两家)。
从临床试验实例看优效、等效和非劣效试验[1]
![从临床试验实例看优效、等效和非劣效试验[1]](https://img.taocdn.com/s3/m/1252f5f7a6c30c2258019e40.png)
从临床试验实例看优效、等效和非劣效试验-结合一些临床试验的例子对优效、等效和非劣效试验再做一点阐述,权当加深理解吧。
让我们先看一个简单的例子(J Am Acad Dermatol 2003;48:535-41):为了证实地氯雷他定对慢性荨麻疹的疗效和安全性,研究者设计了一项地氯雷他定比照抚慰剂治疗慢性荨麻疹的随机对照双盲试验。
本试验选择的主要终点是与基线相比搔痒评分的变化。
假设标准差为 1.0分,每组需要100例病人在0.05的显著性水平上有90%的把握能检验出两组0.5分或更多的差异。
最后结果地氯雷他定与基线相比搔痒评分的变化为 1.05,抚慰剂组为0.52,p<0.001. 结论地氯雷他定可以有效治疗慢性荨麻疹。
以上这个例子就是一个最经典的优效性试验的例子,即通过抚慰剂对照试验显示试验药物优于抚慰剂,从而证实试验药物的疗效。
这种抚慰对照的优效性试验在临床试验的发展进程中起到了鼻祖的作用,以前对于某种疾病还没有治疗药物的时候,一种新药物的出现,往往会选择抚慰剂对照来证实疗效,当然随着越来越多标准药物的出现,以及出于伦理等方面的考虑,现在抚慰剂对照的试验也开始变少,但它在药物研发中的地位是决不能抹杀的。
随着医学的发展,现在各个疾病基本上都有自己有效的治疗药物,这时我们推出一种新药,往往在选择对照时,不得不选择那些已有的有效治疗药物,所以相比较抚慰剂对照试验,阳性对照试验越来越多,而阳性对照试验最理想的情况是,你的药物优于阳性对照药物,这和上文中提及的抚慰剂对照试验一样,是证实你的药物的疗效的最好的也是最有力的方法。
这种阳性对照的优效性试验在现在我们的临床试验中发挥了很重要的作用,怎么说呢,一种新药的出现,如果它有突破性的进展,最大的证明就是你的疗效优于现在这种疾病的标准治疗药物,而此时阳性对照的优效性试验就是你证明你疗效的最理想的选择。
给大家介绍一个药物研发历史上一个很著名的阳性对照优效性试验的例子-EVIDENCE研究。
随机对照试验和优效性试验样本量计算公式

随机对照试验和优效性试验样本量计算公式
随机对照试验和优效性试验的样本量计算公式如下:
1. 随机对照试验样本量计算公式:
n = (Zα/2 + Zβ)² * (p(1-p))/Δ²
其中,n为所需样本量,Zα/2为显著性水平α/2对应的Z值,Zβ为1-β的置信度对应的Z 值,p为预计的事件发生概率(可以根据以往研究或经验进行估计),Δ为预期效应的最小差异。
2. 优效性试验样本量计算公式:
n = 2 * (Zα/2 + Zβ)² * (σ²/Δ²)
其中,n为所需样本量,Zα/2为显著性水平α/2对应的Z值,Zβ为1-β的置信度对应的Z 值,σ²为总体方差(可以通过以往研究或经验进行估计),Δ为预期效应的最小差异。
需要注意的是,在计算样本量时,通常会对所预期的效应大小进行合理估计,并选择适当的显著性水平α和置信度1-β。
同时,还需要注意样本量的可行性和研究资源的限制。
实际研究中,可以借助统计软件或在线计算工具来进行样本量计算。
样本含量的计算
编辑ppt
37
三、临床试验的样本量考虑
• 差异性检验 优效性检验 等效性检验 非劣效性检验
编辑ppt
38
按假设检验类型
•优效性检验:反应试验药效果优于对照药物(安慰 剂,阳性药)的试验,常用单侧检验;
•等效性检验:确认2种或多种治疗的效果差别大小 在临床上并无重要意义,试验药与阳性药在疗效上 相当,常用双侧检验;
编辑ppt
19
2.1 数值变量资料的样本含量估计
z 2.1.1总体均数的估计 n
2
2
2
• 详解:σ为总体标准差,一般用样本标准差表示;
δ为容许误差,即样本均数与总体均数间的容许差
值;α取双侧,Z值可以查表。
单侧α 双侧α/2 β 1-β Z值
0.40 0.80 0.40 0.60 0.2532
0.30 0.60 0.30 0.70 0.5243
编辑ppt
14
编辑ppt
15
计算机模拟举例1
• 假设: • -试验组死亡率为20% • -对照组死亡率为50% • -试验组和对照组的样本量均为n=50 • -显著性水平为双侧0.05 • -检验方法=卡方检验
• 结果:16次试验(100次)中未能显示出统计学差异
84次试验显示有统计学差异 1次试验成功率为84%-power
编辑ppt
17
样本量与统计学差异
• 比较90%和80%的事件发生率,是否有统计学差异? • 不仅看率,例数也起关键作用
有效率(A VS B )
9 vs. 8 45 vs.40 90 vs. 80
每组N
10 50 100
p值
0.53 0.16 0.048
编辑ppt
样本含量的计算讲课文档
设计的类型
• 观察性研究 • 实验性研究
• 配对设计
• 随机化设计
第6页,共58页。
按试验类型
• 估计总体
• 样本与总体比较
• 配对资料 • 两样本比较
• 多样本比较
7
第7页,共58页。
主要变量的性质
• 分类变量 • 数值变量
• 一般情况下,分类变量所需要的样本量多于数值变量
第8页,共58页。
N
z2 p 1 2
p
• P为总体率,δ为允许误差,即允许样本率和总体率的最大
容许误差为多少。
第25页,共58页。
• 例5:某口腔医院研究青少年龋齿发病情况,拟了解某市 青少年龋齿患病情况,期望误差在平均患龋齿率30%的 1/6范围内,当α=0.05,问需要抽样调查多少人?
• z0.05=1.96 • P=0.3 • Δ=0.3/6=0.05
(Pc Pe)2
为1p-β水平相应
的标准正态差
试验组发生率
N:为计算所得一个组的样本大小
第31页,共58页。
2.3 观察性研究样本量
• 横截面调查的样本量考虑 • 定量资料的样本量计算 • 定性资料的样本量计算
z n
2
2
2
n
z2p
1
p
2
第32页,共58页。
病例对照样本量计算
n z
2
• 结果:16次试验(100次)中未能显示出统计学差异
84次试验显示有统计学差异 1次试验成功率为84%-power
第15页,共58页。
16
计算机模拟举例2 • 假设: • -试验组死亡率为20% • -对照组死亡率为50% • -试验组和对照组的样本量均为n=100 • -显著性水平为双侧0.05 • -检验方法=卡方检验
样本量估算需要考虑哪些因素——系列之三
2018-04-26样本量估算需要考虑的第三个重要因素:三、研究假设研究假设是针对特定总体提出的、与主要研究目的有关的一种假定。
通常我们在做某一研究时,都要先提出一种假设,然后招募研究对象,获取数据并进行统计分析,根据统计分析结果判断事先做出的假设能否成立。
1. 无效假设与备择假设最基本的两种假设是无效假设(null hypothesis)和备择假设(alternativehypothesis),这是统计检验的基础,在理解下面的几种假设之前,我们有必要先回顾一下这两种最基本的假设。
统计分析的过程可以看作是一个验证假说的过程,当你开始一项研究的时候,总会有一个事先的假定(否则你就不会做研究了)。
比如研究感染幽门螺杆菌是否会增加胃癌发生的风险,你可能会事先有个假定,根据以前的临床观察,认为幽门螺杆菌感染的患者可能发生胃癌的风险会增加,这就是你打算验证的假设。
不过假设检验并不是直接验证你这个预期假定,而是通过无效假设先做出一个“无效”的假定,即认为幽门螺杆菌感染并不增加胃癌发生的风险(或者说,幽门螺杆菌阳性患者的胃癌发生率并不比阴性患者高)。
然后利用收集到的数据计算统计结果,检验这一结果能否推翻无效假设。
有的统计学家也将这一过程称为“攻击稻草人”的过程,它是通过反证法的思想,设定无效假设,然后计算在无效假设成立的条件下,出现现有数据所得结果的概率有多大。
如果出现的概率很低(如<0.05),可以认为,如果无效假设成立,出现现有结果的概率很低,换句话说,这种结果不大可能出现,一旦出现,很有可能是无效假设本身有问题。
所以认为无效假设可能是错误的,不能接受无效假设,而应接受无效假设的对立面,即备择假设。
无效假设和备择假设始终是相互对立的,通常备择假设是你预期想要达到的结论,而无效假设只是你想攻击并推翻的对象。
例如:无效假设:幽门螺杆菌阳性不会增加胃癌发生的风险;备择假设:幽门螺杆菌感染会增加胃癌发生的风险。
医疗器械临床试验设计指导原则20186
总局关于发布医疗器械临床试验设计指导原则的通告(2018年第6号)附件医疗器械临床试验设计指导原则医疗器械临床试验是指在具备相应条件的临床试验机构中,对拟申请注册的医疗器械在正常使用条件下的安全有效性进行确认的过程。
临床试验是以受试人群(样本)为观察对象,观察试验器械在正常使用条件下作用于人体的效应或对人体疾病、健康状态的评价能力,以推断试验器械在预期使用人群(总体)中的效应。
由于医疗器械的固有特征,其试验设计有其自身特点。
本指导原则适用于产品组成、设计和性能已定型的医疗器械,包括治疗类产品、诊断类产品,不包括体外诊断试剂。
本指导原则是供申请人和审查人员使用的技术指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本指导原则。
一、医疗器械临床试验目的临床试验需设定明确、具体的试验目的。
申请人可综合分析试验器械特征、非临床研究情况、已在中国境内上市(下文简称已上市)同类产品的临床数据等因素,设定临床试验目的。
临床试验目的决定了临床试验各设计要素,包括主要评价指标、试验设计类型、对照试验的比较类型等,进而影响临床试验样本量。
不同情形下的临床试验目的举例如下:(一)当通过临床试验确认试验器械在其预期用途下的安全有效性时,若更关注试验器械的疗效是否可满足临床使用的需要,其临床试验目的可设定为确认试验器械的有效性是否优于/等效于/非劣于已上市同类产品,同时确认试验器械的安全性。
此时,临床试验的主要评价指标为有效性指标。
(二)当通过临床试验确认试验器械在其预期用途下的安全有效性时,若更关注试验器械的安全性是否可满足临床使用的需要,其临床试验目的可设定为确认试验器械的安全性是否优于/等效于/非劣于已上市同类产品,同时确认试验器械的有效性。
此时,临床试验的主要评价指标为安全性指标,以乳房植入体为例,临床试验通常选择并发症发生率(如包膜挛缩率、植入体破裂率)作为主要评价指标。
