无机及分析化学第八章配位滴定法
之配位滴定法 ppt课件

15
4. 配位滴定中缓冲溶液的使用
配位滴定中广泛使用pH缓冲溶液,这是由于:
(1)滴定过程中的[H+]发生变化:M + H2Y = MY + 2H+ (2)K’MY与K’MIn均与pH有关; (3)指示剂需要在一定的酸度介质中使用 。
配位滴定中常用的缓冲溶液 pH 4~5 (弱酸性介质),
金属指示剂易变质;不宜久放。
20
2. 使用指示剂中注意的问题
指示剂封闭——指示剂与金属离子生成了稳定的配合 物而不能被滴定剂置换; 例:铬黑T 能被 Fe3+、Al3+、Cu2+、Ni2+封闭,可加入 三乙醇胺掩蔽。 指示剂僵化——如果指示剂与金属离子生成的配合物 不溶于水、生成胶体或沉淀,在滴定时,指示剂与 EDTA的置换作用进行的缓慢而使终点拖后变长。 例:PAN指示剂在温度较低时易发生僵化;可通过加 有机溶剂或加热的方法避免。
18
注意金属指示剂适用 pH 范围:
金属指示剂也是多元弱酸(或弱碱); pH 变化,各 种存在型体改变,从而显示不同的颜色。
因此使用时应注意金属指示剂的适用 pH 范围。 如 铬黑T在不同 pH 时的颜色变化。
大多数金属离子 M与铬黑T形成的 配合物呈酒红色
EBT使用范围pH: 8 ~10.5。
19
29
Z2n ,C2d ,M2n M2g
4. 用其他氨羧配位剂滴定
选择其他氨羧类配位剂,可以提高滴定的选择性。
C a 2 lg K M θ-E D T A 1 0 .6 9 lg K M θ-E G T A 1 1 .0
M g 2 8 .6 9 5 .2
(8)无机及分析化学课件之-配位平衡和配位滴定法2013.11资料

例: [SiF6]2-
[FeF6]3- Fe(CO)5 Ni(CO)4
(2)配位体与配位原子:
① 配位体(亦称配体):在配合物中提供孤对电 子或不定域电子的分子或离子。
② 配位原子:配位体中直接与中心原子键合的 原子称配位原子。
例如:[Co(NH3)5H2O]Cl3
注意:-NO2―硝基 -SCN- ―硫氰根
本章重、难点
1.重点内容:配位化合物的基本概念、命 名和配位平衡的计算。
2.难点内容:配位化合物的价键理论,配 位解离平衡及移动的计算。配位反应的副 反应系数和条件稳定常数。
配合物的发展史
1704年,普鲁士人在染料作坊中发现第一种配合物
国外文献上最早记载的配合物:最早的配合物是 偶然、孤立地发现的,它可以追溯到1693年发现 的铜氨配合物,1704年Diesbach发现的 Fe4[Fe(CN)6]3(普鲁士蓝)(兽皮或牛血+Na2CO3 在铁锅中煮沸)
阴离子配体
N
N
N
N
M
邻菲罗啉(Phen) 又名1,10-二氮菲
CH2 H2N
CH2 NH2
NN
乙二胺(en)
联吡啶(Dipy)
- OOC -OOC
NCH2CH2N
COOCOO-
六齿配体 EDTA
EDTA配合物的结构
不是配体
(3) 配位数(coordination number) 的数目
配合物中,直接与中心原子配合的配位原子的数 目称为中心原子的配位数。
b)中心离子的半径越大,则配位数越高,但若 半径太大,则影响其与配体结合,有时配位数 反而降低。CuCl64-,HgCl42-
配体对配位数的影响:
配体电荷:配体负电荷增加,一方面增加中心阳 离子对配体的吸引力,但同时也增加了配体间的 斥力,总的结果为C.N.数减小。如:SiF62-,SiO42;[Zn(NH3)6]2+,[Zn(CN)4]2-
无机及分析化学-叶兰清-辅导班课件专题中

lgc0(M) · K’(MY)≥6.0
当c0(M) = 0.01mol·L-1时:
KfΘ(MY) 108
lg KfΘ(MY) 8
多种离子能否被分步准确滴定的条件:
以M和N离子为例,分析各种条件下的滴定反应?
c0
(M)
/
c
K
f
(MY)
106
,
c0
(N)
/
c
K
f
(N
Y)
106
,
c0 c0
(M) (N)
1013
K
f
[
Ag
(CN
)2
]
1.3
1021
φΘ(S/ZnS)>φΘ(S/MnS)>φΘ(S/S2-)则 KspΘ( ZnS) 与KspΘ( MnS)大小关系如何?
已知φΘ(Cu2+/Cu+)=0.159V, φΘ(I2/I-)= 0.5345V, KspΘ( CuI) =1.27×10-12,试通过计 算说明反应2Cu2++4I-=2CuI+I2能否自发进行?
lg
[Cu2 ] [Zn2 ]
E
0.0592 2
lg
[Cu2 ] [Zn2 ]
能斯特方程
电极反应可写成通式:
氧化态+ne 还原态
T = 298K时
=Θ+
0.0592 n
lg
c(氧化态) c(还原态)
电对的标准电极电势
相对值 强度性质-其大小反映物质得失电子的倾向,与电极 反应的写法和参与电极反应的物质量无关。
Ksp (BaSO4) 1.11010, Ksp (CaSO4) 4.9105
6. 将50ml含0.953g MgCl2 (相对分子量为95.3)的 溶液与等体积的1.8 mol·L-1 NH3 ·H2O溶液混合, 问在所得的溶液中应加入多少固体NH4Cl(相对 分子量为53.5)才可防止Mg(OH)2沉淀生成? ( KspӨ = 1.2 10-11, Kb Ө = 1.76 10-5 )
《配位滴定法》课件

配位滴定法的优点和缺点
1 优点
对于大多数金属离子具有 良好的选择性和灵敏度。
2 优点
操作简单且成本较低。
3 缺点
不能应用于无机离子以外 的其他物质。
配位滴定法和其他滴定法的比 较
配位滴定法与酸碱滴定法和氧化还原滴定法等其他滴定方法相比,具有不同 的适用范围和优势。配位滴定法更适合于测定金属离子的含量,而酸碱滴定 法和氧化还原滴定法则更适合于其他化学物质的测定。
溶液制备
准备待测溶液和滴定剂的溶液。
2
指示剂添加
向待测溶液中加入适当的指示剂。
3
滴定过程
逐滴加入滴定剂到待测溶液中,观察滴定终点。
配位滴定法的设备与试剂
滴定管和滴定管架
用于控制滴定剂的滴加速度。
滴定瓶
容纳待测和滴定剂的溶液。
指示剂
用于指示滴定过程中的终点。
容量瓶
用于准确制备溶液。
配位滴定法的常见误差
配位滴定法可能存ห้องสมุดไป่ตู้几种误差。这包括试剂的误差,如滴定剂和指示剂的纯 度,溶液的误差,如溶液的浓度和纯度,以及操作误差,如溶液的滴定速度 和终点的判定。了解和控制这些误差可以提高滴定结果的准确性。
配位滴定法的精度和准确性
配位滴定法通常具有较高的精度和准确性。但要获得准确和可靠的结果,必须注意实验条件,并使用高纯度的 试剂和良好校准的仪器。校准滴定剂和指示剂的浓度也是确保结果准确性的关键。
配位滴定法的实验操作注意事项
1 实验前准备
2 实验操作
正确校准仪器并准备好所需的试剂。
控制滴定剂的滴加速度,避免过快或过慢。
3 终点判定
仔细观察指示剂的颜色变化或溶解度变化。
配位滴定法的结果计算
无机及分析化学第八章答案
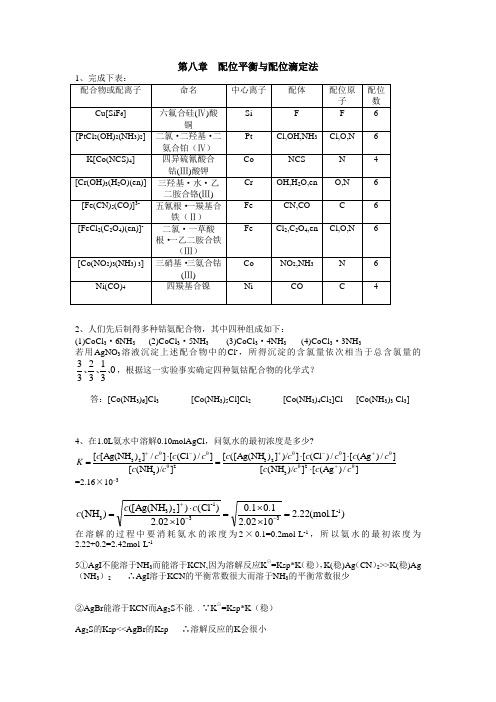
第八章 配位平衡与配位滴定法2、人们先后制得多种钴氨配合物,其中四种组成如下:(1)CoCl 3·6NH 3 (2)CoCl 3·5NH 3 (3)CoCl 3·4NH 3 (4)CoCl 3·3NH 3若用AgNO 3溶液沉淀上述配合物中的Cl -,所得沉淀的含氯量依次相当于总含氯量的0313233、、、,根据这一实验事实确定四种氨钴配合物的化学式?答:[Co(NH 3)6]Cl 3 [Co(NH 3)5Cl]Cl 2 [Co(NH 3)4Cl 2]Cl [Co(NH 3)3 Cl 3]4、在1.0L 氨水中溶解0.10molAgCl ,问氨水的最初浓度是多少?=2.16×10–3)mol.L (22.21002.21.01.01002.2)(Cl )])[Ag(NH ()(NH 1-33-1233=⨯⨯=⨯⋅=--+c c c 在溶解的过程中要消耗氨水的浓度为2×0.1=0.2mol·L -1,所以氨水的最初浓度为 2.22+0.2=2.42mol·L -15①AgI 不能溶于NH 3而能溶于KCN,因为溶解反应K ⊙=Ksp*K (稳),K(稳)Ag (CN )2>>K(稳)Ag (NH 3)2 ∴AgI 溶于KCN 的平衡常数很大而溶于NH 3的平衡常数很少②AgBr 能溶于KCN 而Ag 2S 不能,,∵K ⊙=Ksp*K (稳)Ag 2S 的Ksp<<AgBr 的Ksp ∴溶解反应的K 会很小]/)Ag ([])/(NH []/)Ag ([]/)Cl ([])/])([Ag(NH [])/(NH []/)Cl ([]/])Ag(NH [[θ2θ3θθθ232θ3θθ23c c c c c c c c c c c c c c c c K ++-+-+⋅⋅⋅=⋅=③Fe 与SCN -会生成血红色的配合物 ④略6、0. l0mol ∙L -1的AgNO 3溶液50mL ,加密度为0.932g ∙ mL -1含NH 3 18.24%的氨水30mL ,加水稀释到100mL ,求算这溶液中的Ag +浓度。
无机及分析化学全套课件第八章 配位化合物与配位滴定

[Ni(CO) 4]
只有内界无外界, 电荷为零
2019/2/20
第八章 配位化合物与配位滴定
14
8.1.2 配位化合物的命名
配合物的命名:阴离子在前,阳离子在后; 配阳离子 [Co(NH3)6]Br3 三溴化六氨合钻(Ⅲ) (某化某、某酸某) 配阴离子 K2[SiF6] 六氟合硅(Ⅳ)酸钾 (某酸某) 配体数—配体名称—合—中心离子(罗马数字表示氧化数) 配体数用二、三等中文数字表示;配体间用圆点“·” 分开,也可省略; 配体次序:阴离子—中性配体;无机—有机配体; 阴离子次序:简单离子—复杂离子—有机酸根离子。 中性分子次序:按配位原子元素符号英文字母顺序排列。
2019/2/20
第八章 配位化合物与配位滴定
8
2019/2/20
第八章 配位化合物与配位滴定
9
常见单齿配体
中性分子 配体 配位原子 阴离子 配体 配位原子 阴离子 配体 配位原子 F氟 F H2O 水 O Cl- Br氯 溴 Cl Br NH3 氨 N I碘 I CO 羰基 C OH羟基 O CN氰 C CH3NH2 甲胺 N NO2硝基 N
30
外轨型配合物与内轨型配合物性质的差异:
* 磁性 外轨型配合物,单电子数多,磁矩大; 内轨型配合物,单电子数减少,磁矩减小。 * 稳定性 内轨型配合物的键能大,较稳定,在水中 不易离解。 外轨型配合物的健能小,不稳定,在水中 易离解。
2019/2/20
第八章 配位化合物与配位滴定
31
*配合物几何构型实例
22
外轨型配合物
全部由最外层ns、np、nd 轨道 杂化所形成的配位化 合物称 外轨型配合物,该类配合物键能小,稳定性较 低。
4
2019/2/20
分析化学课件-配位滴定法

lgK
Fe2+ La3+ Al3+ Zn2+ Cd2+ Pb2+ Cu2+
14.3 15.4 16.1 16.5 16.5 18.0 18.8
lgK
Hg2+ 21.8 Th4+ 23.2 Fe3+ 25.1 Bi3+ 27.9 ZrO2+ 29.9
第八页第,七共页46页。
5.2 配合物的稳定性
一、配合物的稳定常数
因为多数条件下,不形成MHY和MOHY,或形成的不稳定,上式
可简化为:
lg K’MY=lg KMY–lg αM – lg αY
第二十二第页二十,一页共46页。
5.3 配位滴定法原理
一、滴定曲线 以浓度为c(0.01mol/L)EDTA溶液滴定浓度为c0
( 0.01mol/L )体积为V0(20.00ml)Ca2+溶液为例,计 算pH=12时,滴定过程中pCa的变化,以pCa作纵坐标,加 入EDTA溶液的百分数作横坐标,绘制滴定曲线如下图:
金属离子与EDTA反应大多形成1:1配合物: M+Y=MY(为简化计,省去了离子电荷)
反应的平衡常数表达式为:
KMY=[MY]/([M]*[Y]) KMY是配合物MY的稳定常数。可以用它来衡量配合物的稳定性。 KMY值
越大,配合物越稳定。
金属离子还能和配位剂L形成MLn型配合物。MLn型配合物 是逐级形成的,它的逐级形成反应和相应的稳定常数是:
(二)金属离子的副反应系数αM
M的存在形式
主反应产物 MY
副反应产物
M(OH)i, MAj, MBk
i =1,2..m; j=1,2,..n; k=1,2..p
《分析化学》第八章-配位滴定法

EDTA各型体分布
2022/3/23
10
各型体浓度与溶液pH关系
❖ pH < 1 强酸性溶液 → H6Y2+ ❖ pH 2.67-6.16 → 主要H2Y2❖ pH > 10.26碱性溶液 → Y4-
2022/3/23
11
三、 EDTA与金属离子形成配 合物的特点
❖ (1)广泛配位性→五元环螯合物→稳定 ❖ (2)具6个配位原子,与金属离子多形成1:1配合物 ❖ (3)配位反应迅速 ❖ (4)大多数配合物可溶于水 ❖ (5)与无色金属离子形成的配合物无色,与有色金属
求出酸效应系数,从表中查出对应的pH, 即是最高酸度
2022/3/23
27
一、 酸度的选择
❖ 练习1
求用EDTA滴定液(0.02000mol/L)滴定 同浓度的Fe3+溶液的最低pH。lg KFeY = 25.10
解 求出酸效应系数
lg aY(H) = lg K FeY -8 = 25.10 -8 =17.10
2022/3/23
33
1.配位掩蔽法
❖ 利用配位反应降低或消除干扰 离子
例:EDTA→Zn2+,Al3+, 加入三乙醇胺掩蔽Al3+
2022/3/23
34
2.沉淀掩蔽法
❖ 加入沉淀,使干扰离子生成沉淀 而被掩蔽,从而消除干扰
例:Ca2+,Mg2+共存溶液,加入NaOH 溶从液而, 消使除pMHg>2+1干2,扰Mg2+→Mg(0H)2 ,
有酸效应
a Y(H)越大,酸效应对主反应的影响越大
aY(H)=1,〔Y〕=〔Y〕 没有酸效应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HOOC—CH2 HOOC—CH2
H+
H+ CH2—COOH N—CH2CH2—N CH2—COOH
在水溶液中EDTA是以H6Y2+ 、 H5Y+ 、 H4Y 、 H3Y、H2Y2- 、 HY3- 、Y4-七种形式存在
17
EDTA与金属离子形成螯合物的特点
1、普遍性,几乎能与所有的金属离子形成稳定的配合物。 优点:应用广泛;缺点:选择性差 2、稳定性,螯合物具有特殊的稳定性。
15
H6Y2+ H5Y+ H4Y H3YH2Y2HY3
H+ + H+ + H+ + H+ + H+ + H+ +
H5Y+ H4Y H3YH2Y2HY3Y4-
各型体浓度取决于溶液pH值
pH < 1 强酸性溶液 → H6Y2+
pH 2.67~6.16 → 主要H2Y2-
pH > 10.26碱性溶液 → Y4-
子。过渡金属的离子最适合做中心离子(ⅢB~ⅡB):
Fe2+、Fe3+、Co2+、Ni2+、Cu2+、Zn2+、Ag+;也有少
数高氧化态的非金属元素离子:Si(Ⅳ)、P(Ⅴ)。
二、配体与配位ቤተ መጻሕፍቲ ባይዱ子:
配离子中,与中心离子紧密结合的中性分子或负离子叫配体。
常见配体:
N H3 、 H 2 O 、Cl 、I 、 SCN 、 S O 、en、EDTA
指示剂的封闭现象:化学计量点时不见指示剂变色 产生原因:
干扰离子: KMIn > KMY →指示剂无法改变颜色
消除方法:加入掩蔽剂 例如:滴定Ca2+和Mg2+时加入三乙醇胺掩蔽Fe3+,AL3+以消除其对EBT的封闭 待测离子: KMY < KMIn→M与In反应不可逆或过慢 消除方法:返滴定法
(1)MIn与In应为不同的颜色,因金属指示剂多为有
机弱酸,颜色随pH而变,须控制合适的pH范围。
比如:鉻黑T当pH<6.3时溶液呈紫红色, pH>11.6时, 呈橙色,均与鉻黑T金属配合物颜色相近,为使终点颜 色变化明显,使用鉻黑T的pH=6.3~11.6
24
(2)MIn的稳定性要适当,既不能太大,也不 能太小。满足下式:
(3)反应必须迅速。
(4)要有适当的指示剂指示滴定终点。
目前常用的配位滴定就是指以EDTA为络合剂的滴定分析。
EDTA的性质
EDTA 用 H4Y 表 示 。 其 二 钠 盐 也 称 EDTA (Na2H2Y·2H2O) M(Na2H2Y·2H2O) = 372.26 g/mol EDTA可形成六元酸H6Y2+,在水中有六级离解平衡:
标定EDTA溶液常用的基准物有Zn、ZnO、CaCO3、Bi、Cu、
MgSO4·7H2O、Hg、Ni、Pb等。通常选用其中与被测组分相同的物质 作基准物,这样滴定条件较一致,可减小误差。
配位滴定法应用实例 P110
同时和一个中心离子相结合的配位体。
螯合物
螯合物是具有环状结构的配合物, 是通过两个或多个配位体与同一金属离 子形成螯合环的螯合作用而得到。
CH2-H2N Cu CH2-H2N NH 2-CH2 NH 2-CH2 2+
适用于配位滴定反应必须具备的条件:
(1)配位反应要进行完全。也就是说,形成的配合物要足够稳定。 (2)配位反应要按一定的化学反应式定量地进行。
例如:滴定AL3+定过量加入EDTA,反应完全后再加入EBT,用Zn2+标液回滴
31
指示剂的僵化现象:化学计量点时指示剂变色缓慢 产生原因
MIn溶解度小→与EDTA置换速度缓慢→终点拖后
消除方法:加入有机溶剂或加热→提高 MIn 溶解 度→加快置换速度
指示剂的氧化变质: 金属指示剂大多是具有双键的有色化合物,易氧化分解变质。 因此常和中性盐配成固体混合物使用。
2 3
配位原子一般为电负性较大的非金属元素的原子,如:C、N、O、S、X。
单基配位体:一个配位体分子中只含有一个配位原子同中心离子结
合的配位体。
如[Ag(NH3)2]+中的NH3分子,〔Hgl4]2-中的I-离子,[Cu(H2O)4]2+中 的H2O分子等。
多基配位体:一个配位体分子中含有两个或两个以上配位原子并能
EDTA标准溶液的配制和标定
乙二胺四乙酸(简称EDTA,常用H4Y表示)难溶于水,在分析中不适用,通常使用其 二钠盐(Na2H2Y·2H2O)M(Na2H2Y·2H2O) = 372.26 g/mol配制标准溶液。通常
采用间接法配制标准溶液。称取一定量的溶于一定体积的蒸馏水,再用基准物质进行
标定。
配合物的组成
[ Cu ( NH3 )4 ]
中心离子 配位体 配位数
SO4
外界离子
内 界
外 界
配合物
配位化合物的组成
内界是整个配合物的中心,由中心离子(或原子)和
构成。它们在溶液中不以简单离子存在,而是一个整体。
配体
2+ H3N H3N Cu NH 3 NH 3
一、中心离子:
配离子的核心,一般是带正电荷的金属离子,也有的是原
结合,形成配位化合物.
配合物:含有配离子或形成配分子的化合物
Ag ( NH 3 )2 Cl 、 K 3 Fe (CN )6 Cu( NH 3 )4 SO4 、 Pt ( NH 3 )2 Cl 2 Ni (CO )4 、
配离子:由一个简单正离子(或原子)和几个中性分子(或负离子) 以配位键结合而成的复杂离子。
Cu2+ + 4NH3 =[Cu(NH3)4]2+
什么是配位化合物?
配位化合物:又称络合物,是一类含有中心金属原子(M)和若干配位体(L)的化合物
(MLn ). ★中心原子M通常是过渡金属元素的原子(或离子) ★配位体L则有一对或一对以上孤对电子 ★ M和L之间通过配位键结合,成为带电的配位离子,配位离子与荷异性电荷的离子
KMY / KMIn >102
a. KMIn太小→置换速度太快→终点提前
b. KMIn >KMY→置换难以进行→终点拖后或无终点
(3) 显色反应灵敏、迅速,且具有良好的可逆性与选择性。
(4) MIn 配合物应易溶于水,不能生成胶体或沉淀,否则会使
变色不明显。 (5) 金属离子指示剂应比较稳定,便于储藏和使用。
金属离子指示剂
配位滴定的指示剂是能与金属离子生成有色配合物
来指示滴定终点溶液中金属离子浓度变化的有机络
合剂,所以称为金属离子指示剂或pM指示剂。
金属离子指示剂变色原理
起始: M + In = MIn 甲色 乙色
显示
终点: MIn + Y = MY + In
乙色 甲色 显示
23
金属离子指示剂应具备的条件:
正 配 离 子 : Co( H 2O )4 2 Ag( NH 3 )2 + 、 2- 4 负 配 离 子 : HgI 、 Fe ( CN ) 4 6 中 性 配 分 子 : Pt( NH3 )2 Cl2 、 Ni(CO )4
习惯上,配合物和配离子没有严格区分,配离子也可以叫配合物。
终点:紫红→亮黄 适宜的pH范围 <6.0(酸性区) 缓冲体系:HAc-NaAc 封闭离子:AL3+,Fe2+,(Cu2+,Co2+,Ni2+) 掩蔽剂:三乙醇胺,氟化胺
4、磺基水杨酸
简称ssal,适宜酸度pH=1.5~2.5,自身为无色, 在此pH范围内与Fe3+形成紫红色配合物。
30
使用指示剂应注意的问题
3、反应速度快,且在水中有较大的溶解度。
4、螯合物大多数无色,有利于指示剂确定终点。 5、配位比1∶1,便于计算。 Mn+ + H2Y2-=MY(n-4) + 2H+ 为书写方便将上式写为:M + Y= MY
18
影响EDTA与金属离子配位平衡的副反应
主要有: 1、水解效应:金属离子在溶液中发生水解反应主反应能力降低的现象 2、配位效应:由于其他配位剂存在使金属离子参加主反应能力降低的现象 3、酸效应:由于H+存在使EDTA与金属离子配位反应能力降低的现象 4、干扰离子效应:由于其他金属离子存在使EDTA主反应配位能力降低的现象 5、混合配位效应:由于生成物发生水解反应促进主反应发生
示意图
主反应: 副反应: L M OH MOH
-
+ H+ HY
Y N NY H+ MHY
MY OH
-
ML ML2
M(OH)Y
M(OH)2? H2Y
MLn 辅助配 位效应
M(OH)n 羟基配 位效应
H6Y 酸效应 干扰离 子效应 混合配位效应
不利于主反应进行
利于主反应进行
注:副反应的发生会影响主反应发生的程度 副反应的发生程度以副反应系数加以描述
配位滴定法用于测定什么?
配位滴定法常用于对金属离子进行测定。
若采用EDTA(乙二胺四乙酸二钠)作配位剂测定金属原子,
其反应可表示为Mn++Y4-===MYn-4, 式中Mn+表示金属离子,Y4-表示EDTA的阴离子。
配合物
CuSO4+4NH3▪H2O = [Cu(NH3)4]SO4+4H2O
离子反应式
26
1、铬黑T(EBT)
终点:酒红→纯蓝 适宜的pH:7.0~11.0(碱性区)
