溶解度及溶解度曲线补偿性训练
微专题09 溶解度及溶解度曲线-备战2023年中考化学热点微专题专项突破训练(全国通用)(原卷版)

微专题09溶解度及溶解度曲线1.(2022·贵州黔西·中考真题)如图为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线。
(1)t 3℃时,甲、乙、丙三物质溶解度由小到大的顺序是_____。
(2)t 2℃时,甲和丙两饱和溶液的溶质质量分数关系是_____。
(3)P 点对应混合物,甲、乙、丙中处于不饱和状态的是_____。
2.(2022·湖北襄阳·统考中考真题)如图为甲、乙、丙三种固体物质的溶解度曲线,据图回答问题。
(1)t 1℃时,甲、丙两种物质的溶解度大小关系是甲______丙(填“>”“<”或“=”)。
(2)溶解度随温度的升高而减小的物质是______。
(3)t 2℃时,将甲、乙两种物质的饱和溶液降温至t 1℃,对所得溶液的叙述正确的是(填序号)。
A.甲溶液仍是饱和溶液,乙溶液变为不饱和溶液B.溶液中溶剂的质量甲<乙C.溶液中溶质的质量分数甲<乙3.(2022·山东滨州·统考中考真题)如图为A、B 两种固体物质的溶解度曲线,请根据图突破一、溶解度曲线示信息回答:℃时,A物质的溶解度是___________g。
(1)t1(2)A、B两种物质中,___________的溶解度受温度的影响较小。
℃时,将35gA物质加入到50g水中,充分溶解后,得到该温度下A物质的___________ (3)t2(填“饱和”或“不饱和”)溶液。
此时溶液的溶质质量分数为___________。
4.(2022·辽宁阜新·统考中考真题)溶液在日常生活,工农业生产和科学研究中具有广泛的用途。
右图是硝酸钾和氯化钠两种物质的溶解度曲线,请回答:(1)在10℃时,氯化钠溶解度_____硝酸钾溶解度(填“>”、“<”或“=”)。
(2)这两种物质中,______的溶解度受温度影响最大。
(3)60℃时,100g水里最多能溶解_____g硝酸钾。
溶解度、溶解曲线图PPT课件 人教版

第九单元 溶液
二 溶解度曲线
1.含义:反映溶解度随温__度______变化的曲线。 2.提供的信息:①某物质在不同温度时的溶__解__度______ ;
②比较不同物质在同一温度下溶解度的大相小等;③两条 曲线的交点表示某温度下两种物质的溶解度________;
④不同物质的溶解度受温度变化影响的大小;⑤物质 的溶解度随温度变化的规律;等等。
A.20 ℃时,100 g水中最多溶解氯化钠36 g B.20 ℃时,氯化钠饱和溶液中水与氯化钠的质量比为 100∶36 C.20 ℃时,100 g饱和溶液中含有氯化钠36 g D.20 ℃时,将36 g氯化钠溶解于100 g水中,所得溶液 为该温度下氯化钠的饱和溶液
第九单元 溶液
[解析] 20 ℃时,氯化钠的溶解度为36 g,其含义 是:20 ℃时,100 g 水中最多溶解氯化钠36 g,溶液 达到饱和状态,故A、B、D说法均正确;由其含义可知, 在20 ℃时,136 g饱和溶液中含有氯化钠36 g,故C说 法错误。
第九单元 溶液
[解析] (1)a3 ℃时,三种固体的溶解度曲线的位置由低 到高的顺序是乙<丙<甲,故它们的溶解度由小到大的顺序 是乙<丙<甲。(2)a2 ℃时,甲和丙的溶解度曲线有交点,说 明a2 ℃时甲和丙的溶解度相等。(3)三种物质的溶解度曲线中 甲最陡,乙最平缓,说明甲的溶解度受温度影响最大,乙的 溶解度受温度影响最小。丙的溶解度曲线呈下降趋势,说明 其溶解度随温度的升高而减小。(4)甲的溶解度受温度变化影 响大,乙的溶解度受温度变化影响小,故可采用冷却热饱和 溶液的方法提纯甲。
第九单元 溶液
(1)a3 ℃时,三种物质的溶解度由小到大的顺序是 _____乙__<__丙__<__甲_____。
2020中考化学 溶液溶解度和溶解度曲线 培优专题练习(含答案)

2020中考化学溶液溶解度及溶解度曲线培优专题练习(含答案)专题训练一一、选择题(本题包括6小题,每小题2分,共12分)1.把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是()A. 碘B. 汽油C. 白糖D. 碳酸钙2.溶液在生活、生产中有广泛的应用。
下列有关溶液的叙述正确的是()A. 均一稳定的液体一定是溶液B. 洗涤剂去油污是乳化现象C. 豆浆、牛奶都是溶液D. 溶液都是无色的3.化学实验常需要配制溶液。
下列说法正确的是()A. 配制溶液时,只能用水作溶剂B. 配制硝酸铵溶液的过程中,溶液的温度会下降C. 用浓硫酸配制稀硫酸时,应将水缓缓注入浓硫酸中D. 将10 g 氯化钠溶于100 g水中,得到质量分数为10%的氯化钠溶液第4题图4.如图是甲、乙的溶解度曲线。
下列说法不正确...的是()A. t1℃时,乙的溶解度大于甲的溶解度B. t2℃时,甲、乙饱和溶液中溶质的质量分数相等C. 降低温度能使接近饱和的甲溶液变为饱和溶液D. t3℃时,75 g甲的饱和溶液中加入50 g水,可以得到质量分数为25%的溶液5.高氯酸钾(KClO()温度/℃20406080溶解度/g 1.68 3.737.313.4A.B. 20 ℃时,将2 g高氯酸钾溶于98 g水可配制2%的溶液C. 60 ℃时,高氯酸钾饱和溶液中溶质的质量分数是7.3%D. 80 ℃的高氯酸钾饱和溶液冷却至40 ℃有结晶现象6.如图为三种物质的溶解度曲线。
下列说法错误..的是()第6题图A. 约在64 ℃时KCl和Na2SO4的溶解度相等B. 在室温至100 ℃区间,随温度升高Na2SO4的溶解度先增大后减小,醋酸钙则相反C. 分离含少量KCl的Na2SO4溶液,采用先蒸发浓缩,再降温结晶的方法D. 在40 ℃时40 g KCl固体溶于60 g水得到40%KCl溶液二、填空及简答题(本题包括4小题,共21分)7.(2分)为了研究物质的溶解现象,设计并进行了如下实验。
(word完整版)2015年初三化学溶解度曲线知识点及习题,推荐文档
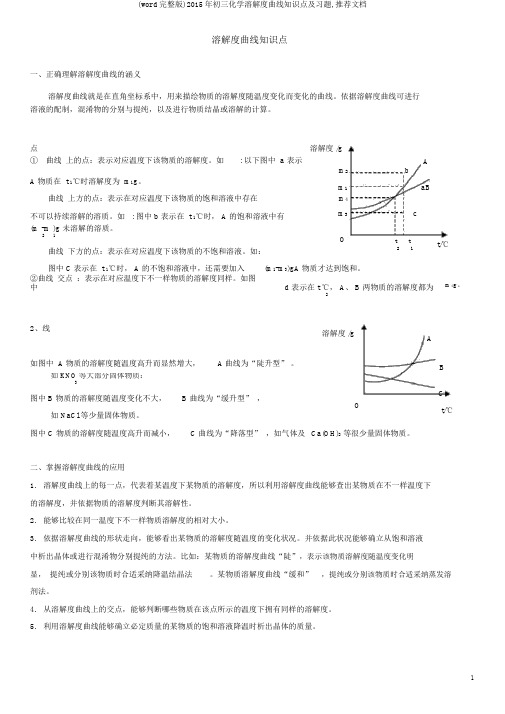
溶解度曲线知识点一、正确理解溶解度曲线的涵义溶解度曲线就是在直角坐标系中,用来描绘物质的溶解度随温度变化而变化的曲线。
依据溶解度曲线可进行溶液的配制,混淆物的分别与提纯,以及进行物质结晶或溶解的计算。
点溶解度 /g① 曲线上的点:表示对应温度下该物质的溶解度。
如: 以下图中 a 表示b Am2A 物质在 t 1℃时溶解度为 m1g。
m1 aB 曲线上方的点:表示在对应温度下该物质的饱和溶液中存在m4不可以持续溶解的溶质。
如 : 图中 b 表示在 t 1℃时, A 的饱和溶液中有m3 c (m -m )g 未溶解的溶质。
2 1 O t t曲线下方的点:表示在对应温度下该物质的不饱和溶液。
如: 2 1 图中 C表示在 t 1℃时, A 的不饱和溶液中,还需要加入(m1-m3)gA 物质才达到饱和。
②曲线交点:表示在对应温度下不一样物质的溶解度同样。
如图中 d 表示在 t ℃, A、 B 两物质的溶解度都为2 t/℃m4g。
2、线溶解度 /gA如图中 A 物质的溶解度随温度高升而显然增大,A曲线为“陡升型”。
B 如 KNO等大部分固体物质:3图中 B 物质的溶解度随温度变化不大, B 曲线为“缓升型” ,C O如 NaCl 等少量固体物质。
t/℃图中 C 物质的溶解度随温度高升而减小, C 曲线为“降落型” ,如气体及Ca(OH)2等很少量固体物质。
二、掌握溶解度曲线的应用1.溶解度曲线上的每一点,代表着某温度下某物质的溶解度,所以利用溶解度曲线能够查出某物质在不一样温度下的溶解度,并依据物质的溶解度判断其溶解性。
2.能够比较在同一温度下不一样物质溶解度的相对大小。
3.依据溶解度曲线的形状走向,能够看出某物质的溶解度随温度的变化状况。
并依据此状况能够确立从饱和溶液中析出晶体或进行混淆物分别提纯的方法。
比如:某物质的溶解度曲线“陡”,表示该物质溶解度随温度变化明显,提纯或分别该物质时合适采纳降温结晶法。
重难点03溶解度及溶解度曲线

重难点03 溶解度及溶解度曲线溶解度曲线一直是中考的热点知识,溶解度曲线题涵盖面广,综合性强。
将溶解度曲线与溶解度定义、溶液的饱和与不饱和转化、结晶方法、溶质质量分数等知识综合起来进行命题。
1. 固体溶解度曲线的意义:内容表示举例点曲线上的点表示物质在对应温度时的溶解度A、B表示物质N、M在t1℃时的溶解度分别为a g和c g两曲线交点表示两物质在该对应温度下的溶解度相等C点表示物质N、M在t2℃时的溶解度相等线表示物质溶解度随温度改变而变化的趋势如M的溶解度随温度的升高而增大,N的溶解度随温度的升高而减小面曲线下面的点表示溶液为不饱和溶液D点表示t1℃时的N的不饱和溶液2. 固体溶解度曲线的变化规律和获得晶体的方法:①多数固体物质的溶解度随温度升高而增大,如KNO3;从溶液中获得晶体的方法可采用降温结晶。
②少数固体物质的溶解度随温度升高而变化不大,如NaCl;从溶液中获得晶体的方法可采用蒸发结晶。
③极少数固体物质的溶解度随温度升高而减小,如Ca(OH)2。
1.曲线中点的含义。
2.某温度下物质溶解度大小的判断与比较3.饱和溶液与不饱和溶液的判断及转化4.溶质质量分数的计算与比较5.判断物质结晶或提纯的方法一、单选题A.t1℃时,50g甲能完全溶于50g水B.乙的溶解度随温度升高而降低C.t2℃时,丙和丁的溶解度相同D.加压或升温能增加戊的溶解度【答案】C【详解】A.t1℃时,甲物质的溶解度为80g,也就是100g水中最多能溶解80g物质甲,所以50g甲中只有40g 能完全溶于50g水,选项错误。
B.随着温度的升高,溶解后剩余固体的质量在减小,说明溶解的物质变多,所以乙的溶解度随温度升高而升高,选项错误。
C.t2℃时,丙和丁的溶解度相同,正确。
D.压强增大或者温度降低戊的溶解度在升高,所以加压或降温能增加戊的溶解度,选项错误。
故选:C。
3.硝酸钾、氯化钠的溶解度曲线如图所示,下列说法正确的是A.用搅拌或加热的方法能增大氯化钠在水中的溶解度B.40℃时,100g硝酸钾饱和溶液中含有硝酸钾63.9gC.t℃时,硝酸钾饱和溶液和氯化钠饱和溶液的溶质质量相等D.将硝酸钾溶液由40℃降温至20℃,不一定有硝酸钾晶体析出【答案】DA.高于t1℃时甲溶液溶质质量分数一定更大B.降温是将a处的甲溶液变饱和的唯一方法C.t1℃时50g乙投入水中一定能完全溶解D.t2℃时相同质量的甲、乙饱和溶液,乙溶液中溶剂质量更大【答案】D【详解】A、高于t1℃时甲的饱和溶液溶质质量分数一定大于乙的饱和溶液溶质质量分数,故选项说法错误;B、a处的甲溶液变成饱和溶液方法可以有降低温度、恒温蒸发溶剂、添加溶质,故选项说法错误;C、t1℃ 时乙的溶解度为50g,则此温度下100g水中最多可以溶解50g乙,若水的质量小于100g,则投入50g 乙不能完全溶解,故选项说法错误;D、根据溶解度曲线图得出t2℃时溶解度甲>乙,则此温度下,相同质量的饱和溶液中,溶质甲的质量大于乙,则溶液中溶剂的质量乙大于甲,故选项说法正确;故选D。
人教版2023中考化学备考精讲题型:微专题8 溶解度曲线及其应用

图1
图2
微专题8 溶解度曲线及其应用
返回目录
考查点3 溶解度概念的理解和大小比较(省卷5年3考,兰州5年2考) (4)50 ℃时,KNO3的溶解度为_8_5_._5_g_;20 ℃时,100 g水中最多溶解 NaCl的质量为_3_6__g。 (5)温度小于t ℃时,NaCl的溶解度_>__(填“>”或“<”)KNO3。
考查点5 溶液相关量的计算与比较(省卷5年2考,兰
州5年3考)
(13)20 ℃时,将35 g KNO3固体加入到100 g水中, 充分溶解,所得溶液的质量为_1_3_1_.6_g,溶质质量分 数约为_2_4_._0_%__(结果保留至0.1%),溶质和溶剂的 质量比为_7_9_∶__2_5_0_(填最简整数比);50 ℃时,137g NaCl的饱和溶液中溶质的质量为__3_7_g。 (14)10 ℃时,图示三种物质饱和溶液的溶质质量分 数大小关系为_N_a_C__l>__K__N_O__3_>__C_a_(_O_H__)2_。
微专题8 溶解度曲线及其应用
1 典例串讲 2 跟踪训练
微专题8 溶解度曲线及其应用
返回目录
典例串讲
考向1 溶解度曲线(省卷仅2022年未考查,兰州近5年连续考查)
例1
根据如图所示溶解度曲线,回答下列问题。
考查点1 交含义(省卷、兰州均5年3考)
(1)图1中P点表示_t_℃__时__,__硝__酸__钾__和__氯__化__钠__
微专题8 溶解度曲线及其应用
返回目录
3.
(2021省卷)如图是甲、乙、丙三种固体物质(均不含
结晶水)的溶解度曲线。下列说法正确的是( D ) A. 三种物质的溶解度大小关系为甲>乙>丙
2021-2022学年九年级化学下册《溶解度和溶解度曲线》精讲精练(人教版)原卷
C.将t2℃时的三种物质的饱和溶液分别升温至t3℃,会析出晶体的是MgSO4
D.t2℃时,将40g MgCl2加入50g水中充分搅拌,所得溶液质量为90g
例5.(2020·内蒙古赤峰)某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是( )
A.实验1后,甲、乙中溶液的溶质质量分数相等
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲中溶液为氯化钠的不饱和溶液
D.实验2后,甲、乙中溶液所含溶质质量相等
例2.下列关于饱和溶液和结晶的说法正确的是( )
A.将稀盐酸在敞口容器中加热蒸干水分可得HCl晶体
B.将硝酸钾的热饱和溶液降低温度后可得硝酸钾晶体
4.下列有关溶液的叙述错误的是( )
A.溶液是均一、稳定的混合物
B.一定条件下,饱和溶液和不饱和溶液可以相互转化
C.固体NaOH溶于水时,溶液温度升高
D.溶液中的溶剂只能是水
5.下列有关溶液的说法正确的是()
A.饱和溶液一定是浓溶液
B.长期放置不分层的液体一定是溶液
C.NaCl、NaOH溶于水均会放出热量
C.砂糖溶解得很快D.砂糖固体有剩余
2.下列说法正确的是( )
A.植物油与水混合一定形成溶液
B.将100g 10%的氯化钠溶液倒掉一半,剩余溶液的质量分数变为5%
C.饱和溶液一定是浓溶液
D.生活中利用洗涤剂清洗油污属于乳化现象
3.20℃时,取下表中的四种物质各10克,分别加入到100克水中充分溶解后,有固体剩余的是( )
(2)在一定温度下,在同种溶剂的条件下,同种溶质的饱和溶液要比不饱和溶液浓。
溶解度曲线训练专题
<<固体溶解度曲线>>训练专题【固体溶解度曲线知识点】固体溶解度曲线:就是用纵坐标表示溶解度(用字母S表示,单位为克/g),横坐标表示温度(用字母t表示,单位为℃),根据物质在不同温度时的溶解度不同,画出的物质溶解度随温度变化线。
溶解度曲线的作用可从点、线、面几个方面来理解.具体如下:1.点:溶解度曲线上的每个点(即饱和点)表示的是某温度下某种物质的溶解度,即曲线上的任意一点都对应有相应的温度和溶解度.溶解度曲线上的点有三个作用:(1)根据已知的温度可以查出有关物质的溶解度;(2)根据物质的溶解度也可以查出它所对应的温度;(3)可以判断或比较相同温度下,不同物质溶解度的大小(或饱和溶液中溶质的质量分数的大小)。
交点(两条溶解度曲线的交点)表示该点所示的温度下,两物质的溶解度是相同的,并且此时两种物质饱和溶液的溶质质量分数也相同的.2.线:溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况,曲线的坡度越大,说明溶解度受温度影响越大;反之说明受温度影响较小。
溶解度曲线也有三个应用:(1)根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况。
一般规律是:大部分固体随温度升高溶解度增大,如硝酸钾;只有少数固体溶解度受温度影响不大,如氯化钠;极少数物质溶解度随温度升高反而减小,如熟石灰.(2)根据溶解度曲线,判断或比较某一物质在不同温度下的溶解度大小。
(3)根据溶解度曲线,选择分离、提纯某些可溶性混合物的方法(即选用“蒸发结晶”还是“降温结晶”);并且还可以判断或比较析出晶体的质量大小(即饱和溶液质量相同时曲线越陡,析出的晶体就越多)。
3.面:曲线下部上的任何点,依其数据配制的溶液为对应温度时的不饱和溶液;曲线上部上的点,依其数据配制的溶液为对应温度时的饱和溶液,并且溶质有剩余。
如果要使不饱和溶液(曲线下部的一点)变成对应温度下的饱和溶液,方法有两种:一是向该溶液中添加适量的溶质使之到达曲线上;二是恒温蒸发掉过量的溶剂。
2023中考化学专题训练:溶解度曲线及其应用
甲 > (选填“>”“=”或“<”)丙。
1
2
3
4
5
6
7
8
9 10 11 12 13 14 15
专题训练一 溶解度曲线及其应用
(3)t2 ℃时分别把15 g甲、乙、丙固体加入50 g水中,能形成饱和溶液的
1
2
3
4
5
6
7
8
9 10 11 12 13 14 15
专题训练一 溶解度曲线及其应用
2.(2022•四川内江)我国航天员王亚平在太空演示“冰雪”实验时用到 了过饱和醋酸钠溶液。下图是醋酸钠的溶解度曲线图,下列说法正确的 是( B ) A.常温下,醋酸钠属于微溶物质 B.图中P点所表示的醋酸钠溶液是 不饱和的 C.40 ℃时,饱和醋酸钠溶液的溶质 质量分数是65.6% D.将A点的饱和溶液降温至20 ℃, 溶质质量分数增大
7
8
9 10 11 12 13 14 15
专题训练一 溶解度曲线及其应用
12.(2022•四川达州)t1 ℃时,将相同质量的KNO3和KCl分别加入盛有100 g
水的甲、乙烧杯中,充分搅拌后现象如图Ⅰ所示,图Ⅱ为两物质的溶解度曲D 线。以下说法正确的是D ( ) A.甲烧杯中的溶质为KNO3 B.将温度升高到t2 ℃时,乙烧杯中 仍然有固体剩余
1
2
3
4
5
6
7
8
9 10 11 12 13 14 15
专题训练一 溶解度曲线及其应用
4.(2022•江苏宿迁)“侯氏制碱法”创立了更为先进的“制碱”工艺,主要反应是 NaCl+NH4HCO3 NaHCO3↓+NH4Cl。如图是三种物质的溶解度曲线图,下列
溶解度溶解度曲线 ppt课件
D 正确的是( )
❖ A.硝酸钾的溶解度是55克
B.硝酸钾的溶解度是110克
❖ C.60℃时硝酸钾的溶解度是55克 D. 60℃硝酸钾的溶解 度是110克
❖ 5.t℃时硝酸钾的溶解度为20g,则此温度下硝酸钾的饱和溶液
C 中,质量比关系正确的是 ( )
❖ A 溶液质量:溶剂质量=1:4
❖ B溶质质量:溶液质量=1:5
溶解度溶解度曲线
❖ (1)向盛有20℃水的烧杯中加入36.0g氯化钠,向盛有 40℃等量水中加入63.9g硝酸钾,都恰好达到饱和状态, 比较氯化钠与硝酸钾溶解的量,并讨论能否在该条件下定 量地比较出二者的溶解能力? 温度不同,无法比较
❖ (2)向100克20℃水中加入36.0g氯化钠,向50克20℃水 中加入15.8g硝酸钾,都恰好达到饱和状态,比较氯化钠 与硝酸钾溶解的量,并讨论能否在该条件下定量地比较出 二者的溶解能力? 溶剂的质量不同,无法比较
﹤0.01
难溶
0.01~1
微溶
1~10
可溶
﹥10
易溶
溶解度溶解度曲线
(1)不溶物就是绝对不溶的物质。这句话是否 正确?
( 碳2酸)钙2是0℃难__碳(_酸_不_钙__)的__溶溶解物度质是。0.0013克,所以
(3)20℃食盐的溶解度是36克,所以食盐属
于__易_______溶物质。
溶解度溶解度曲线
溶解度溶解度曲线
❖ 概念:在一定温度下,该物质在100克溶剂 (通常溶剂为水)里达到饱和状态时溶解 的质量。
❖四大要素:一定温度、100克溶剂、饱和状态、 溶质的质量
溶解度溶解度曲线
❖ 1、20℃硝酸钾的溶解度是31.6克,这句话的含义是什么?
❖ 2、20℃时100克水中最多能溶解36克食盐,据此下列叙述
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶解度及溶解度曲线补偿性训练
类型1溶解过程和溶解度
1.25 ℃时,在两只各盛有60 g水的烧杯中,分别加入25 g氯化钠和蔗糖晶体,搅拌使其充分溶解,结果如图所示。
下列说法正确的是( )
A.两烧杯中的溶液质量相等
B.氯化钠溶液一定是饱和溶液
C.25 ℃时两者的溶解度相等
D.蔗糖溶液一定是不饱和溶液
2.工业上利用太阳能进行海水晒盐,已知海水蒸发浓缩过程中结晶析出盐的种类和质量如下表( 表中数据为每升海水在蒸发浓缩过程中结晶析出各种盐的质量,单位为g )。
海水密度-1-1
A.各种盐的溶解度都减少
B.海水中溴化钠的质量分数不变
C.析出粗盐中氯化钠的质量分数增大
D.浓缩过程中,最先析出的是氯化钠
3.( 黄石中考)向蒸馏水中加入NaOH颗粒,不断搅拌,用温度传感器记录溶解过程的温度变化如图所示。
a、c两点观察到溶液中有固体存在,b点固体完全消失。
下列说法不正确的是( )
A.NaOH固体溶于水是放热过程
B.a、c两点时,NaOH的溶解度相同
C.b点时,该溶液一定是饱和溶液
D.c点时的溶剂质量等于a点时的溶剂质量
类型2溶解度曲线
4.甲、乙两种固体物质的溶解度曲线如图所示。
下列说法不正确的是( )
A.甲的溶解度大于乙的溶解度
B.甲、乙的溶解度都随温度的升高而增大
C.20 ℃时,甲、乙饱和溶液中溶质的质量分数一定相等
D.将40 ℃的乙的饱和溶液降温至20 ℃,得到的仍是饱和溶液
5.( 安徽中考)地球深处的水处于超临界状态,称为超临界水。
如图为某压强下CaCl2和NaCl 在超临界水中的溶解度曲线,该压强下,下列说法正确的是( )
A.在超临界水中,NaCl的溶解度大于CaCl2的溶解度
B.在超临界水中,两种物质的溶解度都随温度升高而增大
C.450 ℃时,NaCl在超临界水中的溶解度为0.04 g
D.450 ℃时,可得到0.04%的CaCl2的超临界水溶液
6.( 泸州中考)氯化钾( KCl )和氯酸钾( KClO3)的溶解度随温度变化的曲线如图所示,下列说法正确的( )
A.30 ℃时,KCl饱和溶液的溶质质量分数为35%
B.60 ℃时,a点对应的KCl溶液恒温加水可变饱和
C.KCl的溶解度随温度变化的趋势比KClO3大
D.90 ℃的150 g KClO3饱和溶液降温到10 ℃可析出45 g晶体
7.( 宿迁中考)如图是甲、乙、丙三种物质的溶解度曲线,下列说法正确的是( )
A.t1℃时,三种物质的溶解度由大到小的顺序是甲>乙>丙
B.若甲物质在2 ℃时的溶解度为12 g,则甲物质属于易溶物质
C.丙物质的不饱和溶液升温后溶质质量分数会增大
D.t2℃时,等质量的甲、乙两物质溶液中所含溶质质量相等
8.( 江西中考)甲、乙两种固体的溶解度曲线如图1所示。
( 1 )t1℃时,溶解度大小关系为甲乙( 填“>”“<”或“=”)。
( 2 )t2℃时,配制180 g甲物质的饱和溶液,需称量甲的质量g。
( 3 )由图2推测硝酸钾是图1中的物质。
( 4 )图2“某一步操作”前后的溶液状态变化过程可以在图1中表示为( 填序号)。
A.b点→a点
B.c点→a点
C.b点→c点
D.c点→d点
类型3溶解度表
9.如表是
A.两种物质的溶解度受温度影响较大的是NaCl
B.两物质的溶解度相等的温度在0~20 ℃之间
C.20 ℃时,NaCl饱和溶液的溶质质量分数为36%
D.当NH4Cl中含有少量的NaCl时可以采取蒸发结晶的方式提纯NH4Cl
10.图表法是一种常用的数据处理方法,根据所给图表( 氢氧化钠、碳酸钠分别在水、酒精中的溶解度),下列说法正确的是( )
A.上述图像表示碳酸钠的溶解度曲线
B.20 ℃时,氢氧化钠的溶解度大于碳酸钠
C.40 ℃时,将50 g NaOH分别投入100 g水和100 g酒精中,均能形成饱和溶液
D.40 ℃时,将适量CO2通入饱和NaOH的酒精溶液中,观察不到明显的现象
11.分析处理图表中的信息是学习化学的一种重要方法。
下表是氯化钠和碳酸钠在不同温度
( 1 )40 ℃时,氯化钠的溶解度为g。
( 2 )碳酸钠的溶解度随温度的升高而( 填“增大”或“减小”)。
20 ℃时,将30 g碳酸钠加入100 g水中,充分搅拌后得到的是碳酸钠的( 填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30 ℃,所得溶液的溶质质量分数为( 结果精确到0.1% )。
( 3 )10 ℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的是溶液。
