烃的概述、烷烃的化学性质
烷烃
相互关系 E F C A D B
白磷与红磷 正丁烷与异丁烷
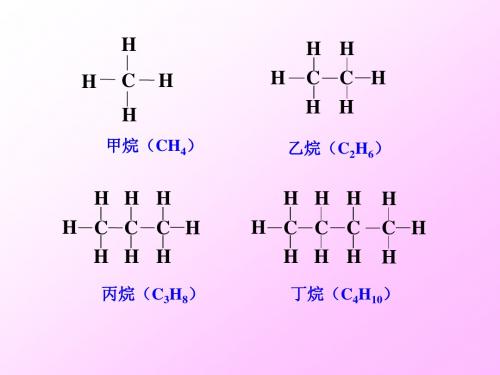
H H H C C H H H
H H H H C C C H H H H
丙烷( 丙烷(C3H8) 结构简式: 结构简式:CH3CH2CH3
乙烷( 乙烷(C2H6) 结构简式: 结构简式:CH3CH3 CH3—CH3
H H H H C C C 丁烷(C4H10) 结构简式: 结构简式:CH3CH2CH2CH3 或CH3(CH2)2CH3 CnH2n+2(n≥1) ) CnH2n(n≥3) )
(三)同系物
结构相似,在分子组成上相差一个或若干个 结构相似,在分子组成上相差一个或若干个CH2 原子团的物质 相差一个或若干个 互称同系物。 互称同系物。 同:通式同,组成元素同,同类物质 通式同,组成元素同, 原子团,(分子式不同) ,(分子式不同 异:组成上相差n个CH2原子团,(分子式不同) 组成上相差 个 式量相差: 式量相差:14n 电子数相差: 电子数相差:8n
同系物一定不是同分异构体; 同系物一定不是同分异构体;同分异构体一定不是同系物
练习:选择正确答案的序号, 练习:选择正确答案的序号, 填入下表空格中 A.同位素 B.同分异构体 . . C.同系物 D.同素异形体 . . E.同一物质 F.同类物质 . . 物质名称 氯仿与三氯甲烷 一氯甲烷与四氯化碳 乙烷与新戊烷
气态, (1)状态:常温常压下的烷烃, C1~C4,气态, )状态:常温常压下的烷烃, C5~C16,液态, 液态, C17及以上,固态。 及以上,固态。 (2)密度: 液态时密度均小于1g/cm3(均比水轻)。 )密度: 液态时密度均小于 均比水轻)。 (3)溶解性:均难溶于水,易溶于有机溶剂。 )溶解性:均难溶于水,易溶于有机溶剂。
有机化学 烷烃

3
5
2
4
3
2
1
C H
C H
C H C H
3
C H C H C H
2 2
C H C H
3
C H C H
3
C H
3
C H 3 2 , 3 , 5 - 三 甲 基 - 4 - 丙 基 庚 烷
六个碳的主链上有四个取代基
六个碳的主链上有两个取代基
主链选最长;侧链当作基;编号近侧链;基位注在前。 (6)若在主链的等距离两端同时遇到取代基且多 于两个时,则要比较第二个取代基的位次大小,依 次类推(使取代基位次之和最小)。 6 5 4 3 2 1 CH3 CH CH2 CH CH CH3
戊烷C6H14有3个构造异构体
• 戊烷可看成是正丁烷和异丁烷上的一个 H被甲基-CH3 取代的产物。
随着碳原子数的增加,异构体的数目增加很快
• • • • • •
己烷C6H14有5个构造异构体, 庚烷C7H16有9个构造异构体, 辛烷C8H18有18个构造异构体. C10H22有75个构造异构体. C13H28有802个构造异构体, C25H52有3679个构造异构体…
对简单烷基可以用普通命名法:烷变基
CH3
甲基 Methyl (Me)
CH3CH2
乙基 Ethyl (Et)
CH3CH2CH2
(正)丙基 Propyl (Pr)
CH3CHCH3
异丙基
Isopropyl (i-Pr)
CH3 CH3
CH3CH2CH2CH2— CH3CHCH2CH3 CH3CHCH2— CH3-C— CH3
3、系统命名原则 1)选主链(母体)和取代基
•选择主链 ——把构造式中连续的最长碳链作为母体
烷烃的化学性质

烷烃的化学性质烷烃是一类简单的烃类化合物,由碳和氢元素组成,通式为CnH2n+2。
烷烃分为直链烷烃和环烷烃两种。
直链烷烃分子中碳原子通过单键连接,而环烷烃中存在环状结构。
物理性质烷烃是无色、无味的气体、液体或固体,随着碳原子数的增加,它们的物理性质也有所不同。
由于烷烃是非极性分子,所以它们的溶解度较低,常用作有机燃料。
烷烃的密度随分子的大小而增加,其沸点和凝固点也会随之增加。
化学性质燃烧烷烃是一类优良的燃料,能够在氧气的存在下发生完全燃烧反应。
在充分供氧的条件下,烷烃燃烧生成二氧化碳和水,释放大量热量。
烷烃燃烧的反应方程式如下:CnH2n+2 + (3n+1)/2 O2 → n CO2 + (n+1) H2O氧化反应烷烃还可以通过氧化反应获得相应的醇、醛、酮等化合物。
例如,在存在氧气的条件下,烷烃会发生部分氧化反应生成醛。
这种反应通常需要催化剂的存在来促进反应进行。
卤代反应烷烃可以与卤素发生取代反应,生成卤代烷。
这种反应是通过将卤素与烷烃在适当条件下加热反应得到的,反应过程中会释放一定能量。
裂解反应烷烃在高温条件下也能发生裂解反应,分解为较小的烃类分子。
这种裂解反应对烷烃的工业生产具有重要意义,可实现大分子烷烃的转化。
应用烷烃在化工、燃料等领域有着广泛的应用。
作为有机溶剂、燃料、润滑油等,烷烃在人类生产生活中扮演着不可或缺的角色。
同时,烷烃作为原料还能够提炼出更多有用的化合物,为化工工业的发展做出贡献。
总的来说,烷烃作为一类简单的烃类化合物,具有重要的化学性质,对于我们的工业生产和生活具有重要意义。
我们需要深入研究其性质和应用,以发挥其最大的潜力。
烷烃

3.数字意义: 阿拉伯数字---------取代基位置 汉字数字---------相同取代基的个数
1、最长原则
2、最近原则 3、最小原则 4、最简原则
1、用系统命名法命名 下列物质:
CH3—CH—CH2—CH—CH3
CH2 CH3 CH2 CH3
CH3—CH—CH2—CH—CH3 CH3 CH2—CH3
己烷
2、编号,定支链所在的位置。
把主链中离支链最近的一端作为起点, 用1、2、3等数字给主链的各碳原子依次编 号定位,以确定支链所在的位置。
CH3—CH—CH2—CH—CH3
6
5
4
3
1
2
CH3
3
4 2
CH2—CH3
1
5
6
2、编号,定支链所在的位置。
CH3 CH3–C–CH2–CH–CH2–CH3 CH3 CH2–CH3
2,2—二甲基—4—乙基己烷
最简原则:当有两条相同 碳原子的主链时,选支链 最简单的一条为主链。
CH3 CH3–CH–2,5—二甲基—3—乙基己烷
1.命名步骤: (1)找主链------最长的主链; (2)编号-----靠近支链(小、多)的一端; (3)写名称-------先简后繁,相同基合并写. 2.名称组成:
练习1:
1 互为同位素,___ 2 是同素异形体, 下列五组物质中___ 5 是同分异构体,___ 4 是同系物,___ 3 是同一物质。 ___
1、 12 C
6 14 6
C
2、白磷、红磷
3、
H H | | H-C-Cl 、Cl-C-Cl | | Cl H
烷烃ppt课件

烷烃在光照、高温或催化剂作用下可发生裂解、异构化、烷基化等反应;与卤 素、氧气等发生取代、氧化等反应。
02 烷烃的化学性质
自由基取代反应
01
02
03
自由基的产生
光照、加热等条件下,烷 烃分子中的C-H键均裂产 生氢自由基。
自由基的链式反应
氢自由基与烷烃分子发生 碰撞,引发新的C-H键均 裂,产生新的氢自由基和 烷基自由基。
的离子型异构化反应。
03 烷烃的来源与制 备
天然气及石油中的烷烃成分
天然气主要成分
天然气和石油的成因
甲烷(CH4),少量乙烷、丙烷等低 碳烷烃。
生物成因和化学成因,经过长期地质 作用形成。
石油中的烷烃
从C5到C20+的各种烷烃,以直链和 支链形式存在。
实验室合成方法简介
1 2
格氏试剂法 卤代烃与镁在无水乙醚中反应,生成格氏试剂, 再与羰基化合物反应得到烷烃。
05 环境影响与安全 防护措施
大气中烷烃的污染问题
温室效应
烷烃在大气中的存在会加剧温室效应,导致全球气候变暖。
光化学烟雾
在阳光照射下,烷烃与氮氧化物等污染物发生光化学反应,生成光 化学烟雾,对人类健康和生态环境造成危害。
大气污染
烷烃作为挥发性有机物(VOCs)的主要成分,对大气环境造成污染, 影响空气质量。
武兹反应 卤代烃与钠在无水乙醇中反应,生成烷烃和卤化 钠。
3
科尔贝-施密特反应 烯烃在高压下与氢气和催化剂反应,得到烷烃。
工业生产途径概述
石油裂化
在高温高压下,重质石油馏分裂 化为轻质烷烃和烯烃。
天然气液化分离
将天然气冷却至低温,使不同碳数 的烷烃依次液化分离。
烷烃的主要知识点总结

烷烃的主要知识点总结1. 烷烃的分类烷烃分为饱和烷烃和不饱和烷烃两大类。
饱和烷烃的分子中只含有碳碳单键,如甲烷、乙烷、丙烷等。
不饱和烷烃的分子中含有至少一个碳碳双键或者环状结构,如乙烯、丙烯、环戊烷等。
2. 烷烃的物理性质烷烃是无色、无味、无毒的气体或液体,室温下多为气体。
它们是脂肪族烃,燃烧时产生大量的热能并放出水和二氧化碳。
烷烃的密度小,挥发性大,不溶于水,但溶于非极性溶剂。
随着碳原子数的增加,烷烃的相关性质也发生了变化,例如熔点、沸点、密度等。
3. 烷烃的化学性质烷烃是碳氢化合物,因此其化学性质主要表现为烃基的作用。
饱和烷烃具有很高的稳定性,通常需要高温和高压或者使用催化剂才能进行化学反应。
不饱和烷烃由于含有碳碳双键或者环结构,因此其化学反应活性较高,可以发生加成反应、氧化反应、裂解反应等。
4. 烷烃的制备烷烃的制备通常采用石油、天然气等石油烃资源作为原料进行加工,具体方法包括裂解、重整、蒸汽重整等。
裂解是指将较长链的烃类分子裂解成较短链的烃类分子,重整是指通过催化剂的作用将较短链的烃类分子重新组合成较长链的烃类分子。
5. 烷烃的应用烷烃是现代工业生产的重要原料,广泛应用于燃料、润滑油、合成橡胶、合成塑料、合成纤维、合成药品等领域。
其中,烷烃作为燃料的应用是最为广泛的,可以用于发电、汽车、机械等领域。
烷烃还具有重要的环境和生态意义,例如甲烷是一种重要的温室气体,它参与了地球大气中的温室效应,对于气候的变化和全球变暖具有重要的影响。
总结来说,烷烃作为一种重要的有机化合物,在工业生产和生态系统中具有重要的作用。
它的化学性质、化合物的制备和应用以及对环境的影响都是我们需要深入了解和研究的内容。
希望以上对烷烃的主要知识点总结能够帮助您更好地了解和掌握这一领域的知识。
烷烃的化学性质

烷烃的化学性质烷烃(Alkanes)是一类碳氢化合物,通式为CnH2n+2,是碳氢化合物中最简单的一类。
它们的化学性质主要是通过碳碳键和碳氢键的化学反应来反映。
烷烃的化学性质涉及到其物理性质,比如燃烧性质、氧化、卤素取代反应等一系列的反应过程,以及其它的有机化学反应。
1. 燃烧性质:烷烃的燃烧是指把烷烃与氧气反应,产生二氧化碳和水。
烷烃在空气中燃烧会产生明亮的火苗,有一定的热值。
燃烧反应是烷烃常见的化学反应之一,也是在日常生活中使用的常见性质。
例如,将天然气(主要成分是甲烷)用作燃料时,燃烧产生的热可以用于加热。
2. 氧化反应:烷烃一般很难被氧气氧化,因为它们的分子中所有的碳氢键都已饱和,分子结构稳定。
但是,在存在良好的氧化剂的情况下,烷烃可以发生氧化反应。
氧化剂会断裂分子中的碳氢键,形成碳氧和氢氧。
最典型的氧化反应是烷烃的燃烧,也会发生部分氧化反应。
3. 卤素取代反应:烷烃中的氢可以被卤素原子取代,形成卤代烷烃。
取代反应是在有机化学中常见的一类反应,可以发生在很多种有机化合物中。
在烷烃中,氢会被卤素原子取代产生卤代烷烃。
典型的卤素取代反应包括氯代反应和溴代反应等。
4. 加成反应:烷烃可以与分子中的其他化合物发生加成反应,形成新的共价键。
在炼油、石油化工行业中,烷烃可以通过加成反应形成不同的烃类,例如烯烃和芳香族化合物等。
5. 烷基化反应:烷基化反应是一种有机化学反应,可以为一个有机分子合成新的烷基。
在烷基化反应中,烃分子中某个碳原子的烷基被迁移或注入其他化学物质,形成新的烷基化合物。
在工业上,烷基化反应主要是用来合成高级烃类,例如烷基锂和烷基钠等。
总而言之,烷烃的化学性质中,燃烧性质、氧化反应、卤素取代反应、加成反应以及烷基化反应等的反应过程,都是烷烃常见的化学反应。
它们可以被用作燃料,或者在工业、化学实验和科研中进行各种有机化学反应,对经济、生活和学术等方面都有着重要的作用和意义。
烃的概述烷烃的化学性质

第1章第3节第1课时烃的概述烷烃的化学性质班级:高二( )班姓名:座号:【目标导航】1.了解烃的分类。
2.了解烷烃、烯烃、炔烃、苯及其同系物的物理性质。
3.掌握烯烃、炔烃的命名规则(含一个双键或叁键)。
(重点) 4.掌握烷烃的结构和化学性质。
(重点) 知识点1 烃的概述微体验(1)烷烃属于饱和烃,也属于链烃。
() (2)不饱和烃分子中一定含有碳碳双键或碳碳叁键。
()(3)含有苯环的有机物属于芳香烃。
()题组1烃的分类及物理性质1.下列关于芳香族化合物的叙述中正确的是()A.其分子组成的通式是C n H2n-6B.分子里含有苯环的烃C.分子里含有苯环的有机物D.苯及其同系物的总称2.已知①丁烷;②2-甲基丙烷;③正戊烷;④2-甲基丁烷;⑤2,2-二甲基丙烷,下列关于它们的沸点的排列顺序正确的是()A.①>②>③>④>⑤B.⑤>④>③>②>①C.③>④>⑤>①>②D.②>①>⑤>④>③3.下列各烃属于苯的同系物的是()4.按照要求对下列物质进行分类(将序号填在横线上)。
(1)属于链烃的为________。
(2)属于环烃的为________。
(3)属于脂环烃的为________。
(4)属于芳香烃的为________。
题组2烃的命名5.下列有机物命名正确的是()6.下列四种命名正确的是()A.2-甲基-2-丁炔B.2-乙基丙烷C.3-甲基-2-丁烯D.2-甲基-2-丁烯7.分子式为C8H10的芳香烃,苯环上的一硝基取代物只有一种,该芳香烃的名称是() A.乙苯B.邻二甲苯C.间二甲苯D.对二甲苯8.(1)用系统命名法命名下列物质:(2)根据下列名称写出各物质的结构简式:知识点2 烷烃的化学性质微体验(1)烷烃能使酸性KMnO4溶液退色。
()(2)常温下,烷烃均为气体,易燃烧。
()(3)烷烃在一定条件下与卤素单质反应生成卤代烃。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
-0.5
36.1 沸点/ºC -103.7 -47.4 -6.3 30
0.578
0.626 相对密度 0.566 0.519 0.595 0.640
新戊烷 9.5
1、链烃
(1)烷烃、烯烃、炔烃相似的物理性质。
物理性质 状态 溶解性 沸点 密度 变化规律 当碳原子数小于或等于4时,在常温下呈气态, 其他的常温下呈 固态 或液态(新戊烷常温下为气 态) 都不溶于 水 ,易溶于 有机溶剂 。 随碳原子数的增加,沸点逐渐 升高 。碳原子数 相同的烃,支链越多,沸点越 低 。 随碳原子数的增加,相对密度逐渐 增大 。但密 度 小于 水的密度
2.下列有关烷烃的叙述中,正确的是(双选)(
)
A.在烷烃分子中,所有的化学键都是单键
B.烷烃中除甲烷外,很多都能使酸性KMnO4溶液 的紫色退去 C.分子通式为CnH2n+2的烃不一定是烷烃 D.所有的烷烃在光照条件下都能与氯气发生取代 反应
答案:
AD
CH3 2-甲基-2-丁烯
练习:给下列物质命名
选主链
→
↓
近双(叁)键 定位号
选择含碳碳双(叁)键的 最 长碳链为主链,根据主链碳原子数称 “某烯(或某炔)”
→用阿拉伯数字表明碳碳双(叁)
键的位置,用“二、三”等标明双键 或叁键的个数
↓
标双(叁)键 合并算
→从距离碳碳双(叁)键最近的
一端开始给主链碳原子编号定位次
选修《有机化学基础》
第1章 有机化合物的结构与性质 第3 节
第一课时 烃的概述
烃
烃
烷烃的化学性质
知识回顾 1、烃的分类、甲烷的性质; 2、复习同分异构体的概念及书写方法; 3、讨论交流总结出烃的物理性质的相似 性及递变性。 4、复习烷烃的系统命名法。 5、苯的物理性质 6、苯和苯的同系物、芳香烃、芳香族化 合物的关系?
结构简式
CH4 CH3CH3
沸点/ºC
-164 -88.6
相对密度
0.466 0.572
丁烷
戊烷 名称 乙烯 丙烯 1-丁烯 1-戊烯
名称 沸点ቤተ መጻሕፍቲ ባይዱºC
CH3(CH2) 2CH3
CH3(CH2)3CH3 结构简式 CH2=CH2 CH2=CHCH3 CH2=CHCH2CH3 CH2=CH(CH2) 2CH3
(2) 烯烃和炔烃的命名 以C5H10为例写出其烯烃类的同分异构体,并用 系统命名法命名.
CH2=CHCH2CH2CH3 CH3CH=CHCH2CH3 CH2=C—CH2CH3 1-戊烯 2-戊烯 CH3 2-甲基-1-丁烯 CH2=CHCHCH3 CH3CH=CCH3 CH3 3-甲基-1-丁烯
(3)取代反应
CH4+Cl2 光照
CH3Cl+HCl
二、烷烃的化学性质
烷 烃 的 化 学 性 质 稳定性 特征反应——取代反应 与氧气的反应——可燃性 分解反应——高温裂化或裂解
1.烷烃的稳定性
常温下很不活泼,与强酸、强碱、强氧化
剂和还原剂等都不发生反应。
2.与卤素单质的反应(特征反应——取代反应)
↓
其他同烷烃
请写出下列芳香烃的分子式,并判断哪些是苯的同系物。
—CH3
CH3
—CH2 —CH3
CH3
C7H8
√
C8H10
√
C8H10
√
—CH2—
—CH =CH2
C13H12
C10H8
C8H8
苯的同系物:①分子结构中只有一个苯环②侧链必须为烷烃基
[问题]苯的同系物的命名方法如何?说出下列物质的 名称。
CH =CH2
①以苯环为母体 ②从连有比较复杂的取代基开始编号(编号和最小) ③2个取代基是可用“邻、间、对”表示。
P30
通过甲烷的化学性质,结合烷烃的结构特征,研讨烷烃 的化学性质。
回顾:甲烷的化学性质 (1)甲烷的稳定性 通常情况下,不易与其它物质反应和强酸、 强碱、强氧化剂都不起反应,不能使酸性KMnO4溶 液褪色。 点燃 (2)可燃性 CH4+2O2 CO2+2H2O
一、烃的概述
烷烃
(饱和烃)
CnH2n+2 (n≥1) CnH2n (n≥2) CnH2n-2 (n≥2)
链烃(脂肪烃)
烯烃
炔烃
烃
环烃
芳香烃
苯及同系物:CnH2n-6 (n≥6)
环烷烃
脂环烃
(饱和烃)
CnH2n (n≥3) CnH2n-2 (n≥3)
环烯烃
阅读下列表格信息,总结链烃的物理性质
名称
甲烷 乙烷
hv CH3CH3+Cl2 → CH3CH2Cl+HCl
卤代烃
3.与氧气的反应——可燃性
3n 1 点燃 CnH2n+2 + O2 2
nCO2 + (n+1)H2O
4.分解反应——高温裂化或裂解 C16H34 催化剂 ――→ C8H16+C8H18
高温
练一练
1.①丁烷②2甲基丙烷③戊烷④2甲基丁烷⑤2,2甲基 丙烷等物质的沸点排列顺序正确的是( ) A.①>②>③>④>⑤ B.⑤>④>③>②>① C.③>④>⑤>①>② D.②>①>⑤>④>③ 解析: 对于烷烃而言, 相对分子质量越大,分子间作 用力越大,沸点越高 ,即:③、④、⑤大于①、② , 对于相对分子质量相同的烷烃,支链越多,沸点 越低,即①>②,③>④>⑤,综合排序可得,③>④> ⑤>①>②。选C。 答案: C
