铝土矿制备铝的工艺流程
高中化学课件:从铝土矿中提取铝

过滤
灼烧
铝土矿
NaAlO2(aq)
Al(OH)3
Al2O3
酸处理
液 NaHCO3
铝 土 矿
Al2O3 足量盐酸 液 Fe2O3 过滤
AlCl3足量NaOH
FeCl3 HCl
过滤
液
NaAlO2 NaCl
足量CO2
NaOH 过滤
NaCl 固Al(OH)3灼烧 Al2O3
固 Fe(OH)3
SiO2等
固 SiO2等
century, “The uses for Aluminum are boundless(没有边界
的、无穷的).”
“美铝AL”CO将A 继con续tinu致es力to d于ev挖elo掘p n这ew种app非lic凡atio金ns(属用的新用 途途,)为fo新r th一is r代em的ark生abl产e(方杰出式的和、理显念著的拓)宽m思eta路l, 。
Al2O3+3H2O
碳酸(CO2)
NaAlO2+CO2+2H2O =Al(OH)3↓+NaHCO3 不反应
不反应
如何使溶液中NaAlO2完全形成Al(OH)3沉淀?
1.向一支试管中取少量 NaAlO2溶液,向其中逐滴滴加盐酸,直到 氢氧化铝沉淀完全
2.向另一支试管中取少量 NaAlO2溶液,向试管中通入CO2,直到 氢氧化铝沉淀完全
二、从铝土矿制备铝的工艺流程:
NaOH溶液
二氧化碳
溶解
酸化
铝土矿 过滤 NaAlO2溶液 过滤 Al(OH)3
滤渣
滤液
提纯Al2O3 2Al2O3 通电 4Al+3O2↑
冰晶石
灼烧 Al2O3 电解 熔融
铝的生产过程
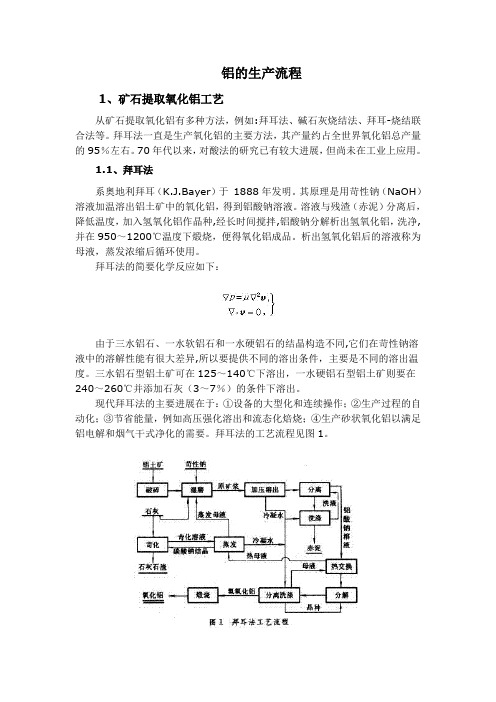
铝的生产流程1、矿石提取氧化铝工艺从矿石提取氧化铝有多种方法,例如:拜耳法、碱石灰烧结法、拜耳-烧结联合法等。
拜耳法一直是生产氧化铝的主要方法,其产量约占全世界氧化铝总产量的95%左右。
70年代以来,对酸法的研究已有较大进展,但尚未在工业上应用。
1.1、拜耳法系奥地利拜耳(K.J.Bayer)于1888年发明。
其原理是用苛性钠(NaOH)溶液加温溶出铝土矿中的氧化铝,得到铝酸钠溶液。
溶液与残渣(赤泥)分离后,降低温度,加入氢氧化铝作晶种,经长时间搅拌,铝酸钠分解析出氢氧化铝,洗净,并在950~1200℃温度下煅烧,便得氧化铝成品。
析出氢氧化铝后的溶液称为母液,蒸发浓缩后循环使用。
拜耳法的简要化学反应如下:由于三水铝石、一水软铝石和一水硬铝石的结晶构造不同,它们在苛性钠溶液中的溶解性能有很大差异,所以要提供不同的溶出条件,主要是不同的溶出温度。
三水铝石型铝土矿可在125~140℃下溶出,一水硬铝石型铝土矿则要在240~260℃并添加石灰(3~7%)的条件下溶出。
现代拜耳法的主要进展在于:①设备的大型化和连续操作;②生产过程的自动化;③节省能量,例如高压强化溶出和流态化焙烧;④生产砂状氧化铝以满足铝电解和烟气干式净化的需要。
拜耳法的工艺流程见图1。
拜耳法的优点主要是流程简单、投资省和能耗较低,最低者每吨氧化铝的能耗仅3×106千卡左右,碱耗一般为100公斤左右(以Na2CO3计)。
拜耳法生产的经济效果决定于铝土矿的质量,主要是矿石中的SiO2含量,通常以矿石的铝硅比,即矿石中的Al2O3与SiO2含量的重量比来表示。
因为在拜耳法的溶出过程中,SiO2转变成方钠石型的水合铝硅酸钠(Na2O·Al2O3·1.7SiO2·nH2O),随同赤泥排出。
矿石中每公斤SiO2大约要造成1公斤Al2O3和0.8公斤NaOH的损失。
铝土矿的铝硅比越低,拜耳法的经济效果越差。
直到70年代后期,拜耳法所处理的铝土矿的铝硅比均大于7~8。
铝冶炼中的电解制铝工艺

铝土矿的破碎与磨细
将铝土矿破碎成小块,然后通过磨矿 机将其磨细,以便于后续的化学处理 。
电解槽的启动与运行
电解槽的构造
电解槽由阳极、阴极和电解质组 成,是电解制铝的核心设备。
通电电解
在电解槽中通入直流电,使铝离子 在阴极上还原成铝,同时氧气在阳 极上析出。
电解槽的维护
定期检查电解槽的运行状况,确保 电解过程的稳定和安全。
02
电解制铝是现代铝工业中最主要 的生产方式,具有高效、环保、 节能等优点。
电解制铝的原理
电解制铝的原理基于电解反应,即电 流通过电解质时,在阴极上发生还原 反应,析出铝;在阳极上发生氧化反 应,生成氧气。
电解过程中,电流效率、电压效率和 电能效率是衡量电解制铝工艺效率的 重要指标。
电解制铝的工艺流程
电解槽故障及处理方法
电解槽漏电
检查电解槽的绝缘材料是否老化或破损,及时修复或更换。
电解槽温度异常
调整电解槽的冷却水流量,保持适宜的温度。
电解槽电压波动
检查电解槽的电源电压是否稳定,调整电解槽的负载平衡。
电解铝质量问题的解决措施
铝含量不达标
优化电解工艺参数,提高电解铝的纯度。
铝锭表面质量差
调整电解铝的冷却速度和结晶工艺,改善铝锭表面质量。
电解铝的提取与处理
铝的收集
电解过程中产生的铝通过收集系 统集中收集。
铝的熔炼
收集到的铝经过熔炼,形成一定 规格的铝锭。
铝的精炼
通过精炼去除铝中的杂质,提高 铝的纯度。
电解铝的质量控制
质量检测
对电解铝进行质量检测,确保其符合相关标准和 客户要求。
质量追溯
建立质量追溯体系,对每个生产环节进行记录和 监控,以便于问题追溯和解决。
铝土矿提取氧化铝

铝土矿提取氧化铝铝土矿提取氧化铝是工业领域一项极为重要的工艺技术,据调查,全球氧化铝的产量占据了铝产量的约90%。
本文将从铝土矿的定义、提取氧化铝的工艺流程、以及目前常用的提取方法三个方面对铝土矿提取氧化铝进行分析,具体内容如下:一、铝土矿的定义铝土矿是指以铝石和高岭土为主要原料的矿物,是一种含铝的非金属矿产。
铝土矿主要分布在地球的热带和亚热带地区,其中中国拥有世界上最大的铝土矿资源储量。
铝土矿在工业生产中是重要的原材料之一,主要用于提取氧化铝。
二、提取氧化铝的工艺流程铝土矿提取氧化铝的工艺流程一般包括以下几个步骤:1、粉碎:将原料的大块铝土矿经过破碎后,获得的矿石颗粒尺寸需要达到1-5mm。
2、酸浸:采用硫酸或氢氧化钠等酸性溶液进行酸浸,将铝土矿中的铝氧化物化为可溶性的铝离子。
3、净化:将浸出液进行清洗和沉淀,去除其中的杂质,以保证萃取后的纯度。
4、输送:将清洁的提取液输送至萃取车间。
5、萃取:采用具有选择性的药剂进行萃取,将铝离子从提取液中萃取出来,并获得成品。
6、精制:将萃取出的氧化铝进行进一步的精制,提高氧化铝的纯度,以便制造乙烯、电线电缆、航空器、建筑及交通工具等产品。
三、常用的提取方法目前,铝土矿提取氧化铝常用的方法有卡尔门处理法和贝尔法两种。
1、卡尔门处理法卡尔门处理法也称氢氟酸法,由挪威尔尔柏格卡尔门发明,故得名。
这种方法的原理是将铝土矿与氢氟酸相反应,制成萃取液,并将萃取液用分离、蒸发等工艺处理,获得纯度较高的氧化铝。
2、贝尔法贝尔法是利用碱金属氰化物在碱性介质中萃取氧化铝的工艺方法。
与卡尔门处理法不同,这种方法可以同时提取铝、锂和钠等多种金属。
其优点是能产生低成本的氢氧化铝,并且可以降低铝土矿浸出和提取的成本。
总之,铝土矿提取氧化铝是一项极为重要的工业技术,其发展进程不断加快。
在未来,随着铝土矿资源的逐渐匮乏,对于铝土矿的可持续性开发和利用,以及提取氧化铝的新技术的开发和研究,在实现高质量、高效率、低成本的生产目标方面将会面临更大的挑战。
高考化学 考点 化工流程中铝的化合物的转化必刷题试题
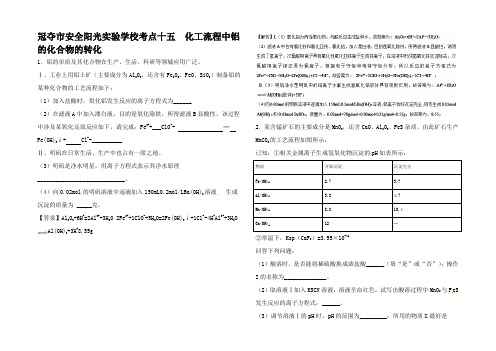
冠夺市安全阳光实验学校考点十五化工流程中铝的化合物的转化1.铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ、工业上用铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)制备铝的某种化合物的工艺流程如下:(1)加入盐酸时,氧化铝发生反应的离子方程式为______(2)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
该过程中涉及某氧化还原反应如下,请完成:Fe2++___ClO-+ ═Fe(OH)3↓+ Cl-+__________Ⅱ、明矾在日常生活、生产中也占有一席之地。
(3)明矾是净水明星,用离子方程式表示其净水原理_____________________________。
(4)向0.02mol的明矾溶液中逐滴加入150mL0.2mol/LBa(OH)2溶液,生成沉淀的质量为 _____克。
【答案】Al2O3+6H+=2Al3++3H2O 2Fe2++1ClO-+5H2O=2Fe(OH)3↓+1C1-+4H+Al3++3H2O Al(OH)3+3H+8.55g 2.某含锰矿石的主要成分是MnO2,还含CaO、Al2O3、FeS杂质,由此矿石生产MnCO3的工艺流程如图所示:已知:①相关金属离子生成氢氧化物沉淀的pH如表所示:物质开始沉淀沉淀完全Fe(OH)3 2.7 3.7Al(OH)3 3.8 4.7Mn(OH)28.8 10.4Ca(OH)212 ─②常温下,Ksp(CaF2)=3.95×10-11回答下列问题:(1)酸溶时,是否能将稀硫酸换成浓盐酸______(填“是”或“否”);操作I的名称为______________。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中MnO2与FeS 发生反应的离子方程式:______。
(3)调节溶液Ⅰ的pH时,pH的范围为_________;所用的物质X最好是________(填字母)。
A.盐酸 B.NaOH溶液 C.氨水 D.MnCO3固体(4)滤渣Ⅰ为___________________,滤渣Ⅱ为_____________。
从铝土矿中提取铝PPT课件1

二、从铝土矿制备铝的工艺流程:
NaOH溶液 二氧化碳
溶解
酸化
铝土矿
过滤 NaAlO 溶液 过滤 Al(OH)3 灼烧 Al2O3 2
?
滤 渣
滤 液
交流与讨论
如何从氧化铝中提取铝?
资料卡
化合物类型 NaCl
MgCl2 AlCl3 Al2O3
熔点 801℃
714℃ 194℃ 2054℃
离子化合物
离子化合物 共价化合物 离子化合物
资料卡
盐酸
NaAlO2 Al(OH)3 Fe(OH)3
NaAlO2+HCl+H2O =NaCl+Al(OH)3 ↓
氢氧化钠溶液
不反应
碳酸(CO2)
NaAlO2+CO2+2H2O= Al(OH)3↓+NaHCO3
Al(OH)3 +3HCl Al(OH)3+ NaOH 不反应 =AlCl3+3H2O = NaAlO2+2H2O Fe(OH)3 +3HCl 不反应 =FeCl3+3H2O 2Al(OH)3
Fe2O3 Fe2O3+6HCl=2FeCl3+3H2O
SiO2
不反应
SiO2+2NaOH=Na2SiO3+H2O
不反应
注意:溶液中的NaAlO2 、Na2SiO3与NaOH在一定条件 下会生成铝硅酸钠沉淀
交流与讨论
如何将铝土矿(主要成分为Al2O3,还有少 量Fe2O3、SiO2等杂质)中Al2O3提纯?
二、从铝土矿制备铝的工艺流程:
NaOH溶液
二氧化碳
溶解
酸化
冰晶 石
铝土矿
过滤 NaAlO 溶液 过滤 Al(OH)3 灼烧 Al2O3 2 电解 熔融
高铝球生产工艺流程

高铝球生产工艺流程高铝球生产工艺流程高铝球是一种常用的磨料,广泛用于金属矿石研磨、水泥厂磨矿等行业。
下面介绍高铝球的生产工艺流程。
首先,高铝球的原材料是优质铝土矿和高铝粉。
铝土矿是铝的重要矿石,具有高铝含量和较低的杂质含量,是生产高铝球的重要原料。
第一步是原料的制备。
将优质铝土矿进行破碎,经过磨矿机处理,使其粒度达到所需要求。
同时,将高铝粉进行干燥处理,以去除水分。
第二步是混合。
将经过破碎和干燥处理的铝土矿和高铝粉按照一定比例进行混合。
混合的目的是使不同粒径的颗粒均匀分布,提高烧结效果。
第三步是成型。
将混合好的原料放入高压球机进行成型。
高压球机采用一定的压力将原料压制成固定形状的高铝球,常见的形状有圆球和圆柱。
第四步是烧结。
将成型好的高铝球放入烧结炉进行烧结。
烧结炉内提供高温环境,使高铝球内部发生化学反应,颗粒之间发生结合,形成坚固的球体。
第五步是冷却。
烧结好的高铝球会非常热,需要进行冷却处理。
可以使用冷却塔或者冷水进行快速冷却,降低高铝球的温度。
第六步是筛选和分类。
将冷却好的高铝球进行筛选,去除过大或者过小的颗粒,只保留合格的高铝球。
然后根据客户的要求进行分类,不同粒径的高铝球用于不同的应用。
最后一步是包装和出货。
将筛选好的高铝球进行包装,一般采用编织袋进行包装。
然后将包装好的高铝球装入货车或者集装箱,出货给客户。
以上是高铝球的生产工艺流程。
每个环节都需要严格控制操作,以确保高铝球的质量和性能符合要求。
工艺流程的合理性和稳定性对于产品质量的稳定性和提高生产效率非常重要。
铝粉提炼铝锭的工艺流程

铝粉提炼铝锭的工艺流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!1. 原料准备:首先,需要准备高质量的铝粉作为原料。
铝粉通常通过氧化铝还原法或者电解法得到。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
的氢气在标准状况下的体积为3.36 L,0.2 mol的Al生成的氢气在
标准状况下的体积为6.72 L,所以镁和铝混合物生成的氢气在标
准状况下的体积为10.08 L,故选D项。
【解题技法】——数形结合法解决变量的相互关系问题
1.优点 数形结合是指将化学问题抽象成数学问题,利用数学工 具来解决化学问题的一种解题方法。许多化学问题中常 常直接或间接隐含着一些数学原理,解题时依据化学原 理建立数学模型或运用数学方法将化学问题数形化,是 化学解题中常用的一种数学工具,它能将复杂和抽象的 物质关系与直观形象的数学图形联系起来,以此开阔解 题思路,增强解题的灵活性与综合性,并能提高学生分 析问题、解决问题的能力。
Al(OH)3
A→B NaAlO2+HCl+H2O====NaCl+Al(OH)3↓
AB
B→C C HCl Al(OH)3+3HCl====AlCl3+3H2O
生成Al(OH)3消耗的HCl和溶解Al(OH)3消耗的HCl的物质的量 之比为1:3。
3.向等物质的量的MgCl2、AlCl3溶液中滴加NaOH溶液直至 过量
专题3 从矿物到矿物材料
3.1.2 从铝土矿到铝合金(2)
欧昌友
高中化学第一轮复习
………三年6考 高考指数:★★ 1.了解铝的主要性质及应用。 2.了解铝的重要化合物的主要性质及应用。 3.实验内容:氢氧化铝的两性。
三.以铝土矿制备铝的工艺流程
NaOH溶液 二氧化碳 Al(OH)3
Al2O3
6.铝土矿(主要成分为Al2O3,还有少量杂质)是提取氧化 铝的原料。提取氧化铝的工艺流程如图:
(1)请用离子方程式表示以上工艺流程中第①步反应: _____________________。 (2)写出以上工艺流程中第③步反应的化学方程式: _____________________。
(3)金属铝与氧化铁混合点燃,会发生剧烈的反应。该反应的 化学方程式为: _____________________。请举一例该反应 的用途_____________________。 (4)电解熔融氧化铝制取金属铝,若有0.6 mol电子发生转移, 理论上能得到金属铝的质量是_____________________。
解析:选C
3.将一定质量的镁铝混合物投入200 mL硫酸中,固体全部溶 解后,向所得溶液中加入5 mol·L-1的NaOH溶液,生成沉淀的 物质的量n与加入NaOH溶液的体积V的变化如图所示:
则下列说法不正确的是( )
【解析】选D。
A.镁和铝的总质量为9 g
B.最初20 mL NaOH溶液用于中和过量的硫酸
【高考警示钟】 (1)分析图像或作图时不仅要注意加入的酸或碱的强弱,而且 要注意所加入的量和滴加的顺序,因为滴加的顺序不同可能 产生的现象不同。 (2)若产生的沉淀有多种,则应仔细分析相关量间的关系,要 特别关注沉淀是否同步生成,沉淀物是否溶于所加入的过量 试剂中,同时要注意横纵坐标的意义。
[跟踪训练]1.在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化
C.硫酸的物质的量浓度为2.5 mol·L-1
D.生成的氢气在标准状况下的体积为11.2 L
【解析】选D。由图像知,n[Mg(OH)2]=0.15 mol,n[Al(OH)3]= 0.35 mol-0.15 mol=0.2 mol,则m(Mg)=0.15 mol×24
g·mol-1=
3.6 g,m(Al)=0.2 mol×27 g·mol-1=5.4 g,所以,镁和铝的总
A→B
沉淀
MgCl2+2NaOH====Mg(OH)2↓+2NaCl
AlCl3+3NaOH====Al(OH)3↓+3NaCl
B→C
Al(OH)3+NaOH====NaAlO2+2H2O
A
B C NaOH
根据沉淀溶解消耗的NaOH的量可以确定原溶液中Al3+的量,再 结合生成沉淀消耗的NaOH的总量可以确定原溶液中Mg2+的量。
答案:(1)Al2O3+2OH-====2AlO2-+H2O
(2)NaAlO2+CO2+2H2O====Al(OH)3↓+NaHCO3或
2NaAlO2+CO2+3H2O====2Al(OH)3↓+Na2CO3
(3)2Al+Fe2O3=高=温=2Fe+Al2O3 焊接钢轨
(4)5.4 g
=
四.有关氢氧化铝沉淀的图像分析
2.(2012·高考安徽卷)已知室温下,Al(OH)3 的 Ksp 或溶解 度远大于 Fe(OH)3。向浓度均为 0.1 mol·L-1 的 Fe(NO3)3 和 Al(NO3)3 混合溶液中,逐滴加入 NaOH 溶液。下列示 意图表示生成 Al(OH)3 的物质的量与加入 NaOH 溶液的 体积的关系,合理的是( )
钠溶液,直至过量。下列表示氢氧化钠溶液加入量(x)与溶 液中沉淀的物质的量(y)的关系示意图正确的是( )
解析:选 C。向硝酸铝和硝酸镁的混合溶液中,加入过量的 NaOH 溶液,发生反应的离子方程式为:Mg2++2OH- ===Mg(OH)2↓、 Al3++3OH-===Al(OH)3↓、Al(OH)3+OH-===AlO-2 +2H2O,即加 入 NaOH 溶液后,Mg2+、Al3+分别生成沉淀 Mg(OH)2、Al(OH)3, 待沉淀完全后,再加入 NaOH 溶液时,Mg(OH)2 不变,而 Al(OH)3 不断溶解,最后完全变为可溶性的 NaAlO2。
质量为9 g;由图像知,最初20 mL NaOH溶液用于中和过量的硫
酸;当沉淀达到最大值时,溶液中的溶质只有Na2SO4,则有
n(Na+)=2n(5SmOo24lg2L-0).1,2L0即.2nL(NaOH)=2n(H2SO4),所以,硫酸的物质 的
量浓度为:
2.5 mol·L-1;0.15 mol的Mg生成
1.向AlCl3溶液中滴加NaOH溶液直至过量
A→B
Al(OH)3
AlCl3+3NaOH====Al(OH)3↓+3NaCl
B→C
A
B C NaOH NaOH+Al(OH)3====NaAlO2+2H2O
生成Al(OH)3消耗的NaOH和溶解Al(OH)3消耗的NaOH的物质的 量之比为3:1。
2.向NaAlO2溶液中滴加盐酸至过量
