乳腺导管原位癌
乳腺导管原位癌临床特点及其影像学诊断价值

目前 常 用 的 乳 腺 癌 分 子 分 型 由P e r o u 等¨ 提 出 ,依据免 疫组化雌激 素受体 ( e s t r o g e n r e c e p t o r , E R)、孕 激素受 体 ( p r o g e s t e r o n e r e c e p t o r ,P R)
随机分布 ,无坏死和有丝分裂 。女性患者前者多见 , 而男性患者乳 头状亚型及 筛状亚型常 见 。 有学者根据更细微 的病理特征提出新分类 法 ” :
@L a g i o s 分类 :根据 胞核分 级 ,分高 、中 、低级 ; @ No t t i n g h a m分 类 :根 据 有无 细 胞 坏 死 ,分 粉 刺
相 同病理分级 的DC I S 患者 ,性别对预后影 响不大 】 。
D C I S 手术可治愈 。E r b a s 随访 临床 上误诊 为 良性
病 变而 未治 疗 的D CI S 病例 ,1 4 ~ 5 3 %在 1 0 - 1 5 年
发 展为浸润性癌 。 源自1 . 3 DCI S的治 疗 进 展
除配合放疗的 比例上升口 ] 。早期乳腺全 切除作 为D C I S 的标 准 治 疗模 式 被 多数 医师 采 用 ,胸 壁 复 发 率 为 l %。 目前认 为 ,乳房 全切除对 于相当一部分病 灶较
乳腺导管原位癌的病理诊断
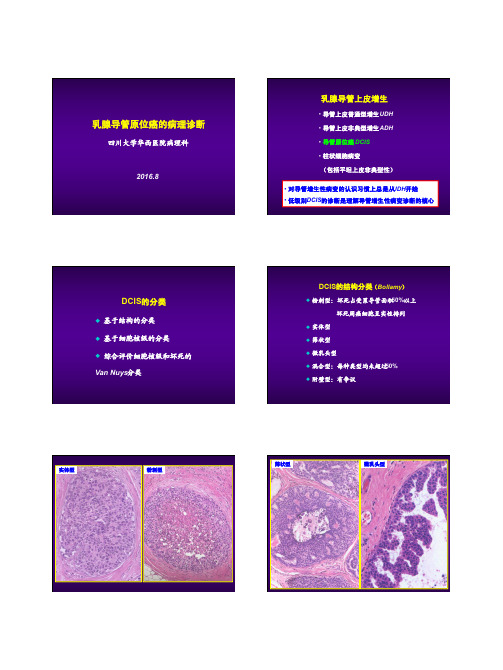
乳腺导管原位癌的病理诊断四川大学华西医院病理科2016.8乳腺导管上皮增生•导管上皮普通型增生UDH•导管上皮非典型增生ADH•导管原位癌DCIS•柱状细胞病变(包括平坦上皮非典型性)•对导管增生性病变的认识习惯上总是从UDH开始•低级别DCIS 的诊断是理解导管增生性病变诊断的核心DCIS的分类u 基于结构的分类u 基于细胞核级的分类u 综合评价细胞核级和坏死的Van Nuys 分类DCIS的结构分类(Bollamy)u粉刺型:坏死占受累导管面积50%以上坏死周癌细胞呈实性排列u实体型u筛状型u微乳头型u混合型:每种类型均未超过50%u 附壁型:有争议实体型粉刺型筛状型微乳头型所谓的“附壁型”2012 WHO:只有那些伴有高级别核改变的病变才能诊断为DCIS导管原位癌核级(低、中、高)Schnitt低级别DCIS的简要诊断标准u增生细胞纯化(特别是细胞核)u细胞分布较均匀u特征性的结构模式u病变往往累及多支导管低级别DCIS的结构模式u结构特点:1 筛状结构:细胞群内出现“冲凿”样圆形或椭圆形的腔隙,腔缘光滑、有张力、均匀分布2 微乳头:纺锤状(基底细,体部膨大)、量多体积大3 僵直的细胞搭桥、有张力的拱形结构4 实体结构:依赖对细胞形态的判断Tavassoli筛状结构有张力、均匀分布WHO纯化;细胞分布均匀WHO微乳头状结构WHO细胞纯化细胞纯化纺锤状Tavassoli僵直的细胞搭桥有张力的拱形结构WHO低级别DCIS诊断的量化标准u至少有两个导管完全受累(Page)u受累导管合计>2mm(Tavassoli )中等级别DCISu显示低核级,但部分导管含有坏死u 显示中等核级,坏死可有或无导管原位癌核级(低、中、高)Schnitt高级别DCISu核明显多形、极向紊乱、分布不均,核形不规则,染色质粗糙,核仁明显u核分裂常见,但不是诊断必需u呈单层、微乳头、筛状或实性u坏死常呈粉刺样,但并非必需u即使一个导管有典型形态学特点也足够诊断高级别核大汗腺型DCIS少见亚型u大汗腺型u梭形细胞型u印戒细胞型u透明细胞型u小细胞型u二态型u黏液型u鳞状细胞型u 囊性高分泌型梭形细胞型印戒细胞型透明细胞型二态型小细胞型p63黏液型囊性高分泌型鳞状细胞型如何报告“导管原位癌”• 核级(低、中、高)、坏死、钙化、组织学模式• 导管原位癌(高核级伴坏死、钙化,筛状、微乳头状结构)鉴别诊断UDH的简要诊断标准u 增生细胞间腔隙不规则,分布不均匀,多位于周边u 细胞核分布不均匀、有重叠(合体状)u 细胞形态多样,非纯化(杂)结构–细胞间腔隙WHO旺炽性增生florid hyperplasiaSchnitt 结构–细胞间腔隙结构 - 细胞间腔隙细胞 - 合体状Rosen细胞重叠、分界不清、合体状Schnitt细胞呈梭形,合体状Schnitt细胞呈梭形,流水状细胞形态多样,非纯化WHO 微乳头结构Schnitt细胞搭桥Schnitt TDLU内的UDHRosenUDH 伴有粉刺样坏死SchnittUDH 伴有坏死UDH 中有无肌上皮细胞成分?SMA calponinp63u 仅根据SMA 等肌上皮标记在导管增生性病灶中呈阴性表达就否定UDH 可能会导致误诊u UDH 偶尔表达p63Boecker ,J Pathol 2002绿色:SMA 红色:Ck8/18/19Note that the myoepithelial cells are not acomponent of the intraductal cell proliferation普通型增生Boecker :5 种细胞,即定向干细胞、腺中间细胞、腺上皮终端细胞、肌上皮中间细胞和肌上皮终端细胞仅表达高分子量CK ,如CK5/6仅表达CK8/18/19仅表达SMA 等表达CK5/6、CK8/18/19表达CK5/6、SMACK5/6UDH的增生细胞群确实含有多种成分,包括定向干细胞、腺中间细胞和腺终端细胞,但未发现具有肌上皮特点的细胞参与其中UDH ADHCK5/6DCIS DCISER染色UDH DCISWHO UDH DCIS UDHDCISADH 的传统诊断标准u 增生病灶出现低级别DCIS 的部分(不是全部)特征即可诊断ADH (不满足DCIS 定性标准)u 如果增生病灶具有低级别DCIS 的全部特征(包括细胞学和结构),只要不超过两个导管或大小不超过2mm ,也诊断ADH (不满足DCIS 定量标准)u 当诊断DCIS 有迟疑时则诊断ADHTavassoli :具有低级别DCIS 细胞学和结构特征的病变仅部分累及单个或多个导管非典型增生增生导管部分区域出现低核级DCIS 的特征Schnitt SchnittSchnitt• 变迁中的定量标准(ADH )- 1985 Page: < than 2 separate spaces (i.e., 1 space) - 1990 Tavassoli + Norris: < or = 2mm - 1998 Jensen and Page: 2-3mm - 2003 Page <4-5mm(2012 WHO :低级别DCIS 发生浸润性癌的时间间隔平均超过15年)• 多数情况下,是在TDLU受累以后使用• 仅测量形成充分的病灶• 病变导管呈纵切面时,不使用此标准SchnittSchnitt Koerner中等核级DCIS SchnittWHOADH是否存在分度(程度划分)?•完全受累(具有低核级DCIS特征),但范围小 - 重度•部分区域具有低核级DCIS特征,多病灶 - 中/重度•部分区域具有低核级DCIS特征,单病灶 - 轻/中度•导管内少数细胞具有纯化特征 - 轻度•如:borderline atypical d uctal hyperplasia / low-gradeductal carcinoma in situmarked ADH / severe ADH / extensive ADHfocal ADHRosen’ breast pathologySchnitt’ breast pathology2012 WHO易被误诊为浸润性癌的DCIS改变u DCIS的小叶癌化(lobular cancerization)u DCIS假浸润:纤维化导致DCIS形态不规则炎细胞浸润背景u DCIS出芽改变u DCIS累及腺病(硬化性、小管型、大汗腺型)和RS等u人工现象:如穿刺导致DCIS 细胞移位小叶癌化小叶癌化炎细胞浸润DCIS出芽改变貌似浸润癌的DCISHER2 DCIS假浸润DCIS假浸润DCIS假浸润DCIS累及腺病DCIS假浸润DCIS累及腺病穿刺导致DCIS细胞移位腺泡型浸润性小叶癌貌似DCIS 的癌栓特殊病例来自张祥盛老师女 38岁 左乳3cm肿物p63Calponin左腋窝淋巴结20/23、左侧锁骨下11/11有转移呈扩张性侵袭 / 膨胀性浸润的癌Bhargava, Dabbs缺乏肌上皮层的“DCIS”p63SMMHC病例p63ER ERPRPR病理诊断送检组织中查见癌,癌组织呈DCIS 形态,但部分肿瘤导管周围缺乏肌上皮层,不能排除其为呈膨胀性生长的浸润癌小 结• 乳腺DCIS 的病理诊断有章可循,但无绝对标准;诊断的主观性客观存在• 量化标准的运用• 基底型CK 的诊断价值• 真假浸润(包括DCIS 缺失肌上皮)致 谢u 华西医院病理科各位老师、同事!u 吴蕴 M.D. Anderson Cancer Center, USAu唐平 University of Rochester Medical Center, USA。
中国乳腺导管原位癌病理诊断共识(2022版)

中国乳腺导管原位癌病理诊断共识(2022版)摘要乳腺导管原位癌具有独特的临床特征、组织形态学和分子特征。
本共识全面阐述了导管原位癌相关生物标志物的临床意义,旨在提高导管原位癌标本取材、病理评估以及相关检测的准确性和可重复性,从而促进导管原位癌病理报告内容的规范化,为临床治疗和预后评估提供可靠依据。
正文乳腺导管原位癌(ductaIcareinomainsitu,DCIS)是一种乳腺非浸润性上皮细胞恶性肿瘤,局限于导管-小叶系统,显示不同程度的结构异常和细胞核级。
在临床、影像、组织形态及基因改变上均具有异质性,有进展为浸润性癌的风险,但并非必然。
随着乳腺影像学检查的普及,DC1.S检出率明显增加,占所有新发乳腺癌的20%~25%°由于DC1.S生物学行为不一,给临床治疗带来挑战。
正确诊断DC1.S对于临床治疗方案的确定和患者预后的评估至关重要。
2016年中国乳腺原位癌诊疗共识专家组制定了《乳腺原位癌诊疗专家共识》,但目前还缺乏相应的中国乳腺DCIS病理诊断规范。
本共识由中华医学会病理学分会乳腺疾病学组、中国抗癌协会肿瘤病理专业委员会乳腺肿瘤学组和中国临床肿瘤学会肿瘤病理专家委员会组织编写,由病理医师和临床医师共同制定,涵盖DCIS标本取材、肿瘤生物标志物检测及病理诊断报告内容等各环节规范化操作要点,旨在使DC1.S的病理诊断更精准,为相关临床诊疗提供依据。
一、乳腺DCIS取材及切缘评估1.瘤床取材:手术科室应提供详细的临床病史和病理信息,包括病变解剖部位(左右侧及象限)、影像学检查结果、有无术前穿刺活检及病理诊断、有无乳腺癌病史和家族史等。
对于乳腺广泛切除或区段切除标本,外科医师应用缝合线或其他标志物作解剖学定位(如上、下、内、外侧)。
病理取材医师应涂染料标记切缘,并结合临床标记和影像学检查进行肿物定位,间隔5~10mm将整个标本平行切开,作好标记。
有条件的单位可对标本进行X线照相。
若病变区域的直径<5cm,建议全部取材;若病变区域的直径25cm,需间隔1Cm至少取材一块组织,有条件的单位尽可能更多取材。
不典型乳腺导管原位癌的X线表现

不典型乳腺导管原位癌的X线表现导管原位癌(ductal carcinoma in-situ,DCIS)又称导管内癌,是非侵袭性乳腺癌的一种形式,有约30%-50%DCIS可发展为浸润癌。
而通过适当的治疗,DCIS又能获得很高的生存率,因此,DCIS的早期确诊是非常重要的。
DCIS以恶性钙化为最常见X线征象[1],而关于恶性钙化以外的表现报道很少。
本文回顾性分析27例经手术病理证实的DCIS,初步探讨不同于单纯恶性微钙化的钼靶X线表现。
1 材料与方法1.1 一般资料本组27例患者均为女性,平均年龄52.6岁,临床表现为乳房肿块或增厚感21例,溢液6例。
所有病例腋下淋巴结病理均阴性。
1.2 乳腺X线检查方法所有患者术前均行乳腺钼靶X线检查,常规摄取双乳侧斜位(mediolateraloblique,MLO)和轴位(craniocaudal,CC)。
根据乳腺内腺体组成的不同分成脂肪型、少量腺体型、多量腺体型和致密腺体型,对发现异常者从形态、边缘、密度等方面进行分析。
2 结果27例DCIS的钼靶表现为肿块者15例,占55.6%,同时伴钙化者4例;11例见于少量腺体型或脂肪型乳腺中;肿块高密度10例,等密度5例;边缘清晰3例,模糊11例,小分叶1例;形态为椭圆形4例,不规则形10例,分叶形1例。
非对称性致密影5例,占18.5%,均表现为无明显边缘的局限性密度增高影。
结构扭曲2例,占7.4%,多发生于多量腺体型乳腺,表现为乳腺结构紊乱,有局灶性收缩感,但无明显的肿块可见。
钼靶X线表现阴性5例,占18.5%,临床触及肿块4例,溢液1例,4例发生在致密或多量腺体型乳腺中,1例MRI表现为异常强化小结节和片状异常强化灶,4例由超声检查发现。
3 讨论早期诊断可以提高DCIS的生存率。
大多数DCIS通过钼靶X线检查是可以发现的,了解其钼靶X线表现,对诊断及确定准确的病变位置以获得病理结果显得非常重要。
在两个相互垂直的投照位置上均能见到的有一定轮廓的占位性病变。
乳腺导管原位癌ppt课件

15
小结
• DCIS多由乳腺X线摄影发现,而临床触及不到肿 块
• 乳腺X线摄影特征性发现是微小钙化,沿导管走 行呈线样及段样分布
• 约17%病变缺乏明显的微小钙化,乳腺X线片可 为阴性,或表现为结构扭曲、不对称致密影或肿 块,与一些良性增生性病变容易混淆
• 乳腺增强MRI对DCIS的检查具有高敏感性,与乳 腺X线摄影联合诊断,可以提高诊断准确性
精选版课件ppt
16
精选版课件ppt
17
钙化的形态和分布不能鉴别组织亚型
精选版课件ppt
8
精选版课件ppt
9
精选版课件ppt
10
• 少见X线表现: 结构扭曲 不对称致密影 结节性肿块
精选版课件ppt
11
精选版课件ppt
12
MR表现
动态增强乳腺MRI对检出DCIS具有高敏感性, 诊断依据主要参考增强的形态学特征评价, 平扫价值不大
4
• 乳腺X线筛查开展后,导管原位癌的发生率上升 至占乳腺恶性肿瘤中的30%。
• 患者发病年龄为30-87岁,中位年龄44岁。
• 患者常无任何临床症状和体征。在出现症状和体 征的患者组中,71.5%触及有肿块,边界不清, 大小0.5-9cm(中位2.5),与皮肤无粘连。 39.8%出现乳头溢液,其中约70%为血性溢液。 10.6%表现有乳头糜烂(Paget病)。约1/4病例 伴有乳腺疼痛不适
精选版课件ppt
பைடு நூலகம்
5
• 组织学主要分两型即粉刺型癌和非粉刺型 癌,前者比后者易有临床可触及的肿块, 较多伴有微浸润及淋巴结受累,这反映了 导管原位癌中的粉刺型有较强的侵袭性。
精选版课件ppt
6
X线表现
乳腺癌导管癌的治疗方案

一、概述乳腺癌导管癌是女性最常见的恶性肿瘤之一,占乳腺癌总数的70%以上。
导管癌起源于乳腺导管上皮细胞,分为导管原位癌和浸润性导管癌。
导管癌的治疗方案应根据患者的病情、年龄、身体状况等因素综合考虑,以下为乳腺癌导管癌的治疗方案。
二、治疗方案1. 早期导管癌(导管原位癌)(1)手术治疗:早期导管癌患者首选手术治疗,包括乳腺切除和乳房重建。
手术方式有全乳腺切除术、改良根治术和保乳手术。
(2)放射治疗:术后放疗是早期导管癌治疗的重要手段,可降低局部复发率。
放疗时间一般为术后4-6周。
(3)内分泌治疗:对于激素受体阳性的患者,内分泌治疗是重要的辅助治疗手段。
常用的内分泌药物有他莫昔芬、氟维司群、芳香化酶抑制剂等。
(4)化疗:早期导管癌患者化疗应用较少,仅在部分高危患者中考虑。
化疗药物有蒽环类药物、紫杉类药物等。
2. 浸润性导管癌(1)手术治疗:浸润性导管癌患者首选手术治疗,包括乳腺切除和乳房重建。
手术方式与早期导管癌相同。
(2)放射治疗:术后放疗是浸润性导管癌治疗的重要手段,可降低局部复发率。
放疗时间一般为术后4-6周。
(3)内分泌治疗:对于激素受体阳性的患者,内分泌治疗是重要的辅助治疗手段。
治疗方法与早期导管癌相同。
(4)化疗:浸润性导管癌患者化疗是重要的辅助治疗手段,可降低远处转移风险。
化疗方案应根据患者的病情、年龄、身体状况等因素综合考虑。
常用的化疗方案有CMF方案、CAF方案、FAC方案等。
(5)靶向治疗:针对HER2阳性的患者,靶向治疗是重要的辅助治疗手段。
常用的靶向药物有曲妥珠单抗、帕妥珠单抗等。
(6)免疫治疗:近年来,免疫治疗在乳腺癌治疗中逐渐受到关注。
针对PD-1/PD-L1通路的小分子抑制剂和抗体药物已取得一定疗效。
3. 复发或转移性导管癌(1)内分泌治疗:对于激素受体阳性的患者,内分泌治疗仍是重要的治疗手段。
(2)化疗:复发或转移性导管癌患者化疗是重要的治疗手段,可缓解症状、延长生存期。
乳腺导管癌能活多久时间

乳腺导管癌能活多久时间导管癌简介乳腺导管癌,是一种常见的乳腺癌类型,起源于乳腺的导管系统。
乳腺导管癌通常进展较慢,大多数患者能够通过早期发现和治疗来延长生存期。
然而,患者的预后很大程度上取决于病程、癌症分型和治疗方法。
早期乳腺导管癌早期乳腺导管癌通常指没有侵犯淋巴结或其他组织的癌症。
对于早期乳腺导管癌的治疗,最常见的方法是手术切除肿瘤组织。
手术后,通常会进行辅助治疗,如放疗、化疗或内分泌治疗,以预防或控制病情的进展。
根据统计数据,早期乳腺导管癌的5年生存率通常在90%以上。
这意味着在接受标准治疗后,大多数早期患者可以存活至少5年以上。
然而,需要注意的是,这些数据只是统计结果,并不能代表个体患者的预后情况,因为许多其他因素也会影响患者的生存期。
晚期乳腺导管癌晚期乳腺导管癌是指已经侵犯了淋巴结或其他组织的癌症。
晚期患者的预后相对较差,但仍然有治疗的机会。
对于晚期乳腺导管癌的治疗,通常采用综合治疗的方式,包括手术切除、放疗、化疗和靶向治疗等。
个体化治疗方案的选择会根据患者的生理状况、病情严重程度、癌症分子表型等因素进行调整。
晚期乳腺导管癌的预后通常较早期患者差,但有些患者仍然可以通过治疗来延长生存期。
对于患者来说,积极配合治疗、保持良好的生活方式、接受心理支持都是至关重要的。
乳腺导管癌的复发即使患者接受了成功的治疗并且进入了缓解期,乳腺导管癌仍有可能复发。
复发的时间和形式会有很大的差异,有些患者在治疗后几个月内就出现复发,而有些则在多年后才复发。
乳腺导管癌的复发通常发生在原发肿瘤的周围组织或其他部位,如淋巴结、骨骼、肝脏、肺等。
复发对于患者的预后通常会产生重要的影响,因此对于复发的患者,及时进行评估和治疗非常重要。
乳腺导管癌的生存期预测预测乳腺导管癌患者的生存期是一项复杂的任务,涉及到多个因素的综合评估。
目前,医生通常会根据患者的年龄、性别、既往病史、癌症分期、分子表型等因素来进行生存期预测。
对于早期乳腺导管癌患者,一般认为预后较好,生存期通常在5年以上。
乳腺导管原位癌护理课件

临床表现
乳腺肿块
乳腺导管原位癌在早期 可能无明显症状,随着 病情发展,可出现无痛
性肿块。
乳头溢液
部分患者可能出现乳头 溢液,多为血性或浆液
性。
皮肤改变
肿瘤侵犯皮肤时,可能 出现皮肤凹陷、橘皮样
改变等。
腋窝淋巴结肿大
晚期患者可能出现腋窝 淋巴结转移,表现为淋 巴结肿大、质地硬、活
动度差。
PART 02
乳腺导管原位癌的护理
REPORTING
心理护理
关注患者心理状态,提供心理支持
乳腺导管原位癌患者在治疗过程中可能会经历焦虑、恐惧和不安等情绪,护理人 员应关注患者的心理状态,提供心理支持和安慰,帮助患者树立战胜疾病的信心 。
饮食护理
提供营养均衡的饮食,避免刺激性食物
乳腺导管原位癌患者在治疗过程中需要保持营养均衡的饮食,多吃高蛋白、低脂肪的食物,如鱼、瘦 肉、豆类等,同时多吃蔬菜、水果,保持大便通畅。避免食用刺激性食物和饮料,如辛辣、油腻、烟 酒等。
疗。
建议
根据患者的具体情况选择合适的治疗方法,并遵循医生的建议进行治疗和随访,有助于 提高治愈率和生存率。
THANKS
感谢观看
REPORTING
日常护理指导
指导患者保持良好的生活习惯,预防并发症
护理人员应指导患者保持良好的生活习惯,如保持充足的睡眠、适当的运动等,同时注意个人卫生,预防感染等并发症的发 生。对于患者的病情状况和自身认知情况进行了解和评估,为患者提供个性化的护理方案。
PART 03
乳腺导管原位癌的治疗与 康复
REPORTING
乳腺导管原位癌护理 课件
REPORTING
• 乳腺导管原位癌概述 • 乳腺导管原位癌的护理 • 乳腺导管原位癌的治疗与康复 • 乳腺导管原位癌的预防与筛查 • 乳腺导管原位癌的常见问题与解答
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
这是最常见的典型中等级别DCIS,特点为筛状 结构和管腔内坏死。
B:平坦型,接近高级别 DCIS。两个相邻的管腔内衬 非典型性细胞,核分裂像罕见, 可见凋亡。
中等级别DCIS A:微乳头型。 微乳头形状不同,细胞呈中等 非典型,具有多形性核。
C、D:导管/部分导管有 微乳头状非典型性上皮增 生,注意管腔内分泌物, 不要与粉刺样坏死混淆。
乳腺导管原位癌
乳腺导管原位癌
定义:一种肿瘤性导管内病变,其特征是上皮细胞
增生显著,细胞异型性从轻微到明显,有发展成为
浸润性乳腺癌的倾向,但不一定会进展为浸润性乳
腺癌。导管原位癌(DCIS)被认为是一种前驱病变 (必然或者非必然),其发生到浸润性癌的相对危 险度为8-11,但有证据表明,保守治疗(彻底局部 根治)通常有效。
肿瘤大小、范围和分布
大小/范围是DCIS治疗中的重要因素。DCIS范围评 估很复杂,需要结合乳腺X线照相、标本X线片和组 织切片。 更为特别的是低级别DCIS主要呈连续生长,而高级 别DCIS可呈不连续(多灶)分布。 DCIS在乳腺分布一般为非多中心性,多中心是指肿 瘤累及两个或者更多远离的区域,其间有5cm的正常 腺体组织。
治疗 尽管乳房切除一直是DCIS的传统治疗方法,
但是许多患者似乎是治疗过度了,尤其是那 些X线检查发现的病变较小的患者。临床需 要仔细进行乳腺X线和病理学检查分析,以 确定患者是否适合做保乳治疗。 DCIS切除和放疗能有效降低复发率,有些病 变较小、级别低的患者仅需要单纯切除就行 了,但对于病变广泛着还是切除乳房。
预后及预测因素
复发 影响肿瘤复发的最重要的因素是肿瘤切除后瘤细胞 还存在,手术边缘的意义主要在于确定肿瘤细胞已 经完全切除。有实验表明粉刺样坏死是局部复发的 一个重要标志,也有实验表明实性和筛状生长方式 伴有切除边缘浸润是局部复发的征兆。在回顾性实 验中发现,DCIS进行乳腺保守治疗后,高级别核异 型、病变范围大、粉刺状坏死以及切除边缘浸润有 局部复发。
DCIS的分级:依据细胞核的异型程度、管腔内坏死、 核分裂象和钙化,通常将DCIS分为3级,多数分级 中以前两个特点为主要分类指标。即为低级别 DCIS、 中级别DCIS、高级别DCIS。
低级别DCIS 低级别DCIS的最低诊断标准
细胞学形态特点 1、单一性、一致性圆形细胞; 2、核/浆比轻微增大; 3、细胞核呈等距离或极规则分布; 4、圆形核; 5、可以出现或不出现染色质浓染; 结构特点 拱形、筛状、实性和/或微乳头型
E 扁平型伴有明显核多形性。
鉴别诊断
实性低级别的DCIS可被误认为小叶瘤变, E-cadherin和CK34βE12可以鉴别。 低级别E-cadherin100%阳性,CK34βE12 92%阴 性; 而小叶瘤变E-cadherin几乎均为阴性,CK34βE12 几乎均为阳性。 DCIS中导管周围出现单个细胞或者细胞团(微小浸 润)是常造成诊断困难,尤其是病变周围常有大量 淋巴细胞、浆细胞浸润,致使诊断困难。上皮肌上 皮标志物(P63、SMA、actin等)双重染求单个导管横切面全部被
特征性的细胞和结构替代,而有些则要求2个
管腔或者1个以上导管横切面直径达2mm。
微钙化常常呈砂砾体型。偶尔管腔内可出现 脱落细胞,但低级别DCIS不应该出现坏死和 粉刺样物质。
低级别导管原位癌,微乳 头型,微乳头缺乏纤维血 管轴心,一致的细胞排列 呈柱状,核为圆形。
低级别导管原位癌,微乳 头型,导管纵切面可见多 个微乳头
高度一致的细胞具有圆形核, 等距离分布呈筛网状。 筛状型。多个相邻的导管膨 胀,单一性一致的细胞呈筛 状增生,腔圆,分布规律。
中等级别DCIS
中等级别的DCIS常由形态类似于低级别的
DCIS的细胞构成,形成实性、筛状、或者微 乳头结构,但有些导管内出现坏死。有时核 的改变呈中等级别,偶见核仁和粗大染色质, 坏死可有可无。无定形或片状微小钙化的分 布与低级别DCIS相似,或呈现低级别DCIS 和高级别DCIS两者的特点。
B 粉刺型。增生细胞有显著 核非典型性和核分裂像,管 腔内有坏死。 高级别导管内原位癌。A 多个 管腔有无定形的微小钙化,周 边上皮细胞增生。
D 扁平型。高度间变细胞 取代正常乳腺上皮层。
C 扁平型。明显非典型 性细胞取代了正常乳腺 上皮。
F 扁平型。高度间变细 胞取代正常乳腺上皮层, 但无明显管腔内增生
F:大汗腺型。细胞核中度 多形性,丰富的粉红色、 颗粒状胞浆提示为大汗腺 细胞型。
E:透明细胞型。瘤细胞 胞浆透亮,细胞核有中度 多形性。
高级别DCIS
高级别DCIS通常>5mm,但即使是单个<1mm的小 导管,只要具有典型形态特点就足以诊断。病变由 高度异型的单层细胞增生组成,形成微乳头、筛状 或实性结构,核呈高级别改变,明显多形性,极向 差,染色质粗、不规则,核仁明显。常见核分裂, 但不是必备条件。特征性改变为粉刺样坏死,管腔 内有大量坏死性碎屑,其周围通常是大的多形性肿 瘤细胞增生呈实性。但是管腔内坏死也不是必备条 件,即使管腔内只被覆单层平坦型生长的高度异型 性细胞也足以诊断。无定型微小钙化常见。
