化工实验--实验热重-差热分析联用法研究CuSO4·5H2O的脱水过程
差热分析实验报告

差热分析实验报告一、引言差热分析(DTA)是在程序控制温度下测量物质和参比物之间的温度差与温度(或时间)关系的一种技术。
描述这种关系的曲线称为差热曲线或DTA曲线。
描述这种关系的曲线称为差热曲线或DTA曲线。
由于试样和参比物之间的温度差主要取决于试样的温度变化,因此就其本质来说,差热分析是一种主要与焓变测定有关并籍此了解物质有关性质的技术。
二、实验目的1、了解差热分析的基本原理和实验基本步骤。
2、测量五水硫酸铜和锡的差热曲线,并简单计算曲线峰的面积。
三、实验原理物质在加热或冷却过程中会发生物理变化或化学变化,与此同时,往往还伴随吸热或放热现象。
伴随热效应的变化,有晶型转变、沸腾、升华、蒸发、熔融等物理变化,以及氧化还原、分解、脱水和离解等化学变化。
另有一些物理变化,虽无热效应发生但比热容等某些物理性质也会发生改变,这类变化如玻璃化转变等。
物质发生焓变时质量不一定改变,但温度是必定会变化的。
差热分析正是在物质这类性质基础上建立的一种技术。
若将在实验温区内呈热稳定的已知物质(参比物)和试样一起放入加热系统中(图1),并以线性程序温度对它们加热。
在试样没有发生吸热或放热变化且与程序温度间不存在温度滞后时,试样和参比物的温度与线性程序温度是一致的。
若试样发生放热变化,由于热量不可能从试样瞬间导出,于是试样温度偏离线性升温线,且向高温方向移动。
反之,在试样发生吸热变化时,由于试样不可能从环境瞬间吸取足够的热量,从而使试样温度低于程序温度。
只有经历一个传热过程试样才能回复到与程序温度相同的温度。
图1加热和测定试样与参比物温度的装置示意图在试样和参比物的比热容、导热系数和质量等相同的理想情况,用图1装置测得的试样和参比物的温度及它们之间的温度差随时间的变化如图2所示。
图中参比物的温度始终与程序温度一致,试样温度则随吸热和放热过程的发生而偏离程序温度线。
当T S-T R=ΔT为零时,因中参比物与试样温度一致,两温度线重合,在ΔT曲线则为一条水平基线。
TG-实验三 热重法测定CuSO4

实验CuSO4·5H2O的热重分析演示实验一、实验目的1.熟悉热重分析的基本原理2.掌握热重分析的实验方法和数据处理方法3.了解CuSO4.5H2O 的脱水机理。
二、基本原理1.热重法原理:热重法(thermogravimetry,简称TG) 是研究在温度程序控制下,物质的质量与温度之间关系的一种方法。
只要物质在加热过程中有质量变化,如含水化合物的失水、无机和有机化合物的热分解、固体和液体物质的升华或蒸发等,就有可能运用热重法进行测定。
通常是将试样以恒定的升温速度加热时,连续测量试样的质量,所得质量m与温度T 的关系图称为热重曲线(TG 曲线)。
图1 某含结晶水物质的TG曲线图1 为某含结晶水物质的TG 曲线。
若在此温度范围内只发生失水反应,则曲线中质量保持基本不变的部分ab、cd、ef,分别代表试样、第一步及第二步失水产物稳定存在的温度区间。
若样品在某一温度开始失重,则在TG 曲线上出现下降的转折,失水率越大,转折线越陡,例如bc、de、fg 部分。
由图可知:第一步(1)第二步(2)依此类推。
用各步失水率与各种可能失水的理论失水率进行比较,即可写出各步失水方程式。
升温速度对热重分析影响很大。
如分解反应的起始温度和终止温度都随着升温速度的增加而升高。
就同一样品而言,升温速度越慢越有利于中间产物的检出。
一般选用速度为5~10 ℃/ min为宜。
2. 仪器装置进行热重分析的仪器称热天平,它既可加热样品,又可测定其质量。
热天平主要由天平测量系统、微分系统和温度控制系统组成,辅之以气氛和冷却风扇,测量结果计算机处理系统,见图2。
图.2 热天平结构示意图热重法的误差来源是多方面的,主要有支持器的空气浮力和炉内气体的对流。
前者往往表现为随温度增加,表观质量亦增加,就是所谓“浮力效应”;后者是由于炉内气体对流引起的表观增重或失重,主要取决于坩埚尺寸和形状。
为了减小这些误差,一般是在相同条件下,作热天平空载热重试验予以校正。
五水硫酸铜CuSO45H2O的脱水

利用校正软件对DSC仪进行校正
没有经过校正的金属铟熔融曲线
针对热阻进行校正后的熔融曲线
针对时间常数与热阻进行校正后的曲线
3、DSC曲线的数据处理方法
称量法: 误差 2%以内。 数格法: 误差 2%—4%。 用求积仪:误差 4%。 计算机: 误差 0.5%。
21
4、DSC法的应用
(1)纯度测定 利用Vant Hoff方程进行纯度测定。
硅酸锂玻璃DTA曲线
12
DTA分析在高分子材料方面的应用
物性测定
可用DTA和DSC技术测定 的高聚物的物性有:玻璃 化转变温度、熔融温度、 结晶转变温度、结晶度, 结晶速率、添加剂含量、 热化学数据(如比热容、熔 化热、分解热、蒸发热、 结晶热、溶解热、吸附与 解吸热、反应热等)以及分
子量等。
6、DTA曲线的解析 (1)含水矿物的脱水
——普通吸附水脱水温度:100-110℃ 。 ——层间结合水或胶体水:400 ℃内,大多数200或300 ℃内。 ——架状结构水:400 ℃左右。 ——结晶水:500 ℃内,分阶段脱水。 ——结构水:450 ℃以上。
五水硫酸铜(CuSO4.5H2O)的脱水
说明: 1、脱去4个结晶水 2、脱去1个结晶水 3-4、 CuSO4→CuO+SO3 样品用量: 虚线:78mg 实线:742mg
热通量式差示扫描量热法
——利用热电堆精确测量试样和参比物温度,灵敏度 和精确度高,用于精密热量测定。
16
功率补偿型 DSC的优点
Sample
Platinum Alloy PRT Sensor
Platinum Resistance Heater
Heat Sink
Reference
cuso4.5h2o
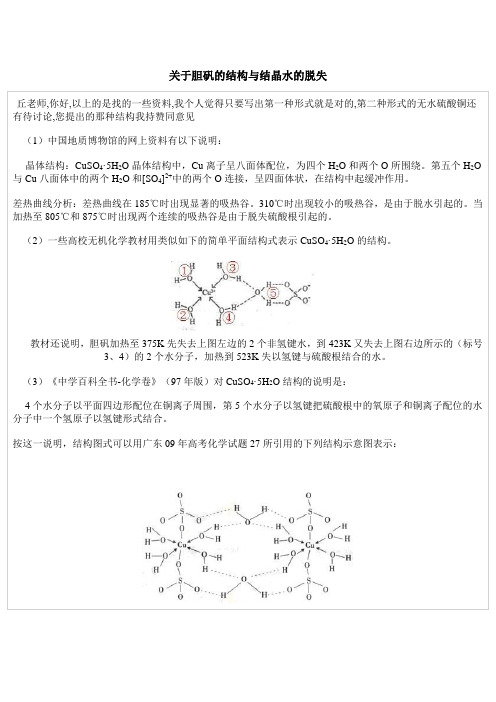
关于胆矾的结构与结晶水的脱失
丘老师,你好,以上的是找的一些资料,我个人觉得只要写出第一种形式就是对的,第二种形式的无水硫酸铜还有待讨论,您提出的那种结构我持赞同意见
(1)中国地质博物馆的网上资料有以下说明:
晶体结构:CuSO4·5H2O晶体结构中,Cu离子呈八面体配位,为四个H2O和两个O所围绕。
第五个H2O 与Cu八面体中的两个H2O和[SO4]2+中的两个O连接,呈四面体状,在结构中起缓冲作用。
差热曲线分析:差热曲线在185℃时出现显著的吸热谷。
310℃时出现较小的吸热谷,是由于脱水引起的。
当加热至805℃和875℃时出现两个连续的吸热谷是由于脱失硫酸根引起的。
(2)一些高校无机化学教材用类似如下的简单平面结构式表示CuSO4·5H2O的结构。
教材还说明,胆矾加热至375K先失去上图左边的2个非氢键水,到423K又失去上图右边所示的(标号
3、4)的2个水分子,加热到523K失以氢键与硫酸根结合的水。
(3)《中学百科全书-化学卷》(97年版)对CuSO4·5H2O结构的说明是:
4个水分子以平面四边形配位在铜离子周围,第5个水分子以氢键把硫酸根中的氧原子和铜离子配位的水分子中一个氢原子以氢键形式结合。
按这一说明,结构图式可以用广东09年高考化学试题27所引用的下列结构示意图表示:。
热分析教案邱金恒物理化学实验教案

白云石分解-气氛的影响
白云石分解为氧化镁和氧化钙的过程分为两个步骤。第一步为碳酸镁分解,第二步为碳酸 钙分解。在氮气气氛下两步分辨得不明显。但是在二氧化碳气氛下两步分解明显分开。其 原因在于,二氧化碳的存在延迟了分解反应,而且对第二步反应的影响尤其显著
非晶态金属
高温DSC仪器可用于检测非晶态金属的 玻璃化转变以及后续的一系列相变。
(2) 阶梯高度 代表经历一个物理或化学过程重量 变化的多少,由它可以计算中间产物或最终产 物的量以及结晶水分子数或水含量等,故阶梯 高度是进行定量计算的基础。
(3) 阶梯斜度 对于同一过程,它与实验条件有关; 而对于相同的实验条件,它取决于变化过程。 阶梯斜度越大,说明对应过程的变化速率越快,
反之,则慢。由于阶梯斜度与反应速率有关, 由此可以求得动力学参数。
熔点与熔融热焓(DSC)
根据熔点,可以对结晶高分子进行大致的定性鉴别。 根据熔点,可以判断体系是无规共聚物还是共混物,以及共混的程度。 根据熔融峰面积,可以计算部分结晶样品的结晶度。 结晶性聚合物共混组成的测定(DSC) 图中对HDPE/PP 共混物的熔融过程进行了测定,可以清楚地看到熔融过程分为两
换句话说,试样在物理变化或化学反应时产生 的热量变化,由于及时输入电功率得到补偿。 所以实际记录的是试样和参比物下面两只加热 器电热补偿的热功率之差随时间t的变化。在程 控线性升温中,也即热功率之差随时间t(或温 度T)的变化,其积分峰面积对应的即为热效应 。 若事先用已知相变热的试样(如纯金属锡、铅、 铟等)的熔化来标定仪器常数,则峰面积就可 以得到 ΔH的绝对值。
1)热重法(TG,Thermogravimetry)
在热重法中,被测物理量即为试样受热反应而 产生的质量变化。许多物质在加热过程中若发 生如熔化、蒸发、升华、吸附等物理变化,或 是脱水、解离、氧化、还原等化学变化,即引 起质量改变。在程序控温的情况下,温度T与 时间t成线性关系。以质量对时间t或温度T作图, 得热重曲线(TG曲线)。TG曲线所提供的信 息主要有:物理或化学过程对应的质量变化以 及温度区间。热重法使用的基本仪器为热天平, 一般包括天平、加热炉、控温系统、记录系统 等几个部分。有的热天平还配有通入气氛或真 空装置。
CuSO4热重分析讲义

CuSO4·5H2O的热重分析一、实验目的1、学习热重分析仪的使用操作,了解热重分析仪的构造。
2、用热重分析仪对CuSO4·5H2O进行热重分析。
3、掌握热重分析仪的基本原理和分析方法。
二、热重分析仪工作原理热重法是在程序温度(升/降/恒温及其组合)过程中,由天平连续测量样品质量随温度(或时间)的变化并将数据传递到计算机中对质量/温度(或时间)进行作图,得到热重曲线。
TG曲线的纵坐标为质量,横坐标为温度(或时间)。
从热重曲线可得到试样组成、热稳定性、热分解温度、热分解产物和热分解动力学等有关数据。
三、影响热重分析的因素1、试样量和试样皿热重法测定,试样量要少,一般2~5mg。
应控制在10mg以内。
试样皿的材质,要求耐高温,对试样、中间产物、最终产物和气氛都是惰性的,即不能有反应活性和催化活性。
通常用的试样皿有铂金的、陶瓷、石英、玻璃、铝等。
2、升温速率升温速度越快,温度滞后越严重,使曲线的分辨力下降,会丢失某些中间产物的信息。
3、气氛的影响热天平周围气氛的改变对TG曲线影响显著,应在惰性气氛中进行。
一般选择氮气。
4、挥发物的冷凝分解产物从样品中挥发出来,往往会在低温处再冷凝,如果冷凝在试样皿上会造成测得失重结果偏低,而当温度进一步升高,冷凝物再次挥发会产生假失重,使TG 曲线变形。
解决的办法,一般采用加大气体的流速,使挥发物立即离开试样皿。
5、浮力浮力变化是由于升温使样品周围的气体热膨胀从而相对密度下降,浮力减小,使样品表观增重。
实用校正方法是做空白试验,(空载热重实验),消除表观增重。
四、TG失重曲线的处理和计算1、TG曲线关键温度表示法(1)典型热重图谱示例TG起始点:热稳定性的表征DTG 峰温:质量变化速率最大的温度点DTG的作用(2)CuSO4·5H2O的热重曲线分析:CuSO4·5H2O热重失水过程第一步:CuSO4·5H2O→CuSO4·3H2O + 2H20第二步:CuSO4·3H2O→CuSO4·H2O + 2H20第三步:CuSO4·H2O→CuSO4 + H20T1→T2:第一步失重为W0-W1,在T2形成稳定相CuSO4·3H2O, 其失重百分数为:T2→T3,在T3生成CuSO4·H2OT3→T4,在T4 CuSO4生成。
差热与热重分析研究五水硫酸铜的脱水过程与差示扫描量热法

差热与热重分析研究五水硫酸铜的脱水过程与差示扫描量热法差热与热重分析研究CuSO4•5H20的脱水过程与差示扫描量热法一.实验目的(1)掌握差热分析法和热重法的基本原理和分析方法,了解差热分析仪,热重分析仪,差热热重联用仪的基本结构,熟练掌握仪器操作。
(2)运用分析软件对测得数据进行分析,研究CuSO4•5H20的脱水过程。
(3)了解差示扫描量热法的基本原理和差示扫描量热仪的基本结构,熟练掌握仪器操作。
二.实验原理1.差热分析法物质在受热或冷却过程中,当达到某一温度时,往往回发生熔化、凝固、晶型转变、分解、化合、吸附、脱附等物理或化学变化,并伴随着焓的改变,因而产生热效应,其表现为体系与环境(样品与参比物)之间有温度差。
差热分析是在程序控温下测量样品和参比物的温度差与温度(或时间)相互关系。
在加热(或冷却)过程中,因物理-化学变化而产生吸热或者放热效应的物质,均可运用差热分析法进行鉴定。
2.热重法物质受热时,发生化学反应,质量也随之改变,测定物质质量的变化就可研究其过程。
热重法(TG)是在程序控制温度下,测量物质质量与温度关系的一种技术。
热重法的主要特点是定量强,能准确地测量物质的变化及变化的速率。
从热重法派生出微商热重法(DTG),即TG 曲线对温度(或时间)的一阶导数。
DTG曲线能精确地反映出起始反应温度,达到最大反应速率的温度和反应终止温度。
在TG曲线上,对应于整个变化过程中各阶段的变化互相衔接而不易分开,同样的变化过程在DTG曲线上能呈现出明显的最大值,故DTG能很好地显示出重叠反应,区分各个反应阶段,而且DTG曲线峰的面积精确地对应着变化了的质量,因而DTG能精确地进行定量分析。
现在发展起来的差热-热重(DTA-TG)联用仪,是将DTA与TG的样品室相连,在同样气氛中,控制同样的升温速率进行测试,同时得到DTA和TG曲线,从而一次测试得到更多的信息,对照进行研究。
3.差示扫描量热法差示扫描量热法(简称DSC)是在程序升温的条件下,测量试样与参比物之间的能量差随温度变化的一种分析方法。
差热-热重分析法测定硫酸铜的热分析图谱实验报告

差热-热重分析法测定硫酸铜的热分析图谱一、实验目的1.了解差热分析法、热重分析法的基本原理。
2.了解差热热重同步热分析仪的基本构造并掌握使用方法。
3.正确控制实验条件,并学会对热分析谱图进行定性分析和定量处理。
二、实验原理1.差热分析法(Differential Thermal Analysis,DTA)差热分析是在程序控制温度下,测量试样与参比物(一种在测量温度范围内不发生任何热效应的物质)之间的温度差与温度关系的一种技术。
许多物质在加热或冷却过程中会发生熔化、凝固、晶型转变、吸附、脱附等物理转变及分解、化合、氧化还原等化学反应。
这些变化在微观上必将伴随体系焓的改变,从而产生热效应,在宏观上表现为该物质与外界环境之间有温度差。
选择一种对热稳定的物质作为参比物,将其与试样一起置于可按设定速率升温的热分析仪中,分别记录参比物的温度以及试样与参比物间的温度差。
以温差对温度作图就可以得到差热分析曲线,简称DTA曲线。
2. 热重法(Thermogravimetry,TG)热重法是在程序控制温度下,测量物质的质量变化与温度关系的一种技术,其基本原理是热天平。
热天平分为零位法和变位法两种。
变位法,就是根据天平梁的倾斜度与质量变化呈比例的关系,用差动变压器等检知倾斜度,并自动记录。
零位法,是采用差动变压器法、光学法或电触点法测定天平梁的倾斜度,并用螺线管线圈对安装在天平系统中的永久磁铁施加力,使天平梁的倾斜复原。
由于对永久磁铁所施加的力与质量变化呈比例,这个力又与流过螺线管的电流呈比例,因此只要测量并记录电流,便可得到质量变化的曲线,以质量对温度作图就可以得到热重曲线,简称TG曲线。
三、实验用品1.仪器日本SHIMADZU DTG-60差热-热重同步热分析仪(TA-60工作站),镊子,坩埚,研钵。
2.药品参比物:α-AL2O3(A.R,原装进口)试样:CuSO4·5H2O(A.R)四、操作步骤1、熟悉差热-热重同步热分析仪的组成及相应旋钮的作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2)差热分析法 Differential Thermal Analysis
图 典型的DTA曲线
图中基线相当于DT=0, 样品无热效应发生,向上 和向下的峰反映了样品的 放热、吸热过程。
① 零线:理想状态ΔT=0的线; ② 基线:实际条件下试样无热效应时的曲线部分; ③ 吸热峰:TS<TR ,ΔT<0时的曲线部分; ④ 放热峰:TS>TR , ΔT>0时的曲线部分; ⑤ 起始温度(Ti):热效应发生时曲线开始偏离基 线的温度; ⑥ 终止温度(Tf):曲线开始回到基线的温度; ⑦ 峰顶温度(Tp):吸、放热峰的峰形顶部的温度, 该点瞬间d(ΔT)/dt=0; ⑧ 峰高:是指内插基线与峰顶之间的距离,表示试 样与参比物之间最大温差; ⑨ 峰面积:是指峰形与内插基线所围面积; ⑩ 外推起始点:是指峰的起始边斜率最大处所作切 线与外推基线的交点,其对应的温度称为外推起始 温度(Teo);根据ICTA共同试样的测定结果,以外 推起始温度(Teo)最为接近热力学平衡温度。
钙、锶、钡水合草酸盐的TG曲线与DTG曲线(a)DTG曲线;(b)TG曲线 1、热重曲线中质量(m)对时间(t)进行一次微商从而得到dm/dt-T(或t)曲线,称为微商热重
(DTG)曲线。 2、 它表示质量随时间的变化率(失重速率)与温度(或时间)的关系。 3、 微商热重曲线与热重曲线的对应关系是:微商曲线上的峰顶点(d2m/dt2=0,失重速率最大值
点)与热重曲线的拐点相对应。微商热重曲线上的峰数与热重曲线的台阶数相等,微商热重 曲线峰面积则与失重量成正比。
热重曲线
(2)差热分析法 Differential Thermal Analysis
在程序控制温度下,测量物质与参比物之间的温度差随温 度变化的一种技术。
物质在受热或冷却过程中发生的物 理变化和化学变化伴随着吸热和放 热现象。如晶型转变、沸腾、升华、 蒸发、熔融等物理变化,以及氧化 还原、分解、脱水和离解等等化学 变化均伴随一定的热效应变化。
2、 到达一定温度(即CaC2O4•2H2O的分解温度)结晶水释放完毕,温度升高,重量不会改变, 出现第一个平台,它对应于DTA或DSC上的第一个吸热峰,(分解温度即峰顶部温度)由于原联 接于草酸钙的被束缚的结晶水脱离需外解提供能量,所以要吸热。
(1)热重法 Thermogravimetry, TG
是在温度程序控制下,测量物质质量与温度之间的关 系的技术。
热重法
热重装置结构示意图
(1)热重法 Thermogravimetry, TG
由热重法记录的重量变化对温 纵坐标m为质量,以mg或剩余百分数%表示;
度的关系曲线称热重曲线 (TG曲线)。
横坐标T为温度,热力学温度(K)或摄氏温度
A(固)
(℃);
B(固)+C(气)
Ti 表示表观质量变化的起始温度;
Tf表示终止温度,即累积质量变化到达最大值时
的温度;
Tf-Ti表示反应区间,即起始温度与终止温度的温 度间隔;
曲线中AB 和CD,即质量保持基本不变的部分叫
作平台,BC部分为台阶。
热重曲线
微商热重(DTG)曲线
差热分析
(2)差热分析法 Differential Thermal Analysis
Furnace
Sam ple
.
Q PR
Ref er.
DT
差热分析的基本原理,是把被测试样和一种中性物(参比物)置放在同样的热条 件下,进行加热或冷却,在这个过程中,试样在某一特定温度下会发生物理化学 反应引起热效应变化 ,即试样侧的温度在某一区间会变化,不跟随程序温度升 高,而是有时高于或低于程序温度。而参比物一侧在整个加热过程中始终不发生 热效应,它的温度一直跟随程序温度升高,这样,两侧就有一个温度差,然后利 用某种方法把这温差记录下来,就得到了差热曲线。
度)等
逸出气分析
(EGA – MS, FTIR)
几种常见的热分析法:
1. TG热重法。在程序控制温度下,测量物质的质 量与温度或时程序控制温度下,测量被物 质和参比物的温度差与温度关系的一种方法(即 DTA)。
3. DSC差示扫描量热法。在程序控制温度下,测量 输入到测量物质和参比物的功率差与温度的关系 的一种方法(即DSC)。由于DSC直接测量的是热 量,所以是一种量热法。“差示”是指除用试样 外,还要用参比物。扫描是指温度扫描。即温度 从低到高或从高到低的动态扫描。
热分析主要用于研究物理变化 (晶型转变、熔融、升华和吸附 等)和化学变化(脱水、分解、 氧化和还原等)。热分析不仅提 供热力学参数,而且还可以给出 有一定参考价值的动力学数据。 热分析技术
热分析技术分类
差热分析与差示扫 描量热法
(DTA, DSC)
热重分析法
(TGA)
热机械分析法 (TMA)
介电分析法 (DEA)
差热分析
TG - DTA 同步热分析
W W M M 0
1
CaC2O4 2H2O
CaC2O4
W0
M CaC2O4 2H2O
W0 W2 MCaC2O4 2H2O MCaCO3
W0
M CaC2O4 2H2O
草酸钙的TG与DTA曲线
1、 在0∽800℃范围内DTA有两个峰(另一个超出800℃)一个吸热,另一个放热。而在 0∽800℃范围内,热重曲线上有两个平台。在100℃前为斜坡,产生原因是粉末草酸钙样品吸附 的少量水份随着温度升高逐渐释放出来,使样品重量减轻,当温度继续升高,结晶水也会释放出 来。
导热系数仪 热流法 激光散射法
测量物理与化学过 程(相转变,化学 反应等)产生的热
效应; 比热测量
测量由分解 、挥发、气 固反应等过 程造成的样 品质量随温 度/时间的
变化
测量样品的维度变 化、形变、粘弹性 、相转变、密度等
测量介电常数、 损耗因子、导电 性能、电阻率( 离子粘度)、固 化指数(交联程
热重-差热分析联用法研究 CuSO4·5H2O的脱水过程
一、实验目的:
1.熟悉热重和差热分析法的基本原理。 2.掌握热重-差热分析联用的实验方法和数据
处理方法。 3.了解CuSO4·5H2O 的脱水机理。
二、方法原理:
国际热分析协会(International Confederation for Thermal Analysis ICTA) 1977年对热分析技术的定义: “热分析是在程序控制温度下测量物质的物理性质与温度关系 的一种技术”
