有机化学杂环化合物a
有机化学---第17章 杂环化合物

、 内酯、环状酸酐等。
环为平面型共轭体系,环内π电子数符合4n+2规 则,具有一定芳香性的杂环化合物。
2
2、杂环化合物的分类
五元杂环, 如 单杂环 六元杂环, 如 杂环化合物 稠杂环 两个以上单杂环稠并
N N N H
O N
N H
S
苯环与单杂环稠并, 如 N H
N
N
3
3、杂环化合物的命名 (1)音译法 ——在同音汉字左边 + 口字旁
N ..
H2SO4,HgSO4 220℃
N
N
NO2
β-硝基吡啶
SO3H
β-吡啶磺酸
34
当吡啶环上连有供电子基团时,将有利于亲电取
代反应的发生;反之,就更难以进行亲电取代反应。
NO2
HNO3,H2SO4
H3 C N CH3
100℃
H3 C
N
CH3
吡啶环也象硝基苯一样,不能发生F―C烷基化和 酰基化反应。
吲哚具有芳香性,亲电取代反应发生在吡咯环上; 吲哚亲电取代反应的活性比苯高,但比吡咯低。 亲电取代反应的位置:
5 4 3 7
E+
1
苯 环
6
N H
2
吡咯环
26
进攻 C2 N H + E
+
进攻 C3
只有一个带有完 E N 2 H 整苯环的共振杂化体。 H 3 E 3 E H H + + N N H H
OH
6
S1
苯并呋喃
1
苯并吡咯 喹啉
N
9 7 8
苯并噻唑
N N
3
5 4
HO
N H
OH
12 杂环化合物《有机化学》

Br
(80%)
O
O Cl2
-40℃ , CH3COOH
Cl
O
(64%)
Br2
CH3COOH
Br
S
(78%)
S Cl2
50℃
Cl
S
(36%)
I2,HgO C6H6, 0℃
I
S
(70%)
吡咯极易卤化生成四卤吡咯。
(2)硝化
呋喃和吡咯很易被氧化,遇无机酸容易发生聚合, 因而不能用硝酸硝化。通常用比较温和的非质子硝化试 剂,如用硝酸乙酰酯
离域能 呋喃、吡咯和噻吩的离域能分别为: 67 kJ·mol-1、 88 kJ·mol-1和117 kJ·mol-1 比苯的离域能(150.5 kJ·mol-1 )低,但比大多数共 轭二烯烃的离域能(约12~28 kJ·mol-1 )要大得多。
芳香性:苯>噻吩>吡咯>呋喃
2、 呋喃、噻吩和吡咯化学性质
有机化学 第12章 杂环化合物
基本要求:
• 1.掌握呋喃、吡咯、噻吩、吡啶、嘧啶、 喹啉、吲哚、嘌呤及其衍生物的命名。
• 2.掌握呋喃、吡咯、噻吩、吡啶的结构 与芳香性的关系,结构与亲电取代反应 活性的关系。
• 3.掌握吡咯和吡啶的酸碱性,呋喃、吡 咯、噻吩、吡啶的亲电取代反应(卤代、 磺化),还原反应,吡啶侧链的氧化反应。
COOH
(烟酸 )
N
HNO3
COOH
COOH
N
△
COOH △
N
N
吡啶可被催化加氢或用乙醇和钠还原而成为六氢吡啶。
Na + C2H5OH
N
或 H2/Pt ,0.3MPa,25℃
N H
常见吡啶衍生物
有机化学-第十七章 杂环化合物
Br
Br
N H
Br2
N H
乙 醇
Br
Br
噻吩对氧化剂稳定,可用一般的硝化剂和磺化剂
H2SO4 , 25℃
S
SO3H S
α-噻吩磺酸
呋喃和吡咯对及氧化剂都比较敏感,应使用特殊的试
剂乙酰硝酸酯进行硝化,使用吡啶三氧化硫进行磺化。
+
N
SO3
-
SO3H O
O CH3 C ONO2 (CH3CO)2O,-10 ℃
O
α-呋喃磺酸
N H
N H
α-硝基吡咯
NO2
吡啶比苯难发生亲电取代反应,反应条件要求和硝基
苯差不多;在发生反应时取代基主要进入β-位。
HNO3 , H2SO4
NO2 N
β(3)-硝基吡啶
N
300 ℃
吡啶的氯代要用AlCl3催化且要加热; 吡啶的磺化要用发烟H2SO4并要加热;
(2) 氧化反应 吡啶环对氧化剂稳定,比苯环难氧化。
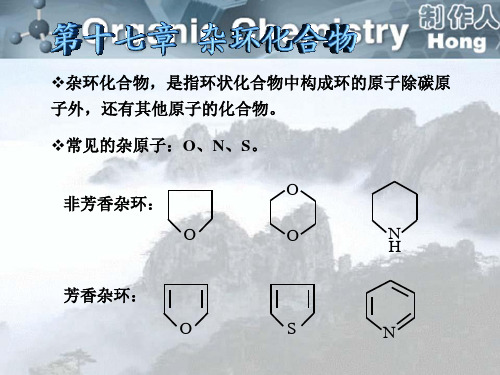
杂环化合物,是指环状化合物中构成环的原子除碳原
子外,还有其他原子的化合物。
常见的杂原子:O、N、S。 非芳香杂环:
O O O N H
芳香杂环:
O
S
N
17-1 分类和命名
一、杂环化合物的分类
单杂环:
{
五元杂环 六元杂环
O
呋喃
N H
吡咯
S
噻吩
N S
噻唑
N N H
咪唑
N
N
吡啶
N
嘧啶
稠杂环:
{
N
1 6 5
N N
3 4
N7
8
N2
2
N9 H
有机化学第12章 杂环化合物

生物碱
存在于植物体内的一类碱性含氮有机化合物称为生物碱。
HO O
CH3 N H O-C-CH 952年确定结构。)
H O-C H
C H3O
颠茄碱(阿托品)
CH=C H2
N N CH3
N 金鸡纳碱(奎宁)
烟碱(尼古丁)
有芳香性
有芳香性
12.3 五元杂环化合物
12.3.1 呋喃
存在于松木焦油中,为无色液体,难溶于水,易溶于有机溶剂。其蒸汽遇 有被盐酸浸过的松木时,即呈绿色(叫松木反应,鉴别呋喃的存在)。
工业上用糠醛(-呋喃甲醛)制备:
(1)呋喃的制备
• 实验室采用糠酸加热脱羧制得:
(2)化学性质
呋喃具有芳香性,较苯活泼,容易发生取代反应;还有一定程度的不饱和 化合物的性质(发生加成反应)。
芳香性强弱的次序
苯 > 噻吩 呋喃 112 离域能:152
取代反应活性的次序
>
吡咯
>
88
62 KJ/mol
位电子 云密度 -0.10
• 吡咯 > 呋喃 > 噻吩 > 苯 -0.03 -0.06 0 (不一致)
(2)六元杂环化合物——吡啶
氮原子与碳原子处在同一平面。 吡啶的结构与苯相似,符合休克尔规则,具有芳香性。
第12章 杂环化合物
一般把除碳以外的成环原子叫杂原子,常见的杂原子有氧、硫和氮:
• 环系中可含一个、两个或多个相同或不同的杂原子。
•环可以有三元环、四元环、五元环、六元环或更大,可以 是稠合的环。
• 杂环化合物种类繁多,约占全部已知有机化合物的 三分之一。
• 已经学过的杂环化合物:
• 本章介绍的是具有不同芳香性的杂环化合物(简称芳杂 化合物)。
有机化学 第二十章杂环化合物
2.加成反应 呋喃、吡咯催化氢化,失去芳香性,得到饱和 的杂环化合物:
四氢吡咯为有机碱,广泛存在于自然界中的某 些生物碱中。
四氢呋喃是重要的有机溶剂。
噻吩中含硫,会使一般的催化剂中毒,氢化时必 须采用特殊催化剂。
工业上通常用开链化合物合成四氢噻吩。四氢噻 吩氧化成四亚甲基砜(或环丁砜),它是一个重要的 溶剂。
(6 )取代呋喃、噻吩、吡咯的定位效应
一取代呋喃、噻吩及吡咯进一步取代,定位效 应应由环上杂原子的α定位效应及取代基共同决定。 例如,3位上有取代基,第二个基团进入环的1位或5 位(即α位),是1位还是5位又由环上原有取代基 的性质决定◦例如,噻吩-3-甲酸溴代,生成5-溴噻 吩-3-甲酸。羧基是间位定位基,因此第二个基团进 入5位即羧基的间位。
一、五元杂环
五元环中含两个或两个(至少有一个氮原子) 以上的杂原子的体系称唑(azole)。如果杂原子不 同,则按氧、硫、氮的顺序编号。
二、六元杂环 三、稠杂环
20.2 五元单杂环化合物
一、呋喃、噻吩、吡咯的物理性质和结构
呋喃、噻吩、吡咯是最重要的含一个杂原子的 五元杂环化合物。它们的重要性不在于它们的单体, 而是它们的衍生物。它们的衍生物不但种类繁多, 而且有些是重要的工业原料,有些具有重要的生理 作用。
叶绿素与蛋白质结合,存在于植物的叶和绿色 的茎中,叶绿素利用卟啉环的多共辗体系易吸收紫 外光,成为激发态,促进光合作用,使光能转变为 化学能。
血红素存在于哺乳动物的红血球中,它与蛋白 质结合成血红蛋白,血红素中的Fe2+具有空的d轨道, 可以可逆地络合氧,在动物体内起到输送氧气的作 用。一氧化碳会使人中毒,其原因之一是因为它与 血红蛋白结合的能力强于氧,从而阻止了血红蛋白 与氧的结合。
有机化学第十五章 杂环化合物

+
N
N
NO 2
N
N S O 3H
Br
B r2/H 2 S O 4
H+
+
N
N
B r 2 /CCl 4
OH -
Br Br
N
K MnO 4 /H +
CO 2 H
N
CO 2 H
H 2/P t N H
易发生亲电取代和氧化
5
8
N
易发生亲核取代和还原3
N +C3 H I
N
+ N C3 H I N
N
Br
+Br2 NH 2 N
1、亲电取代——困难:发生在β 位
混 酸 P hH室 温 P hN2O
混 酸
N2O
3 0 0 ℃ /1 天
N
N
H2SO4/H+g
220℃
N
N
SO3H
C3H N
H 2SO 4/K N3 O
100℃
C3H
C3H N
N2 O C3H
Br2/HcA Br NH 2 N
N—氧化物 δ+
NH 2 N
δ+
N
N+
吡唑和咪唑的分子聚合和互变异构:
b.p
水溶性
N
188
N
H N 263
N H
11 易溶
N
N
H
H
N
N
二聚体
N HN
N HN
N N
H
多聚体
嘌呤
N
N
N
NH
N
N
H 9—H
NH2
N
杂环化合物的命名
杂环化合物(hetero cyclic compounds)属于环状有机化合物的一种,是指由碳原子和非碳原子共同介入组成环的环状化合物.这种介入成环的非碳原子称为杂原子.杂原子年夜都属于周期表中Ⅳ、Ⅴ、Ⅵ三族的主族元素,最罕见的是氮、氧、硫,其中以氮原子最为多见.依照这个界说,在前面一些章节中曾讨论过的内酯、交酯、环状酸酐和内酰胺等,也应属于杂环化合物.但这些化合物通常容易开环成原来的链状化合物,其性质又与相应的链状化合物相同,因此一般不把它们列入杂环化合物的范围.有机化学中所要讨论的杂环化合物,一般都比力稳定,不容易开环,有些杂环化合物的性质与苯、萘等相似,具有分歧水平的芳香性.杂环化合物的种类繁多,数目庞年夜.据统计,在已发现的几百万种有机化合物中,杂环化合物约占总数65%以上.这说明杂环化合物在有机化学的各个研究领域中都占有相当重要的位置.杂环化合物广泛地存在于自然界中,动植物体内所含的生物碱、苷类、色素等往往都含有杂环结构.许多药物,包括天然药物和人工合成药物,例如头孢菌素(抗生素)、羟基树碱(抗肿瘤药)、小檗碱(抗菌药)等也都含有杂环.与人类生命活动及各种代谢关系非常密切的物质──核酸,其碱基部份也含有杂环.近几十年来,在杂环化合物的理论和应用方面的研究不竭取得重年夜进展,许多天然杂环化合物,包括维生素B那样结构极其复杂的杂环分子,已经能够用人工方法进行全合成;同时,人类也合成了许多自然界不存在的杂环化合物.这些化合物作为药物,作为超导资料,作为工程资料,也都具有很重要的意义.之阿布丰王创作时间:二O二一年七月二十九日杂环化合物的分类杂环化合物的种类繁多,其罕见的分类方法按所依据的原则分歧,可分为按分子所含环系的几多及其连接方式分类和按分子中所含π电子的状态和数量几多分类两种.按分子所含环系的几多及其连接方式分类按分子中所含π电子的状态和数量几多分类依照这种方法可将杂环化合物年夜致分为四类,即:(1)多π-(π-excessive)杂环.以苯分子为参照标准,凡是环中π电子云密度年夜于苯,并像苯一样有一个闭合的环状共轭体系的杂环化合物属于此类,如:呋喃、吡咯、噻吩等.这类杂环的主要特征是亲电取代反应活性比苯高.(2)缺π-(π-deficient)杂环.这类杂环也同样具有闭合的环状共轭体系,但环中π电子云密度小于苯,其亲电取代反应活性比苯低.吡啶、嘧啶等属于此类.(3)烯型杂环.这类杂环不含有闭合的环状共轭体系,只具有孤立的π键或不连续的共轭π键.α-呋喃、γ-吡喃等属于此类.(4)烷型杂环.这类杂环不含不饱和键,是完全饱和的杂环.四氢呋喃、六氢吡啶等属于此类.另外,,实际分类时,可将分歧方法结合进行,一般分为五元杂环、六元杂环、稠杂环等几类.稠杂环化合物的结构较为复杂,可以是芳环和杂环相稠合,也可以是杂环和杂环相稠合,还可能是含有共用杂原子的稠杂环.杂环化合物的命名杂环化合物的命名比力复杂,其名称应包括基本母核名称和环上取代基的名称这两部份.取代基的命名原则基本上与前面各章所介绍的相同,本章主要介绍有特命名称的杂环母核以及无特命名称的稠杂环母核的命名.有特定译音名称杂环母核的命名许多杂环化合物都有英文俗名或半俗名,这些俗名习用已久,有些已作为特命名称为IUPAC的系统命名法所收载.对此类杂环,可采纳译音命名法命名,即依照该杂环的英文特命名称选用发音相同或相似的汉字,并在左边加“口”字偏旁,作为其名称.例如:这类杂环母核的编号都采纳固定的方法,其一般原则如下:(1)含一个杂原子的单杂环.编号用阿拉伯数字,以杂原子为起编点,同时应使取代基所在碳原子有最低位次.,再其次为γ位.(2.如果其中一个杂原子连有氢或取代基,则应从此杂原子开始编号,并使其他杂原子有最低位次.一般杂环母核都含有最多的非聚积双键,当杂环上某个不饱和碳原子再额外连接氢原子(即由=CH酿成—CH)时,这个氢就叫“额外氢”或“指示氢”.指求氢位置分歧的异构体命名时,应以所在位次加“H”(用斜体年夜写),放在母体名称之前.例如:(3)含有分歧杂原子的单杂环编号时,一般按O、S、N的顺序优先选择起编点,例如:(4)有特定译音名称的稠杂环一般按相应芳环的编号方式编号(嘌呤除外).例如:嘌呤不按上述原则,则按自己的习惯方式编号..例如:无特定译音名称稠杂环化合物的命名对这类杂环化合物,可将其母核分解成两个有特命名称的环系,并将其中一个定为基本环,另一个定为附加环.命名时将附加环名称放在前,基本环名称放在后,两环名称间缀以方括号,方括号内分别用阿拉伯数字和小写英文字母暗示两环的稠合情况.现就其具体方法说明如下:基本环的选择方法稠合方式的暗示方法稠合方式的暗示方法关于基本环的选择,主要按以下几条规则依次考虑.①由杂环和芳环构成的稠杂环,优先选择杂环作基本环.如还有选择时,应优先选择环数较多,且有特命名称的杂环作基本环.例如:Ⅰ中噻唑为基本环,苯为附加环,称为苯并噻唑;Ⅱ称为苯并异喹啉(不称萘并吡啶).②由杂环和杂环构成的稠杂环,环年夜小分歧时,优先选择年夜环作基本环;环年夜小相同时,按N、O、S的顺序优先选择基本环.例如:Ⅲ的基本环是吡喃,称呋喃并吡喃;Ⅳ的基本环是呋喃,称噻吩并呋喃.中杂原子数目分歧时,含杂原子数目多的环优先;数目相同时,则含杂原子种类多的环优先.例如:Ⅴ应称吡啶并哒嗪(杂原子数目多的优先);Ⅵ应称咪唑并噻唑(杂原子种类多的优先);但Ⅶ应称噻吩并吡咯(含氮杂环优先).④环的年夜小、杂原子的数目、种类都相同时,优先选择稠合前杂原子编号较小的杂环为基本环.例如:Ⅷ应称吡嗪并哒嗪.⑤含有共用杂原子的稠杂环,应视为两环都含有该共用杂原子来进行选择.例如:Ⅸ应称为咪唑并噻唑(含杂原子种类多的优先).为了将基本环与附加环的稠合方式表达清楚,应先将两部份各自按编号原则编号,再将基本环的每条边按编号方向依次用a、b、c、d……代表,然后将附加环稠合边原子序号写在前,基本环稠合边字母写在后,二者之间用“-”隔开,一起放到两环系名称之间的方括号内.附加环稠合边原子序号在书写时应与基本环字母次第的方向一致,两者顺序相同时小数字在前,年夜数字在后;反之则年夜数字在前,小数字在后.例如:该化合物两环稠合边编号方向相反,命名时应使其一致,所以应称为咪唑并[2,1-b]噻唑,而不称咪唑并[1,2-b]噻唑.又例如前面所见到的Ⅰ应称为苯并[d]唑(苯环的稠合边原子序号在此无需标出),Ⅳ称为噻吩并[2,3-b]呋喃,Ⅵ称为咪唑并[5,4-d]噻唑,Ⅷ称为吡嗪并[2,3-d]哒嗪.当此类化合物分子中存在有其他取代基或官能团时,需要对整个化合物进行统一编号(此编号方式与暗示稠合方式的编号无关),其编号方式应注意以下几点:①应尽可能使所有杂原子都有最低位次,其次按O、S、NH、N 的顺序选择优先编号的杂原子,例如:②共用碳原子一般不编号(个别例外),但在满足上一条规则的前提下,应尽可能使其具有较低的序号(其编号方式是依整个分子的编号方向在其前一个原子的编号下加注“a”、“b”、“c”等).例如:下面化合物可有三种分歧的编号方式,获得杂原子的编号均为1、4、5、8,但第一种共用碳原子的编号为4a,后两种则为8a,故正确的编号方式应为第一种.③氢原子和指示氢的编号应尽可能低.例如:命名实例:杂环化合物的命名杂环化合物的命名比力复杂,现在一般通用的有两种类型的命名方法.一种是依照化合物的西文名称音译,另一种是根据相应的碳环化合物名称类比命名.最经常使用的是音译法.18.1.1音译法音译法是根据每个杂环化合物的基本杂环母核的西文名称按读音译成汉字,原则上是 2~3 个汉字名词的结构尊重我国的习惯,在汉字上加上一个象形性的偏旁“口”字,作为杂环的标识表记标帜构成杂环化合物的基本名称.1.单杂环的命名方法第一步,写出杂环化合物的基本名称furan pyrrole thiophene imidazole oxazole呋喃吡咯噻吩咪唑噁唑thiazole pyran pyridine pyrimidine pyrazine 噻唑吡喃吡啶嘧啶吡嗪第二步, 是将杂环上每个"环节"原子编号,并使杂原子处在最小号数位置,如果一个环上有两个或多个分歧种类的杂原子时,则规定按O,S,N,…顺序使其位号由小到年夜.例如:第三步,当环上有取代基时,先将取代基的名称放在杂环基本名称(或称主体环名称)的前面,并把主体环的位号写在取代基名称的前面,以暗示取代基在主体环上的位置.如果杂环分子上有两个或两个以上取代基时,则依照最低系列原则编号.例如:3-甲基吡啶1,3-二甲基吡咯(不是1,4-二甲基吡咯)第四步,对分歧水平饱和的杂环化合物,命名时不单要标明氢化(饱和)的水平,而且要标示出氢化的位置,用中文数字标明其数目,用阿拉伯数字标明其位置,全氢化物可只标明数目.例如:四氢呋喃六氢吡啶2,3-二氢吡咯2,5-二氢吡咯2.稠杂环命名方法(1)对一些简单的稠杂环,可以直接采纳与单杂环相同的命名方法,例如:indole quinoline purine carbazole 吲哚喹啉嘌呤咔唑(2)对年夜大都稠杂环的命名方法,是确定稠杂环中的主体环(固然必需是分子中的杂环部份),并以它的名字作为整个稠环分子的基本名称,其它与之骈合的环的名字都看成是这个专主体环的前缀而放在主体环名称的前面,如下式所示.benzothiazole 苯骈噻唑当稠环中的主体环和骈合环具有非专一位置时,则要标明用以骈合的主体环的边号.边序号是用a,b,c,d,…暗示的,并规定1-2位间的键(边)为a,2-3位间者为b等,按顺序标识表记标帜.最后把骈合边的边序号放在骈合环和主体环的名称之间,并以方括号括起来.例如:苯喹啉苯骈[g]喹啉(3) 在稠杂环分子中,若含有两个或多个有可能被选择作为主体环时(即在杂环骈杂环分子中),通常是优先选择最年夜的含氮杂环作为主体环,其次是含氧的和含硫的杂环等等.但总体环(即整个稠环分子)的编号仍然是按O,S,N……的顺序优先选择起算点.在这样的分子中,骈合边位置的标示也比苯骈杂环的情形要复杂.首先要将主体环和所有骈合环分别各自编号,然后标明主体环的边序号 a,b,c,d,......骈合边的位置是用主体环上的边序号和骈合环的编号一起暗示的,而且都放在方括号内.可是在方括号列出的骈合环的骈合边的位置号码,必需要和主体环的边序号的走向顺序一致.18.1.2 碳环类比命名法这种命名方法的基本动身点是把所有的杂环化合物都看成是在碳环环节原子中搀杂进去一个或多个杂原子的结果.所以,各种杂环化合物的名称,只要在相应的碳环化合物的名字中加上某杂就行了.如吡啶又可以名之为氮杂苯,呋喃可以名之为氧杂茂等等.类别碳环化合物杂环化合物结构名称杂原子单杂原子化合物多杂原子化合物三员环环丙烷O氧杂环丙烷S硫杂环丙烷N氮杂环丙烷四员环环丁烷O氧杂环丁烷S硫杂环丁烷N氮杂环丁烷五员环茂O氧杂茂N氮杂茂S硫杂茂六员环苯芑O氧杂芑(吡喃)1,3-二氮杂苯N氮杂苯(吡啶)S硫杂芑(噻喃)稠环茚O氧杂茚N氮杂茚S硫杂茚18.2 杂环化合物的分类杂环化合物的数量十分庞年夜,种类非常复杂,通常是根据杂环化合物的结构特征进行分类,年夜致有三种分类方法.1.依照杂环分子中所含电子的状态和数量来分类;可以分为四种类型:(1)以苯分子为参比标准,凡是环中的电子密度比苯年夜,并像苯一样有一个连续封闭的共轭体系的杂环环系,称为超电子环系(-excessive).例如呋喃环系、吡啶环系等.它们在性质上的主要特征是亲电取代反应的反应性比苯还年夜.(2)杂环分子中虽然存在一个像苯一样的连续封闭的共轭体系,但环中的电子密度比苯中的小,这类杂环环系称为缺电子环系(-deficient).显然,这类杂环的亲电取代反应性要比苯小,例如吡啶等.(3)含有孤立的π键或者不连续的键的杂环环系,也称为烯型杂环环系.例如吡喃环系、二氢吡咯等等.(4)不含有键的杂环环系,即饱和杂环环系,也称为烷型杂环环系,例如四氢呋喃、二氧六环、六氢吡啶.2.将所有杂环化合物分为芳香型杂环环系和脂肪型杂环环系;3.依照分子中所含的成环原子数目(亦即按环的年夜小)分为三员杂环、四员杂环、五员杂环等.上述分类应包括单杂环系和稠杂环系,综合杂环化合物的性质和分子结构,可以将杂环化合物分为单杂环、稠杂环、巨杂环、螺杂环、和桥杂环与杂环多面体等五类.具体分类如下:单杂环类稠杂环类巨杂环类螺杂环类桥杂环和杂环多面体类时间:二O二一年七月二十九日。
有机化学课件--第二十章杂环化合物精品

S
O
2019/8/20
+ Ac2O + Ac2O
H3PO4 BF3
课件
S COCH3 O COCH3
19
(5) 吡咯的特殊反应
吡咯十分活泼,活性类似于苯胺、苯酚.
H+ + C6H5N2+ClN H
N N=NC6H5 H
+ CHCl3 + KOH N H
2019/8/20
课件
CHO N H
20
(6)、五元杂环化合物亲电取代反应的定位规律
0
0
0
0
0
0
- 0.02
- 0.03
O
+ 0.1
- 0.04
- 0.06
S
+ 0.20
- 0.06
- 0.10
N H
+ 0.32
2019/8/20
课件
12
亲电取代反应活性: 吡咯 >呋喃 >噻吩>苯 主要进入α-位
说明:吡咯、呋喃、噻吩的亲电取代反应, 对试剂及反应条件必须有所选择和控制。
2019/8/20
不能用混酸硝化,一般是用乙酰基硝酸 (CH3COONO2)作硝化试剂,在低温下进行。
醋酸硝酰 ,一种弱的硝化试剂
硝化
O + CH 3 COONO 2
O NO 2
S + CH 3 COONO 2
S NO 2
不用强酸,否则呋喃或噻吩开环聚合
2019/8/20
课件
17
(3)卤代 由于反应太活泼,所以反应要控制,常在低
无色,有吡啶臭味液体,沸点117℃,与水互溶,有 弱碱性,是稳定的化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
此外,根据环上各键的键长并不 相等,说明杂环中的电子密度没 有完全平均化芳香性弱于苯环。 δ苯>吡咯>呋喃>噻吩。其电子密度 的变化情况类似于苯胺。
吡啶是典型的六元杂环化合物, 环原子以sp2方式杂化。并且, 每个原子的未参加杂化p轨道上 均只有一个单电子,组成 6 Π 6 大Π键符合4n+2休克尔规则,六 元杂环化合物同样具有芳香性电 子密度变化情况如左图
氮(杂)茂
N H
吡咯 pyrrole
S
噻吩 thiophene
硫(杂)茂
N 噁唑 O
oxazole
1,3-氧氮 (杂)茂
N
1,3-二氮 ( 杂) 茂
N H
咪唑 imidazole
N 噻唑 S
thiazole
1,3-硫氮 (杂)茂
O
N异噁唑 isoxazole
1,2-氧氮 ( 杂) 茂
N pyrazole S isothiazole H 1,2-硫氮 1,2-二氮
§11.2.1富电子体系—五元杂环
§11.2.2缺电子体系—六元杂环
§11.2.1富电子体系
典型的物质:呋喃、 噻吩、吡咯。环原子 为sp2杂化,平面结构 杂原子提供一对p电 子,参与大Π键的组 6 成。 NH 5Π 符合4n+2的休克尔规 则。因此,具有芳香 性。环的电子密度大 于苯环。尤其在杂原 子的邻位。
N H
Br
O
BF3
O
COCH3
Ac2O
N H
150-200 OC
N H
COCH3
KOH
N H
二、加成反应
N
K
C6H5COCl 110OC
N
C6H5CO
1.亲双烯加成反应
O O
O O O O
+
O O
O
+
+
O
N H
NH
一般认为:呋喃较易发生亲双烯加成反应, 吡咯也能和活性较大的亲双烯体发生反应,噻 吩不易发生反应。
N
H3C
5-甲基噻唑 5-methylthiazole
4-甲基咪唑 4-methylimidazole
S
NH2
N N
CH3 N O
N 腺嘌呤A N H O
OH 鸟嘌呤G
N N N N H
NH2
CH 3 N
N N 咖啡因 CH3 1,3,7-三甲基-2,6-二氧嘌呤
N
N 吡啶pyridine
氮苯
N 哒嗪 pyridazine
§11.1.2 杂环化合物的命名
一般有“译音名”和环母体加杂原子两种方式。 碳环母体如下:
环戊二烯 茂
苯
1,4-环己二烯 芑
茚 Indene
萘
芴 Fluorene
杂环的编号以杂原字为最小号,存在两个以上 杂原子的以O、S、NH、N顺序进行。即不含 双键的取1号位次。
O
呋喃 furan
氧(杂)茂
1,2-二氮苯
N
N 嘧啶pyrimidine
1,3-二氮苯
N
吡嗪pyrazine 1,4-二氮苯
N
O 吡喃pyran
氧芑
5 6 7 8
4 3
5 6 7 8
4 3
N
1
2
N2
1
喹啉quinoline 氮萘
5 10 6 7 8
4 3
异喹啉isoquinoline 2-氮萘
N
1
N N
N
9
2 1
吖啶acridine 氮蒽
1. 05 1.10 ‥ δN0.64
§11.2.2缺电子体系
H
0.87 δ+
1.02 δδ+ 0.84
N ‥
N
芳香性
具有闭合环结构,具有环多烯结构, 具有共平面或近似平面结构,π电子 数符合4n+2规则。 符合休克尔规则,因此具有芳香性。 易发生亲电取代反应。富电子体系亲 电取代反应发生在-位为主;缺电子 体系亲电取代反应发生在-位为主。
N H
O
此外,还有一类带有杂原子的饱和环状化合物, 例:
O N O H 吖丁啶 1,3-环氧丙烷 环氧乙烷 氮丙啶;吖丙啶 氧化乙烯 氮杂环丁烷 氧杂环丁烷 氮杂环丙烷 O S 噁噻烷 O 四氢呋喃 O N-H 吗啉 S 四氢噻吩 O O N-H
H-N
哌嗪
N-H
二噁烷
§11.2杂环化合物的结构
§11.1杂环化合物的分类、命名 §11.2杂环化合物的结构 §11.3五元杂环—富电子单杂环体系 §11.4六元杂环—缺电子单杂环体系 §11.5稠杂环体系
§11.1 杂环化合物的分类和命名
§11.1.1 杂环化合物的分类 由于组成杂环化合物的杂原子的种类、数目 不同,环的大小及稠合的形式不同。因此其 种类繁多数目可观,约占全部有机物的1/3, 一般以环骨架为基础。 1.杂环化合物分为五元杂环化合物和六元杂环 化合物。 2.杂环化合物分为单杂原子杂环化合物和多杂 原子杂环化合物。 3.杂环化合物分为单杂环化合物和稠杂环化合 物。
S
100 C
S
SO3H
3. 卤代反应
O
O
S
Cl2 -40 OC
O
O
S
+
Cl
Br
Cl
O
Cl
Br2 0OC
O O
Br2 CH3COOH
Br
S
I2 0OC Hg2O
S
I
N H
Cl2 0OC C2H5OC2H5
N H
Cl
Br Br
Br
N H
Br2 0OC C2H5OH
4. 傅克反应:主要是酰基化反应,烷基化反应 得到混合物。 Ac2O
S
NO2
O AcOH Ac2O + CH3CONO2 0 OC
N H
O
O + CH3CONO2
AcOH Ac2O -10 OC
N H
O
NO2
O + CH3CONO2
硝乙酐
AcOH Ac2O -5-- 30 OC
N
NO2
2. 磺化反应
SO3 72h
O
SO3
N
O
SO3H
N H
N
N H
N
O
SO3HBiblioteka SO3(杂)茂 (杂)茂
N 吡唑
N异噻唑
4 5
3
苯并呋喃 benzofuran 氧茚
O
6 7
吲哚indole 氮茚 6
1
N1 H
2
N
2
5
N
7 8
N
3
4
茚Indene
嘌呤 purine 1,3,7,9-四氮茚
N9 H
CH2COOH
O
CHO
H3C N N H
2-呋喃甲醛 α-呋喃甲醛 糠醛
N H
3-吲哚乙酸 β-吲哚乙酸
喋啶pteridine 1,3,5,8-四氮萘
N
4 5 6 3
COOH
5
4 5 3
CH 3 4
3
3-吡啶甲酸 β-吡啶甲酸
N1
2
CH3 NH2
6
O
N1
4-甲基吡啶 γ-甲基吡啶
N1
2
3-甲基-1-苯基-5-吡唑酮
H2N N O N H
H N O
O
H N
O CH3 N H
胸腺嘧啶T
胞嘧啶C
尿嘧啶U
芳香性强弱
亲电反应强弱(反应活性)
N H
>
O
>
S
>
环稳定性大小 > >
S
N H
>
O
相互转化 佑尔业夫(Yupev):利用Al2O3为催化 剂,实现噻吩、吡咯、呋喃环之间的转 化。
H2O
N H
H2S NH3
NH3 H2O H2S
O
S
§11.3五元杂环—富电子单杂环体系
一、亲电取代反应
S
1.硝化反应
