离子浓度大小比较
离子浓度大小的比较

( 2 )水解能力大于电离能力(如NaHCO3 、 Na2HPO4 、NaHS) 练习:试比较NaHCO3溶液中各离子浓度大小。
答案: C(Na+ ) > C(HCO3 –) > C(OH-) > C(H+) > C(CO3 2-) H2CO3?
六、单一正盐(AB型)溶液中离子浓度大小的比 (考虑水解和电离)
5、现有NH4Cl和氨水组成的混合溶液(填“>”、“<”或 “=”) = ①若溶液的pH=7,则该溶液中C(Nt;7,则该溶液中C(NH4+) < C(Cl-); ③若C(NH4+)< C(Cl-),则溶液的pH 7。
变式:NaHCO3溶液
三、质子守恒
在NH4Cl溶液中,存在两个守恒:
由水电离提供的H+与OH-相等(可由电荷守恒及物料守恒推出)。
电荷守恒:c(NH4+)+c(H+)=c(OH-) +c(Cl-) 物料守恒:c(Cl-)=c(NH4+)+c(NH3· 2O) H 两式相加 质子守恒: c(H+) = c(OH-) +c(NH3· 2O) H
4.在Na2CO3溶液中下列关系不正确的是( A ) A. 2c(Na+) = c(CO32-) + c( HCO3-) + c(H2CO3) B. c(Na+) +c(H+)= 2c(CO32-) + c(HCO3-) + c(OH-) C. c(Na+) > c(CO32-) >c(OH-)>c(HCO3-) >c(H+) D.c(OH-)= c(H+)+ c(HCO3-)+2c(H2CO3) 电荷守恒: c(Na+) +c(H+)= 2c(CO32-) + c(HCO3-) + c(OH-) 物料守恒: c(Na+) = 2c(CO32-) +2 c( HCO3-) + 2c(H2CO3) 质子守恒:c(OH-) = c(HCO3-) + c(H+) + 2c(H2CO3)
离子浓度大小比较
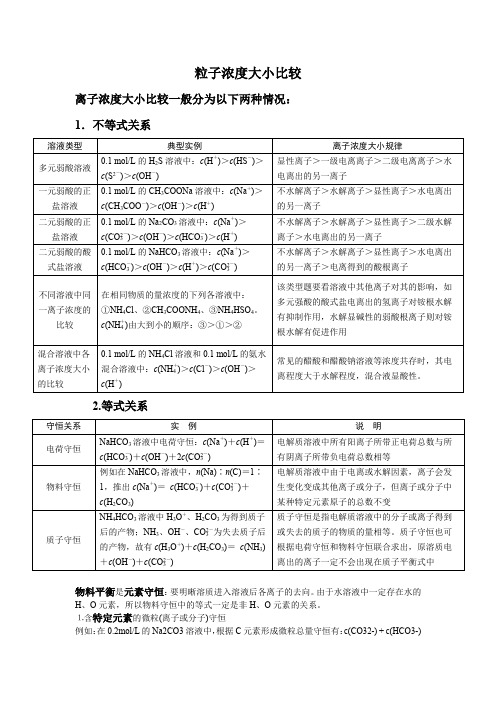
粒子浓度大小比较离子浓度大小比较一般分为以下两种情况:1.不等式关系2.等式关系物料平衡是元素守恒:要明晰溶质进入溶液后各离子的去向。
由于水溶液中一定存在水的H、O元素,所以物料守恒中的等式一定是非H、O元素的关系。
⒈含特定元素的微粒(离子或分子)守恒例如:在0.2mol/L的Na2CO3溶液中,根据C元素形成微粒总量守恒有:c(CO32-) + c(HCO3-)+ c(H2CO3) = 0.2mol/L。
⒉不同元素间形成的特定微粒比守恒例如:在Na2CO3 溶液中,根据Na与C形成微粒的关系有:c(Na+) = 2[c(CO32- ) + c(HCO3- ) + c(H2CO3 )]分析:上述Na2CO3 溶液中,C原子守恒,n(Na) : n(C)恒为2:13.混合溶液中弱电解质及其对应离子总量守恒例如:相同浓度的HAc溶液与NaAc溶液等体积混合后,混合溶液中有:2c(Na+ )=c(Ac-)+c(HAc)分析:上述混合溶液中,虽存在Ac-的水解和HAc的电离,但也仅是Ac-和HAc两种微粒间的转化,其总量不变。
质子守恒规律:水电离的特征是c(H)=c(OH-),只不过有些会水解的盐会导致氢离子、氢氧根可能会有不同的去向,我们需要把它们的去向全部找出来。
例如:NaHCO3溶液,初始H+ 来源于HCO3- 和H2O的电离,c初(H+) = c(CO32- ) + c(OH- );伴随着的水解的发生,一部分H+转化到H2CO3中,因此,c初(H+) = c现(H+) + c(H2CO3 ),从而得出,溶液中离子浓度的关系如下:c(CO32- ) + c(OH- ) = c(H+) +c(H2CO3 )对同一溶液来说:质子守恒=电荷守恒-物料平衡快速书写质子守恒的方法第一步:确定溶液的酸碱性,溶液显酸性,把氢离子浓度写在左边,反之则把氢氧根离子浓度写在左边。
第二步:根据溶液能电离出的离子和溶液中存在的离子,来补全等式右边。
微专题——离子浓度大小比较(教师版)

微专题——离子浓度大小比较知识点一:溶液中的三种守恒:以Na2S和NaHS溶液为例:1、电荷守恒:Na2S水溶液:[Na+]+[H+]=2[S2-]+[HS-]+[OH-]NaHS水溶液:[Na+]+[H+]=2[S2-]+[HS-]+[OH-]意义:溶液呈电中性,因此阴阳离子所带正负电荷总数相等。
写法:将溶液中所有阳离子浓度相加,等于溶液中所有阴离子浓度相加,其中每个离子浓度前的系数等于其所带电荷电量的绝对值。
特点:电荷守恒式只与溶液中离子种类相关,与浓度无关。
2、物料守恒:Na2S水溶液:[Na+]=2([S2-]+[HS-]+[H2S])NaHS水溶液:[Na+]=[S2-]+[HS-]+[H2S]意义:加入的物质中各种原子进入溶液后只是存在形态发生的改变,但数目守恒。
写法:观察加入的物质中非H、O元素的原子比例,将溶液中某原子的所有存在微粒浓度相加表示该原子的总浓度,再根据原加入物质中原子数目之比配平系数。
特点:不能以H、O原子书写物料守恒,因为水中有大量的H、O原子。
3、质子守恒:Na2S水溶液:[OH-]=[HS-]+2[H2S]+[H+]NaHS水溶液:[OH-]+[S2-]=[H2S]+[H+]意义:溶液中各微粒得质子(即H+)总数等于失去的质子总数。
写法:①将电荷守恒与物料守恒联立,约去[Na+]即可得到质子守恒式。
②将溶液中得到质子后形成的微粒浓度乘以得到质子的数目再相加,相当于于得质子总数;所有失去质子后得到的微粒浓度乘以失去的质子数再相加,相当于失去的质子总数;二者相等即可。
物理意义写法:(Na2S为例)得到的质子总数=n(HS -)+2n(H 2S)+n(H +),失去的质子数=n(OH -),二者相等。
再除以溶液体积即可得到质子守恒式知识点二:溶液中离子的浓度大小比较:1、弱酸溶液:0.1mol/L 的HAc 溶液中离子浓度由大到小的排列顺序是:([HAc] >)[H +] >[Ac -] >[OH -]0.1mol/L 的H 2S 溶液中离子浓度由大到小的排列顺序是:([H 2S] >)[H +] >[HS -] >[OH -]>[S 2-](说明:H 2S 的二级电离常数太小,导致[OH -]>[S 2-],如果是碳酸,则是[CO 32-]>[OH -])2、一元弱酸的正盐溶液:0.1mol/L 的CH 3COONa 溶液中离子浓度由大到小的排列顺序是:[Na +] >[Ac -] >[OH -]>[H +]3、二元弱酸的正盐溶液:0.1mol/L 的Na 2CO 3溶液中离子浓度由大到小的排列顺序是:[Na +]>[CO 32-]>[OH -]>[HCO 3-](>[H 2CO 3])>[H +](一步水解后产生等量OH -和HCO 3-,但后者还要水解,浓度会减小,故[OH -]>[HCO 3-],溶液碱性,[H +]最小) (关于碳酸与氢离子浓度大小比较可以由1323[][][]k H HCO H CO +-=进行讨论,常温下k 1数量级是10-7,而[HCO 3-]接近[OH -],一般大于这个值,因此整个分数小于1,故[H 2CO 3])>[H +])4、二元弱酸的酸式盐溶液:0.1mol/L 的NaHCO 3溶液中离子浓度由大到小的排列顺序是:[Na +]>[HCO 3-]>[OH -](>[H 2CO 3])>[H +]>[CO 32-](水解大于电离,故水解产物(H 2CO 3、OH -)浓度大于电离产物(CO 32-、H +)浓度,水也电离,故[H +]>[CO 32-])0.1mol/L 的NaHSO 3溶液中离子浓度由大到小的排列顺序是:[Na +]>[HSO 3-]>[H +]>[SO 32-] >[OH -](>[H 2SO 3])(电离大于水解,因此电离产物(SO 32-与H +)浓度大于水解产物(OH -)浓度,水电离导致,[H 2SO 3]最小)5、常见的混合溶液情况分析:① 混合后若反应,则先弄清反应后溶液中的溶质以及各溶质浓度,计算浓度时不要忘记体积的稀释效果; ② 混合溶液中物料守恒可能等式的一边以具体的浓度出现,要能看出来。
离子浓度大小的比较

离子浓度大小的比较一、离子浓度大小的比较这类问题包括一种物质的溶液和两种物质的溶液。
具体分析问题和解题是要先整体,后局部;先宏观,后微观。
对于一种电解质溶液,先观看,后分析;对于两种电解质混合的溶液,由于反应,则应先计算,后观看。
具体解题思路是:算相关的物质的量,看电离、水解、反应的情况,进行综合分析判断。
例1.明矾溶于水,所得溶液中各种离子的物质的量浓度的关系是( D )A. [K+]>[SO42-]>[Al3+]>[H+]>[OH-]B. [SO42-]>[K+] =[Al3+]>[OH-]>[H+]C. [SO42-]>[K+] =[Al3+]>[H+]>[OH-]D. [SO42-]>[K+]>[Al3+]>[H+]>[OH-](上海高考88.一.9)解析:由KAl(SO4)2·12H2O =K++Al3++2SO42-+12H2O知,[SO42-]最多;由Al3++O Al(OH)3+3H+知,溶液显酸性,[H+]>[OH-];K+不水解,故[K+]>[Al3+],本题3H应选D。
对于这种离子浓度大小的比较,还存在一种小规律,即阴、阳离子交错的比较一定是错的。
用此规律看选项A、B,就知是错的。
例2.将0.2 mol / L的醋酸钾溶液与0.1 mol / L盐酸等体积混合后,溶液中下列粒子的物质的量浓度的关系正确的是(MCE91.30)( D )A. [CH3COO-] =[Cl-] =[H+]>[CH3COOH]B. [CH3COO-] =[Cl-]>[CH3COOH]>[H+]C. [CH3COO-]>[Cl-]>[H+]>[CH3COOH]D. [CH3COO-]>[Cl-]>[CH3COOH]>[H+]解析:由题给反应知,生成0.1 mol / L的氯化钾溶液和0.1 mol / L的醋酸溶液,还剩余0.1 mol / L的醋酸钾溶液。
一些学生会认为醋酸的电离产生醋酸根离子,而醋酸根的水解又产生醋酸,这种循环使其无法判断哪种微粒浓度大。
高中化学-溶液中粒子浓度大小比较

【练3】常温下,Ka1(H2C2O4)=10-1.3,Ka2(H2C2O4)=10-4.2。 用0.1000 mol/L NaOH溶液滴定10.00 mL 0.1000 mol/L H2C2O4溶 液所得滴定曲线如图。
A.点①所示溶液中:c(Na+) >c(HC2O4-)>c(H2C2O4)>c(C2O42-)
13
四、酸碱中和滴定曲线分析
【例1】室温时,用0.1mol/L NaOH溶液滴定20 mL 0.1mol/L HA溶液, (1)Ka(HA)=? Ka(HA)的数量级为? (2)点溶液中各粒子 浓度大小?
(3)点溶液中各粒子 浓度大小?
(4)五点中水的电离程度大小? 点—点:水的电离程度逐渐增大 点之后:水的电离程度逐渐减小
物料守恒关系式:c(NH4+)+ c(NH3·H2O)=2c(Cl-)
5【注意】NH3·H2O 的电离程度 > NH4Cl 中NH4+的水解程度
(5)0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合, 所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)。( )
14
【练1】化学上常用AG表示溶液中的lg c(OH-)/c(H+)。25 ℃时,用 0.100 mol/L的NaOH溶液滴定20.00 mL 0.100 mol/L的HNO2溶液, AG与所加NaOH溶液的体积(V)的关系如图所示,
B.25 ℃时,HNO2的电离常 数Ka≈1.0×10-4.5
C.b点溶液中存在2c(H+)- 2c(OH-)=c(NO2-)-c(HNO2)
【例1】V1 mL 0.1 mol/L 的氨水和 V2 mL 0.1mol/L 的盐酸混合, (1)若 V1 = V2, 所得溶液中溶质为 NH4Cl ,溶液呈 酸 性,
离子浓度大小的比较方法及规律

离子浓度大小的比较方法及规律
离子浓度是指解离出来的离子在溶液中的浓度,反映了溶液中离子的
数量。
在化学研究和实验中,比较离子浓度的方法及规律可以通过以下几
个方面来进行分析:
1.离子电荷数:离子的电荷数越多,其浓度越低。
因为在相同体积溶
液中,离子电荷越多,相互之间的排斥力越大,导致离子间的互相靠近程
度受到限制,浓度相应降低。
2.溶解度:不同离子化合物的溶解度不同,溶解度高的离子化合物会
使溶液中的离子浓度较高。
一般情况下,溶解度较高的化合物能够解离更
多的离子,在溶液中浓度较高;而溶解度较低的化合物解离的离子数量较少,浓度较低。
3.化学反应:一些化学反应会影响离子浓度,例如溶液中的酸碱反应、沉淀反应等。
在酸碱反应中,溶液中酸和碱的浓度决定了产生的离子浓度;在沉淀反应中,离子会结合形成沉淀,导致溶液中的离子浓度减少。
4.离子迁移速率:在电解质溶液中,离子的迁移速率是影响离子浓度
大小的因素之一、迁移速率较快的离子会在相同时间内在溶液中形成更高
的浓度。
离子迁移速率与离子电荷量、溶液电导率等因素有关。
5.离子浓度计算:通过实验测定,可以使用浓度计算公式来比较不同
离子的浓度。
离子浓度计算方法有多种,例如摩尔浓度、质量浓度、体积
浓度等,可以根据实际情况选择适合的方法来计算。
总结起来,离子浓度的大小可以通过离子电荷数、溶解度、化学反应、离子迁移速率以及浓度计算等方法和规律来进行比较。
因为每个离子都具
有独特的特性和溶液中的溶解度,所以在具体实验、研究和应用中需要详细考虑这些因素,来获得准确的离子浓度大小。
离子浓度大小的比较

【课堂练习】
1.在0.1mol/L Na2CO3溶液中,下列关系正确的是 A.c(Na+)=2c(CO32-)
( A )
【课堂练习】
3.下列叙述正确的是
( BC )
A. 0.1mol/L氨水中,c(OH-)=c(NH4+)
B. 10mL 0.02mol/L HCl溶液与10mL 0.02mol/L
Ba(OH)2溶液充分混合后溶液体积为20mL,则pH=12
C. 在0.1mol/LCH3COONa溶液中,
c(OH-) =c(CH3COOH)+c(H+)
C.C(CH3COOH)>C(CH3COO-)
D.C(CH3COO-)+C(OH-)=0.2 mol/L
【课堂练习】 • 1、现有NH4Cl和氨水组成的混合溶液C(填“>”、“<” 或“=”) • ①若溶液的pH=7,则该溶液中C(NH4+) = C(Cl-); • ②若溶液的pH>7,则该溶液中C(NH4+) > C(Cl-); < • ③若C(NH4+)< C(Cl-),则溶液的pH 7。 • 2、CH3COOH与CH3COONa等物质的量混合配制成稀 溶液,pH值为4.7,下列说法错误的是( B ) • A、CH3COOH的电离作用大于CH3COONa的水解作用 • B、CH3COONa的水解作用大于CH3COOH的电离作用 • C、CH3COOH的存在抑制了CH3COONa的水解 • D、CH3COONa的存在抑制了CH3COOH的电离
溶液中离子浓度大小的比较方法与技巧.

溶液中离子浓度大小的比较1.溶液中离子浓度大小比较的规律--(1)多元弱酸溶液,根据多步电离分析。
如H3PO4的溶液中,c(H+)>c(H2PO4)>c(HPO42) > c(PO43---)。
多元弱酸的正盐溶液根据弱酸根的分步水解分析:如Na2CO3溶液中,c(Na+)>c(CO32)>c(OH)>-c(HCO3)。
(2)不同溶液中同一离子浓度的比较,则要注意分析溶液中其他离子对其的影响。
如在①NH4Cl②CH3COONH4③NH4HSO4溶液中,c(NH4+)浓度的大小为③>①>②。
(3)如果题目中指明溶质只有一种物质(该溶质经常是可水解的盐),要首先考虑原有阳离子和阴离子的个数,水解程度如何,水解后溶液显酸性还是显碱性。
(4)如果题目中指明是两种物质,则要考虑两种物质能否发生化学反应,有无剩余,剩余物质是强电解质还是弱电解质;若恰好反应,则按照“溶质是一种物质”进行处理;若是混合溶液,应注意分析其电离、水解的相对强弱,进行综合分析。
(5)若题中全部使用的是“>”或“<”,应主要考虑电解质的强弱、水解的难易、各粒子个数的原有情况和变化情况(增多了还是减少了)。
(6)对于HA 和NaA的混合溶液(多元弱酸的酸式盐:NaHA),在比较盐或酸的水解、电离对-溶液酸、碱性的影响时,由于溶液中的Na+保持不变,若水解大于电离,则有c(HA) > c(Na+)>c(A) ,-显碱性;若电离大于水解,则有c(A) > c(Na+)> c(HA),显酸性。
若电离、水解完全相同(或不水解、--不电离),则c(HA) =c(Na+)=c(A),但无论是水解部分还是电离部分,都只能占c(HA) 或c(A)的百-分之几到百分之零点几,因此,由它们的酸或盐电离和水解所产生的c(H+) 或c(OH)都很小。
--【例1】把0.2 mol·L1的偏铝酸钠溶液和0.4 mol·L1的盐酸溶液等体积混合,混合溶液中离子浓度由大到小的顺序正确的是----A.c(Cl)>c(Al3+)>c(Na+)>c(H+)>c(OH) B.c(Cl)>c(Al3+)>c(Na+)>c(OH)> c(H+)----C.c(Cl)> c(Na+) > c(Al3+) > c(H+) > c(OH) D.c(Na+)> c(Cl)> c(Al3+) > c(OH) > c(H+)【解析】偏铝酸钠与盐酸混合后,发生反应:NaAlO2+HCl+H2O===NaCl+Al(OH)3,显然,盐酸过量,过量的盐酸与Al(OH)3进一步反应:Al(OH)3+3HCl=== AlCl3+ 3H2O,故反应后,溶液为AlCl3-与NaCl的混合溶液,Cl浓度最大,反应前后不变,故仍然最大,有部分Al存在于没有溶解的Al(OH)3沉淀中,若Al全部进入溶液中与Na+浓度相同,故c(Na+) > c(Al3+),由于AlCl3水解溶液呈酸性,-故c(H+) > c(OH),故正确答案为C。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【随堂检测】 1:写出磷酸中各离子浓度大小关系?
H3PO4 H2PO4- + H+
H2PO4-
HPO42- + H+
HPO42-
PO43- + H+
H2O
OH- + H+
c(H+)> c(H2PO4-)> c(HPO42-)>c(PO43-)>c(OH-)
2.写出NaHS溶液中各离子浓度的大小关系?
NaHS = Na+ + HS-; 水解>电离 ,碱性
HS- H+ +S2-;
HS- +H2O
H2S +OH-;
H2O H+ + OH-
c(Na+ )>c(HS-)>c(OH-)>c(H+)>c(S2-)
3.在0.1 mol/L的Na2CO3溶液中,下列关系正确
的是( C )
A.c(Na+)=2c(CO32-) B.c(OH-)=2c(H+) C.c(HCO3-)>c(H2CO3) D.c(Na+)<c(CO32-)+c(HCO3-)
首先必须有正确的思路:
酸或碱溶液
考虑电离
电 单一溶液
正盐溶液
解 质
盐溶液
考虑水解
溶
酸式盐溶液 考虑水解与电离
液
(分清主次)
混合溶液
电解质溶液中离子浓度大小比较问题, 是高考的“热点”之一。这种题型考查的知 识点多,灵活性、综合性较强,有较好的区 分度,它能有效的考查学生对强弱电解质、 电离平衡、电离程度、水的电离、pH值、离ห้องสมุดไป่ตู้子反应、盐类水解等基本概念的掌握程度及 对这些知识的综合运用能力。
溶液中离子浓度 大小比较
(第二课时)
主讲人:严智思 黄梅国际育才高级中学
回顾复习:
溶液中离子浓度大小的比较方法:
1、注意一个“影响” 比较同一离子浓度时,要注意其他离子对该离子
浓度的影响。
2、紧抓两个“微弱” ①弱电解质的电离是微弱的,同时注意考虑水
的电离的存在。 ②弱离子的水解 一般是微弱 的。
3、明确三个“主次”
①多元弱酸分步电离,以第一步电离为主,其余各步电 离为次;多元弱酸的酸根离子水解时,以第一步水解为主, 其余各步水解为次。
②弱酸的酸式盐, 如NaHSO3 ,NaH2PO4 电离大于水解,溶液显酸性; 如NaHCO3、NaHS、Na2HPO4 电离小于水解,溶液显碱性;
【小结归纳】
