高中化学化学键与化学反应ppt课件
合集下载
高中化学必修二1-3化学键 课件(共16张PPT)

(4)
(2)(2) 和(6) 质量数相等,但不能互称
同位素。
(3)(3) 和(4) 的中子数相等,但质子数 不相等,所以不是同一种元素。
氯的原子序数为17, 3517Cl是氯的一种
核素,下列说法正确的是 BD
A、 3517Cl原子所含的质子数为18
B、1/18mol的1H35Cl分子所含中子数 约为NA个
概念辨析 元素:具有相同核电荷数的同一类
原子的总称。 核素:具有一定数目质子和一定数
目中子的原子。
同位素:质子数相同而中子数不同 的不同原子的互称。
同素异形体:有相同元素组成不同 形态的单质。O3和O2
课堂练习
2142在 M((g11、))63((Li51、))(73和2(L)i5、)174(N互、61)为64(同3C)位中2131素N:a。、
核 组卷网
素
原子的组成
原子核
学科网
原子核由质子和中子组成
核外电子
原子的质量 取决于 原子核
质量数:
质量数(A) = 质子数(Z) + 中子数(N)
表示原子的通式为
A Z
X
质量数
234 92
U
表示一个质量数为234,院用放射性同位素 12553I 治疗肿瘤该同位素原子核内的中子数
C、3.5g35Cl2的体积约为2.24L
D、35Cl2气体的摩尔质量为70g/mol
1375CCl: 34.966 含量:75%
3177CCl: 36.969 含量:25%
问题:
Cl:35.5
35 17
Cl中的35表示:
35 17
Cl原子的质量数
,
Cl中的34.966表示:
高中化学全套ppt课件

8
4、常见吸热反应与放热反应
①放热反应 放出热量的化学反应。△H 为“-”或△H <0
常见放热反应:中和反应 燃烧反应 活泼金属与酸反应 大多数化合反应
9
②吸热反应
吸收热量的化学反应。△H 为“+”或△H >0 常见的吸热反应: 大多数分解反应 某些金属氧化物的还原反应 C+CO2 C+H2O Ba(OH)2·8H2O+NH4Cl
2H2(g)+O2(g)=2H2O(l),△H1=-Q1kJ/mol H2(g)+1/2O2(g)=H2O(l),△H2=-Q2kJ/mol
Q1﹥Q2
△H1 <△H2
注意:热量比较比数值, △H比较带符号
练:⑴比较Q1<Q2的大小、△H1 >△H2的大小
S(g)+O2(g)==SO2(g) △H1=- Q1 kJ/mol S(s)+O2(g)==SO2(g) △H2=- Q2 kJ/mol
15
1、烧已生知成在二2氧5℃化,碳1和01液kp态a下水,时1放gC8出H148(8辛.4烷0kJ)燃热 量,表示上述反应的热化学方程式正确的是
A.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g) ΔH=-48.40 kJ·mol-1
B.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH=-5518 kJ·mol-1
恒(等)容过程:反应前后体积不变,压强改变 密闭容器、体积不变容器
3
2、焓变
焓:热力学状态函数。
焓变:在一定条件下(恒压)的反应热 生成物与反应物的焓值差
①焓变符号:△H ②焓变单位:kJ/mol ③测量条件:恒压下,一般为敞口容器中 ④“+”:吸热,环境对体系做功自身能量增加
4、常见吸热反应与放热反应
①放热反应 放出热量的化学反应。△H 为“-”或△H <0
常见放热反应:中和反应 燃烧反应 活泼金属与酸反应 大多数化合反应
9
②吸热反应
吸收热量的化学反应。△H 为“+”或△H >0 常见的吸热反应: 大多数分解反应 某些金属氧化物的还原反应 C+CO2 C+H2O Ba(OH)2·8H2O+NH4Cl
2H2(g)+O2(g)=2H2O(l),△H1=-Q1kJ/mol H2(g)+1/2O2(g)=H2O(l),△H2=-Q2kJ/mol
Q1﹥Q2
△H1 <△H2
注意:热量比较比数值, △H比较带符号
练:⑴比较Q1<Q2的大小、△H1 >△H2的大小
S(g)+O2(g)==SO2(g) △H1=- Q1 kJ/mol S(s)+O2(g)==SO2(g) △H2=- Q2 kJ/mol
15
1、烧已生知成在二2氧5℃化,碳1和01液kp态a下水,时1放gC8出H148(8辛.4烷0kJ)燃热 量,表示上述反应的热化学方程式正确的是
A.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g) ΔH=-48.40 kJ·mol-1
B.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH=-5518 kJ·mol-1
恒(等)容过程:反应前后体积不变,压强改变 密闭容器、体积不变容器
3
2、焓变
焓:热力学状态函数。
焓变:在一定条件下(恒压)的反应热 生成物与反应物的焓值差
①焓变符号:△H ②焓变单位:kJ/mol ③测量条件:恒压下,一般为敞口容器中 ④“+”:吸热,环境对体系做功自身能量增加
人教版高中化学必修二第一章第三节《化学键》课件(共38张PPT)
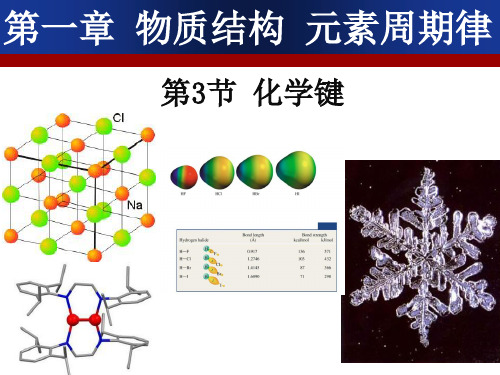
活泼的金属元素和酸根离子形成的盐 把NH4+看作是活泼的金属阳离子
金属氧化物:Na2O,Al2O3等
强碱:NaOH Ba(OH)2等
如何表示氯化钠的形成过程--电子式
•资料卡片
电子式 为方便起见,我们在 元素符号周围用“ · ”或 “×”来表示原子的最外 层电子(价电子)。这种 式子叫做电子式。例如:
归纳:分子间作用力与化学键的比较
作用微粒 作用力大小
意义
化学键 相邻原子间 作用力大 范德华力 分子之间 作用力小
影响化学性质和 物理性质
影响物理性质 (熔沸点等)
一些氢化物的沸点
讨论: 为什么HF、H2O和NH3的沸点会反
常呢?
2.氢键
1)形成条件:原子半径较小,非金属性很强的 原子(N、O、F)与H原子形成强极性共价键 ,与另一个分子中的半径较小,非金属性很强 的原子Y (N、O、F),在分子间H与Y产生
1.原子、离子都要标出最外层电子,离子须标明 电荷;
2.阴离子要用方括号括起来;
3.相同的原子可以合并写,相同的离子要单个写 ;
4.不能把“→”写成“====”;
⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程
氢气在氯气中燃烧
写出该过程的化学方程式和实验现象 思考:活泼的金属元素和活泼非金属元素化 合时形成离子键。请思考,非金属元素之间 化合时,能形成离子键吗?为什么?
较强的静电吸引,形成氢键
2)表示方法:X—H…Y—H(X.Y可相同或不 同,一般为N、O、F)。
3)氢键能级:比化学键弱很多,但比分子间作 用力稍强
特征:具有方向性。
氢键作用:使物质有较高的熔沸点(H2O、HF 、 NH3) 使物质易溶于水
金属氧化物:Na2O,Al2O3等
强碱:NaOH Ba(OH)2等
如何表示氯化钠的形成过程--电子式
•资料卡片
电子式 为方便起见,我们在 元素符号周围用“ · ”或 “×”来表示原子的最外 层电子(价电子)。这种 式子叫做电子式。例如:
归纳:分子间作用力与化学键的比较
作用微粒 作用力大小
意义
化学键 相邻原子间 作用力大 范德华力 分子之间 作用力小
影响化学性质和 物理性质
影响物理性质 (熔沸点等)
一些氢化物的沸点
讨论: 为什么HF、H2O和NH3的沸点会反
常呢?
2.氢键
1)形成条件:原子半径较小,非金属性很强的 原子(N、O、F)与H原子形成强极性共价键 ,与另一个分子中的半径较小,非金属性很强 的原子Y (N、O、F),在分子间H与Y产生
1.原子、离子都要标出最外层电子,离子须标明 电荷;
2.阴离子要用方括号括起来;
3.相同的原子可以合并写,相同的离子要单个写 ;
4.不能把“→”写成“====”;
⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程
氢气在氯气中燃烧
写出该过程的化学方程式和实验现象 思考:活泼的金属元素和活泼非金属元素化 合时形成离子键。请思考,非金属元素之间 化合时,能形成离子键吗?为什么?
较强的静电吸引,形成氢键
2)表示方法:X—H…Y—H(X.Y可相同或不 同,一般为N、O、F)。
3)氢键能级:比化学键弱很多,但比分子间作 用力稍强
特征:具有方向性。
氢键作用:使物质有较高的熔沸点(H2O、HF 、 NH3) 使物质易溶于水
(鲁科版)高中化学必修二:2.1(2)化学键与化学反应中的能量变化ppt课件
第2章 化学键 化学反应与能量
自主预习区 互动探究区 巩固训练区 课时作业
二、化学键与化学反应中的物质变化与能量变化的关 系
[填一填]
化学 必修2
第2章 化学键 化学反应与能量
自主预习区 互动探究区 巩固训练区 课时作业
1.从化学键的断裂与形成分析: E1>E2 E1<E2 反应______ 吸收 能量(_____ 吸热 反应) 释放 能量(______ 放热 反应) 反应_____
第2章 化学键 化学反应与能量
自主预习区 互动探究区 巩固训练区 课时作业
(2)常见的吸热反应 ① 消 石 灰 [Ca(OH)2] 与 氯 化 铵 固 体 的 反 应 : Ca(OH)2 + △ 2NH4Cl=====CaCl2+2NH3↑+2H2O。 △ ②大多数的分解反应,如 NH4Cl=====HCl↑+NH3↑。 △ ③碳与水的反应,C+H2O(g)=====CO+H2。 ④部分以 C、H2、CO 为还原剂的氧化还原反应,如 C+ △ CO2=====2CO。
化学 必修2
第2章 化学键 化学反应与能量
自主预习区 互动探究区 巩固训练区 课时作业
释放 能 2.结论:每个化学反应都伴随着能量变化,有的______ 吸收 能量。 量,有的________
化学 必修2
第2章 化学键 化学反应与能量
自主预习区 互动探究区 巩固训练区 课时作业
[记一记]
(1)常见的放热反应 ①所有的燃烧反应,剧烈的发光发热的化学反应,如木 炭、H2、CH4等在氧气中的燃烧,H2在Cl2中的燃烧。 ②酸碱中和反应,如H++OH-===H2O。 点燃 ③大多数的化合反应,如H2+ Cl2=====2HCl。
化学 必修2
高中化学第2章化学键化学反应与能量第1节化学键与化学反应(第2课时)化学键与化学反应中的能量变化课件鲁

有关化学方 程式及结论
反应混合液的温度 __升__高__
_N__a_O__H__+__H__C__l=__=_=__N__a_C_l_+___H__2O_ 反应时_释___放__能量
锌粉逐渐_溶___解__,有 NaO__H_+___H__C__l=__=_=__N__a_C__l+___H_2O
__气__泡__产生,溶液温度
反应时_释___放__能量
__升__高__
混合粉末变成糊状物,有 C_a__(O__H__)_2_+__2__N__H_4_C__l_=_=__= 刺___激___性__气___味__气___体产生, C_a_C__l2_+___2_N__H__3_↑_+___2_H__2_O_ 玻璃片与小烧杯粘在一起 反应时吸___收___能量
学
知 识
第 2 课时 化学键与化学反应中的能量变化
业 分
点
层
测
评
1.了解化学反应中存在能量变化以及化学反应的实质。 2.知道常见的放热反应和吸热反应。 3.了解化学反应中能量变化的实质。重难点
化学键与化学反应中的能量变化
[基础·初探] 1.化学反应中能量变化的实验探究 (1)活动探究
实验操作
实验现象Biblioteka (2)结论:每个化学反应的发生都伴随着能量变化,有的__释__放__能量,有的 _吸__收___能量。
2.化学反应中能量变化的原因分析 (1)微观角度 化学反应中物质变化的实质是旧化学键断裂和新化学键形成。断裂旧键时, 需要吸___收__一定的能量来克服原子(或离子)间的作用力;形成新键时,又要_释__放___ 一定的能量,并且吸收和释放的能量不__相___等__。所以化学反应一定伴随能量变化。 (2)宏观角度 化学反应的过程可看做“储存”在物质内部的能量(化学能)转化为_热___能__、 _电__能___或_光___能__等_释___放__出来,或者是_热__能___、_电__能___或_光___能__等转化为物质 内部的能量(化学能)被“_储___存__”起来的过程。
高中化学必修二第一章 第三节化学键 课时1 离子键和共价键(共59张PPT)

•
下列有关离子化合物的说法正确的
是( )
• A.离子化合物一定易溶于水
• B.离子化合物由非金属元素和金属元素共
同组成
• C.熔融状态下能够导电的物质,一定是离
子化合物
• D.离子化合物在晶体状态下有离子存在,
但不导电
【解析】 离子化合物不一定易溶于水,如 AgCl、BaSO4等;离子化合物不一定由非金 属元素和金属元素共同组成,如NH4Cl等铵 盐全部由非金属元素组成;熔融状态能导电 的物质,不一定是离子化合物,如金属单质; 离子化合物由阴、阳离子构成,在晶体状态 下,离子不能自由移动,故不能导电。
• 【答案】 D
• 4.氯化钠是日常生活中人们常用的调味品。 在下列事实中,可以证明NaCl中一定存在离 子键的是( )
• (3)证明某化合物一定存在离子键的方法是看在熔融 状态下能否导电。
• 3.离子化合物
• (1)定义:由离子键构成的化合物叫做离子化 合物。
• (2)构成微粒:阴离子、阳离子。
• (3)主要物理性质:熔、沸点较高,硬度较大。
• (4)导电性:固态时不导电,溶于水或受热熔 化后导电。
• (5)溶解性:大多数离子化合物易溶于水,难 溶于汽油、苯、四氯化碳等有机溶剂。
子化合物 • C.离子化合物一定能导电 • D.只有在活泼金属元素和活泼非金属元素
化合时,才能形成离子键
• 【解析】 正确理解离子键和离子化合物的 内涵和外延才能解答本题。
• A项,离子键是指阴、阳离子间的静电作用, 包括引力和斥力二者的平衡;B项,离子键 形成的只能是离子化合物;C项,离子化合 物在熔融状态或水溶液里才能导电,D项NH 与活泼非金属元素之间也可形成离子键。
人教课标版高中化学必修一《化学反应原理全套精品课件》教学PPT

200℃ △H= -14.9kJ/mol 2HI (g) 101KPa
H2 (g)+ I2 (g)
热化学方程式书写要点
①需注明反应的温度和压强 如在25℃、101KPa下进行的反应,可不注 明温度和压强 ②应注明反应物和生成物的状态 气体用g;液体用l;固体用s;溶液用aq
2H2(g)+O2(g)=2H2O(g) △H1=-Q1kJ/mol 2H2(g)+O2(g)=2H2O(l) △H2=-Q2kJ/mol
3、反应热产生的原因
①从物质所具有的能量角度
放热反应: 反应物的总能量>生成物的总能量 △H<0
吸热反应: 生成物的总能量>反应物的总能量
△H>0
ΔH= -183 kJ/mol(理论值) ΔH= -184.6 kJ/mol(实验值)√
②从化学键的角度 化学键断裂——吸热
化学键形成——放热
4、常见吸热反应与放热反应
认为甲烷的燃烧热是445.15kJ/mol? 2、已知: 2H2( g ) + O2 ( g) = 2H2O ( l ) ΔH= - 571.6 kJ/mol
H2( g ) +1/2 O2 ( g) = H2O ( g ) ΔH= - 241.8 kJ/mol
求氢气的燃烧热。
答:ΔH=-285.8 kJ/mol
1 、已知在 25℃, 101kpa 下, 1gC8H18( 辛烷 ) 燃 烧生成二氧化碳和液态水时放出 48.40kJ 热 量,表示上述反应的热化学方程式正确的是
A.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g) Δ H=-48.40 kJ·mol-1 B.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) Δ H=-5518 kJ·mol-1 C.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) Δ H=+5518 kJ·mol-1 D.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) Δ H=-48.40 kJ·mol-1
H2 (g)+ I2 (g)
热化学方程式书写要点
①需注明反应的温度和压强 如在25℃、101KPa下进行的反应,可不注 明温度和压强 ②应注明反应物和生成物的状态 气体用g;液体用l;固体用s;溶液用aq
2H2(g)+O2(g)=2H2O(g) △H1=-Q1kJ/mol 2H2(g)+O2(g)=2H2O(l) △H2=-Q2kJ/mol
3、反应热产生的原因
①从物质所具有的能量角度
放热反应: 反应物的总能量>生成物的总能量 △H<0
吸热反应: 生成物的总能量>反应物的总能量
△H>0
ΔH= -183 kJ/mol(理论值) ΔH= -184.6 kJ/mol(实验值)√
②从化学键的角度 化学键断裂——吸热
化学键形成——放热
4、常见吸热反应与放热反应
认为甲烷的燃烧热是445.15kJ/mol? 2、已知: 2H2( g ) + O2 ( g) = 2H2O ( l ) ΔH= - 571.6 kJ/mol
H2( g ) +1/2 O2 ( g) = H2O ( g ) ΔH= - 241.8 kJ/mol
求氢气的燃烧热。
答:ΔH=-285.8 kJ/mol
1 、已知在 25℃, 101kpa 下, 1gC8H18( 辛烷 ) 燃 烧生成二氧化碳和液态水时放出 48.40kJ 热 量,表示上述反应的热化学方程式正确的是
A.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g) Δ H=-48.40 kJ·mol-1 B.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) Δ H=-5518 kJ·mol-1 C.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) Δ H=+5518 kJ·mol-1 D.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) Δ H=-48.40 kJ·mol-1
高中化学第二章化学键化学反应与能量第3节课时1利用化学反应制备物质课件鲁科版必修

(2)在改正的装置中,请写出下列各试剂的作用: ①饱和食盐水________________________________________; ②浓硫酸_____________________________________________; ③NaOH 溶液________________________________________。 (3)除浓硫酸外,还可选用下列________(填序号)物质干燥 Cl2。 ①碱石灰 ②无水 CaCl2 ③P2O5
1.实验药品:浓盐酸与二氧化锰或浓盐酸与高锰酸钾。 2.反应原理:用氧化剂(MnO2、KMnO4)氧化浓盐酸中的 HCl 而生成 Cl2,发生反应的化学方程式: MnO2+4HCl(浓)==△===MnCl2+Cl2↑+2H2O 或 2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。
()
(3)生石灰能与水反应,可用来干燥氯气。
()
(4)实验室制取氢气和实验室制取二氧化碳所用的装置相同。
()
Hale Waihona Puke [答案] (1)× (2)× (3)× (4)√
2.用向上排空气法收集 Cl2 和 HCl 时,可以用来检验瓶中是否 已经充满又可区别两气体的是( )
A.湿润的 KI-淀粉试纸 B.湿润的蓝色石蕊试纸 C.蘸有浓氨水的玻璃棒 D.湿润的红色石蕊试纸
3.发生装置:氯气的发生装置使用的仪器主要有圆底烧瓶、分 液漏斗、铁架台、石棉网、酒精灯。
4.收集方法:向上排空气法、排饱和食盐水法。 5.验满方法:①因氯气是黄绿色气体,若观察到整个集气瓶内 都是黄绿色,则说明氯气已收集满。②可在集气瓶口放一湿润的淀 粉碘化钾试纸,若试纸变蓝,说明集气瓶内已收集满氯气。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
反应物总能量 < 生成物总能量 是吸热反应
精品课件
25
2、研究化学反应中能量变化的意义
化学反应中能量是如何转化的呢?
化学能
热能,光能, 电能等
精品课件
26
[迁移应用]
1、你能列举出化学能与其他形式能转化的实例 吗?这些转化有什么实际意义? 2、在使用能源的时候我们应该注意什么问题?
热能 ,光能
电能
B.阴、阳离子通过静电引力而形成的化 学键叫做离子键。
C.只有金属元素和非金属元素化合时才 能形成离子键。
D.大多数的盐、碱和低价金属氧化物中 含有离子键。
精品课件
13
练一练
3、下列物质中含有离子键的是
A.H2O B CaCl2 C. HCl D. Cl2
4、下列各组化合物中化学键类型不同的 是
A. NaCl和KF C. CaF2和CsCl
第二章
第一节 化学键与化学反应
精品课件
1
第一节 化学键与化学反应(1)
精品课件
2
精品课件
3
通电
H2O
O2
H2O
H2
H2 H2O
O2
H2O
H2
★这种相邻原子间的精强品课相件 互作用称为化学键4
H2 H2O
O2
H2O
H2
精品课件
5
氢氢键、 氧氧键 氢氢键、 氯氯键
氮氮键、 氢氢键
精品课件
氢氧键 氢氯键 氮氢键
精品课件
17
石墨晶体结构
金刚石晶体结构
精品课件
18
练一练
9、判断下列化合物是离子化合物 还是共价化合物
Na2O SO2 CaCl2 H2O NaOH HCl CuSO4 NH3
离子化合物
共价化合物
精品课件
19
练一练
10、判断下列化合物中含有哪些类型 化学键,是离子化合物还是共价化合 物
NaF HF
确的是C( )
A. 3Q1+Q2 > 2Q3 B. Q1+Q2 > Q3 C. 3Q1+Q2 < 2Q3 D. Q1+Q2 < Q3
精品课件
29
练一练
8.下列反应中,属于吸热反应的是( C、D )
A.实验室制H2的反应 C.水的分解反应
B.实验室制CO2的反应 D.石灰石分解的反应
C 9.下列说法不正确的是( ) A.化学反应除了生成新物质外,还伴随着能量的变化
H2O
氢气燃烧生成水蒸气时,为放热反应
精品课件
23
反应物
吸收能量E1
旧化学键断裂 新化学键形成
生成物
释放能量E2
E1 > E2 E1 < E2
吸热反应 放热反应
精品课件
24
能 反应物总能量
能
量
量
释放能量
生成物总能量 吸收能量
生成物总能量
反应物总能量
0
反应过程
0
反应过程
反应物总能量 > 生成物总能量 是放热反应
共价键 离子键 离子键 11
练一练
1、下列关于化学键的叙述,正确的是 A 化学键既存在于相邻分子间,又存在于
相邻原子间 B 两个原子间的相互作用叫化学键 C 化学键通常指的是相邻原子间的强烈的
相互作用 D相邻的原子之间强烈的相互吸引叫化学
键
精品课件
12
练一练
2、下列说法中正确的是
A.两个原子或多个原子之间的相互作用 叫做化学键。
6
精品课件
7
烧金 属 钠 在 氯 气 中 燃
Na +11 2 8 1
7 8 2 +17 Cl
精品课件
8
共价键
成键
微粒
原子
离子 键
阴、阳离子
微粒 间的
原子间通过共用电
作用 子对相互作用
阴、阳离子间静 电作用
成键 元素
活泼金属(ⅠA、ⅡA)
同种或不同种的非元素与 活泼非金属(ⅥA、
范围
金属元素
ⅦA)元素
B. H2O和NH3 D. CCl4和Na2O
精品课件
14
练一练
5、 下列变化不需要破坏化学键的是:
A. 加热分解氯化铵 B. 干冰气化
C. 水通电分解
D. 氯化钠溶于水
6、下列几组化合物,化学键型不相同的
是:
A. NH3 和H2O C. H2S和Na2S
B. HCl和HNO3 D. CaCl2和NaCl
精品课件
15
练一练
7、下列微粒中,含有离子键又含有共
价键的是
A. NH3 C. H2S
B. NH4Cl D. KCl
精品课件
16
练一练
8、根据化学反应的实质是旧键断 裂,新键生成这一事实,判断下列 变化哪些是化学变化,并说出理由。
1、石墨在高温下转化为金刚石; 2、碘升华; 3、氯气加压变成液氯;
成键 微粒由不稳定结构通 微粒由不稳定结构通过得
原因 过共用电子对相互作 失电子后变成稳定结构。
用后变成稳定结构。
精品课件
10
指出构成下列物质的微粒和键型
物质 形成化学键的微粒 化学键类型
水
H原子和O原子
共价键
氨气
H原子和N原子
共价键
二氧化碳 氯化钾 氯化钙
C原子和O原子 K+和Cl-
Ca2+和C精品l课- 件
B.物质燃烧和中和反应均放出热量
C.分解反应肯定是吸热反应
D.化学反应是吸热还是放热决定于生成物具有的总能量
和反应物具有的总能量
精品课件
30
练一练
10.金刚石和石墨都是碳的单质,石墨在一 定条件下可以转 化为金刚石。已知12g 石墨完全转化为金刚石时,要吸收EkJ的
吸收能量 2、5 释精品放课件能量1、3、4、6 28
练一练
7、氢气与氮气的反应是一个释放能量的反应。 在反应过程中,破坏1 molH2 中的化学键吸 收的能量为Q1 kJ,破坏1 mol N2 中的化学键 吸收的能量为Q2 kJ,形成1 molNH3 中的化 学键释放的能量为Q3 kJ。下列关系式中,正
应
混合液的温
度升高
Ca(OH)2与 NH4Cl反应
烧杯温度降 低
此反应吸收能量
精品课件
22
交流研讨
根据下列信息判断氢气燃烧生成水蒸气时,是释放能 量还是吸收能量
1
H2
molH2的共价键断裂 吸收436kJ能量
2H
½
O2
½
molO2的共价键断裂 吸收249kJ能量
O
形成1molH2O的共价键 释放930kJ能量
精品课件
27
练一练
下列化学反应是释放能量还是吸收能量?
1、2Mg+O点2=燃2MgO
2、
高温
C+CO2=2CO
3、 H2SO4+2KOH=K2SO4+2H2O
4、 Mg+2HCl=MgCl2+H2 ↑
5、Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O 6、2Al+Fe2O3高=温Al2O3+2Fe
CH4 CaCl2
H2O O2
NaNO3
NaOH
CaO KBr CO 2 NH3
HNO3
精品课件
20
第一节 化学键与化学反应(2)
精品课件
21
[活动探究] 感受化学反应中的能量变化
实验内容 实验现象
实验结论
NaOH溶液与 混合液的 盐酸反应 温度升高
此反应释放能量
锌粉与HCl反 有气泡产生 此反应释放能量
