医学生物化学课件
《医学生物化学》课件

《医学生物化学》课件汇报人:日期:contents •生物化学概述•蛋白质的结构与功能•核酸的结构与功能•酶的结构与功能•糖类的结构与功能•脂类的结构与功能•维生素和矿物质的结构与功能目录生物化学概述01CATALOGUE生物化学的定义它涉及生命现象的分子水平和细胞水平,为理解生物体的基本生命活动和疾病的发生机制提供了基础。
生物化学是医学专业的重要基础课程之一,为后续的医学专业课程如药理学、病理学等提供了必要的基础。
生物化学是一门研究生物体分子结构与功能、物质代谢与调控以及遗传信息传递与表达的学科。
生物化学的发展可以追溯到19世纪末,当时科学家开始研究生物体中的化学物质和它们的作用。
20世纪初,许多重要的生物化学发现和理论不断涌现,如蛋白质的氨基酸组成、DNA的双螺旋结构等。
近年来,随着分子生物学和遗传学等学科的发展,生物化学的研究领域不断扩大,涉及到的主题包括基因表达调控、蛋白质修饰与降解、细胞信号转导等。
生物化学的发展历程生物化学的研究内容01生物化学研究的主要内容包括02蛋白质的结构与功能:研究蛋白质的氨基酸组成、三维结构及其与功能的关联。
03酶的作用与调控:探讨酶的结构、催化机制及代谢调控。
04糖类、脂质和维生素代谢:研究这些物质的代谢途径、调控机制及与疾病的关系。
05核酸代谢与基因表达:探讨DNA复制、转录、翻译的过程及调控机制。
06细胞信号转导:研究细胞内信号转导途径及其在生理和病理过程中的作用。
蛋白质的结构与功能02CATALOGUE氨基酸肽键肽链的盘曲结构氨基酸通过肽键连接形成肽链。
多肽链形成后,会进一步盘曲形成特定的空间构象。
0302 01蛋白质的基本构成单位,由氨基、羧基、侧链组成。
肽链局部区域的构象,主要有α-螺旋、β-折叠、γ-转角等。
二级结构整条肽链全部氨基酸残基的相对空间位置,主要通过疏水相互作用和氢键维系。
三级结构由二硫键、离子键和氢键等形成的肽链之间的相互作用。
四级结构许多酶是蛋白质,能催化生物体内的化学反应。
医学生物化学全套课件

甘油三酯分解代谢过程
甘油三酯的分解
甘油三酯在脂肪酶的作用 下分解为甘油和脂肪酸。
甘油的代谢
甘油在甘油激酶的作用下 磷酸化为甘油-3-磷酸,然 后进入糖酵解途径进行代 谢。
脂肪酸的代谢
脂肪酸在细胞内经过β-氧 化作用,生成乙酰CoA, 然后进入三羧酸循环进行 彻底氧化。
胆固醇合成、转运和排泄过程
1 2
糖类定义
糖类是多羟基醛或多羟基酮及其 缩聚物和某些衍生物的总称,一 般由碳、氢与氧三种元素所组成。
糖类分类
根据水解情况,糖类可分为单糖、 低聚糖和多糖。
生理功能
糖类是生物体维持生命活动所需 能量的主要来源,具有多种生理 功能,如提供能量、构成细胞和 组织、调节生理机能等。
血糖来源去路及调节过程
血糖来源
外源性食物摄入、肝糖原分解、非糖物质转化。
血糖去路
氧化分解供能、合成糖原储存、转化为非糖物质、维持血糖浓度 相对恒定。
调节过程
通过神经调节和激素调节两种方式,使血糖维持在正常水平。其 中,胰岛素和胰高血糖素是主要的调节激素。
糖无氧氧化途径及其意义
糖无氧氧化途径
糖在无氧条件下,经过糖酵解过程分解为丙酮酸,然后进一步分解为乳酸或乙醇等。
酶抑制剂和激活剂的 应用
酶抑制剂和激活剂在医学、农业、工 业等领域具有广泛的应用价值。例如, 在医学领域,酶抑制剂可以作为药物 用于治疗某些疾病;在农业领域,酶 抑制剂可以作为农药用于防治病虫害; 在工业领域,酶抑制剂和激活剂可以 用于优化生产过程和提高产品质量等。
04 糖代谢途径与调 控机制
糖类概述及分类方法
05 脂类代谢途径与 调控机制
脂类概述及分类方法
脂类定义
生物化学(安医)全套PPT课件

下公式推算出蛋白质的大致含量:
100克样品中蛋白质的含量 ( g % )
= 每克样品含氮克数× 6.25×100 1/16%
一、氨基酸
—— 组成蛋白质的基本单位
存在自然界中的氨基酸有 300 余种,但
组成人体蛋白质的基本氨基酸仅有20种
COO
+
CH 3 R H
H
C
NH3
甘氨酸 丙氨酸 L-氨基酸的通式
1. 非极性疏水性氨基酸 甘氨酸 丙氨酸 缬氨酸 亮氨酸 异亮氨酸 glycine alanine valine leucine isoleucine Gly Ala Val Leu Ile G A V L I F P
5.97 6.00 5.96 5.98 6.02 5.48
苯丙氨酸 phenylalanine Phe 脯氨酸 proline Pro
——侧链基团在中性溶液中解离后带正电荷。
赖氨酸 Lys(K)
9.74
精氨酸 Arg (R) 10.76
组氨酸 His (H) 7.59
另外:
1、蛋白质中的很多氨基酸是经过加工修 饰的——修饰氨基酸 如:脯氨酸 羟基化 成 羟脯氨酸 赖氨酸 羟基化 成 羟赖氨酸
2、半胱氨酸Cys常以胱氨酸的形式存在
第一章
蛋白质的结构与功能
Structure and Function of Protein
Protein —— 来自希腊字母,意思是‚头等 重要的,原始的‛ 蛋白质 —— 来源于对蛋清(清蛋白)的研究 分布广:所有器官、组织都含有蛋白质;
细胞的各个部分都含有蛋白质。
含量高:蛋白质是细胞内最丰富的有机分
半胱氨酸
-SH HS-CH -CH-COO + 2 2
《大学医学生物化学课件》

细胞信号传导途径主要由信号分子、受体、信号转导蛋白 和效应蛋白等组成。
受体介导细胞内信号转导过程剖析
01
受体的定义和分类
受体是一类位于细胞表面或细胞内的蛋白质,能够与特定的信号分子结
合并传递信号。根据受体的位置和性质,可分为膜受体和胞内受体两大
类。
02
受体介导的信号转导过程
当信号分子与受体结合后,受体会发生构象变化并激活与之相关联的信
针对特定抗原表位设计单克隆抗体, 通过特异性结合抗原发挥治疗作用, 如用于治疗肿瘤、感染性疾病等。
激酶抑制剂
针对激酶靶点设计药物,通过抑制激 酶活性阻断信号传导通路,用于治疗 肿瘤、自身免疫性疾病等。
细胞凋亡调节剂
针对细胞凋亡相关蛋白设计药物,通 过促进或抑制细胞凋亡达到治疗目的, 如用于治疗神经退行性疾病、心血管 疾病等。
02
生物大分子结构与功能
蛋白质结构与功能
1 2
蛋白质的基本组成单位 氨基酸的种类、结构和性质
蛋白质的分子结构 一级、二级、三级和四级结构的定义和特点
3
蛋白质的功能 酶、激素、抗体、转运蛋白等的功能和作用机制
核酸结构与功能
01
02
03
04
核酸的基本组成单位: 核苷酸的结构和种类
DNA的双螺旋结构:碱 基配对、DNA的超螺旋 和拓扑异构
氮代谢及调控机制
蛋白质的消化吸收
食物中的蛋白质在消化道内被分解为氨基酸,被小肠吸收进 入血液。
氨基酸的转运和储存
血液中的氨基酸通过特定的转运蛋白转运至肝脏和肌肉等组 织储存。
氨基酸的分解代谢
在细胞内,氨基酸经过脱氨基作用分解为氨和相应的α-酮 酸。氨在肝脏中转化为尿素排出体外,α-酮酸可进一步氧 化分解供能。
医学生物化学课件-生化细胞色素PPT
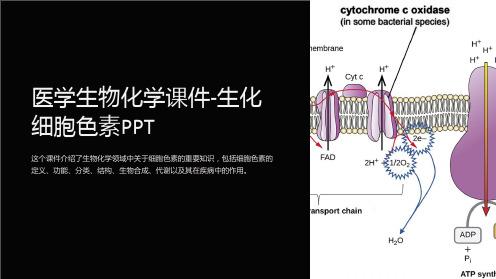
3 细胞色素的定义和功
能
细胞色素是一类存在于细 胞内的色素,具有重要的 生物学功能。
细胞色素的分类和特征
不同类型的细胞色素
包括血红素、叶绿素、细胞 色素c等。
细胞色素的结构和功能
具有特的结构和功能,参 与呼吸、光合作用等生物过 程。
细胞色素的生物学角色
在细胞中发挥重要的催化和 传递作用。
细胞色素的生物合成和代谢
细胞色素在神经退行性疾病的病理过程中发挥 着重要作用。
1
细胞色素的合成途径
细胞色素通过一系列生物合成途径在细胞内合成。
2
细胞色素的降解途径
细胞色素在细胞内经过一定的降解途径进行代谢。
3
细胞色素的代谢调控
细胞色素的合成和降解受到一系列调控机制的影响。
细胞色素在疾病中的作用
细胞色素与癌症的关系
细胞色素与癌症发生、发展和治疗具有密切关 联。
细胞色素在神经退行性疾病中的作用
医学生物化学课件-生化 细胞色素PPT
这个课件介绍了生物化学领域中关于细胞色素的重要知识,包括细胞色素的 定义、功能、分类、结构、生物合成、代谢以及其在疾病中的作用。
绪论
1 生物化学概述
生物化学是研究生物体内 化学反应的科学。
2 细胞生物化学的重要
性
细胞是生命的基本单位, 细胞生物化学研究对于深 入理解生命活动具有重要 意义。
《医学生物化学基础课件》

DNA修复和基因调控
DNA损伤修复机制和基因调控的生物化学基础,以及其在维持基因组稳定性 和发育过程中的作用。
医学生物化学实践技能培养
通过实验室操作和实践培养学生的医学生物化学技能,包括数据分析、实验 设计和科学沟通等。
代谢途径——糖代谢
糖类的吸收、运输和代谢途径,包括糖异生和糖酵解的生物化学过程。
代谢途径——脂质代谢
脂质的合成、降解和运输机制,以及脂质在能量代谢和信号调控中的作用。
代谢途径—氨基酸代谢
氨基酸的合成、降解和转化途径,以及氨基酸在蛋白质合成和能量代谢中的重要作用。
转录和翻译的生物化学基础
基因表达的两大过程:转录与翻译的生物学基础,以及调控途径和机制。
蛋白质的组成、结构与功能,包括蛋白质折叠、酶催化、信号传导等重要方面。
生物大分子——核酸的结构和功能
核酸的组成、结构与功能,以及DNA和RNA在遗传信息传递中的作用。
生物大分子——多糖的结构和 功能
多糖的种类、结构与功能,以及多糖在生物体内的重要生理功能。
酶和酶学
酶的基本特性、催化机制和调控方式。介绍酶的分类和在生物代谢中的作用。
医学生物化学基础课件
医学生物化学基础课程是首要的学科之一。通过本课件的学习,你将全面了 解生物化学基础知识,为后续医学学习打下扎实的基础。
生物化学基础概述
生物化学的定义、历史背景和重要性。介绍生物分子的组成和生物化学研究方法。
细胞膜生物化学
细胞膜的结构与功能,渗透和运输机制的生物化学基础。
生物大分子——蛋白质的结构和功能
医学生物化学医药卫生【33页】

医学生物化学_医药卫生
演讲人
2 0 2 x - 11 - 11
01 第一章蛋白质的结构与功能
第一章蛋白 质的结构与
功能
01 1 .1 概述
02 1 .2 氨 基 酸 的 结构、
分类和基本理化性质
03 1 .3 肽 和 蛋 白 质
04 1 .4 蛋 白质 的一级结
构
05 1 .5 蛋 白 质 的 二级结 06 1 .6 蛋 白 质 的 三级结
第二章 酶 和酶促反 应
0 1
2.1酶的活性中 心
0 2
2.2同工酶
0 3
2.3酶的特性
0 4
2.4酶动力学— 底物浓度对酶促 反应速率的影响
0 5
2.5温度和ph值 对酶促反应速率 的影响
0 6
2.6不可逆性抑 制
第二章 酶和酶促 反应
2.7可逆性抑制 2.8酶的快速调节 附件 本章常见问题汇总 酶和酶促反应
蛋白质消化吸收和 氨基酸代谢
07 第七章 代谢的整合与调节
第七章 代谢的整合与调节
7.1 物质代谢的特点与 相互联系
7.2 肝在物质代谢中的 作用
7.3 肝外重要组织器官 物质代谢特点及联系
7.4 细胞水平的代谢调 节
7.5 激素水平的代谢调 节
7.6整体水平的代谢调 节
第七章 代谢的整 合与调节
位
4
4.5氧化磷酸化的偶联机
5
制——化学渗透假说
4.6ATP合酶的结构及工
作原理
6
第四章 生物氧化
4.7atp在能量代谢中的核心作用 4.8氧化磷酸化的影响因素 4.9细胞质中nadh的氧化途径 4.10细胞内其他氧化与抗氧化体 系 生物氧化 4.8氧化磷酸化的影响因素 4.9细胞质中NADH的氧化途径 4.10细胞内其他氧化与抗氧化体 系
《医学生物化学课件》:医学卫生类专业必修课程详细课件

动脉粥样硬化
胆固醇沉积在动脉壁上,导 致血管狭窄和血液循环问题。
染色体的结构和功能
染色体是细胞内遗传信息的载体,由DNA和蛋白质组成。染色体的不正常结 构和功能可能导致遗传病和癌症。
DNA的结构和功能
DNA是双螺旋结构,由四种碱基组成。它存储了生物体的遗传信息,通过复制和转录过程传递给 后代。
RNA的结构和功能
3 细胞代谢
细胞中的化学反应组 成了细胞代谢网络, 维持生物体的正常功 能。
生物分子的结构
蛋白质
由氨基酸组成的聚合物,具 有多样的结构和功能。
糖类
包括单糖、双糖和多糖,是 细胞能量的重要来源。
脂质
包括脂肪、磷脂和类固醇, 构成细胞膜和储存能量。
生物膜的结构和功能
Байду номын сангаас
1 细胞膜
2 信号传导
由磷脂双层和蛋白质组成, 控制物质在细胞内外的交换。
RNA是单链分子,有多种类型,包括mRNA、tRNA和rRNA。它在蛋白质合成过程中起着重要角色。
蛋白质合成的过程
1
翻译
2
通过核糖体将mRNA转译成多肽链,
形成蛋白质。
3
转录
将DNA转录成mRNA,将遗传信息 转移到RNA分子上。
折叠
新合成的多肽链经过折叠和修饰, 形成特定的蛋白质结构。
糖代谢和糖尿病的关系
1
糖原
多糖的形式储存在肝脏和肌肉中,
糖酵解
2
作为能量的来源。
将葡萄糖分解为乳酸或酒精,产生
能量。
3
葡萄糖酮症
糖代谢异常导致血液中酮体水平升 高,可能出现酮症酸中毒。
脂质代谢和心血管疾病的关系
胆固醇
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1/16%
一、组成人体蛋白质的20种氨基酸 均属于L--氨基酸
存在自然界中的氨基酸有300余种,
但组成人体蛋白质的氨基酸仅有20种, 且均属 L-氨基酸(甘氨酸除外)。
COO
-
H CH3 R
H
C
+
NH3
甘氨酸 丙氨酸 L-氨基酸的通式
二、氨基酸可根据侧链结构和理化性质 进行分类
非极性脂肪族氨基酸 极性中性氨基酸
二级结构组合形式有3种:αα,βαβ,ββ 。
二个或三个具有二级结构的肽段,在空间 上相互接近,形成一个特殊的空间构象,称为 模体(motif) 。
模体是具有特殊功能的超二级结构。
模体常见的形式 •
α-螺旋-β转角(或 环)-α-螺旋模体 链-β转角-链模体 链-β转角-α-螺旋-β 转角-链模体
芳香族氨基酸
酸性氨基酸
碱性氨基酸
(一)侧链含烃链的氨基酸属于非极性脂肪族 氨基酸
(二)侧链有极性但不带电荷的氨基酸是极性 中性氨基酸
(三)侧链含芳香基团的氨基酸是芳香族氨基酸
(四)侧链含负性解离基团的氨基酸是酸性氨基酸
(五)侧链含正性解离基团的氨基酸属于碱性 氨基酸
几种特殊氨基酸
参与肽键的6个原子C1、C、O、N、H、C2位于同一平
面,C1 和C2 在平面上所处的位臵为反式(trans)构型,此同
一平面上的6个原子构成了所谓的肽单元 (peptide unit) 。
(二)α -螺旋结构是常见的蛋白质二级结构
蛋白质二级结构
-螺旋 ( -helix) -折叠 (-pleated sheet) -转角 (-turn) 无规卷曲 (random coil)
+OHR CH COOR CH COO-
NH3+
+H+
NH2
pH<pI 阳离子
pH=pI 氨基酸的兼性离子
pH>pI 阴离子
(二)含共轭双键的氨基酸具有紫外吸收性质
色氨酸、酪氨酸的 最大吸收峰在 280 nm 附近。 大多数蛋白质含有 这两种氨基酸残基,所 以测定蛋白质溶液 280nm的光吸收值是分 析溶液中蛋白质含量的 快速简便的方法。 芳香族氨基酸的紫外吸收
1962年,确定了血红蛋白的四级结构。 20世纪90年代,功能基因组与蛋白质组研究地 展开。
蛋白质的生物学重要性
1. 蛋白质是生物体重要组成成分 分布广:所有器官、组织都含有蛋白质;细胞
的各个部分都含有蛋白质。
含量高:蛋白质是细胞内最丰富的有机分子, 占人体干重的45%,某些组织含量更高,例如 脾、肺及横纹肌等高达80%。
第三节
蛋白质结构与功能的关系
The Relation of Structure and Function of Protein
一、蛋白质一级结构是高级结构 与功能的基础
(一)一级结构是空间构象的基础
二 硫 键
牛核糖核酸酶的 一级结构
天然状态, 有催化活性 去除尿素、 β-巯基乙醇
尿素、 β-巯基乙醇
定义:
整条肽链中全部氨基酸残基的相对空间位臵。 即肽链中所有原子在三维空间的排布位臵。
主要的化学键:
疏水键、离子键、氢键和 Van der Waals力等。
• 肌红蛋白 (Mb)
C 端 N端
(二)结构域是三级结构层次上的局部折叠区
分子量较大的蛋白质常可折叠成多个结构较为紧 密的区域,并各行其功能,称为结构域 (domain) 。
纤连蛋白分子的结构域
(三)分子伴侣参与蛋白质折叠
分子伴侣(chaperon)通过提供一个保护环境从而 加速蛋白质折叠成天然构象或形成四级结构。 分子伴侣可逆地与未折叠肽段的疏水部分结合随 后松开,如此重复进行可防止错误的聚集发生, 使肽链正确折叠。 分子伴侣也可与错误聚集的肽段结合,使之解聚 后,再诱导其正确折叠。 分子伴侣在蛋白质分子折叠过程中二硫键的正确 形成起了重要的作用。
主要的化学键:氢键
(一)参与肽键形成的6个原子在同一平面上
参与肽键的6个原子C1、C、O、N、H、C2位于同一平 面,C1 和C2 在平面上所处的位臵为反式(trans)构型,此同 一平面上的6个原子构成了所谓的肽单元 (peptide unit) 。
(一)参与肽键形成的6个原子在同一平面上
• •
钙结合蛋白中结合 钙离子的模体
锌指结构
(六)氨基酸残基的侧链对二级结构形成的影响
蛋白质二级结构是以一级结构为基础的。
一段肽链其氨基酸残基的侧链适合形成-螺旋
或β-折叠,它就会出现相应的二级结构。
三、在二级结构基础上多肽链进一步折叠 形成蛋白质三级结构
(一)三级结构是指整条肽链中全部氨基酸 残基的相对空间位置
• 脯氨酸
(亚氨基酸)
CH2 CH2 CH2
CHCOO NH2+
半胱氨酸
-OOC-CH-CH
+NH 3
-SH + HS-CH2-CH-COO2
-HH
+NH 3
-OOC-CH-CH
+NH 3
-S S-CH2-CH-COO2
+NH
二硫键
3
•胱氨酸
三、20种氨基酸具有共同或特异的理化性质
(一)氨基酸具有两性解离的性质
(三)氨基酸与茚三酮反应生成蓝紫色化合物
氨基酸与茚三酮水合物共热,可生成蓝 紫色化合物,其最大吸收峰在570nm处。 由于此吸收峰值与氨基酸的含量存在正 比关系,因此可作为氨基酸定量分析方法。
四、蛋白质是由许多氨基酸残基组成 的多肽链
(一)氨基酸通过肽键连接而形成肽 (peptide)
肽键(peptide bond)是由一个氨基酸的羧基与另一个氨基酸的-氨基脱水缩合而形成 的化学键。
Ser
Ile
Ala
(三)氨基酸序列提供重要的生物化学信息
一些广泛存在于生 物界的蛋白质如细胞色 素(cytochrome C),比 较它们的一级结构,可
以帮助了解物种进化间
的关系。
(四)重要蛋白质的氨基酸序列改变可引起疾病
例:镰刀形红细胞贫血
HbA β 肽 链 N-val · his · leu · thr · pro · glu · glu · · · · ·C(146) HbS β 肽链 N-val · his · leu · thr · pro · val · glu · · · · ·C(146)
纤维状蛋白质
球状蛋白质
六、蛋白质组学
(一)蛋白质组学基本概念
蛋白质组是指一种细胞或一种生物所表 达的全部蛋白质,即“一种基因组所表达的 全套蛋白质”。
(二)蛋白质组学研究技术平台
蛋白质组学是高通量,高效率的研究: 双向电泳分离样品蛋白质 蛋白质点的定位、切取 蛋白质点的质谱分析
(三)蛋白质组学研究的科学意义
2. 蛋白质具有重要的生物学功能
作为生物催化剂(酶)
代谢调节作用
免疫保护作用 物质的转运和存储 运动与支持作用 参与细胞间信息传递
3. 氧化供能
第一节
蛋白质的分子组成
The Molecular Component of Protein
组成蛋白质的元素
主要有C、H、O、N和 S。
非折叠状态,无活性
(二)一级结构相似的蛋白质具有相似的高级 结构与功能
胰岛素
人 A5 Thr 氨基酸残基序号 A6 A10 Ser Ile B30 Thr
猪
狗 兔
Thr
Thr Thr
Ser
Ser Gly
Ile
Ile Ile
Ala
Ala Ser
牛
羊
Ala
Ala
Gly
Ser
Val
Val
Ala
Ala
马
Thr
多肽链(polypeptide chain)是指许多氨 基酸之间以肽键连接而成的一种结构。
多肽链有两端: N 末端:多肽链中有游离α-氨基的一端 C 末端:多肽链中有游离α-羧基的一端
N末端
C末端
牛核糖核酸酶
(二)体内存在多种重要的生物活性肽
1. 谷胱甘肽(glutathione, GSH)
有些蛋白质含有少量磷或金属元素铁、
铜、锌、锰、钴、钼,个别蛋白质还含有
碘。
蛋白质元素组成的特点
各种蛋白质的含氮量很接近,平均为16%。
由于体内的含氮物质以蛋白质为主,
因此,只要测定生物样品中的含氮量,就
可以根据以下公式推算出蛋白质的大致含
量: 100克样品中蛋白质的含量 (g %)
= 每克样品含氮克数× 6.25×100
由2个亚基组成的蛋白质四级结构中,若亚基分子 结构相同,称之为同二聚体(homodimer),若亚基分子 结构不同,则称之为异二聚体(heterodimer)。
血红蛋白的 四级结构
五、蛋白质的分类
根据蛋白质组成成分:
单纯蛋白质 结合蛋白质 = 蛋白质部分 + 非蛋白质部分
根据蛋白质形状:
C-端的氨基酸排列顺序。 主要的化学键: 肽键,有些蛋白质还包括二硫键。
一级结构是蛋白质空间构象和特异生物学功能 的基础,但不是决定蛋白质空间构象的唯一因素。
二、多肽链的局部主链构象为蛋白质 二级结构
定义:
蛋白质分子中某一段肽链的局部空间
结构,即该段肽链主链骨架原子的相对空
间位臵,并不涉及氨基酸残基侧链的构象 。
生 物 化 学
BIOCHEMISTRY
王泽平 生物化学与分子生物学教研室
第1章
蛋白质的结构与功能
