晶体结构与常见晶体结构类型第五讲
化学第五讲晶体结构与性质

第五讲分子结构、性质与晶体结构、性质知识点一配位化合物理论1、配位键〔1〕配位键的形成:成键原子一方提供,另一方提供形成共价键。
〔2〕配位键的表示:为了区别于普通共价键与离子键,配位键用A“→〞B表示,A提供_________,B提供____________ 。
NH4+的结构式可表示为:从形成过程看,尽管一个N-H键与其它的三个不同,但形成NH4+后,这四个共价键无论从、、三个参数看都是完全相同的,表现的化学性质也完全相同,所以NH4+空间构型为____________。
2、配合物[Co(NH3)5Cl]Cl2这种配合物的中心离子是,配位体是__,中心离子和配位体构成了配合物的,配位数是____。
Cl-称为,内外界之间形成了键,在水中_____电离。
[Co(NH3)5Cl]Cl2的电离方程式为3、在CuSO4溶液中逐滴滴加氨水的现象是,对应的离子方程式为;再参加乙醇静置后的现象是,其名称为。
【练习】1.F-、K+和Fe3+三种离子组成的化合物K3FeF6,其中化学键的类型有________;该化合物中存在一个复杂离子,该离子的化学式为________,配位体是________。
2.一项科学研究成果说明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中参加Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①写出基态Mn原子的价电子排布式为____________________________________。
②CO2-3的空间构型是__________________(用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①甲醛分子中碳原子轨道的杂化类型为___________;甲醛分子的空间构型___________;②CO2分子中C原子轨道的杂化类型为____________________________________。
常见的晶体结构PPT幻灯片课件

1、NaCl型结构
——立方晶系
(1)密堆积情况: Cl- 离子面心立方堆积; Na+离子填充八面体空隙; 晶胞分子数:Z=4; 晶胞中:4个八面体空隙 8个四面体空隙; Na+离子填充全部八面体空隙
19
(2)质点坐标:
Cl : 000, 1 1 0, 1 0 1 ,0 1 1 22 2 2 22
Cl : 000
Cl : 1 1 1
或
222
Cs : 1 1 1
Cs : 000
222
(3)配位数与配位多面体:
r 0.174 nm 0.96 0.732 r 0.181nm
CN 8,立方体配位
CsCl型:CsBr、CsI、TlCl、NH4Cl……
23
3、闪锌矿型结构(-ZnS) ——立方晶系
晶胞的3个棱边长度(a、b、c)与原子半径r 之间的关系,可由简单的几何知识求出。
面心立方结构(a=b=c):
a2 a2 2r 2r2
a 2 2r
4
(6)配位数:
CN=12
(7)致密度(堆垛密度): K=0.74
(8)密度:
密度
=
原子数 晶胞原子量 晶胞体积 阿佛加德罗常数
a4 3r 3
9
(6)配位数: CN=8
(7)致密度(堆垛密度): 致密度:K=0.68
A2型结构:-Fe、铬、钨、结构(A3型)
(1)密堆积情况: 原子以ABAB……的方式堆积,
六方紧密堆积, (0001)面为密排面。
(2)原子分布:
12个原子分布在六方晶胞的 顶点、2个原子处于上下底心、3 个原子在六方晶胞体内。
(完整版)第二章晶体结构与常见晶体结构类型第五讲

如果每个硅氧四面体通过共用两个顶点向一维方向无限延伸, 则形成单链,见图2-35-1 。单链结构以[Si2O6]4-为结构单元不断重复, 结构单元的化学式为[Si2O6]n4n-。在单链结构中,按照重复出现与第一 个硅氧四面体的空间取向完全一致的周期不等,单链分为1节链、2节链、 3节链……7节链等7种类型,见图2-35-2 。两条相同的单链通过尚未共 用的氧组成带状,形成双链。双链以[Si4O11]6-为结构单元向一维方向无 限伸展,化学式为[Si4O11] n6n-。
双四面体 [Si2O7]6-
三节环 [Si3O9]6-
四节环 [Si4O12]8-
六节环 [Si6O18]12-
图2-33 孤立的有限硅氧四面体群
组群状结构中Si/O比为2:7或1:3。其中硅钙石 Ca3[Si2O7],铝方柱石Ca2Al[AlSiO7]和镁方柱石 Ca2Mg[Si2O7]等具有双四面体结构。蓝锥矿BaTi[Si3O9] 具有三节环结构。绿宝石Be3Al2[Si6O18]具有六节环结 构。
2/22/2020
4
• 硅酸盐化学式表示方法:
3.无机络盐表示法:把构成硅酸盐晶体的所有离子 按照一定比例和顺序全部写出来,先是1价、2价的金属 离子,其次是Al3+和Si4+,最后是O2-或OH-。如钾长石为 KAlSi3O8。
• 硅酸盐矿物中的水分子 • 1.吸附水:中性水分子,不参与晶体结构,
由于氧原子用于键合的是两个具有方向 性的轨道,所以[SiO4]4-亚单元之间通常 以共顶相连接,偶尔共棱,从不共面
(鲍林规则:Si高电价、低配位)
硅酸盐晶体结构的共同特点:
晶体三极管的结构和类型

是了解一下:
2018/11/22
4
2018/11/22
5
晶体三极管样图
2018/11/22
6
晶体三极管的三种工作状态
截止状态
放大状态
饱和导通状态
2018/11/22
7
2
2018/11/22
二、三极管的封装形式和管 脚识别
常用三极管的封装形式有金属封装和塑料封装两大类,引脚的排列方式具有一定的
规律,如图对于小功率金属封装三极管,按图示底视图位置放置,使三个引脚构成 等腰三角形的顶点上,从左向右依次为e b c;对于中小功率塑料三极管按图使其 平面朝向自己,三个引脚朝下放置,则从左到右依次为e b c。
电子制作中常用的三极管有90××系列,包括低频小功率硅管9013(NPN)、
பைடு நூலகம்
9012(PNP),低噪声管9014(NPN),高频小功率管9018(NPN)等。它们的
型号一般都标在塑壳上,而样子都一样,都是TO-92标准封装。在老式的电子产品 中还能见到3DG6(低频小功率硅管)、3AX31(低频小功率锗管)等,它们的型 号也都印在金属的外壳上。我国生产的晶体管有一套命名规则,电子爱好者最好还
2018/11/22 1
引出相应的电极,分别为基极b发射极e和集电极c。 发射区和基区之间的PN结叫发射结,集电区和基 区之间的PN结叫集电极。基区很薄,而发射区较厚, 杂质浓度大,PNP型三极管发射区"发射"的是空穴, 其移动方向与电流方向一致,故发射极箭头向里; NPN型三极管发射区"发射"的是自由电子,其移动 方向与电流方向相反,故发射极箭头向外。发射极 箭头向外。发射极箭头指向也是PN结在正向电压下 的导通方向。硅晶体三极管和锗晶体三极管都有 PNP型和NPN型两种类型。 电压须在外部施用,以使晶体管操作。施用电压以 使电流朝著发射极箭头的方向移动。施用电压时, 发射极电流Ie、集电极电流Ic和基点电流Ib将产生以 下的关系:
晶体结构(共78张PPT)

山东大学材料科学基础
共价键结合,有方 向性和饱和性,键 能约80kJ/mol
Si,InSb, PbTe
金属键结合, 无方向性,配 位数高,键能 约80kJ/mol
Fe,Cu,W
范得华力结合 ,键能低, 约 8-40 kJ /mol
Ar,H2,CO2
熔点高
强度和硬度由中到 高,质地脆
闪锌矿〔立方ZnS〕结构 S
Zn
属于闪锌矿结构的晶体有β-SiC,GaAs,AlP,InSb
山东大学材料科学基础
•
•
•
•
萤石〔CaF2〕型结构
立方晶系Fm3m空间群,
a0=0.545nm, Z=4。 AB2型化合物, rc/ra>0.732〔0.975〕 配位数:8:4
Ca2+作立方紧密堆积,
F-填入全部四面体 空隙中。 注意:所有八面 体空隙都未被占据。
山东大学材料科学基础
钙钛矿〔CaTiO3〕结构
Ti
ABO3型
立方晶系:以
•
一个Ca2+和3个
O2-作面心立方
Ca
密堆积,
Ti4+占1/4八面体C空aT隙iO3。晶胞 配位多面体连接与Ca2+配位数
Ti4+配位数6,rc/ra=0.436(0.414-0.732)
Ca2+配位数12,rc/ra=0.96
O2-配位数6;
取决温度、组成、掺杂等条件,钙钛矿结构呈现立方、
四方、正交等结构形式。
山东大学材料科学基础
许多化学式为ABO3型的化合物,其中A与B两种阳 离子的半径相差颇大时常取钙钛矿型结构。在钙钛矿 结构中实际上并不存在一个密堆积的亚格子,该结构 可以看成是面心立方密堆积的衍生结构。较小的B离 子占据面心立方点阵的八面体格位,其最近邻仅是氧 离子。
第五讲 晶体学基础

第五讲晶体学基础*(一)晶体(crystal)的点阵结构(1)晶体的结构特征晶体是内部粒子(原子分子离子)或离子集团在空间按一定的规律周期性排列的固体。
周期性是指一定种类的粒子(原子或原子团)在空间一定的方向上每隔一定的距离重复出现的现象。
周期性重复的两要素:周期性重复的内容(结构基元(structural motif))和重复大小和方向。
(2)点阵(lattice)结构点阵: 连接任意两点的向量平移后能重合的一组点。
a 线性高分子—(CH2)n—与直线点阵素向量b As2O3,B(OH)3,石墨与平面点阵平面点阵单位:正方,六方,巨型,带心,一般。
c NaCL晶体与空间点阵点阵单位:素单位(P) 底心(C) 体心(I) 面心(F)(3) 晶体与点阵对应关系:晶楞--直线点阵;晶面--平面点阵;晶体--空间点阵;*晶体结构= 点阵+ 结构基元(晶体基本特征)(二)晶胞晶胞:空间点阵单位所截出晶体的一块平行六面体。
(1)晶胞(crystal cell)两要素:大小形状和内容。
(2)晶胞参数: 三个互不平行的楞长(a,b,c)及他们的夹角γαβ。
<ab γ,<bc=α,<ca=β(3)原子坐标:晶轴:a, b, c ;分数坐标例NaCL: Na 0 0 0, 1/2 1/2 0, 0 1/2 1/2, 1/2 0 1/2Cl 1/2 0 0, 0 1/2 0, 0 0 1/2, 1/2 1/2 1/2CsCL: Cs 0 0 0, Cl 1/2 1/2 1/2(CC 4): C=Na,C / 1/4 1/4 1/4, 1/4 3/4 3/4, 3/4 1/4 3/4, 3/4 3/4 1/4* 坐标系不变,原子移动:例:*坐标系平移(原点选择不同):例: 金刚石(CC 4)(4)两点间距离:P 2—P 1 =b y y a x x )()(1212-+-+c z z )(12-= [(P 2-P 1).(P 2-P 1)]1/2正交:P 2—P 1 = [(x 2-x 1)2a 2+(y 2-y 1)2b 2+(z 2-z 1)2c 2]1/2可用于计算键长P 2--P 1 ,键角(c 2=a 2+b 2-2abCosin ab α)及二面角,确定分子结构,讨论分子性能;计算分子间的距离,讨论分子间作用力及氢键等。
晶体结构与常见晶体结构类型PPT课件
Z 底对角 线
底对角 线 面对角 线
1,`1 2,m,2/m 222,mm2,mmm
4,`4,4/m,422, 4mm, `42m, 4/mmm
3,`3, 32,3m, `3m
6,`6, 6/m,622, 6mm, `62m, 6/mmm
23,m3,432, `43m, m`3m
晶体的分类
晶族和晶系
过该点的任意直线的两端可以找到与其等距离的点。
对应的对称操作:对此点的反伸(倒反)。
C
一个晶体中可以有对称中心,也可以没有对称中心;如果有对称中心,那么只能有一个, 且位于晶体的几何中心。
第37页/共63页
2 、对称面m(mirror plane):一个假想的平面,它能将晶体分成互成镜 像反 映的两个相同部分。
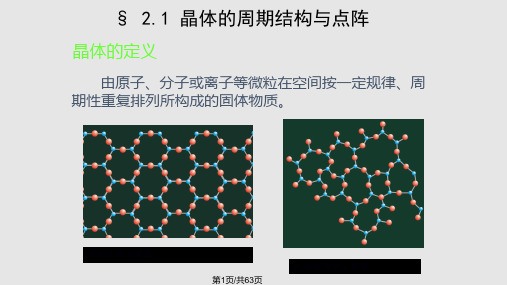
§ 2.1 晶体的周期结构与点阵
晶体的定义
由原子、分子或离子等微粒在空间按一定规律、周 期性重复排列所构成的固体物质。
晶态结构示意图
第1页/共63页
非晶态结构示意图
周期结构与点阵
(1)结构周期:晶体内部质点在三维空间周期性重复排列构成周期结构。
以NaCl晶体为例
Cl Na
0.563nm
2
第2页/共63页
第8页/共63页
第9页/共63页
(4)复式点阵(格子)
若晶体的基元中包括两种或两种以上的原子,则基元中每种原子可分别构成彼此完 全相同的点阵,但它们之间存在相对位移,形成复式点阵。
复式格子的特点 复式格子是由若干相同的布拉菲格子相互位移套构而成。
第10页/共63页
基元
结点
复式格子的特点
第11页/共63页
对称要素:在进行对称操作时所应用的辅助几何要素(点、线、
晶体结构与常见晶体结构类型

常见的晶体结构类型包 括金刚石结构、氯化钠 结构、铜锌结构等。
金刚石结构:以碳原子 氯化钠结构:以钠离子 铜锌结构:以铜和锌为
为例,金刚石结构中每 和氯离子为例,氯化钠 例,铜锌结构中铜原子
个碳原子通过共价键与 结构中每个离子通过静 和锌原子交替排列,形
四个相邻的碳原子相连, 电相互作用与六个相邻 成了一个立方面心晶格
晶体结构的研究有助于解决环 境、能源等领域的实际问题, 推动可持续发展。
晶体结构研究的方法
X射线晶体学
通过X射线衍射分析晶体结构, 是研究晶体结构最常用的方法 。
电子显微镜
通过观察晶体表面形貌和内部 结构,推断晶体结ቤተ መጻሕፍቲ ባይዱ。
原子力显微镜
通过观察表面原子排列,推断 晶体结构。
理论计算
通过计算模拟晶体结构,验证 实验结果。
形成了一个非常坚固和 的离子相连,形成了一 结构。这种结构在黄铜
稳定的晶格结构。这种 个立方面心晶格结构。 等合金中较为常见。
结构具有高硬度和光学 这种结构在食盐(氯化
性能等特点。
钠)等矿物中较为常见。
02
常见晶体结构类型
面心立方晶格(FCC)
总结词
面心立方晶格是一种常见的晶体结构,其原子分布在立方体的面心上,每个原子周围都 有12个最近邻原子。
VS
详细描述
在体心立方晶格中,原子位于立方体的角 上和体心上,每个原子与周围8个最近邻 原子相连接,形成了一个较为紧密的结构 。这种结构在某些金属元素中较为常见, 如铬、钼和钨等。由于其特殊的原子排列 方式,体心立方晶格结构具有较高的硬度 和强度,常用于制造耐磨和耐高温的部件 。
密排六方晶格(HCP)
晶体结构与常见晶体结构类型
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2-32(b)中25、75的Mg2+被Ca2+取代,则形成钙橄榄石
(4)[SiO4]四面体中心的Si4+离子可部分地被Al3+ 所取代。
硅酸盐晶体结构的分类:
硅酸盐晶体化学式中不同的Si/O比对应基本结构单元之间的不 同结合方式。X射线结构分析表明,硅酸盐晶体中[SiO4]四面体的
结合方式有岛状、组群状、链状、层状和架状等五种方式。硅酸盐
晶体也分为相应的五种类型,其对应的Si/O由1/4变化到1/2,结构
泥熟料中的-C2S、-C2S和C3S等。
镁橄榄石Mg2[SiO4]结构
属斜方晶系,空间群Pbnm;晶胞参数a=0.476nm, b=1.021nm,c=0.599nm;晶胞分子数Z=4。如图2-32-1、 2-32-2、2-32-3所示。 镁橄榄石结构中,O2-离子近似于六方最紧密堆积排 列,Si4+离子填于四面体空隙的1/8;Mg2+离子填于八面体 空隙的1/2。每个[SiO4]四面体被[MgO6]八面体所隔开,呈 孤岛状分布。
• 硅酸盐化学式表示方法:
• 2. 结构式:先写连结硅氧骨干的阳离子,按低价 到高价的顺序,然后写硅氧骨干,并用 [ ]括起来, 最后写水,水可以是OH-形式的,也可以是H2O 分子形式的。 • 【Eg.】 钾长石 • 高岭土
K[ AlSi3O8 ] Al2 [Si2O5 ](OH )4
• 多水高岭土 Al2 [ Si2O5 ](OH )4 nH 2O
(a) (100) 面上的 投影图
(c) 立体侧 视图
(b)(001)面上的投影图
图2-32-1 镁橄榄石结构
图2-32-2 镁橄榄石晶体理想结构
图2-32-3 镁橄榄石结构
(a)(100)面上的投影图
图2-32-3 镁橄榄石结构
(b)(001)面上的投影图
结构中的同晶取代:镁橄榄石中的Mg2+可以被Fe2+以任
10/13/2018 3
• 硅酸盐化学式表示方法:
3.无机络盐表示法:把构成硅酸盐晶体的所有离子按照 一定比例和顺序全部写出来,先是1价、2价的金属离 子,其次是Al3+和Si4+,最后是O2-或OH-。如钾长石为 KAlSi3O8。
• 硅酸盐矿物中的水分子
• 1.吸附水:中性水分子,不参与晶体结构, 物理吸附于矿物颗粒表面/缝隙,含量不固 定,100 ℃以上逸出
一、硅酸盐晶体的组成表征、结构特点及分类
组成表征:
在地壳中形成矿物时,由于成矿的环境不可能十分纯净,
矿物组成中常含有其它元素,加之硅酸盐晶体中的正负离
子都可以被其它离子部分或全部地取代,这就使得硅酸盐 晶体的化学组成甚为复杂。因此,在表征硅酸盐晶体的化 学式时,通常有两种方法:一种是所谓的氧化物方法,另 一种是无机络盐表示法和结构式写法。
(鲍林规则:Si高电价、低配位)
硅酸盐晶体结构的共同特点:
(1)构成硅酸盐晶体的基本结构单元[SiO4]四面体。Si-O-
Si键是一条夹角不等的折线,一般在145o左右。
(2)[SiO4]四面体的每个顶点,即O2-离子最多只能为两个
[SiO4]四面体所共用。
(3)两个相邻的[SiO4]四面体之间只能共顶而不能共棱或 共面连接。
• 2.结构水:(化合水)以OH-存在,参与 晶体结构,占据晶格固定位置,含量比确 定,600~1000℃逸出导致结构破坏重组
Al2 [Si2O5 ](OH )4
• 硅酸盐矿物中的水分子
• 3.层间水:层状硅酸盐结构层之间,中性水 分子,参与晶体结构,含量大范围波动,110 ℃以上大量逸出
• 层间水含量受交换阳离子及空气潮湿环境影 响,吸水膨胀性(层间距↑),水分子逸出, 层间距↓
2、无机硅酸盐在空间的结合 (1) 结构亚单元间的结合形式 A、直接连接--共顶(棱、面) 共用顶角氧 B、间接连接 a、离子键键合:为达电中性引入 正离子而形成的离子键 b、分子间力:亚单元(及其结合体) 间的Van der waals力
由于氧原子用于键合的是两个具有方向 性的轨道,所以[SiO4]4-亚单元之间通常 以共顶相连接,偶尔共棱,从不共面
• 硅酸盐化学式表示方法:
• 1. 氧化物式:金属氧化物先低价、后高价, SiO2在最后,之后写结构水、层间水(+) • 【Eg.】 钾长石 • 高岭土
K2O Al2O3 6SiO2
Al2O3 2SiO2 2H 2O • 多水高岭土 Al2O3 2SiO2 2H 2O nH 2O
二、岛状结构
结构特点:
[SiO4]四面体以孤岛状存在,各顶点之间并不互相连接, 每个O2-一侧与1个Si4+连接,另一侧与其它金属离子相配位使 电价酸盐晶体主要有锆石英Zr[SiO4]、镁橄榄石
Mg2[SiO4]、蓝晶石Al2O3· SiO2、莫来石3Al2O3· 2SiO2以及水
变得越来越复杂,见表2-8。
表2-8 硅酸盐晶体结构类型与Si/O比的关系
结构类 型 岛状 [SiO4]4- 共 用 O2-数 0 1 组群状 2 四面体 [SiO4]4[Si2O7]6[Si3O9]6[Si4O12]8[Si6O18]12[Si2O6]4[Si4O11]6[Si4O10]4[SiO2]0 架状 4 骨架 [AlSi3O8]1[AlSiO4]11:2 1:4 2:7 1:3 1:3 1:3 1:3 4:11 4:10 镁橄榄石 Mg2[SiO4] 镁铝石榴石 Al2Mg3[SiO4]3 双四面体 三节环 四节环 硅钙石 Ca3[Si2O7] 蓝锥矿 BaTi[Si3O9] 斧石 Ca2Al2(Fe,Mn)BO3[Si4O12](OH) 六节环 链状 2 2,3 层状 3 单链 双链 平面层 绿宝石 Be3Al2[Si6O18] 透辉石 CaMg[Si2O6] 透闪石 Ca2Mg5[Si4O11]2(OH)2 滑石 Mg3[Si4O10](OH)2 石英 SiO2 钾长石 K[AlSi3O8] 方钠石 Na[AlSiO4] 4/3H2O 形状 络阴离子 Si/O 实例
