第15章 杂环化合物
有机化学习题指南(2)
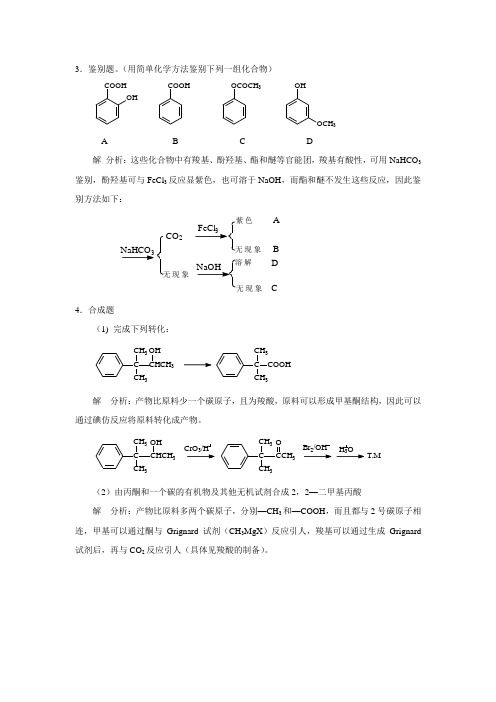
3.鉴别题。
(用简单化学方法鉴别下列一组化合物)COOHOHCOOH OCOCH3OHOCH3A B C D解分析:这些化合物中有羧基、酚羟基、酯和醚等官能团,羧基有酸性,可用NaHCO3鉴别,酚羟基可与FeCl3反应显紫色,也可溶于NaOH,而酯和醚不发生这些反应,因此鉴别方法如下:NaHCO3CO2无现象色现象解现象ABDC4.合成题(1) 完成下列转化:C CH3 CH3CHCH3OHCCH3COOHCH3解分析:产物比原料少一个碳原子,且为羧酸,原料可以形成甲基酮结构,因此可以通过碘仿反应将原料转化成产物。
C CH3 CH3CHCH3OH/HCCH3CH33OBr/OH H3O T.M(2)由丙酮和一个碳的有机物及其他无机试剂合成2,2—二甲基丙酸解分析:产物比原料多两个碳原子,分别—CH3和—COOH,而且都与2号碳原子相连,甲基可以通过酮与Grignard试剂(CH3MgX)反应引人,羧基可以通过生成Grignard 试剂后,再与CO2反应引人(具体见羧酸的制备)。
CH 3CH 33O CH 3MgX(1)2+CH 3CCH 3OHPBr 3CH 3CH 3CCH 3Br 2 Mg/无水乙醚CH 3CH 3CCH 3MgBr(2) H 2O/H +CH 3CH 3CCH 3COOH5.推导题化合物A (C 3H 4OCl 2) 与冷水作用生成酸性化合物B (C 3H 5O 2Cl),A 与乙醇反应生成液体化合物C(C 5H 9O 2Cl),A 在水中煮沸可得化合物D(C 3H 6O 3);D 含有手性碳原子并且可以被乙酰化。
试推断A 、B 、C 、D 的构造式。
解 通过计算可知,化合物A 的不饱和度u=1,与冷水作用生成酸性化合物B ,说明A 为酰氯,B 为羧酸,A 与乙醇反应生成的液体化合物C 为酯。
A 在水中煮沸可得化合物D ,D 含有手性碳原子并且可以被乙酰化,表明D 含有羟基,而且该羟基与手性碳相连,因此A 、B 、C 、D 的构造式分别为A B C DCH 3CHCOClClCH 3CHCOOHClCH 3CHC OOC 2H Cl5CH 3CHCOOHOH第13章 胺及其衍生物13.1 知识要点1.胺的命名简单的胺以习惯命名法命名,在胺之前加上烃基的名称来命名。
15-杂环化合物和生物碱

维生素B6
HO CH3 N CHO ) ( orCH2NH2 ¡ 吡哆醇 CH OH
2
CH2OH CH2OH
CHO CH2OH HO CH3 N CONHNH2 吡多醛
HO ) 3C
CH2OH N
N Î É ¬ ú Ë Ø B6 CH3 N Ñ ¼ Ì î £ á ¹ Å ¶ ¡ ¬Ä © Ò Å µ É ±³ æ ¼ Á ¨
(Ⅱ) 7H 嘌呤
嘌呤为无色晶体,m.p216~217℃,易溶于水,其水溶液呈中性, 但能与酸或碱成盐。 纯嘌呤环在自然界不存在,嘌呤的衍生物广泛存在于动植物体内。 O OH
NH 2 O N N N H N
N H2 N
HN
N
N H
HN H2N N N H
N
N N H2N NH N
腺嘌呤(A)
鸟嘌呤
19
第15章
杂环化合物
在环状化合物中,组成环的原子除C外,还含有
O、S、N等其它元素原子的化合物称为杂环化合物。
1
杂环化合物
1. 1.
杂环化合物的分类和命名 杂环化合物的分类
五元杂环 六元杂环
单杂环
稠杂环
2 .
苯并杂环
杂环并杂环
杂环化合物的命名
杂环化合物的命名有音译法和系统命名法两种。 音译法是按杂环化合物的外文名称音译,以口字旁同音 汉字表示。
COOCH 3 叶绿素
血红素
R= CHO b CH 3 CH 3 R'= CH 3 CHCH 2CH 2CH 2 3C CHCH 2
14
HOH 2C O O H
O H O H
H
OH N N CH3 CH3
P O
有机化学第十五章 杂环化合物

+
N
N
NO 2
N
N S O 3H
Br
B r2/H 2 S O 4
H+
+
N
N
B r 2 /CCl 4
OH -
Br Br
N
K MnO 4 /H +
CO 2 H
N
CO 2 H
H 2/P t N H
易发生亲电取代和氧化
5
8
N
易发生亲核取代和还原3
N +C3 H I
N
+ N C3 H I N
N
Br
+Br2 NH 2 N
1、亲电取代——困难:发生在β 位
混 酸 P hH室 温 P hN2O
混 酸
N2O
3 0 0 ℃ /1 天
N
N
H2SO4/H+g
220℃
N
N
SO3H
C3H N
H 2SO 4/K N3 O
100℃
C3H
C3H N
N2 O C3H
Br2/HcA Br NH 2 N
N—氧化物 δ+
NH 2 N
δ+
N
N+
吡唑和咪唑的分子聚合和互变异构:
b.p
水溶性
N
188
N
H N 263
N H
11 易溶
N
N
H
H
N
N
二聚体
N HN
N HN
N N
H
多聚体
嘌呤
N
N
N
NH
N
N
H 9—H
NH2
N
第十五章杂环化合物

唑的化学性质
y 碱性
>
>
>
>
1,3-唑 > 1,2-唑
唑的化学性质
y 亲电取代活性
苯 > 唑 > 吡啶
>
>
>
>
N
O
常见的五元杂环化合物
y 含单个杂原子的五元杂环
吡咯
呋喃 噻吩
吲哚
y 含多个杂原子的五元杂环
咪唑
噁唑
噻唑
N
N
吡唑 O 异噁唑 S 异噻唑
嘌呤
嘌呤
6
7
1
5
8 2
49
3
9H-嘌呤
7H-嘌呤
吡咯等的化学性质:亲电取代
y 傅克酰化:使用温和催化剂
吡咯等的化学性质:还原
H2/Ni
O
O
呋喃的双烯加成
呋喃芳香性较差,可体现共轭二烯的性质 吡咯、噻吩一般条件下不发生此类反应
吲哚的化学性质
C6H5CO2NO2
N H
O
O 0oC
NO2 N H
亲电取代反应性与呋喃类似 注意取代主要发生于3-位
Br2, 300oC
Br 39%
N
吡啶的化学性质:亲电取代
CH3
CH3
H3C
N
H2SO4 / HNO3 CH3 100oC, 5h H3C
N
NO2 CH3
93%
吡啶的化学性质:亲核取代
Cl
OMe
NaOMe/MeOH
N
N
吡啶的化学性质:亲核取代
(Chichibabin反应)
吡啶的化学性质:还原
常见的五元杂环化合物
第十五章 杂环化合物

O R-C-CH3 + N2
O
O
R'
+ R-C-CH2R' + N2
R
3
主要内容
第一节 第二节 第三节 第四节
杂环化合物的分类及命名 杂环化合物结构与芳香性 六元杂环化合物 五元杂环化合物
O
HH
NH
S CH3
NH2 O
N
CH3
COONa
氨苄青霉素钠 (amoxicillin)
0.140
4
3
0.139
N2
0.147 单
0.134 0.128 双
无芳香性
O
2H-吡喃 (无芳香性)
芳香性
N
N
嘧啶
N
喹啉
4n+2? 休克尔规则 4H-吡喃
(无芳香性)
O
N
异喹啉
二、五元杂环化合物
43
2
Z
Z = O、NH、S
ZC
C2 C3
呋喃 0.136(0.143) 0.1361
吡咯 0.1370(0.147) 0.1383
3
6
N2
N
1
6
2
N
1
6
2
N
1
哒嗪(pyridazine) 嘧啶(pyrimidine) 吡嗪(pyrazine)
六元杂环苯并环系
5 6
7 8
4 3
N2 1
喹啉
(quinoline)
5 6
7 8
4 3
N2 1
异喹啉
(isoquinoline)
54
O
6
【有机化学】杂环化合物

呋喃、噻吩的酰化反应在-C上发生,而吡咯的酰化反 应(不用催化剂)既能在 -C上发生,又能在N上发生。
(6) 呋喃、噻吩、吡咯的傅氏烷基化反应
总体看,在合成上无实用价值。
+ CH2O + HCl S
ZnCl2 0℃
CH2O + HCl ZnCl2, 25oC
ClH2C S
CH2Cl S CH2Cl
2.环的稳定性顺序 (根据离域能的大小) 苯〉噻吩〉吡咯〉呋喃 150 122 90 68
遇氧化剂或酸不稳定
3 吡咯的反应
NBS
N H
HNO 3, ( CH3C O )2O N H
N , SO3 N H
DMF, PO Cl3 N H
Br N H
NO 2 N H
SO 3H N H
C HO N H
+C 6H5N2+C l-
5
1
N H
2α
吡咯(pyrrole)
4
5
3
6 7
2 N H1
苯并吡咯
吲哚 (indole)
四 六元杂环化合物的命名
六元杂环
γ 4
5
3β
6 N 2α 1
吡啶(pyridine)
4
5
3
6
N2
N
1
哒嗪(pyridazine)
γ 4
5
3β
6 O 2α 1
O
4
5
3
6O 2 1
4
5
3
6
2
OO
1
吡喃(pyran) γ-吡喃酮
HNO 2
RO
Zn - HOAc
RO
EtOOC
第十五章+杂环化合物
号时,把连有氢原子的杂原子编号为 , 号时,把连有氢原子的杂原子编号为1,并使其余 杂原子的位次尽可能小 。
CH3
4
N3
N 2 1
4 –甲基咪唑 甲基咪唑
(3)如果环上有多个不同杂原子时,按氧、硫、 )如果环上有多个不同杂原子时,按氧、
氮的顺序编号
H 3 C
4
N
3
H 3 C
5
S
1
2
4,5–二甲基噻唑 二甲基噻唑
+
H2 O
吡啶的硝化反应需在浓酸和高温下才能进行, 吡啶的硝化反应需在浓酸和高温下才能进行,硝基 主要进β-位 主要进 位。
(3)磺化反应 )
+
O N
+ SO 3
C2H4Cl2 室温三天 O SO 3H
+
N
+
N H
N
+
SO3Biblioteka -C2H4Cl2100 ℃
N H
SO3H
+
N
吡咯,呋喃对酸很敏感,强酸能使它们开环聚合, 吡咯 呋喃对酸很敏感,强酸能使它们开环聚合,常用温和的非质子 呋喃对酸很敏感 磺化试剂:吡啶与SO 的加成物。 磺化试剂:吡啶与 3的加成物。
4
N3
4 5
N3 S1
2
O
S
N H
5
N1
2
呋喃 噻吩 吡咯 (furan) (thiophene) (pyrrole)
咪唑 (imidazole)
H
噻唑 (thiazole)
4 5
N3 N1
2
O
吡喃 (pyran)
6
N
吡啶 (pyridine)
第十五章 杂环化合物与生物碱
Kb: 2.5×10-15
2×10-4
15.3 六元杂环化合物
六元杂环化合物包括环中有1个杂原子的六元 杂环(如吡啶等);环中有多个杂原子的六元杂环 (如嘧啶等);以及稠杂环(如喹啉、嘌呤等)。 一、吡啶(C5H5N) 吡啶存在于煤焦油、骨焦油中,其衍生物广泛 存在于自然界。工业上主要从煤焦油的轻油部分提 取吡啶。 吡啶是具有特殊臭味的无色液体, bp115.5℃ , 可与水、乙醇、乙醚等混溶。
1. 吡啶的结构
结构似苯,也是平面六边形分子(但不是正六边形)。 分子中 C—C键长139pm(与苯的相等),C—N键长137pm, 介于一般的 C—N 单键 (157pm) 与 C=N 双键 (128pm) 之间。
139pm
139pm
137pm Pyridine Benzine
H
H
H
环中的N和C都 以 sp2 杂化轨道相互 以s 键相连。每个原 子余下的 p 轨道相互 平行重叠,形成环 闭共轭体系, p 电子 数为6,具有芳香性.
70%
NO2 NO2 S
5%
磺化: 95%H2SO4 25℃
(69%~76%)
S
SO3H
噻吩-2-磺酸
溴代: Br2 (或I2) 乙醇(稀释)/0℃
Br Br
Br Br
产物均为 四卤吡咯
硝化: CH3CO2NO2 乙酸酐/5℃
NO2 NO2 51% 13%
吡咯
磺化:吡啶.SO3 100℃
SO3H
吡咯-2-磺酸
亲电取代反应主要在2-位发生;若2、5两个位 置已有基团存在,则亲电取代在b位发生。
-0.06 -0.10 +0.32
这些杂环进行亲电取代反应时, 须用缓和的试剂在温和的条件下进行。
杂环化合物和生物碱-有机化学
溶解1份吡咯、呋喃及噻吩,分别需要17、 35、700份的水。 当五元杂环上连有羟基时,溶解度增大。
如: O
H3C O OH
S
S
OH
(1:35)
(1:20)
(1:700)
(1:16)
3. 杂环化合物的化学性质 (1)、亲电取代反 应
N H O S
HNO3
I2 NaOH
吡咯、呋喃、噻吩 α位取代
I
第四节 稠杂环化合物
稠杂环化合物是指苯环与杂环稠合或杂环与杂环稠合在一起的化 合物。常见的有喹啉、吲哚和嘌呤。
泳衣品牌
3 2 d ★ c
N
a b
N
1
N
★ b 2 a 3
N1
S
N
吡啶并[2,3-d]嘧啶
咪唑并[2,1-b] 噻唑
第二节
五元杂环化合物
五元杂环化合物包括含有1个杂原子的五元杂 环和含2个杂原子的五元杂环。 一、含1个杂原子的五元杂环化合物 1.结构
4 5 1N 3 2
4 5 3 2 4 5 3 2
OH
2.亲电取代反应
Cl2, AlCl 3 100 ℃ Br2, 浮石催化 300 ℃ 气相
Cl
3 氯吡啶
N
Br
3 溴吡啶
N
NO2
N
浓 H2SO4 HgSO4 催化, ℃ 220 混酸 300 ℃
3 硝基吡啶
N
SO3H
吡啶 3 磺酸
N
3.氧化还原反应
(1)氧化反应
COOH N β 吡啶甲酸(烟酸) HNO 3 N COOH N α 吡啶甲酸
由于吡啶环的N上在环外有一孤对电子,故吡啶环上的电荷分布不均。
有机化学第十五章杂环化合物
第十五章 杂环化合物 糠醛经催化加氢转化为四氢糠醇,具有醇和醚的性 质,是优良的溶剂。
糠醛用KMnO4的碱溶液或用Cu或Ag的氧化物为催化 剂,用空气氧化生成糠酸。
糠醛作为溶剂,可选择性地从石油、植物油中萃取其中的 不饱和组分和含硫化合物。如从润滑油中萃取芳香烃等以精致 润滑油。在合成橡胶工业中用于提纯丁二烯和异戊二烯。
第十五章 杂环化合物 六元单杂环吡啶的结构与苯环很相似,氮原子与碳原子 处在同一平面上,原子间是以sp2杂化轨道相互交盖形成六个 σ键,键角为120°。环上每一原子还有一个电子在p轨道上, p轨道与环平面垂直,相互交盖形成包括六个原子在内的分 子轨道。π电子分布在环的上方和下方。每个碳原子的第三 个sp2杂化轨道与氢原子的s轨道交盖形成σ键。氮原子的第三 个sp2杂化轨道上有一对未共用电子对。 由于这些杂环化合物都是闭合的 共轭体系,所以环中的单、双键都不 同程度地趋向平均化,单键比普通单 键短,双键比普通双键长。
第十五章 杂环化合物 教学指导 杂环化合物的分类和命名法 杂环化合物的结构 杂环化合物的性质
第十五章 杂环化合物 教学目的: 了解一些常见的重要杂环化合物物理和化学性质; 熟悉杂环化合物命名规则; 掌握呋喃、吡咯及其衍生物的物理和化学性质。 教学难点:
杂环化合物命名规则;
呋喃、吡咯及其衍生物的物理和化学性质。 教学重点: 呋喃、吡咯及其衍生物的物理和化学性质。
第十五章 杂环化合物 2.吡咯及其衍生物 吡咯与呋喃相似,亲电取代也必须在缓和的条件下 进行,在酸性条件下同样极易发生开环、聚合反应。 溴化:
第十五章 杂环化合物 根据环数的多少分为单杂环和多杂环;单杂环又可根据 成环原子数的多少分为五元杂环及六元杂环等;多杂环可分 为稠杂环、桥杂环及螺杂环,其中以稠杂环较为常见。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
54
6
3
7
N2
81
异喹啉
isoquinoline
[命名] 音译名
(Imidazole)
H N
( Thiophene)
O
S
S
H
H
N
NN
N
N
吡咯 呋喃
(Pyrrole)(Furan)
噻吩 噻唑 咪唑 吡唑
( Thiazole)
(Pyrazole)
N N
N
吡啶Pyridine
喹啉Quinoline
异喹啉Isoquinoline
CH3COONO2
O
- 5~30oC
O NO2
(35%)
CH3COONO2
N H
OH-,5oC,Ac2O
N NO2 + H (83%)
NO2
N H
(7%)
当呋喃或吡咯环上连有吸电子基团时,环的稳定性
增 加,可用一般方法硝化。
O2N
N H
CCH3 O
HNO3 H2SO4
O2N
N H
CCH3 + O
N H
吡啶N
P
N
SP2
N 吡咯N
P
H
SP2
C
呋喃O(噻吩S)
P
P
SP2
SP2
“多π”芳杂环———六个电子由五个原子分配,每个碳 原子的电子云密度比苯环高,故亲电取代比苯容易。
H
O
S
N
2.33 10-30C.m 1.70 10-30C.m 6.03 10-30C.m
N原子
给电子共轭>> 吸电子诱导。
吡啶N:吸电子诱导+吸电子共轭
碱性: 咪唑 酸性: 吡唑 pKa 7.0
> 吡唑 > 咪唑
2.5
> 噻唑 > 吡咯
17.5
3、化学反应及互变异构
吡啶N的吸电作用,其亲电取代比含一个杂原子的五
元杂环要低,对氧化剂也不敏感。
4(5)-硝基咪唑
N 发烟H2SO4
N
S HgSO4,250。C HO3S S
N
CH3 KNO3,1000CCH3
N (66%)
CH3
SO3H (70%)
N
3、亲核取代反应
吡啶类似硝基苯
易发生亲核取代反应。 、位,以位为主, 因α位 离N比γ位近,受吸电子诱导影响较大。
N
+ NaNH2
PhN(CH3)2 回流
H2O N NHNa
N NH2
若两个α位已有基团,则发生在γ位。 齐齐巴宾反应
吡啶与RLi或ArLi(强碱性的亲核试剂)作用,可在吡啶 的α与γ位引入烷基或芳基。—消除-加成机理
+ PhLi N
Ph +LiH N
吡啶环的α位和γ位的C缺少电子,若这些位置上有
易离去的基团(Cl、Br、NO2等,其阴离子较稳定),可与氨 (或胺)、烷氧化物、水等亲核试剂发生SN。
NHC6H5
NaOMe
PhN H2
Cl
N Cl HOMe,
N
NH2
N
NH3
NaOH
N OMe
180~2000C N
N Br H2O,
N OH
4、氧化还原反应
吡啶比苯稳定,不易被氧化,当有侧链时,总是侧链先氧化生 成 相应的吡啶甲酸。
N HNO3
CH3 N
烟碱(尼古丁)
COOH NH3
N
烟酸
CONH2
N
烟酰胺
CH3 HNO3 ,
N
N
NN
嘌呤Purine
H N
吲哚 Indole
编号从杂原子开始,尽可能使取代基的位次较小。遇两 相同杂原子, 则由带取代基(或H)的杂原子开始。含多个不 同杂原子, 则按 O S N 顺序编号。
CH3
C2H5 O CH3 N
O2N O CHO
2-甲基-5乙基呋喃
4-甲基吡啶
5- 硝 基 -2呋喃甲醛
95%H2SO4
S
室温
69%~76% S SO3H
4)傅-克酰基化
吡啶不发生傅-克反应
Ac2O
O BF3
O COCH3 75~92%
Ac2O
S H3PO4 S COCH3 94%
Ac2O
N 150 ~ 200。C N COCH3 60%
H
H
吡咯与苯酚的性质相似(吡啶相似于硝基苯),可发生 瑞默尔-梯门(Reimer-Tiemann)反应及与重氮盐偶合:
吡啶
六氢吡啶
0nm
0.130nm
吸
吸电子诱导
电
吸电子共轭
N 0.134nm
-30
µ=7.4× 10 c.m
N
H
-30
µ=3.9× 10 c.m
子 诱 导
3 ) 缺“π”芳杂环—氮原子使环上碳原子的电子云密度降 低,亲电取代反应比苯难进行。
吡啶的性质
吡啶N
P
1、弱碱性 (pKa=5.19)
Ag(NH3)2
CHO O
COOH O
2. 不含α-H的芳醛,可发生康尼扎罗(Cannizzaro S.)反
应
浓NaOH
CHO O
O
COOH +
O
CH2OH
3. 在醋酸存在下与苯胺作用,生成一种亮红色缩合产 物,可检验糠醛。
O CHO + H2N
- H2O
CH=N O
二)含两个杂原子的五元杂环
1、结构与物理性质
SP2杂化变为SP3杂化, S成分减少,电子受核束缚减弱,结合H+
的能力比SP2杂化的N强)。
三、五元杂环化合物
一)呋喃、噻吩和吡咯
4 4 4
5
2
1O
呋喃
5
2
1S
噻吩
5 1HN
2
吡咯
1、结构和芳香性 furan thiophene pyrrole
sp 2
Z Z= O S NH
碳原子P轨道中有一个电子 杂原子P轨道中有两个电子 形成环状离域大键。 电子数:6 有芳香性。
P
1、吡啶 有特殊臭味,无色液体。
SP2
N
具有碱性
未参与共轭
N
未参与成键
处于sp2杂 化轨道上
一个闭合的共轭体系 特点: 符合休克尔4n+2规则 吡啶具有芳香性
1)C-C键长与苯近似,C-N键长则处于C-N键长和C=N 键长之间。说明吡啶环系具有与苯相似的结构。
2)吸电子诱导效应和吸电子共轭效应共存,方向一致 。 键长不象苯(0.140nm)一样完全平均化。
低 b)Lewis酸与吡啶生成酸碱络和物。
卤化:
Br2,浮石
Br Br
Br
+
N
3000C
N
N
(37%)
(26%) Br2 Br
硝化:
浓HNO3,浓H2SO4
N
NO2
AcOH,200C NH2
N (92%)
NH2
N
3000C,1天
N (6%)
磺化:
CH3
SO3,H2SO4
N
HgSO4
浓H2SO4
NO2
第十五章 杂环化合物
(heterocyclic compounds)
构成环的原子除C外还有其它原子的一类环状化合物 。
最常见的杂原子:O、N和S,以N为最多。
O H2C CH2
O
HC C
HC
O C
O
C NH
C
O
O
环氧乙烷 顺丁烯二酸酐
邻苯二甲酰亚胺
本章主要讨论具有芳香性的杂环化合物,即芳杂环化合 物(aromatic heterocycles)。环比较稳定、在结构上与芳香族化合 物相似。(环为平面型,π电子数符合4n+2规则)
2、亲电取代反应
反应活性: 吡啶 < 苯环
吡啶N的吸电子诱导和吸电子共轭与硝基苯类似
反应发生在位。、位不发生反应。
0.87 1.01
N 0.84
1)硝化、磺化等只能在极强的条件下进行,且产率很低 , 当环上有给电子基团时,能增进吡啶环的反应活性。
2)吡啶环不能发生傅-克反应。原因:a)环上电子云密度
有芳香性,6e
咪
N 吡啶N
唑N
H 吡咯N
吡
N 吡啶N
唑
N H
吡咯N
N吡啶N 噻
S
唑
pKa 7.0
2.5
2.4
碱性: 咪唑 > 吡唑 > 噻唑
碱性中心
N
+ H+ N H
H N+ N H
水溶解度均比吡咯、呋喃、噻吩要大,因增加了一个氮 原子,从而增加了与水分子形成氢键的能力。
沸点差距较大,其中吡唑和咪唑沸点较高,因能形成 分 子间的氢键。
COOH
N
SeO2 N CH3
或 KMnO4/OH
N
2-吡啶甲醛
N CHO
3-吡啶甲酸 (烟酸)
N KMnO4 HOOC
N
P SP2
吡啶还原比苯容易
哌啶(六氢吡啶) SP3
有芳 香性
Na + C2H5OH
无芳 香性
N 或 H2/Pt , 0.3MPa, 250C
N
H
六氢吡啶易溶于水、乙醇和乙醚。碱性比吡啶强(N由
位比位活泼。亲电取代主要发生在位。
1)卤化
O
S
Br2
00C, 二噁烷 O
