以海绵铜为原料生产电镀级硫酸铜工艺技术
2020年高考化学一轮必刷好题专题18:化工流程中铜的化合物的转化含答案

2020年高考化学一轮必刷好题专题18:化工流程中铜的化合物的转化1、(2016四川)CuCl广泛应用于化工和印染等行业。
某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
【资料查阅】【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。
请回答下列问题:(1)仪器X的名称是__________。
(2)实验操作的先后顺序是a→______→e(填操作的编号)。
a.检查装置的气密性后加入药品b.熄灭酒精灯,冷却c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热e.停止通入HCl,然后通入N2(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是_______。
(4)装置D中发生的氧化还原反应的离子方程式是________________。
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:①若杂质是CuCl2,则产生的原因是________________。
②若杂质是CuO,则产生的原因是________________。
【答案】(1)干燥管(2)c d b(3)先变红,后褪色(4)Cl2+2OH-=Cl-+ClO-+H2O(5)①加热时间不足或温度偏低②通入HCl的量不足【解析】试题分析:(1)根据仪器X的构造特点知其名称为干燥管,答案为:干燥管。
(2)加热CuCl2·2H2O制备CuCl,为防止生成的CuCl被空气中的氧气氧化和Cu+水解,必须要先通入干燥的HCl气体赶走装置中的空气再加热,且要在HCl气流中加热制备,反应结束后先熄灭酒精灯,继续通入氮气直至装置冷却,所以操作顺序为:a-c-d-b-e,答案为:c d b。
(3)B中物质由白色变为蓝色,说明有水生成,产物中还有Cl2,所以C中石蕊试纸先逐渐变为红色,后褪色,答案为:先变红,后褪色。
(4)D中是Cl2和NaOH反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,答案为:Cl2+2OH-=Cl-+ClO-+H2O。
《易错题》初中高中化学必修二第五章《化工生产中的重要非金属元素》习题(培优练)

一、选择题1.下列表述Ⅰ、Ⅱ均正确并且有因果关系的是 选项 表述Ⅰ 表述ⅡA SO 2具有漂白性SO 2能使酸性KMnO 4溶液褪色B SiO 2具有弱氧化性 工业上利用SiO 2与焦炭制备粗硅C NH 3是电解质NH 3的水溶液可以导电D 浓硫酸具有吸水性 可用来干燥H 2S 气体A .AB .BC .CD .D2.下列离子在指定溶液中能大量共存的是 A .1.0 mol·L -1的KNO 3溶液:H +、Fe 2+、Cl -、SO 24-B .1.0 mol·L -1的FeCl 2溶液:NO 3-、Na +、K +、ClO - C .使酚酞变红的溶液中:Na +、Cl -、SO 24-、Fe 3+ D .酸性溶液中:NO 3-、SO 24-、Fe 3+、Mg 2+3.以海绵铜(含有少量CuO 杂质的海绵状的铜)为原料生产CuCl 的工艺流程如图所示。
已知CuCl 难溶于水,可溶于氯离子浓度较大的溶液,易水解、氧化。
下列说法正确的是A .“溶解”过程中可用浓盐酸代替硫酸B .“溶解”过程中反应的离子方程式为Cu+4H ++2-3NO =Cu 2++2NO 2↑+2H 2O C .“反应”过程中反应的离子方程式为2Cu 2++2Cl -+2-3SO +H 2O=2CuCl↓+2-4SO +2H + D .“烘干”过程可用坩埚在空气中进行4.以下化合物中,不能通过化合反应直接生成的有①Fe 3O 4;②Fe(OH)3;③HNO 3;④NH 4NO 3;⑤NaAl(OH)4;⑥Na 2CO 3;⑦NaHCO 3;⑧Na 2O 2。
A .0种B .1种C .2种D .3种5.氮化铝(AlN) 是一种新型无机材料。
某学习小组为测定m g 氮化铝(仅含有Al 2O 3杂质)样品中AlN 的纯度,设计如图实验装置,下列说法中不正确的是已知:AlN+NaOH+H 2O=NaAlO 2+ NH 3↑ A .读数时量气装置两侧液面一定要保持相平B .为测定生成气体的体积,装置中的X 可以是NH 4Cl 溶液C .完全反应后,测得标准状况下气体的体积为V mL ,则氮化铝的纯度为41V22400m×100%D .如果撤去导管a ,测得样品的纯度偏高6.将表面镀铜的铝件浸入某种酸中后快速提出,可除去镀层而不损坏铝件。
硫酸铜电镀工艺介绍

硫酸铜电镀工艺介绍现代电镀网6月17日讯:(每日电镀行业最新资讯推送请关注微信公众号:现代电镀网)铜既要掩盖钢辊的缺陷,又要为下道工序——电雕展示最好的工作面。
镀铜是一个极为复杂的过程,对其控制应极为严密,稍有马虎,就需要耗费大量的时间、人力、物力来纠正所出现的问题。
(一)镀铜工艺流程金工滚筒→检验→发配滚筒→滚筒前处理→预镀镍→打磨清洗→镀铜→卸滚筒→交车磨(二)滚筒镀铜原理镀铜层呈粉红色,质柔软,具有良好的延展性。
镀铜槽中电解溶液的主要成分是硫酸(H2SO4)和硫酸铜(CuSO4²5H2O)。
铜在这种溶液中以铜离子(Cu2+)形式存在。
电解铜作为阳极,按半圆弧分布于电解溶液中,并与电源阳极相接。
滚筒横放在电解槽中,其表面有的是全部浸入电解溶液中,有的是半浸或1/3浸入电解溶液中,它与阴极相接,并以一定转速旋转。
通电后,阴阳两极发生化学反应,铜离子带有正电荷,被阴极吸引,在阴极获得电子而形成铜原子,并附着在滚筒上,完成电镀。
但事实上,由于某些原因会干扰这种反应过程,正负离子始终不会平衡,所以在实际生产中不容易制得很满意的电镀滚筒。
针对这种情况,只能尽力做到减少干扰因素,根据本公司的条件,进行各种器材、工艺的匹配,以制得满意的电镀滚筒。
(三)加强导电性管理提高铜层质量,重要的是控制好电流差,保证导电部位干净和接触良好,使电流值分布均匀,使滚筒两端和中间的铜层硬度一致。
(四)镀铜液的主要成分凹版电镀采用硫酸盐镀铜,镀液的基础成分是硫酸铜和硫酸。
硫酸铜用来供给镀液中的铜离子,硫酸则能起到防止铜盐水解、提高镀液导电能力和阴极极化的作用。
由于镀液的电流效率高(近于100%),可镀得较厚的镀层。
当然,要保证各种化学品的纯度与稳定。
镀铜液的主要成分如下:1.硫酸铜(CuSO4²5H2O),是蓝色晶体,颗粒大小如玉米粒,应尽量无黄色,工业级可用。
根据生产条件和不同要求,硫酸铜的含量有的公司规范为200~250g/L,有的为210~230g/L,有的为180~220g/L。
2020-2021高考化学铜及其化合物推断题综合题含答案解析

2020-2021高考化学铜及其化合物推断题综合题含答案解析一、铜及其化合物1.A 为金属单质,B 、C 、D 、E 四种均为含有氯元素的物质,它们存在如图转化关系(部分产物已略去,有的反应在溶液中进行)。
请回答:(1)A 是_____________,C 是_____________。
(均用化学式表示)(2)写出实验室制备 D 的化学方程式:_____________。
(3)写出用 B 溶液与 Cu 反应制作印刷电路板的离子方程式:_____________。
(4)设计实验方案,检验 C 溶液中的金属阳离子:_____________【答案】Fe FeCl 2 MnO 2+4HCl(浓)=∆MnCl 2+Cl 2↑+2H 2O Cu+2Fe 3+═Cu 2++2Fe 2+ 取C 溶液于试管中,向其中滴加KSCN 溶液,溶液不变色,再滴加氧化剂(如氯水、双氧水)后溶液显血红色,说明含有Fe 2+,或者取样滴加用铁氰化钾溶液,有蓝色沉淀产生,则含有Fe 2+【解析】【分析】A 为金属单质,B 、C 、D 、E 四种均为含有氯元素的物质,根据转化关系可知,A 为变价金属,且B 与A 反应生成C ,则A 为Fe ,D 为Cl 2,B 为FeCl 3,C 为FeCl 2,A 与E 反应生成C(FeCl 2),结合(3)“用B 溶液与Cu 反应制作印刷电路板”可知,E 为HCl ,据此解答。
【详解】(1)根据分析可知,A 为Fe ,C 为FeCl 2,故答案为:Fe ;FeCl 2;(2)实验室中通过加热浓盐酸与二氧化锰制取氯气,该反应的化学方程式为:MnO 2+4HCl(浓)=∆MnCl 2+Cl 2↑+2H 2O ,故答案为:MnO 2+4HCl(浓)=∆MnCl 2+Cl 2↑+2H 2O ;(3)B 为FeCl 3,Cu 与氯化铁反应生成氯化亚铁和氯化铜,该反应的离子方程式为:Cu+2Fe 3+═Cu 2++2Fe 2+,故答案为:Cu+2Fe 3+═Cu 2++2Fe 2+;(4)C 为FeCl 2,其阳离子为Fe 2+,检验Fe 2+的方法为:取C 溶液于试管中,向其中滴加KSCN 溶液,溶液不变色,再滴加氧化剂(如氯水.双氧水)后溶液显血红色,说明含有Fe 2+,或者取样滴加用铁氰化钾溶液,有蓝色沉淀产生,则含有Fe 2+,故答案为:取C 溶液于试管中,向其中滴加 KSCN 溶液,溶液不变色,再滴加氧化剂(如氯水.双氧水)后溶液显血红色,说明含有Fe 2+,或者取样滴加用铁氰化钾溶液,有蓝色沉淀产生,则含有Fe 2+。
《好题》初中高中化学必修二第五章《化工生产中的重要非金属元素》经典题(含答案)
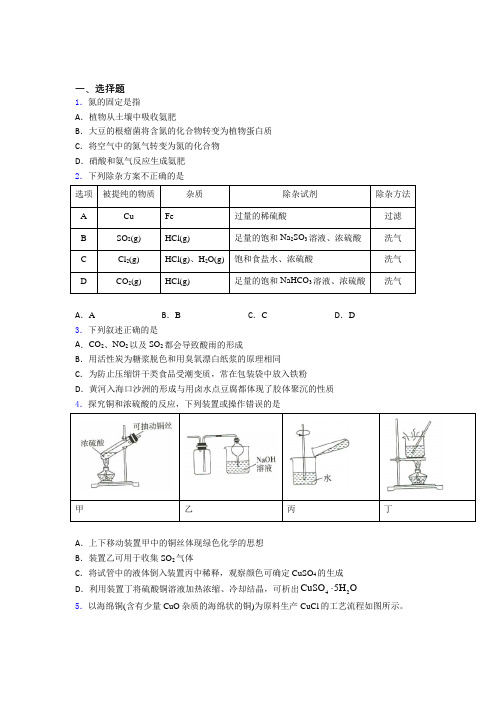
一、选择题1.氮的固定是指A .植物从土壤中吸收氨肥B .大豆的根瘤菌将含氮的化合物转变为植物蛋白质C .将空气中的氮气转变为氮的化合物D .硝酸和氨气反应生成氨肥2.下列除杂方案不正确的是 选项 被提纯的物质 杂质 除杂试剂 除杂方法 ACu Fe 过量的稀硫酸 过滤 BSO 2(g) HCl(g) 足量的饱和Na 2SO 3溶液、浓硫酸 洗气 CCl 2(g) HCl(g)、H 2O(g) 饱和食盐水、浓硫酸 洗气 D CO 2(g) HCl(g) 足量的饱和NaHCO 3溶液、浓硫酸洗气A .AB .BC .CD .D3.下列叙述正确的是A .CO 2、NO 2以及SO 2都会导致酸雨的形成B .用活性炭为糖浆脱色和用臭氧漂白纸浆的原理相同C .为防止压缩饼干类食品受潮变质,常在包装袋中放入铁粉D .黄河入海口沙洲的形成与用卤水点豆腐都体现了胶体聚沉的性质4.探究铜和浓硫酸的反应,下列装置或操作错误的是甲 乙 丙 丁 A .上下移动装置甲中的铜丝体现绿色化学的思想B .装置乙可用于收集SO 2气体C .将试管中的液体倒入装置丙中稀释,观察颜色可确定CuSO 4的生成D .利用装置丁将硫酸铜溶液加热浓缩、冷却结晶,可析出42CuSO 5H O5.以海绵铜(含有少量CuO 杂质的海绵状的铜)为原料生产CuCl 的工艺流程如图所示。
已知CuCl 难溶于水,可溶于氯离子浓度较大的溶液,易水解、氧化。
下列说法正确的是A .“溶解”过程中可用浓盐酸代替硫酸B .“溶解”过程中反应的离子方程式为Cu+4H ++2-3NO =Cu 2++2NO 2↑+2H 2OC .“反应”过程中反应的离子方程式为2Cu 2++2Cl -+2-3SO +H 2O=2CuCl↓+2-4SO +2H + D .“烘干”过程可用坩埚在空气中进行6.实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )A .装置①常用于分离互溶的液体混合物B .装置②可用于吸收HCl 气体,并防止倒吸C .以NH 4Cl 为原料,装置③可用于实验室制备少量NH 3D .装置④b 口进气可收集H 2、NO 等气体7.下列有关物质的性质与用途具有对应关系的是( )A .二氧化硫具有强还原性,可用作漂白剂B .硅胶具有弱酸性,可用作袋装食品的干燥剂C .硝酸能发生酯化反应,可用于制造硝化甘油D .氧化铝熔点高,可用于制坩埚熔化烧碱固体8.下列说法不正确的是A .向浓氨水中滴入AgNO 3溶液制取银氨溶液B .水玻璃浸泡过的木材,既耐腐蚀又不易着火C .氢氧化铝可用于治疗胃酸过多D .超纯硅可用以制造计算机芯片9.含氮化合物在水体中过多蓄积会导致水体富营养化,需将其从水体中除去,该过程称为脱氮.常用的脱氮方法有吹脱法和折点氯化法.吹脱法:调节水体pH 至8左右,然后持续向水中吹入大量空气.折点氯化法:调节水体pH 至6左右,向水中加入适量NaClO .下列分析不正确的是( )A .含氨和铵盐的水体中存在平衡:43232NH OH NH H O NH H O +-+⋅+B .吹脱法的原理是通过鼓气降低3NH 浓度,从而降低水中32NH H O ⋅与4NH +的含量C .折点氯化法除4NH +的原理为:+-+4222NH +3ClO =N +3Cl +3H O+2H -↑D .吹脱法无法对含-2NO 的水体脱氮,但折点氯化法可以对含-2NO 的水体脱氮10.某废催化剂主要成分有SiO 2、ZnO 、ZnS 和CuS 。
2020-2021化学铜及其化合物推断题的专项培优 易错 难题练习题附答案

2020-2021化学铜及其化合物推断题的专项培优 易错 难题练习题附答案一、铜及其化合物1.A 为金属单质,B 、C 、D 、E 四种均为含有氯元素的物质,它们存在如图转化关系(部分产物已略去,有的反应在溶液中进行)。
请回答:(1)A 是_____________,C 是_____________。
(均用化学式表示)(2)写出实验室制备 D 的化学方程式:_____________。
(3)写出用 B 溶液与 Cu 反应制作印刷电路板的离子方程式:_____________。
(4)设计实验方案,检验 C 溶液中的金属阳离子:_____________【答案】Fe FeCl 2 MnO 2+4HCl(浓)=∆MnCl 2+Cl 2↑+2H 2O Cu+2Fe 3+═Cu 2++2Fe 2+ 取C 溶液于试管中,向其中滴加KSCN 溶液,溶液不变色,再滴加氧化剂(如氯水、双氧水)后溶液显血红色,说明含有Fe 2+,或者取样滴加用铁氰化钾溶液,有蓝色沉淀产生,则含有Fe 2+【解析】【分析】A 为金属单质,B 、C 、D 、E 四种均为含有氯元素的物质,根据转化关系可知,A 为变价金属,且B 与A 反应生成C ,则A 为Fe ,D 为Cl 2,B 为FeCl 3,C 为FeCl 2,A 与E 反应生成C(FeCl 2),结合(3)“用B 溶液与Cu 反应制作印刷电路板”可知,E 为HCl ,据此解答。
【详解】(1)根据分析可知,A 为Fe ,C 为FeCl 2,故答案为:Fe ;FeCl 2;(2)实验室中通过加热浓盐酸与二氧化锰制取氯气,该反应的化学方程式为:MnO 2+4HCl(浓)=∆MnCl 2+Cl 2↑+2H 2O ,故答案为:MnO 2+4HCl(浓)=∆MnCl 2+Cl 2↑+2H 2O ;(3)B 为FeCl 3,Cu 与氯化铁反应生成氯化亚铁和氯化铜,该反应的离子方程式为:Cu+2Fe 3+═Cu 2++2Fe 2+,故答案为:Cu+2Fe 3+═Cu 2++2Fe 2+;(4)C 为FeCl 2,其阳离子为Fe 2+,检验Fe 2+的方法为:取C 溶液于试管中,向其中滴加KSCN 溶液,溶液不变色,再滴加氧化剂(如氯水.双氧水)后溶液显血红色,说明含有Fe 2+,或者取样滴加用铁氰化钾溶液,有蓝色沉淀产生,则含有Fe 2+,故答案为:取C 溶液于试管中,向其中滴加 KSCN 溶液,溶液不变色,再滴加氧化剂(如氯水.双氧水)后溶液显血红色,说明含有Fe 2+,或者取样滴加用铁氰化钾溶液,有蓝色沉淀产生,则含有Fe 2+。
【学生卷】初中高中化学必修二第五章《化工生产中的重要非金属元素》经典测试(课后培优)

一、选择题1.下列表述Ⅰ、Ⅱ均正确并且有因果关系的是选项表述Ⅰ表述ⅡA SO2具有漂白性SO2能使酸性KMnO4溶液褪色B SiO2具有弱氧化性工业上利用SiO2与焦炭制备粗硅C NH3是电解质NH3的水溶液可以导电D浓硫酸具有吸水性可用来干燥H2S气体A.A B.B C.C D.D2.下列有关NH3两个实验说法中正确的是A.两个实验均表现了NH3易溶于水B.两个实验均表现了NH3易挥发C.两个实验均表现了NH3是碱性气体D.两个实验均表现了NH3是还原性气体3.下列有关反应的颜色变化与氧化还原反应无关的是A.新制氯水久置后浅黄绿色消失B.将NH3通入滴有酚酞的水中,溶液变红色,加热后又变无色C.往FeCl2溶液中滴入NaOH溶液,先出现白色沉淀,后转化为灰绿色,最后转化为红褐色D.NO2溶于水后变为无色,同时有气体放出,放出的气体遇到空气变为红棕色4.下列说法正确的是(N A是阿伏加德罗常数的值)A.0.1 mol FeCl3水解形成的Fe(OH)3胶体粒子数为0.1N AB.密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2N AC.1 mol Fe溶于过量硝酸,电子转移数为2N AD.120 g NaHSO4和KHSO3的固体混合物中含有的阳离子数为N A5.以海绵铜(含有少量CuO杂质的海绵状的铜)为原料生产CuCl的工艺流程如图所示。
已知CuCl难溶于水,可溶于氯离子浓度较大的溶液,易水解、氧化。
下列说法正确的是A.“溶解”过程中可用浓盐酸代替硫酸B .“溶解”过程中反应的离子方程式为Cu+4H ++2-3NO =Cu 2++2NO 2↑+2H 2O C .“反应”过程中反应的离子方程式为2Cu 2++2Cl -+2-3SO +H 2O=2CuCl↓+2-4SO +2H + D .“烘干”过程可用坩埚在空气中进行6.今有一混合物的水溶液,只可能含有以下离子中的若干种:K +、4NH +、Cl -、Mg 2+、Ba 2+、23CO -、24SO -,现取三份100mL 溶液进行如下实验: (1)第一份加入AgNO 3溶液有沉淀产生(2)第二份加足量NaOH 溶液加热后,收集到气体0.04mol(3)第三份加足量BaCl 2溶液后,得干燥沉淀6.27g ,经足量盐酸洗涤、干燥后,沉淀质量为2.33g 。
2023新教材高考化学二轮专题复习 专练4 实验、工艺流程之“小题大做”
专练4 实验、工艺流程之“小题大做”一、单项选择题1.[2022·山东卷]实验室用基准Na2CO3配制标准溶液并标定盐酸浓度,应选甲基橙为指示剂,并以盐酸滴定Na2CO3标准溶液。
下列说法错误的是( )A.可用量筒量取25.00 mL Na2CO3标准溶液置于锥形瓶中B.应选用配带塑料塞的容量瓶配制Na2CO3标准溶液C.应选用烧杯而非称量纸称量Na2CO3固体D.达到滴定终点时溶液显橙色2.[2022·湖北卷]下列实验装置(部分夹持装置略)或现象错误的是( )3.[2021·广东卷]化学是以实验为基础的科学。
下列实验操作或做法正确且能达到目的的是( )4.[2022·全国甲卷]根据实验目的,下列实验及现象、结论都正确的是( )5.[2021·肇庆模拟]侯德榜是我国近代著名的化学家,他提出的联合制碱法得到世界各国的认可,其工业流程如图。
下列说法错误的是( )A.该工艺流程中没有发生氧化还原反应B.应该向“饱和食盐水”中先通入过量CO2,再通入NH3C.向滤液中通入NH3,可减少溶液中的HCO-3,有利于NH4Cl析出D.最终所得“母液”可循环利用6.[2022·河北省石家庄市一模]以铝土矿粉(主要含Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料生产Al2O3和Fe3O4的部分流程如下:下列说法正确的是( )A.“焙烧Ⅰ”时,加入少量CaO可提高矿粉中硫的去除率B.用NaOH溶液吸收过量SO2的离子方程式为:2OH-+SO2===SO2-3+H2O C.滤液中通入足量CO2,过滤后可得到Al2O3D.无氧条件下进行“焙烧Ⅱ”时,理论上消耗的n(FeS2)∶n(Fe2O3)=1∶167.NiSO4·6H2O易溶于水,其溶解度随温度升高明显增大。
以电镀废渣(主要成分是NiO,还有CuO、FeO等少量杂质)为原料制备该晶体的流程如下:下列叙述错误的是( )A.溶解废渣时不能用稀盐酸代替稀H2SO4B.除去Cu2+可采用FeSC.流程中a-b的目的是富集NiSO4D.“操作Ⅰ”为蒸发浓缩、冷却结晶8.[2022·广东省佛山市一模]比较Cl与Br非金属性强弱的实验装置如图所示,仪器及药品均正确的是( )A.装置Ⅳ B.装置ⅠC.装置Ⅱ D.装置Ⅲ二、不定项选择题9.[2022·福建省漳州市二检]高铁酸钾(K2FeO4)具有强氧化性,是一种环保、高效、多功能的饮用水处理剂,可以用如下流程进行制备。
