气固相催化反应本征动力学方程.
2.3 气固相催化反应本征动力学方程

从分母可看出A是解离吸附;反应涉及 3个活性点。
24
2)吸附控制
同样的反应,设为组分A吸附为控制步骤,即:
A +σ Aσ
则:
k P * aA A V
kdAA
ad
可推导得:
1
KRS
kaA(
P* A
P P* * RS
/
P* B
K
)
P P* * RS P* B
KBPB*
1)催化剂具有均匀的表面(理想表面)——催化剂表面各处
的吸附能力一样,能量均匀表面;
气体在催化剂上的吸
2)吸附分子间没有相互影响;
附速率∝气体分压和自
3)单分子层吸附;
由表面
4)吸附分子与脱附分子间达到平衡;
5)具有相同的吸附机理,吸附络合物相同。
(真实吸附模型——略)
15
设固体表面被吸附分子 i 覆盖分率为 θi ,则
1
1
n
KiPi
i1
18
吸附机理不同, θ的表达式亦不同。
.如解离吸附,A2 2A,且吸附时占据两个活性点,即:
A2 2 2 A
a ka PAV 2
d
kd
2
A
平衡时:kaPAV 2 kd A2
KA ka/ kd
A
1
K A PA K A PA
P38表2-4 化学吸附 高温下显著
反应热、活化能小
反应热、活化能大
可单分子层、多分子层吸附
单分子层吸附
无选择性
有选择性
催化反应中,化学吸附 起主要作用
2-1气固相催化反应本证及动力学

吸附等温方程
动力学(理论)方程 实验室反应器
动力学方程 化学化工学院
[例1] 设一氧化碳与水蒸气在铁催化剂上的催化反应机理如下 (1) (2) (3)
化学工学院
1、过程为单组分反应物的化学吸附控制
设催化反应速率为rA 若催化反应过程为A的化学吸附所控制。A的化学吸附为控制 步骤,其它各步均已达到平衡。催化反应速率等于A的化学 吸附速率,则有 化学化工学院
将上述各参数代入
化学化工学院
化学化工学院
2、过程为表面化学反应控制
若反应中有惰性组分I,且组分I 被吸附。催化反应速率 按质量作用定律可表示为:
P A
设气体A在催化剂内表面上被吸附。 化学吸附是一个可逆过程,可表示为:
A ( )
A
A
ra
( A)
rd ra是吸附速率,rd是脱附速率,吸附 净速率为 r=ra-rd
化学化工学院
1.影响吸附速率
的因素
1)单位表面上的气体分子碰撞数 在单位时间内气体分子和表面的碰撞次数越多,被吸 附的可能越大。由气体分子运动论,碰撞次数Z为:
p
p
(1 )
m
t
化学化工学院
3. 孔径及其分布
催化剂中孔道的大小、形状和长度都是不均一的,催化剂孔道 半径可分成三类: 1)微孔,孔半径为1nm左右; 2)中孔,孔半径为1~25nm左右; 3)大孔,孔半径大于25nm的孔。 载体的作用是作为催化剂的骨架,同时提供催化剂的内表面积。
二者的区别:
化学化工学院
类别 项目
物理吸附 分子间力 差 可单层可多层 快 2-20kJ/mol
化学吸附 化学键力 好 单层 慢 80-400kJ/mol
催化反应动力学

V:
未被覆盖的活性中心数 V 总活性中心数
( i ) V 1
i 1 n
θ
i
--- i 组分的吸附率
② 吸附速率式
吸附过程可视为化学反应(基元反应),吸附速率与被吸附组分的气
相分压和未被覆盖分率成正比:
ra ka pAV
r a---吸附速率;
pA ---A组分在气相中的分压。
气固催化反应过程示意图
相界面是指多孔催化剂颗粒的内表面, 化学反应主要在催化剂的孔道内表面上进行。
5
气固相催化反应的7个步骤:
设有气-固相催化反应:
CO( g ) H 2O( g ) CO2 ( g ) H 2 ( g ) A B C D
① A 和 B 从气相主体扩散到达颗粒外表面; ② A 和 B 从颗粒外表面扩散进入颗粒内部; ③ A 和 B 被催化剂内表面的活性位吸附,成为吸附态 的A 和 B;④ 吸附态的A 和 B在催化剂内表面的活性 中心上发 生表面化学反应,生成吸附态 C和D(产物); ⑤ 吸附态 C 和 D 脱附成为自由的 C 和 D; ⑥ C 和 D 从颗粒内部扩散到达颗粒外表面; ⑦ C 和 D 从颗粒外表面扩散到达气相主体。 以上七个步骤是前后串联的。
A 1 A1 B 2 B2
A1 B2 R1 S2
R1 R 1
S 2 S 2
对两类活性中心分别有:
A R V 1 1
B S V 2 1
第一类活性中心有:
速率式
rA kA pAV 1 kAA rR kRR kR pRV 1
•
2.化学吸附
吸附剂与被吸附物之间可视为发生化学反应,是固 体表面与气相分子间的化学键力造成的。 化学吸附是吸附剂和被吸附物之间的电子共用或转 移发生相互作用,使气相分子的结构发生了变化, 降低了活化能,从而加快了反应速率,起到催化作 用。 化学吸附是吸附剂和被吸附物之间的电子转移或共 用,因此二者之间有很强的选择性。
第五章气固相催化反应本征动力学
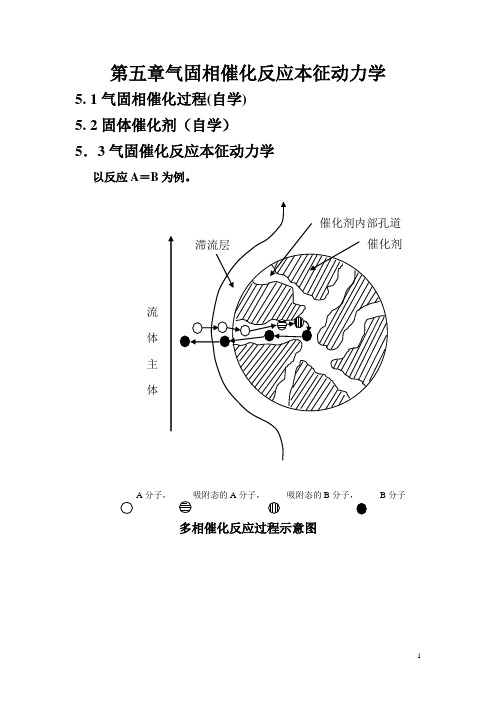
第五章气固相催化反应本征动力学5. 1气固相催化过程(自学) 5. 2固体催化剂(自学) 5.3气固催化反应本征动力学以反应A =B 为例。
A分子,A 分子, 吸附态的B 分子, B 分子多相催化反应过程示意图整个多相催化反应过程可概括为下列七个步骤组成:1、反应组分从流体主体扩散到固体催化剂的外表面(外扩散过程);2、反应物自催化剂外表面扩散到催化剂内部(内扩散过程);3、反应物在催化剂的表面上被吸附(吸附过程);4、吸附的反应物转换为吸附态的生成物(表面反应过程);5、生成物从催化剂的表面上脱附下来(脱附过程);6、脱附的产物分子由催化剂的孔道向外扩散到催化剂的外表面(内扩散过程);7、产物自催化剂的外表面扩散到流体主体(外扩散过程)。
什么是气固相催化反应本征动力学?气固相催化反应本征动力学由如下三步构成(不包括扩散的影响):1)吸附—气相分子在催化剂表面上化学吸附形成吸附络合物。
2)反应—吸附络合物之间相互反应生成产物络合物。
3)脱附—产物络合物由固体表面脱附出来。
5.3.1化学吸附与脱附目的—由吸附、脱附速率方程求出:1.θ~P的关系;2.如果其为控制步骤时就认为是本正动力学速率。
一、化学吸附速率的一般表达式A+Aσσ→θ①组分A的吸附率(活性中心覆盖率)A总的活性中心数覆盖的活性中心数被组分A A =θ 5.3—1②空位率V θ总的活性中心数心数气相分子覆盖的活性中未被 V =θ 5.3—2设i θ为i 组分的覆盖率,则有下式:1V i =θ+θ∑理论基础—表面质量作用定律:对如下的多相基元反应dD cC bB aA +=+吸吸反应速率r 与反应物的吸附量或覆盖度(吸附率)θ成正比,其覆盖度的指数等于相应的化学计量系数:bB a A k r θθ= 5.3—3表面质量作用定律是理想吸附催化反应动力学的基础,它在多相催化反应动力学中的地位相当于质量作用定律在均相反应动力学中的地位。
化学吸附为何可用表面质量作用定律?—化学吸附作用为化学键力,相当于基元化学反应过程,因此可用表面质量作用定律。
第五章气固相催化反应本征动力学

rd kd exp(h ) kd kd 0 f ( ) exp( Ed0 RT ) h RT
表观吸附速率为 r ra rd ka pA exp(g ) kd exp(h )
平衡时:ka kd
pA
exp[( g h) ]
令
K
A
ka kd
f hg
则
1 f
ln(K A pA )
焦姆金等温吸附方程
令
ka ka0 exp( Ea0 RT ) f ( )
活性 选择性 寿命
催化剂的性能
影响
物理性质: 比表面积; 孔容积; 孔容积分布。
1、比表面积:单位质量的催化剂具有的表面积Sg,m2/g; 影响催化剂的吸附量和活性。
!!!测定表面积的方法是:氮吸附法。
2、孔容积:每克催化剂内部微孔的容积Vg。cm3/g !!!测定孔容积较准确的方法是:氦-汞法。
非活化的,低活化能;活化的, 高活化能。>40kJ/mol
<8kJ/mol
>40kJ/mol
多分子层
单分子层
高度可逆
常不可逆
用于测定表面积、微孔尺寸
用于测定活化中心的面积及阐 明反应动力学规律
2、化学吸附速率的一般表达式
1)吸附方程:
A+σ→A σ
吸附率: A
被A组分覆盖的活性中心数 总的活性中心数
3)提高催化剂的机械强度。
4、催化剂活化:目的是除去吸附和沉积Байду номын сангаас外来杂质。
方法是:1)适度加热驱除易除去的外来杂质; 2)小心燃烧除去顽固杂质; 3)用氢气、硫化氢、一氧化碳或氯化烃作为活化剂
活化催化剂。
5、催化剂的开工和停工
化学反应工程-15-第四章-气固相催化反应本征动力学

Ed 则:rd k f A exp RT
' 0 '
净吸附速率:
E ' E r ra rd k0 PA f A exp a k0 f ' A exp d RT RT ka PA f A kd f ' A
K N PNV N
以上各式左、右两边分别相加,则:
V Ki Pi i
V
1 K i Pi 1
i
i
V 1
i i
K P 1 K P
i
i
∴
K i Pi i 1 K i Pi
课后习题
P95
7、8
P127
1、2、3
下周一交!
三、真实吸附层等温方程
1、焦姆金吸附模型 均匀表面吸附理论的关键在于认为催化剂表面各处吸附能力完全相 同,即吸附、脱附活化能和吸附程度无关,但实际上是有关系的。 一般吸附活化能Ea随覆盖率的增大而增大,脱附活化能Ed则随覆盖 率的增大而减小。 焦姆金认为:
0 Ea Ea A 0 Ed Ed A
4.3催化反应本征动力学
4.3.1化学吸附与脱附
吸附和温度: 低温下,物理吸附速率很快,化学吸附速率慢;物理吸附占主 导地位,化学吸附处于从属位置。随温度升高,物理吸附迅速减 弱,化学吸附的重要性显著起来。 温度达到一定值时,就完全是化学吸附了。 重要的是:实际进行的化学反应温度正是在化学吸附的温度范围 之内,所以研究化学吸附非常重要。
P
颗粒的孔体积 颗粒的总体积
压汞法测定催化剂孔径分布: 原理:压力愈高,汞进入的小孔的直径也愈细。
化学反应工程-16-第四章-气固相催化反应本征动力学

积分反应器定义:组分单程转化率较大(xA>25%)时的情况。 问题:由于转化率高,对于热效应大的反应,如何保持反应器恒温? 问题:由于转化率高,对于热效应大的反应,如何保持反应器恒温? ①气体进入催化剂床层之前,常有一段预热区;且要求反应管要 足够细,管外的传热要足够好。 ②用等粒度的惰性物质稀释催化剂,以减轻管壁传热的负荷。为 了强化管外传热,可选用恒温浴、流化床、铜块等方式,力求催 化剂床层等温。
2、内扩散影响的检验: 、内扩散影响的检验: 方法:改变催化剂的粒度(直径 d P),在恒定的 w / FA0下测量转化率 xA 以x A ~ d P 作图:
若 d P 在b点左边,x A 不变。表明内扩散无影响。
x 若d P 在b点右边, A 变化。表明内扩散有阻力存在。
二、实验反应器
1、固定床积分反应器 、
(1) (2)
试推导由式(1)(2)分别控制时的均匀表面吸附动力学方程。
解:(1)式控制时,由控制步骤得:
r = k1 PH 2 Oθ V − k1' PH 2θ O
因(2)式达到平衡:
' k 2 PCOθ O = k 2 PCO 2θ V
θ O + θV = 1
1 PCO 2 +1 k 2 PCO
θ B = K B PBθV
(2′)
对(4)
′ ′ k 4θ R = k 4 PRθV
θ R = K R PRθV
同理对(5)
′ k4 KR = k4 (4′)
θ S = K S PSθV
(5′)
θ A + θ B + θ R + θ S + θV = 1
1 1 + ∑ K i Pi
化学反应工程第一章气固相催化反应本征及宏观动力学

n 1-12 n 1-13 n 1-14 n 1-15
固体催化剂 吸附等温方程 均匀表面吸附动力学方程 不均匀表面吸附动力学方程
PPT文档演模板
化学反应工程第一章气固相催化反应 本征及宏观动力学
1-12 固体催化剂
速率常数与活化能及温度的关系
•速率常数
•活化能
PPT文档演模板
•温度
化学反应工程第一章气固相催化反应 本征及宏观动力学
1-9反应速率常数及温度对反应速率常数 影响的异常现象
•ln k •ln k
PPT文档演模板
•1/T
•1/T
化学反应工程第一章气固相催化反应 本征及宏观动力学
第四节 气-固相催化反应本征动力学方程
新途径,它涵盖了化学量测的全过程,包括采样理论与方法、
试验设计与化学化工过程优化控制、化学信号处理、分析信号
的校正与分辨、化学模式识别、化学过程和化学量测过程的计
算机模拟、化学定量构效关系、化学数据库、人工智能与化学
专家系统等,是一门内涵相当丰富的化学学科分支。
PPT文档演模板
化学反应工程第一章气固相催化反应 本征及宏观动力学
xA=(15mol-13mol)/15mol=0.133 第一个反应所消耗的乙烯=转化的乙烯×S
第二个反应所消耗的乙烯=转化的乙烯×(1-S)
PPT文档演模板
化学反应工程第一章气固相催化反应 本征及宏观动力学
•例题
•故有:2mol ×S ×0.5+2mol ×(1-S) ×3=7mol-4.76mol •S=0.752 •Y=第一个反应所消耗的乙烯÷加入的乙烯总量(15mol) •故Y=2 × 0.752÷15=0.100 •或Y= xA S=0.100
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四节
气固相催化反应本征动力学方程
n * b p i i n i i 1 n * i 1 1 b p i i 11 bi pi* i n 1 bi pi* 11
如果气相中有n个组分被吸附,则: 等温吸附方程的两种极限情况: (1)稀疏覆盖的表面 * p A 很小, A 很小, 对于单分子吸附, * 此时,bp* A 1 , 1 bpA 1 , 因此有: A bp* n A * 1 b p 对于多组分吸附, i i 1 i 1 则: i bi pi*
0 E E a a A 0 E E d A d 0 0 Ea ,Ed ,,为常数
第四节
气固相催化反应本征动力学方程 Nhomakorabea当吸附达到平衡时, ra= rd ,此时,气相中的组分A的分压为平 衡分压 p* A ,则有:
ka pA* (1- θA) - kd θA=0
* (k d k a p* ) k p A A a A
ka * ka b p A * * kd ka p A kd bpA A * kd ka p A 1 ka p* 1 bp* A A kd
(2)完全覆盖表面 * * bp p 对于单组分吸附, A 很大, A 1 * 则: A 1 1 bp* bp A A 对于多组分吸附,1
b p b p
i 1 i * i i 1 i
n
n
* i
i 1
i 1
n
第四节
气固相催化反应本征动力学方程
真实吸附层等温方程 实际催化剂表面的不均匀性造成: 1)吸附活化能和脱附活化能随表面覆盖度的改变而改变 2)不同表面覆盖度时吸附能力不同 关于Ea,Ed与表面覆盖度的关系,有不同的假设。应用最广的是 由焦姆金(тёмкин,Temkin)提出的理论。他认为: 对于中等覆盖度的不均匀表面,在吸附过程中,随表面覆盖度的 增加,吸附活化能线性增加,脱附活化能线性下降,即:
第四节
气固相催化反应本征动力学方程
在多孔催化剂上进行的气固相催化反应,由反应物在位于催化剂
内表面的活性位上的化学吸附、活化吸附态组分进行化学反应和 产物的脱附三个连串步骤组成,因此,气固相催化反应本征动力 学的基础是化学吸附。
第四节
下表。
类别
项目 吸附剂
气固相催化反应本征动力学方程
气体在固体表面的吸附可分为物理吸附和化学吸附。二者区别见
物理吸附
所有固体
化学吸附
某些固体
产生原因
可逆性 选择性 覆盖情况
分子间力
高温可逆 差 可单层可多层
化学键力
常为不可逆 好 单层
吸(脱)附速度 热效应
温度效应
快 2-20kJ/mol
温度提高,吸附量减小
慢 80-400kJ/mol
温度提高,吸附量增加
第四节 气固相催化反应本征动力学方程
影响化学吸附速率的三种因素: 1)单位表面上的气体分子碰撞数 若组分A被吸附,则其值与A的分压pA成正 比; 2)吸附活化能Ea 只有能量超过Ea 的分子才有可能被吸附,这种分子占总分子 数的分率为exp(-Ea/RgT); 3)表面覆盖度θA 表示已被组分A覆盖的活性位占活性位总数的分率,其值为 f(θA ) 考虑以上三种因素,吸附速率可以用下式表示: ra=σA pA f(θA ) exp(-Ea/RgT) 影响脱附速率的因素有两个: 1)表面覆盖度,用函数f’(θA )表示 2)脱附活化能Ed,即与exp(-Ed/RgT)成正比 考虑以上两种因素,脱附速率可以用下式表示: rd=k’ f’(θA ) exp(-Ed/RgT) 吸附净速率为: r= ra- rd=σA pA f(θA ) exp(-Ea/RgT)- k’ f’(θA ) exp(-Ed/RgT)
第四节
气固相催化反应本征动力学方程
吸附等温线:对于一定的吸附系统,恒温下测得的平衡吸附量与
分压的关系称为吸附等温线。 描述吸附等温线的模型有两类:1)理想吸附层(Langmuir均匀 表面吸附)模型;2)真实吸附层(不均匀表面吸附)模型 理想吸附层等温方程是由Langmuir提出的,具有下列基本要点: 1)催化剂表面是均匀的;2)吸附分子间没有相互作用 3)吸附和脱附可以建立动态平衡 r= ra- rd=σA pA f(θA ) exp(-Ea/RgT)- k’ f ’(θA ) exp(-Ed/RgT) 根据这一理论, Ea 、Ed 、σA 、k’ 在吸附过程中均不随表面覆盖 度而变化,可以令ka= σAexp(-Ea/RgT),kd= k’ exp(-Ed/RgT) 吸附速率与未覆盖表面占总表面的分率成正比,即f(θA) =1- θA 脱附速率与表面覆盖度成正比,即 f ’(θA) = θA 因此,上述速率式可以写成: r = ra- rd = ka pA (1- θA) - kd θA Langmuir吸附速率方程
Langmuir理想吸附层等温方程
第四节
气固相催化反应本征动力学方程
如果气相中的组分A及B都同时被固体表面吸附,其表面覆盖度分 别为θA,θB,则A组分的吸附速率为: ra kaA pA 1 A B k 脱附速率为: rd kdA A bA aA * k dA k p A 吸附达平衡时,ra=rd,则有: aA A bA p* A
1 A B
对组分B,同理可得:
* kaB pB B * bB pB 1 A B kdB
bB
k aB k dB
kdA
* bA p * b p A B B A B * * 1 b p b p A A B B 联立上述两方程,可得: * * b p b p A A B B , A B * * * * 1 b p b p 1 b p b p A A B B A A B B
