物理化学大纲(中药学)课件
2024版中药学PPT幻灯片课件

中药的分类方法
按药物功能分类 如解表药、清热药、祛湿药等。
按药用部分分类
如根及根茎类、茎木类、皮类、叶类 等。
2024/1/28
按有效成分分类
如含生物碱类、含挥发油类、含苷类 等。
按自然属性和亲缘关系分类
先把中草药分成植物药、动物药和矿 物药。动植物药材再根据其原植物的 原生形态进行分类。
9
各类中药的代表药物
结构鉴定与活性筛选 通过波谱分析、质谱等手段对分离得到的化合物 进行结构鉴定,并通过活性筛选确定其药理活性。
3
成分间的相互作用研究 探讨中药中多种成分间的相互作用,如协同、拮 抗等,以揭示中药复方治疗疾病的物质基础。
2024/1/28
26
中药的药理作用研究
整体动物实验
通过观察中药对实验动 物的药理作用,如抗炎、 抗氧化、抗肿瘤等,评 价其治疗效果和安全性。
显微鉴定
利用物理或化学的方法,对中药中 所含的主要成分或有效成分进行定 性或定量分析,以评价中药的真伪、 优劣。
22
中药的质量评价标准
有效性
安全性
中药必须具有一定的疗效,能够 治疗或辅助治疗疾病。
中药必须无毒无害,使用安全。
均一性
同一批次的中药,其质量应该是 一致的,不得存在明显的质量差 异。
真实性
明清时期
中药学逐渐成熟,形成了完整 的理论体系和丰富的实践经验。
5
中药学的学科体系
中药药性理论
研究中药的四气五味、升降浮沉、 归经等药性理论。
中药功效与主治
研究中药的功效和主治病症,是 中药学的核心内容。 2024/1/28
中药配伍与禁忌
研究中药的配伍规律和禁忌,指 导临床合理用药。
遵义医学院药学专业《物理化学》教学大纲

四 教材:《物理化学》,人民卫生出版社,侯新朴主编,2003年第五版。
Ⅱ 正文
绪 论
一 教学目的 了解物理化学的任务和内容及在药学中的作用及学习方法。
二 基本要求 理解物理化学的任务和内容及在药学中的作用,理解理想气体的定义及微观模型,掌握理想气体状态方程式及其应用;掌握混合气体中组分气体分压分体积的概念及道尔顿定律;掌握实际气体的范德华方程。
三 教学内容 卡诺循环与卡诺定理,热力学第二定律、熵与熵增原理及熵变的计算、热力学第三定律及化学反应的熵变计算、Helmholtz函数与Gibbs函数、热力学第二定律的本质、纯物质两相平衡的Clapeyron方程、偏摩尔量、化学势。
第三章 化学平衡
一 教学目的 掌握化学反应的平衡条件和化学反应等温方程式,标准平衡常数及其应用、表示方法及计算,了解影响化学平衡的因素,标准吉布斯能变与平衡常数的关系,平衡组成的计算,平衡常数的测定方法及温度对其的影响,反应耦合原理。
二 基本要求 熟悉热力学第二定律的几种叙述方式及其意义;了解卡诺循环、热机效率及卡诺定理;理解熵变的定义式;了解克劳修斯不等式意义及热力学第二定律的联系;理解亥姆霍兹函数、吉布斯函数的定义,可在何种条件下作方向、限度的判据;)了解亥姆霍兹函数、吉布斯函数变化与过程中的最大功的联系;熟练计算各种过程中熵、亥姆霍兹函数、吉布斯函数等热力学函数的变化值;能用热力学第三定律计算纯物质的熵值;理解热力学基本方程和麦克斯韦关系式,其应用可做一般了解。了解混合物及溶液的区分和组成表示方法;掌握拉乌尔定律及其应用;掌握拉乌尔定律的适用对象;掌握亨利定律以及该定律的其他形式,理解亨利常数的单位;掌握亨利定律的适用对象;理解偏摩尔量的定义;了解不同组分同一偏摩尔量间的关系即集合公式和吉布斯-杜亥姆(Gibbs-Duhem)方程,同一组分不同偏摩尔量间的函数关系;理解化学势的定义,特别是 ;掌握化学势判据一般形式 ,了解此式适用条件;理解纯理想气体及理想气体混合物中任意组分B的化学势的表达式;理解真实气体化学势表达式及逸度的定义和逸度系数的概念;理解理想液态混合物的定义以及微观和宏观特征;理解理想液态混合物中任意组分B的化学势的表达式;掌握理想液态混合物的混合性质和平衡性质的有关计算;了解真实液态混合物对理想液态混合物的偏差;了解活度及活度系数的概念;理解理想稀溶液的定义,了解理想稀溶液的溶质、溶剂的化学势表达式;了解真实溶液对理想稀溶液的偏差,了解溶剂的活度和渗透系数、溶质的活度和活度系数的概念;掌握稀溶液的依数性 , ,及其应用条件。
2024版06608_中药学基础知识ppt课件

03
中药的性能与功效
2024/1/24
11
中药的性能特点
四气五味
中药具有寒、热、温、凉四种药性和酸、苦、 甘、辛、咸五种基本味道,是中药治疗疾病的 基本原理。
升降浮沉
中药作用于人体,会产生向上、向下、向内、 向外的不同作用趋向,与疾病所表现的趋向性 相反。
归经
中药对于机体某部分的选择性作用,即主要对 某经(脏腑及其经络)或某几经发生明显的作 用,而对其他经则作用较小,甚至没有作用。
2024/1/24
十九畏
指某些中药之间存在相互 制约的关系,如硫黄畏朴 硝,水银畏砒霜等。
妊娠禁忌
孕妇应禁用或慎用的中药, 如巴豆、牵牛、大戟、斑 蝥等。
25
常用中药的应用与配伍举例
清热药
如金银花、连翘等,用于热毒 疮疡、风热感冒等,常配伍蒲 公英、紫花地丁等。
补虚药
如人参、黄芪等,用于气虚证, 常配伍白术、甘草等。
2024/1/24
17
常用中药的炮制与制剂举例
生甘草偏于清热解毒,
甘
炙甘草偏于补中益气。
草
生大黄泻下作用峻烈,
熟大黄泻下作用缓和,
黄
酒大黄善清上焦血分热
芪
毒,大黄炭多用于出血
证。
生当归偏于补血活血,
大
酒当归偏于活血通经,
黄
土炒当归偏于补血止血。
生黄芪偏于固表止汗、
白
利水消肿,炙黄芪偏于
术
补气升阳、益卫固表。
黄芪
正品黄芪呈圆柱形,表面灰黄色或淡棕褐色,有纵皱纹或纵沟。质硬而韧,不易折断,断面纤维性强,并显粉性, 皮部黄白色,木部淡黄色,有放射状纹理及裂隙,老根中心偶有枯朽状,黑褐色或呈空洞。气微,味微甜,嚼之微 有豆腥味。
药学物化课件—电化学

第五章、 电化学
原电池 电解池
电化学是研究电能与化学能之间的相互转
化过程中存在规律的科学。随着科技事业的发
展,现在电化学理论已被广泛应用于电源、电
解、电镀、金属腐蚀与防腐、冶金及化工生产
等许多方面。在医药学领域,人们采用电化学
分析手段 开展了电泳、电位滴定、极谱分析
以及离子选择性电极的应用等许多卓有成效的
研究工作,在临床与科研方面发挥了重要的作
用。
电解
电能Leabharlann 化学能电池一般说来,电化学所研究的
主要内容有:①电解质溶液理论;
②电化学平衡;③电极过程动力学; ④实用电化学。本章根据专业要求, 主要讨论前面部分内容。
物理化学教学大纲-(工科)07制药
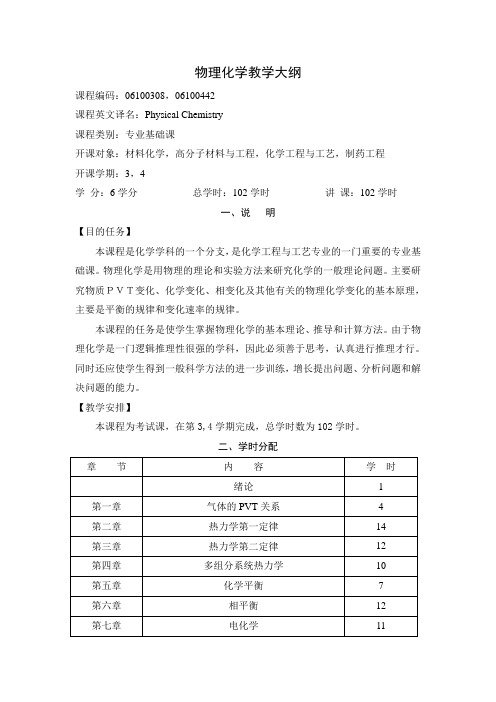
物理化学教学大纲课程编码:06100308,06100442课程英文译名:Physical Chemistry课程类别:专业基础课开课对象:材料化学,高分子材料与工程,化学工程与工艺,制药工程开课学期:3,4学分:6学分总学时:102学时讲课:102学时一、说明【目的任务】本课程是化学学科的一个分支,是化学工程与工艺专业的一门重要的专业基础课。
物理化学是用物理的理论和实验方法来研究化学的一般理论问题。
主要研究物质PVT变化、化学变化、相变化及其他有关的物理化学变化的基本原理,主要是平衡的规律和变化速率的规律。
本课程的任务是使学生掌握物理化学的基本理论、推导和计算方法。
由于物理化学是一门逻辑推理性很强的学科,因此必须善于思考,认真进行推理才行。
同时还应使学生得到一般科学方法的进一步训练,增长提出问题、分析问题和解决问题的能力。
【教学安排】本课程为考试课,在第3,4学期完成,总学时数为102学时。
二、学时分配三、课程内容与教学要求绪论(1学时)【教学要求】了解物理化学课程的内容。
注意学习本课程的要求及方法。
掌握物理量的表示及运算。
【教学内容】1、物理化学课程的内容2、学习物理化学的要求及方法3、物理量的表示及运算第一章气体的PVT关系(4学时)【教学要求】理解下列概念:气体的分压力、分体积,液体的饱和蒸汽压,临界参数。
会应用理想气体状态方程。
了解真实气体状态方程及普遍化压缩因子图。
【教学内容】1、理想气体状态方程2、理想气体混合物3、气体的液化及临界参数4、真实气体状态方程5、对应状态原理及普遍化压缩因子图第二章热力学第一定律(14学时)【教学要求】理解下列概念:状态函数、平衡状态、可逆过程、反应进度、节流膨胀。
明确热力学能、焓、标准摩尔生成焓、标准摩尔燃烧焓、及标准摩尔反应焓的定义并会应用。
会将热力学第一定律和恒容热、恒压热的概念应用于物质的PVT变化、相变化和化学变化过程中热、功、热力学能和焓的计算。
物理化学大纲(中药学)

《物理化学》课程教学大纲适用专业: 中药学院系部: 药学院教研室: 化学教研室制定人: 刘靖丽审核人: 张拴系主任签字:陕西中医学院教务处制2014年3月28日《物理化学》课程教学大纲总学时:64 理论:44 实验: 20 见习:学分:3.5课程类别:基础必修课适用专业:中药学先修课程:高等数学、大学物理、无机化学、有机化学、分析化学前言物理化学是中药学专业及相关专业的一门基础必修课。
它是从物质的物理现象和化学现象的联系入手来探求化学变化规律的一门科学。
中药、中药制药以及制药工程专业的学生在继高等数学、大学物理、无机化学、有机化学和分析化学之后来学习本门课程,通过课堂讲授、学生自习、学科前沿介绍、习题课、讨论课、计算机辅助教学、考试等教学环节达到本课程的教学目的,为以后学习中药化学、药剂学、炮制学和中药鉴定等专业课程以及将来从事药物研发工作奠定良好的化学理论基础。
物理化学的内容十分广泛。
根据本专业对本课程的要求,系统和重点相结合,选定化学热力学、相平衡、化学动力学、表面现象、溶胶、大分子溶液等作为讲课和实验的基本内容。
化学热力学主要讲述热力学第一定律、热力学第二定律及其在气体的简单P、V、T变化,相变化和化学反应中的应用等;相平衡主要讲述吉布斯相律的应用,单组分系统和二组分系统相图的绘制、分析及其运用;化学动力学主要讲述简单级数反应的动力学方程推导和特征,温度对反应速率的影响(阿累尼乌斯公式),催化作用及光化学反应基础等;表面现象主要讲述表面吉布斯自由能,铺展与润湿,弯曲液面的附加压力,高分散度对蒸气压、熔点和溶解度的影响,溶液表面的吸附和表面活性剂等;溶胶主要讲述溶胶的特征、制备、净化及其动力学、光学和电学性质;大分子溶液主要讲述大分子化合物的结构特征,摩尔质量,溶解规律,大分子溶液对溶胶的作用、黏度以及蛋白质电解质溶液等。
本课程的实验内容包括验证物理化学原理和理论,培养物理化学实验技术等。
实验的目的是巩固、加深对物理化学原理的理解,训练仪器的操作技能,以及培养观察现象、正确记录、处理数据和分析问题的独立工作能力,使物理化学的理论与技术更好地应用于药学实践。
《物理化学》课程教学大纲(高职)
《物理化学》课程教学大纲(供高职药学、中药类专业使用)一、前言物理化学是药学、中药类的专业基础课。
本课程是在学生已经学过高等数学、物理学、无机化学、分析化学和有机化学的基础上,进一步系统地阐明化学变化的基本规律。
要求学生系统地掌握物理化学的基本原理、基本方法与基本技能,通过各个教学环节培养学生独立思考、独立分析和创新的能力,使之具有一定的分析和解决药学方面实际问题的能力,从而为进一步学好专业课程及今后从事药学、药物制剂工作和科学研究,奠定良好的化学理论基础。
物理化学内容非常丰富。
根据药学、药物制剂等专业的要求,本课程的任务是学习化学热力学、化学动力学、电化学、表面现象和胶体等基本内容。
本课程理论讲授共36学时,2学分。
物理化学实验在实验化学课程中进行。
理论教学主要通过课堂讲授,多媒体影视课件、习题课(或课堂讨论)、演算习题、自学及实验等教学形式,达到学习本课程的目的。
二、教学内容与要求绪论(一)教学目的与要求1、熟悉物理化学课程的研究对象、任务、内容及发展趋势。
2、了解物理化学在化学与药学中的地位和作用。
3、掌握物理化学的研究方法与学习方法。
(二)教学内容1、概述物理化学的研究对象和任务、内容和特点及发展趋势。
2、物理化学在化学与药学中的地位和作用(重点)。
3、物理化学的研究方法与学习方法(重点)。
(三)教学形式与方法采用课堂讲授、多媒体影视课件、讨论、自学等教学形式。
第一章热力学第一定律(一)教学目的与要求1、熟悉热力学的一些基本概念和可逆过程的意义及特点。
2、掌握热力学第一定律、内能和焓的概念。
掌握状态函数的定义和特性。
3、掌握热力学第一定律的常用计算Q、W、U∆和H∆的方法。
4、了解节流膨胀的概念和意义。
5、掌握应用生成焓及燃烧焓计算反应热的方法。
6.熟悉反应热与温度的关系。
(二)教学内容1、热力学概论,热力学研究的对象、内容,方法和特点。
2、热力学基本概念,体系与环境,体系的性质,状态与状态函数,过程与途径。
制药专业《物理化学1》教学大纲
《物理化学1》教学大纲课程编码:0413101103课程名称:物理化学1学时/学分:48/3先修课程:《大学物理》、《高等数学》、《无机化学》适用专业:制药工程开课教研室:物理化学教研室一、课程性质与任务1.课程性质:本课程是制药工程专业的必修专业基础课,是该专业的核心课程。
2.课程任务:通过本课程的学习,使学生了解物理化学研究问题的一些特殊方法(热力学方法、理想化模型等)及其中包括的一般科学方法;使学生熟悉物理化学的基本概念,掌握化学热力学原理,并具备利用物理化学知识和基本原理分析、解决相关实际问题的能力;为后续课程的学习和进一步掌握新的科技成果打下必要的基础。
二、课程教学基本要求通过本课程的学习,加深学生对先行课程的理解,并为专业课学习打好基础。
该课程重点要求学生掌握化学热力学原理及其处理问题的方法,了解学科的一些新进展;引导学生学习前人提出问题、思考问题和解决问题的方法;培养学生独立思考和独立学习的能力,提高学生的自学能力。
成绩考核形式:期末成绩(闭卷考试)(70%)+平时成绩(作业、期中考试等)(30%)。
成绩评定采用百分制,60分为及格。
三、课程教学内容第一章绪论1.教学基本要求了解物理化学的研究内容和发展过程;掌握学习物理化学的方法;掌握物理量的表示及运算方法。
2.要求学生掌握的基本概念、理论、技能通过本章教学,使学生掌握学习物理化学的方法;掌握物理量的表示及运算方法。
3.教学重点和难点教学重点是物理量的表示及运算。
教学难点是物理量的表示及运算。
4.教学内容(1)物理化学 一门无处不在的学科主要知识点:物理化学的研究内容;物理化学的发展过程。
(2)学习物理化学的要求及方法主要知识点:领会每章的核心思想;掌握重要的概念、公式和定理;理论与实际相结合、学以致用。
(3)物理量的表示及运算主要知识点:物理量的表示;对数中的物理量;量值的计算。
第二章气体的pVT关系1.教学基本要求掌握理想气体状态方程、道尔顿定律、阿马加定律、范德华方程、对应状态原理;掌握应用普遍化压缩因子图进行真实气体p、V、T计算的方法。
物理化学中国药科大学表面活性剂及其作用
医学ppt
28
润湿作用
去润湿作用
医学ppt
29
2.起泡作用
“泡”就是由液体薄膜包围着气体。有的表面 活性剂和水可以形成一定强度的薄膜,包围着空气 而形成泡沫,用于浮游选矿、泡沫灭火和洗涤去污 等,这种活性剂称为起泡剂。
也有时要使用消泡剂,在制糖、制中药过程中 泡沫太多,要加入适当的表面活性剂降低薄膜强度, 消除气泡,防止事故。
表面活性剂是由于胶束而产生增溶作用。
在胶束内部,相当于液态的碳氢化合物。根
据性质相似相溶原理,非极性有机溶剂较易
溶于胶束内部的碳氢化合物之中,这就形成
了增溶现象。因此只有表面活性剂的浓度达
到临界胶束浓度以上,有胶束形成时,才能
有增溶作用。
医学ppt
39
4.2nm 2.452nm 3.6nm 2.452nm
表面活性剂有效值
能够把水的表面张力降低到的最小值。显然, 能把水的表面张力降得愈低,该表面活性剂愈有效。
表面活性剂的效率与有效值在数值上常常是相 反的。例如,当憎水基团的链长增加时,效率提高 而有效值降低。
医学ppt
10
二、表面活性剂的HLB值
• (一)表面活性剂的亲水亲油平衡值
• HLB(hydrophile-lipophile balance)值,亲 水亲油平衡值,表示表面活性剂的亲水性。 定义:石蜡HLB=0,聚乙二醇HLB=20
•
表面活性剂溶于水后,凡能电离的,
称为离子型表面活性剂;不能电离的则
称为非离子型表面活性剂。
医学ppt
2
表面活性剂
1.离子型 2.非离子型
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《物理化学》课程教学大纲适用专业: 中药学院系部: 药学院教研室: 化学教研室制定人: 刘靖丽审核人: 张拴系主任签字:陕西中医学院教务处制2014年3月28日《物理化学》课程教学大纲总学时:64 理论:44 实验: 20 见习:学分:3.5课程类别:基础必修课适用专业:中药学先修课程:高等数学、大学物理、无机化学、有机化学、分析化学前言物理化学是中药学专业及相关专业的一门基础必修课。
它是从物质的物理现象和化学现象的联系入手来探求化学变化规律的一门科学。
中药、中药制药以及制药工程专业的学生在继高等数学、大学物理、无机化学、有机化学和分析化学之后来学习本门课程,通过课堂讲授、学生自习、学科前沿介绍、习题课、讨论课、计算机辅助教学、考试等教学环节达到本课程的教学目的,为以后学习中药化学、药剂学、炮制学和中药鉴定等专业课程以及将来从事药物研发工作奠定良好的化学理论基础。
物理化学的内容十分广泛。
根据本专业对本课程的要求,系统和重点相结合,选定化学热力学、相平衡、化学动力学、表面现象、溶胶、大分子溶液等作为讲课和实验的基本内容。
化学热力学主要讲述热力学第一定律、热力学第二定律及其在气体的简单P、V、T变化,相变化和化学反应中的应用等;相平衡主要讲述吉布斯相律的应用,单组分系统和二组分系统相图的绘制、分析及其运用;化学动力学主要讲述简单级数反应的动力学方程推导和特征,温度对反应速率的影响(阿累尼乌斯公式),催化作用及光化学反应基础等;表面现象主要讲述表面吉布斯自由能,铺展与润湿,弯曲液面的附加压力,高分散度对蒸气压、熔点和溶解度的影响,溶液表面的吸附和表面活性剂等;溶胶主要讲述溶胶的特征、制备、净化及其动力学、光学和电学性质;大分子溶液主要讲述大分子化合物的结构特征,摩尔质量,溶解规律,大分子溶液对溶胶的作用、黏度以及蛋白质电解质溶液等。
本课程的实验内容包括验证物理化学原理和理论,培养物理化学实验技术等。
实验的目的是巩固、加深对物理化学原理的理解,训练仪器的操作技能,以及培养观察现象、正确记录、处理数据和分析问题的独立工作能力,使物理化学的理论与技术更好地应用于药学实践。
同时注意培养学生认真严谨的科学态度,勤于动手,善于思考的科学研究能力。
在教学过程中,要注意贯彻辩证唯物主义观点和理论联系实际的原则,运用启发式、讨论式、问题式和直观式教学等方法,使学生在初步掌握物理化学基本理论的同时,能主动学习,使学生自觉接受新信息, 新思路的科学素养以及逻辑思维能力、表达能力、计算能力以及分析和解决实际问题能力均得到提高。
要求适当结合中医、中药方面的实际事例进行讲授,并能针对性地反映本门学科的现代发展和最新成果。
根据教学计划,本课程共64学时,其中理论课44学时,实验20学时.根据本院实际情况,安排一次实验讲座和4个项目的实验。
基本教材:刘幸平主编.《物理化学》:中国中医药出版社,2012.7。
实验教材:陈振江、程世贤主编.《物理化学实验》:中国中医药出版社,2012.7。
考试方式:100分钟闭卷考试。
以下带*部分为自学内容,带**部分为课堂讨论内容,带***部分为阅读内容(不作要求)。
二、教学内容及要求绪论[目的要求]1、掌握理想气体状态方程。
2、熟悉混合理想气体定律。
3、了解物理化学的任务和内容及其在医药学中的地位和作用。
[教学内容]1、物理化学的任务和内容。
2、物理化学的研究方法。
3、物理化学课程的学习方法。
4、物理化学在医药学中的应用。
5、气体:理想气体状态方程式(波意耳定律,盖﹒吕萨克定律,阿伏加德罗定律),混合理想气体定律(道尔顿定律与阿玛格定律)。
6、实际气体*:范德华方程式。
教学重点与难点教学重点:物理化学的任务和内容。
教学难点:理想气体状态方程式,混合理想气体定律。
[教学方法]课堂讲授、多媒辅助教学、讨论[计划学时]2.0[能力培养目标]通过本单元的教学,初步培养学生对物理化学的学习兴趣和爱好,逐步培养同学们的抽象思维和逻辑思维能力。
第一章热力学第一定律和热化学[目的要求]1、掌握热力学基本概念,热力学第一定律,内能、焓两个状态函数,并能进行计算。
2、熟悉理想气体简单状态变化过程热效应和体积功的计算。
3、理解内能和焓的物理意义及理想气体内能和焓的特征。
4、了解反应热与温度的关系-基尔霍夫定律。
[教学内容]1、热力学概论:热力学的研究对象、内容、方法、局限性、作用及发展。
2、热力学基本概念:体系和环境,广度性质和强度性质,状态和状态函数,过程和途径,热和功。
3、热力学第一定律:经验叙述,热力学能(内能),热力学第一定律的数学式。
4、可逆过程:功与过程(定外压膨胀、多次定外压膨胀,准静态膨胀和准静态压缩过程等),可逆过程及其特点。
5、焓:定容热,定压热。
6、热容:热容的概念,定容热容,定压热容,热容与温度的关系*。
7、热力学第一定律对理想气体的应用:焦耳实验,Cp和Cv的关系,理想气体的定温过程和绝热过程。
8、化学反应的热效应:定容反应热和定压反应热,热化学方程式和盖斯定律。
9、几种热效应:生成热、燃烧热、溶解热*。
10、反应热与温度的关系——基尔霍夫定律。
教学重点与难点教学重点:热力学第一定律及其对理想气体的应用。
教学难点:状态函数及其数学特征,可逆过程、功和热的计算。
[教学方法]采用课堂讲授、多媒体影视课件辅助、讨论相结合的方法进行教学。
[计划学时]8.0[能力培养目标]通过本单元的教学,使学生初步具有分析问题、解决问题的技能,逐步培养同学们的逻辑思维能力和计算能力。
第二章热力学第二定律[目的要求]1、了解卡诺循环和卡诺定理以及在第二定律建立过程中的作用,理解自发过程的概念及意义。
2、熟悉热力学第二定律的经验叙述,掌握克劳修斯不等式及熵增原理和熵判据。
3、掌握亥姆霍兹函数和吉布斯函数作为过程自发进行方向和限度判据的条件及ΔF和ΔG的计算方法。
4、了解偏摩尔量与化学势的定义及物理意义。
[教学内容]1、热力学第二定律:自发过程的共同特征,第二定律的经验叙述。
2、卡诺循环与卡诺定理:卡诺循环,卡诺定理。
3、熵的概念——熵与熵增原理:可逆循环过程与可逆过程的热温商,不可逆循环过程与不可逆过程的热温商,熵增原理。
4、熵变的计算:理想气体定温过程的熵变,变温过程的熵变,P、V、T均变化过程的熵变,相变过程的熵变,理想气体混合过程的熵变,摩尔熵的计算。
5、热力学第二定律的本质——熵的统计意义。
6、亥姆霍兹自由能与吉布斯自由能:亥姆霍兹自由能,吉布斯自由能,ΔG的计算(理想气体的定温过程,相变过程和化学反应)。
7、热力学状态函数之间的关系:热力学基本关系式,麦克斯韦关系式。
8、偏摩尔量与化学势:偏摩尔量,化学势(化学势的定义,化学势判据及其应用,气体的化学势,溶液中各组分的化学势)。
9、化学势在稀溶液中的应用*:蒸气压下降,沸点升高,凝固点降低,渗透压。
10、化学平衡:化学反应的方向和平衡条件,化学反应等温方程,多相反应的化学平衡,反应的标准摩尔吉布斯自由能变及平衡常数的计算。
教学重点与难点教学重点:克劳修斯不等式;熵增原理和熵判据;亥姆霍兹自由能和吉布斯自由能判据;ΔS、ΔF和ΔG的计算方法;化学势的定义、判据及其应用。
教学难点:熵函数的导出、熵判据的条件及结论;亥姆霍兹函数判据和吉布斯函数判据的应用条件及结论;化学势的概念及表示方法。
[教学方法]采用课堂讲授、多媒体影视课件辅助、讨论相结合的方法进行教学。
[计划学时]12.0[能力培养目标]通过本章的学习,使学生初步具有理论联系实际的能力,进一步提高同学们的从实践到理论再到实践的认知能力。
第三章相平衡[目的要求]1、理解相、自由度、独立组分数的概念及定义。
2、掌握:相律,分析相图;克拉贝龙-克劳修斯方程的意义及特鲁顿规则,并能应用公式进行计算。
3、熟悉分馏:水蒸汽蒸馏的基本原理,分配定律几种应用。
[教学内容]1、基本概念:相数,独立组分数,自由度,相律。
2、单组分体系:水的相图、克拉贝龙-克劳修斯方程的推导和计算。
3、二组分气-液平衡系统:完全互溶理想溶液的P-X图、T-X图,完全互溶非理想溶液的P-X 图、T-X图,精馏原理,水蒸气蒸馏。
4、二组分液-液平衡系统:具有最高临界溶解温度的系统,具有最低临界溶解温度的系统,同时具有最高、最低临界溶解温度的系统。
5、二组分液-固平衡系统:生成简单低共熔混合物的系统(热分析法),形成化合物的二组分系统相图(形成稳定化合物的相图,形成不稳定化合物的相图),二组分系统部分互溶的固熔体相图。
6、三组分系统*:三组分系统组成表示法,部分互溶的三液体系统。
7、分配定律及应用*:分配定律,萃取。
教学重点与难点教学重点:基本概念,水的相图,克拉贝龙—克劳修斯方程,二组分气液平衡系统。
教学难点:完全互溶理想溶液的P-X图、T-X图,完全互溶非理想溶液的P-X图、T-X图,精馏原理,生成简单低共熔混合物的系统(热分析法)。
[教学方法]采用课堂讲授、多媒体影视课件辅助、讨论相结合的方法进行教学。
[计划学时]8.0[能力培养目标]通过本章的学习,使学生初步具有分析简单相图的技能,进一步提高同学们的综合分析能力和独立思考的能力。
第四章电化学**[目的要求]1、掌握电导的概念及应用。
2、熟悉离子的迁移现象及迁移数。
3、了解溶液的导电机理。
4、了解电池的电动势的有关内容及电动势测定的应用。
[教学内容]1、电解质溶液的导电性:电解质溶液的导电机理,法拉第定律。
2、离子的电迁移和迁移数:离子的电迁移现象,离子的迁移数。
3、电解质溶液的电导:电导率与摩尔电导率,电解质溶液的电导测定,电导率、摩尔电导率与浓度的关系,离子独立移动定律和离子的摩尔电导率。
4、电导测定的应用:水的纯度测定,弱电解质的电离度及电离常数的测定,难溶盐的溶解度(或溶度积)的测定,电导滴定。
5、可逆电池热力学:可逆电池,可逆电池的热力学。
6、生物电化学。
教学重点与难点教学重点:可逆电池热力学[教学方法]采用学生自学、讨论、多媒体课件辅助相结合的方法。
[计划学时]8.0[能力培养目标]本章学生通过自学和相互讨论,使学生初步具有自学的能力和相互学习的能力,逐步提高和培养学生的独立思考能力。
第五章化学动力学[目的要求]1、掌握基元反应的动力学方程及其特征,阿累尼乌斯公式的意义及其计算。
2、熟悉溶剂、催化剂等因素对反映速度的影响和反应级数的测定方法。
3、熟悉催化作用及酶催化反应的基本特征。
4、了解反应机理的含义,光化学反应的基础。
[教学内容]1、基本概念:化学反应速率的表示方法,反应机理的含义,质量作用定律(反应级数和反应分子数,基元反应,简单反应,复杂反应)。
2、浓度对反应速率的影响:一级、二级、零级反应的动力学方程的推导、特征和应用。
