磷酸镁铵的性质上课讲义
磷酸铵镁

利用碱厂废渣氨二泥生产磷酸铵镁的实验研究来源:中国化工信息网 2007年11月16日中国每年联碱法纯碱产量约300万t,碱厂废渣也近300万t。
碱厂废渣氨二泥来自蒸馏废液中不溶性物料以及盐水精制过程中产生的一、二次盐泥固体废料的混合物,主要成分为CaCO3、SiO2、Mg(OH)2、铁铝盐类,以及CaCl2和NaCl等物质。
碱厂废渣综合利用的一种经济可行的方法是将其转化为磷酸铵镁。
磷酸铵镁是一种较好的缓释性多元素复合肥料和肥料助剂。
利用碱厂废渣氨二泥制成,磷酸铵镁,加工处理流程简单,可实现变废为宝,减轻环境污染,但是目前中国尚无工业化生产磷酸铵镁的报道。
1 实验部分1.1 磷酸铵镁合成反应基础理论磷酸铵镁是一种难溶于水的化合物,其溶度积足Ksp,在25℃时仅为2.5×10-13。
因此,磷酸铵镁合成反应速度很快且比较完全,故从物性分析该反应可行。
日本秋山尧博士用磷酸二氢铵和Mg(OH)2反应,根据其不同配比,在不同温度下,可以生成MgNH4PO4·H2O(记为MH),Mg(NH4)2H2(PO4)2·4H2O(记为M4H)和MgNH4PO4·6H2O(记为M6H)3种形式的水合物,其生成区域见图1(略)。
1.2 实验试剂和原料磷酸(AR,质量分数85%);氨水(AR,质量分数25%-28%)。
固体废弃物氨二泥(某碱厂提供)主要成分为Ca(OH)2、SiO2、Mg(OH)2、NH4HCO3、(NH4)2CO3、NH4OH、铁铝盐类、NH4Cl、CaCl2、NaCl等物质。
其化学分析见表1。
21.3 反应原理及流程利用原料氨二泥中所含的氢氧化镁、镁盐、氨等与工业磷酸、氨水在室温下反应制取六水合磷酸铵镁,主要反应方程式如下:Mg(OH)2+H3PO4+H2O→(室温/pH4-6)MgHPO4·3H2O (1)MgHPO4·3H2O+NH3+3H2O→(室温/pH8.91)MgNH4PO4·6H2O↓ (2)副反应有:CaCO3+2H3PO4→Ca(H2PO4)2+H2O+CO2↑ (3)Ca(OH)2+H3PO4+4H2O+NH3→CaNH4PO4·6H2O (4)3Ca(H2PO4)2+4NaOH→Ca3(PO4)2↓+4NaH2PO4+4H2O (5)3MgHPO4·3H2O+NaOH→Me3(PO4)2↓+NaH2PO4+4H2O (6)称取一定量的氨二泥加入蒸馏水打浆洗涤,用布氏漏斗抽滤,此时几乎所有的氯离子和铵离子以及少量的钙离子和镁离子会溶于水中被除去(滤液返回打浆工序)。
磷酸镁铵 质量指标

磷酸镁铵质量指标
产品名称:磷酸镁铵
一. 总体要求:
磷酸镁铵是一种白色结晶粉末状无机化合物,具有较高的溶解度和热稳定性。
其主要用途是作为肥料和水处理等领域中的添加剂。
为了确保磷酸镁铵质量稳定和达到预期的使用效果,以下是磷酸镁铵的质量指标要求。
二. 质量指标:
1. 外观:
- 磷酸镁铵应为白色结晶粉末状,光洁无杂质。
2. 主要成分:
- 有效氮(N),含量不低于12.0%;
- 水溶性磷酸(P2O5),含量不低于60.0%;
- 镁含量(MgO),含量不低于6.0%。
3. 粒度:
- 通过40目筛的量不高于5%;
- 通过60目筛的量不低于95%。
4. 水溶性:
- 在20℃下,磷酸镁铵在水中的溶解度应不低于60g/L。
5. pH值:
- 磷酸镁铵水溶液的pH值在6.0-7.5之间。
6. 湿度:
- 磷酸镁铵湿度不高于1.0%。
7. 杂质含量:
- 重金属杂质(如铅、汞、铬等)含量应符合国家安全标准;
- 其他杂质含量不超过规定的限量。
三. 包装和储存要求:
1. 包装:
- 磷酸镁铵应采用防潮防湿的包装材料进行包装;
- 包装容器应清洁、完整,并标明产品名称、规格、重量等信息。
2. 储存:
- 储存于通风干燥的室内环境;
- 避免阳光直射和高温;
- 避免与有机物、酸、碱等物质接触;
- 避免与易燃物质放在一起。
以上是磷酸镁铵的质量指标要求,供参考使用。
第08讲镁及其重要化合物2024年高考化学精准一轮复习讲义(解析板)

第08讲 镁及其重要化合物(解析板)知识主线:Mg MgO MgCl Mg(OH)2 一、镁及其重要化合物的性质 1.镁的性质(1)物理性质:具有银白色金属光泽的固体,密度、硬度均较小,熔点较低,有良好的导电、传热和延展性 (2)镁的结构和存在:镁的原子结构示意图为,从原子结构来看,镁原子最外层有2个电子,在化学反应中钠原子很容易失去2个电子而形成最外层为8个电子稳定结构,因此金属镁的化学性质非常活泼,表现出很强的还原性它们都是活泼的金属,在自然界中全部以化合态的形式存在 (地壳和海水中)(3)化学性质①与非金属反应 (O 2、Cl 2、N 2等)a .与O 2反应:2Mg +O 2=====点燃2MgO (发出耀眼的白光)b .与Cl 2反应:Mg +Cl 2=====点燃MgCl 2c .与N 2反应:3Mg +N 2=====点燃Mg 3N 2d .与S 反应:Mg +SMgS ①与H 2O 反应:Mg +2H 2OMg(OH)2+H 2↑ (冷水慢,沸水快) ①与非氧化性酸(如:稀盐酸、稀硫酸)的反应:Mg +2HCl===MgCl 2+H 2↑ Mg +2H +===Mg 2++H 2↑①与CO 2反应:2Mg +CO 2=====点燃2MgO +C (剧烈燃烧,生成白色粉末和黑色固体)①与盐溶液反应:Mg +CuSO 4===MgSO 4+Cu Mg +Cu 2+Mg 2++Cu (4)镁的用途镁合金用于制造火箭、导弹和飞机的部件 镁制造信号弹和焰火;冶金工业上用作还原剂和脱氧剂 ①Mg 在CO 2中能够燃烧,所以活泼金属镁着火不能用干粉灭火器和泡沫灭火器灭火 ①镁也可在氮气中燃烧,生成氮化镁(Mg 3N 2),氮化镁能与水剧烈反应生成Mg(OH)2沉淀并放出氨气2.氧化镁(1)物理性质:白色固体,难溶于水,熔点较高,是优良的耐火材料(2)化学性质:属于碱性氧化物,具有碱性氧化物的通性①与水能缓慢反应:MgO +H 2O===Mg(OH)2①能与酸反应:MgO +2H +===Mg 2++H 2O(3)工业制备(煅烧碳酸镁):MgCO 3MgO +CO 2↑(4)主要用途:氧化镁熔沸点高,可制造耐火、耐高温器材3.氢氧化镁(1)物理性质:白色固体,难溶于水的中强碱,能使酚酞试液变为浅红色(2)化学性质①能与酸反应:Mg(OH)2+2H +===Mg 2++2H 2O高温①热稳定性差:Mg(OH)2MgO +H 2O ①溶解度小于碳酸镁:MgCO 3+H 2OMg(OH)2+CO 2↑ (3)实验室制法 ①将NaOH 溶液滴入MgCl 2溶液中:Mg 2++2OH —===Mg(OH)2↓①将氨水滴入MgSO 4溶液中:Mg 2++2NH 3·H 2O===Mg(OH)2↓+2NH 4+4.从海水中提取镁的流程(1)工艺流程(2)基本步骤及主要反应 制熟石灰CaCO 3=====高温CaO +CO 2↑,CaO +H 2O===Ca(OH)2 沉淀Mg 2+Mg 2++Ca(OH)2===Mg(OH)2↓+Ca 2+酸化,制备MgCl 2Mg(OH)2+2HCl===MgCl 2+2H 2O 蒸发浓缩、冷却结晶析出MgCl 2·6H 2O 脱水,制备无水MgCl 2在氯化氢气流中使MgCl 2·6H 2O 脱水制得无水氯化镁 电解熔融的MgCl 2,制备镁MgCl 2(熔融)=====电解Mg +Cl 2↑ ①MgCl 2·6H 2O 加热脱水制无水氯化镁时,为了防止MgCl 2水解生成Mg(OH)2,Mg(OH)2加热分解得到MgO 需在HCl 气流中加热①因镁在高温下能与O 2、N 2、CO 2等气体发生反应,故工业电解MgCl 2得到的镁,应在H 2氛围中冷却 例1.通过下列实验装置与实验现象,能达到实验目的的是选项A B 实验目的 验证石蜡油分解产物中是否含有乙烯 制备NaHCO 3晶体 实验装置实验现象溴的四氯化碳溶液褪色锥形瓶中有白色晶体析出选项 C D实验目的测定中和反应反应热制备无水氯化镁固体A.A B.B C.C D.DA.装置A中分液漏斗中的溶液为浓氨水B.实验开始时应先点燃C处酒精灯,再点燃E处酒精灯C.装置D的作用只是干燥N2D.取反应后装置E所得固体少许,滴入蒸馏水,可检验是否有Mg3N2【答案】C【分析】该实验主要是N2与Mg在加热时反应生成Mg3N2。
磷酸铵生产工艺培训材料
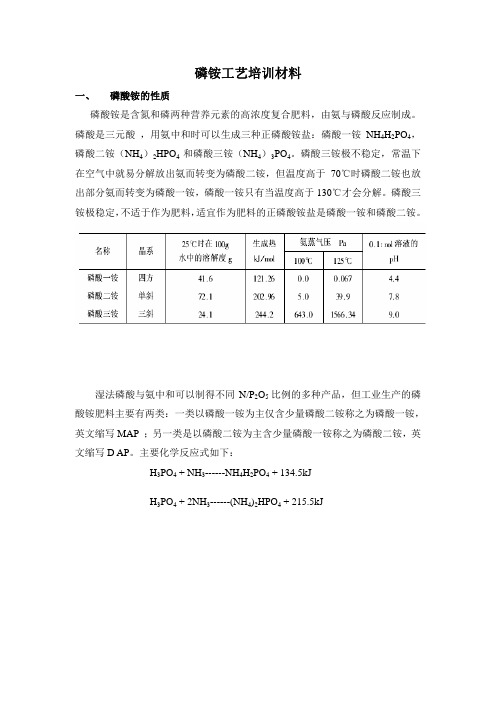
磷铵工艺培训材料一、 磷酸铵的性质磷酸铵是含氮和磷两种营养元素的高浓度复合肥料,由氨与磷酸反应制成。
磷酸是三元酸,用氨中和时可以生成三种正磷酸铵盐:磷酸一铵NH4H2PO4,磷酸二铵(NH4)2HPO4和磷酸三铵(NH4)3PO4。
磷酸三铵极不稳定,常温下在空气中就易分解放出氨而转变为磷酸二铵,但温度高于70℃时磷酸二铵也放出部分氨而转变为磷酸一铵,磷酸一铵只有当温度高于130℃才会分解。
磷酸三铵极稳定,不适于作为肥料,适宜作为肥料的正磷酸铵盐是磷酸一铵和磷酸二铵。
湿法磷酸与氨中和可以制得不同N/P2O5比例的多种产品,但工业生产的磷酸铵肥料主要有两类:一类以磷酸一铵为主仅含少量磷酸二铵称之为磷酸一铵,英文缩写MAP ;另一类是以磷酸二铵为主含少量磷酸一铵称之为磷酸二铵,英文缩写D AP。
主要化学反应式如下:H3PO4 + NH3------NH4H2PO4 + 134.5kJH3PO4 + 2NH3------(NH4)2HPO4 + 215.5kJ目前市场上磷酸一铵、磷酸二铵都主要传统法、料浆法优等品和一等品二、 磷酸铵生产工艺1、粉状磷酸一铵生产工艺流程说明:稀磷酸与气氨在中和槽内反应生成中和度0.95-1.08左右磷酸一铵料浆,稀磷铵料浆在蒸发器循环泵的推动下,经加热器被蒸汽加热,上升进入闪蒸室分离蒸汽,再下降进入料浆循环泵循环,浓缩合格的料浆从循环泵出口进入高压柱塞泵,加压后送入喷雾干燥塔顶部的料浆雾化器,经压力式喷嘴才化且的料浆从塔顶喷洒而下,与塔底上升的热空气逆流换热蒸发水份,并在干燥流化床进一步流化干燥出合格产品,尾气经洗涤后排空。
2、料浆法磷酸二铵生产工艺硫酸、尾洗磷酸、气氨流程说明:稀磷酸经尾气洗涤后送至一次中和槽中与气氨中和,合格中和料浆经浓缩达到工艺要求,再一次与氨进行二次中和,二次中和料浆经喷枪喷入喷浆造粒机内进行涂布造粒,利用来自热风炉的热风进行干燥脱水,干燥后的物料进行两级筛分,粒径合格的经冷却涂膜后包装成成品,不合格大块经破碎膈作为返料进二次造粒,小颗粒直接作为返料反回系统;干燥、冷却、筛分含尘尾气经旋风除尘及两级酸洗除尘、除氟、除氨后排空。
磷酸镁铵 质量指标

磷酸镁铵质量指标1. 简介磷酸镁铵是一种常用的化肥,其主要成分是磷酸镁和铵盐。
它具有提供植物所需的磷、镁和氮元素的功能,可促进植物的生长和发育。
为了确保磷酸镁铵的质量,需要对其进行严格的质量控制和检测。
本文将介绍磷酸镁铵的质量指标以及相关的检测方法和标准。
2. 质量指标磷酸镁铵的质量指标主要包括外观、主要成分含量、水分含量、重金属含量、溶解性等。
2.1 外观磷酸镁铵应为无色结晶体或白色颗粒状固体,无异物和杂质。
2.2 主要成分含量磷酸镁铵的主要成分包括磷酸镁和铵盐。
其磷酸镁含量和氮含量应符合国家标准或合同规定的要求。
2.3 水分含量磷酸镁铵的水分含量是指其含有的游离水分的百分比。
水分含量的测定方法可以采用干燥法或滴定法。
2.4 重金属含量磷酸镁铵中的重金属含量应符合国家标准或合同规定的要求。
常见的重金属包括铅、镉、汞、砷等,它们对植物和环境有一定的毒性。
2.5 溶解性磷酸镁铵的溶解性是指其在水中的溶解度。
溶解度的测定方法可以采用重量法、体积法或电导法。
3. 检测方法为了确保磷酸镁铵的质量,需要对其进行严格的检测。
下面介绍几种常用的检测方法。
3.1 主要成分含量的测定磷酸镁铵的主要成分含量可以通过化学分析方法进行测定。
通常采用的方法包括重量法、滴定法、分光光度法等。
3.2 水分含量的测定磷酸镁铵的水分含量可以通过干燥法进行测定。
将样品加热至一定温度,使其失去水分,然后称重,计算水分含量。
3.3 重金属含量的测定磷酸镁铵中的重金属含量可以通过原子吸收光谱法、电感耦合等离子体发射光谱法等进行测定。
3.4 溶解性的测定磷酸镁铵的溶解性可以通过重量法、体积法或电导法进行测定。
重量法是将一定量的磷酸镁铵溶解于一定体积的水中,测定溶解后的溶液的重量,计算溶解度。
4. 质量标准磷酸镁铵的质量标准可以根据国家标准或合同规定来制定。
质量标准应包括外观、主要成分含量、水分含量、重金属含量、溶解性等指标的要求。
5. 结论磷酸镁铵是一种常用的化肥,其质量指标包括外观、主要成分含量、水分含量、重金属含量、溶解性等。
第08讲镁及其重要化合物2024年高考化学精准一轮复习讲义(原卷板)

第08讲 镁及其重要化合物(原卷板)知识主线:Mg MgO MgCl Mg(OH)2 一、镁及其重要化合物的性质 1.镁的性质(1)物理性质:具有银白色金属光泽的固体,密度、硬度均较小,熔点较低,有良好的导电、传热和延展性 (2)镁的结构和存在:镁的原子结构示意图为,从原子结构来看,镁原子最外层有2个电子,在化学反应中钠原子很容易失去2个电子而形成最外层为8个电子稳定结构,因此金属镁的化学性质非常活泼,表现出很强的还原性它们都是活泼的金属,在自然界中全部以化合态的形式存在 (地壳和海水中)(3)化学性质①与非金属反应 (O 2、Cl 2、N 2等)a .与O 2反应:2Mg +O 2=====点燃2MgO (发出耀眼的白光)b .与Cl 2反应:Mg +Cl 2=====点燃MgCl 2c .与N 2反应:3Mg +N 2=====点燃Mg 3N 2d .与S 反应:Mg +SMgS ①与H 2O 反应:Mg +2H 2OMg(OH)2+H 2↑ (冷水慢,沸水快) ①与非氧化性酸(如:稀盐酸、稀硫酸)的反应:Mg +2HCl===MgCl 2+H 2↑ Mg +2H +===Mg 2++H 2↑①与CO 2反应:2Mg +CO 2=====点燃2MgO +C (剧烈燃烧,生成白色粉末和黑色固体)①与盐溶液反应:Mg +CuSO 4===MgSO 4+Cu Mg +Cu 2+Mg 2++Cu (4)镁的用途镁合金用于制造火箭、导弹和飞机的部件 镁制造信号弹和焰火;冶金工业上用作还原剂和脱氧剂 ①Mg 在CO 2中能够燃烧,所以活泼金属镁着火不能用干粉灭火器和泡沫灭火器灭火 ①镁也可在氮气中燃烧,生成氮化镁(Mg 3N 2),氮化镁能与水剧烈反应生成Mg(OH)2沉淀并放出氨气2.氧化镁(1)物理性质:白色固体,难溶于水,熔点较高,是优良的耐火材料(2)化学性质:属于碱性氧化物,具有碱性氧化物的通性①与水能缓慢反应:MgO +H 2O===Mg(OH)2①能与酸反应:MgO +2H +===Mg 2++H 2O(3)工业制备(煅烧碳酸镁):MgCO 3MgO +CO 2↑(4)主要用途:氧化镁熔沸点高,可制造耐火、耐高温器材3.氢氧化镁(1)物理性质:白色固体,难溶于水的中强碱,能使酚酞试液变为浅红色(2)化学性质①能与酸反应:Mg(OH)2+2H +===Mg 2++2H 2O高温①热稳定性差:Mg(OH)2MgO +H 2O ①溶解度小于碳酸镁:MgCO 3+H 2OMg(OH)2+CO 2↑ (3)实验室制法 ①将NaOH 溶液滴入MgCl 2溶液中:Mg 2++2OH —===Mg(OH)2↓①将氨水滴入MgSO 4溶液中:Mg 2++2NH 3·H 2O===Mg(OH)2↓+2NH 4+4.从海水中提取镁的流程(1)工艺流程(2)基本步骤及主要反应 制熟石灰CaCO 3=====高温CaO +CO 2↑,CaO +H 2O===Ca(OH)2 沉淀Mg 2+Mg 2++Ca(OH)2===Mg(OH)2↓+Ca 2+酸化,制备MgCl 2Mg(OH)2+2HCl===MgCl 2+2H 2O 蒸发浓缩、冷却结晶析出MgCl 2·6H 2O 脱水,制备无水MgCl 2在氯化氢气流中使MgCl 2·6H 2O 脱水制得无水氯化镁 电解熔融的MgCl 2,制备镁MgCl 2(熔融)=====电解Mg +Cl 2↑ ①MgCl 2·6H 2O 加热脱水制无水氯化镁时,为了防止MgCl 2水解生成Mg(OH)2,Mg(OH)2加热分解得到MgO 需在HCl 气流中加热①因镁在高温下能与O 2、N 2、CO 2等气体发生反应,故工业电解MgCl 2得到的镁,应在H 2氛围中冷却 例1.通过下列实验装置与实验现象,能达到实验目的的是选项A B 实验目的 验证石蜡油分解产物中是否含有乙烯 制备NaHCO 3晶体 实验装置实验现象溴的四氯化碳溶液褪色锥形瓶中有白色晶体析出选项 C D实验目的测定中和反应反应热制备无水氯化镁固体A .AB .BC .CD .D末,易水解。
磷酸铵镁结晶

磷酸铵镁结晶1. 磷酸铵镁简介磷酸铵镁,简称"MAP",是一种由金属镁和磷酸组成的复合氮肥料,是肥料行业的重要成分。
磷酸铵镁为白色结晶,具有有效养分、稳定性、易溶解性和不容易吸收水分等优点,能够有效补充植物营养元素,弥补施用全肥时土壤磷肥及微量元素的缺失,从而保证植物的正常生长发育功能。
2. 磷酸铵镁的主要特点(1)氮养分含量高:磷酸铵镁氮养分的含量比其它一般肥料高,可以有效满足植物对氮的需求;(2)易溶解性好:磷酸铵镁的溶解度高,可以快速溶解在水中,能够被植株有效吸收;(3)不会吸收水分:磷酸铵镁强制干料,因此不会吸收水分,并可长期保存,无需受季节影响;(4)弥补有机质中的养分:磷酸铵镁能够弥补土壤有机质中的磷、钾、微量元素,可以促进植物的健康发育;(5)较好的结晶度:磷酸铵镁具有较好的结晶度,可以实现干料的细化和颗粒化,实现肥料均匀施用,保证养分的均匀性。
3. 磷酸铵镁的用途磷酸铵镁可以用于种植小麦、玉米、大豆、棉花等农作物,可以加快植物的生长,提高植物的产量;另外,磷酸铵镁也可以用于花卉植物,能够增强植物的抗逆性,促进花卉植物的早熟。
4. 磷酸铵镁的施用方法(1)撒施:这种施用方式最简单,将磷酸铵镁均匀撒在土壤表面即可;(2)耕入:将磷酸铵镁和碎土一起耕入土壤,使肥料可以和细菌分解发酵,磷元素可以被土壤细菌转化为可以被植物吸收的磷酸镁合成;(3)液施:采用营养液施用磷酸铵镁,可以达到有效的补充植物的营养需求;(4)包袱施用:将磷酸铵镁混合其他肥料一起装入袋子,绑在树干或者植株的茎上(叶片),让肥料与植物直接接触,以达到补充养分的目的。
5. 磷酸铵镁的注意事项(1)磷铵镁施用遵循“少而精”原则,应尽量减少施用量;(2)磷酸铵镁不宜用于覆土施肥,以免因有效成分被土壤和电离辐射被降解而耗散;(3)磷酸铵镁与其他肥料不宜混施,以免出现重金属沉淀,从而影响施肥效果;(4)施肥结束后,应及时进行掩埋,防止肥料被植物吸收以外的外界条件影响。
氮、磷及其化合物

氮、磷及其化合物一、教学目的1、掌握铵盐、硝酸盐、亚硝酸及其盐的主要性质;2、了解磷酸盐的主要性质;3、学会NH 4+,NO 3-,NO 2-,磷酸盐、偏磷酸盐和焦磷酸盐的鉴定方法。
二、实验提要N 的常见氧化值为-3,0,+3,+4,+5。
氨是氮的主要氢化物,加酸生成铵盐,加强碱生成NH 3。
氨气极易溶于水,水溶液显碱性。
铵盐是NH 3与酸所生成的化合物。
在热稳定性方面,由于NH 3的挥发性和还原性,与其它金属离子盐相比要不稳定得多,根据对应酸的行为,分解产物不同。
若对应酸无氧化性则分解放出 NH 3,如 NH 4Cl 、 (NH 4)2SO 4、(NH 4)2HPO 4、(NH 4)2MoO 4等;若对应酸有氧化性,则分解氧化,一般放出 N 2、N 2O ,如 NH 4NO 2、NH 4NO 3、(NH 4)2Cr 2O 7、NH 4ClO 4等。
铵盐的溶解行为与钾盐类似,除少数如酸式酒石酸盐、高氯酸盐外,基本上都易溶于水。
由于 NH 3是弱碱,故铵盐的水溶液由于水解一般呈酸性。
NH 4+ 的鉴定:方法一,加碱,若产生气体使红色石蕊试纸变兰,说明有NH 4+。
方法二,使奈氏试剂变成红棕色,说明有NH 4+。
HNO 2的水溶液是弱酸,K a =5.0×10-4,比醋酸的酸性略强,它可以由NaNO 2与强酸反应制得。
HNO 2是极不稳定的酸,仅在低温时存在于水溶液。
当温度高于4℃时,HNO 2就按下式分解:2HNO 2H 2O+ N 2O 3 (浅蓝色) H 2O+NO+NO 2 加热冷却 加热冷却热的条件下向右进行,冷条件下向左进行。
中间产物N 2O 3在水溶液中呈浅蓝色,N 2O 3不稳定进一步分解为棕色NO 2和无色的NO 气体。
利用该性质可以鉴定NO 2-或HNO 2。
亚硝酸和亚硝酸盐在酸性溶液中,它们的标准电极电势如下:HNO 2+H ++e===NO+H 2O E=0.99VNO 3-+3H ++2e===HNO 2+H 2O E=0.94V可见,HNO 2及其盐在酸性介质中既有氧化性又有还原性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
磷酸镁铵的性质
磷酸镁铵的性质、制备方法及应用
山西大学环境资源学院程芳琴贺寿宝
磷酸镁铵,又名磷酸铵镁,俗称磷酸镁铵石、鸟粪石。
英文名:Ammonium Magnesium Phosphate,分子式:
NH4MgPo4·6H2O,分子量245.41.磷酸镁铵最早发现于鸟粪中,因而成为鸟粪石。
除六水物外,还有一水物。
一、磷酸镁铵的性质和用途
磷酸镁铵属于无色斜方晶系。
性状:白色结晶细粒或粉末,密度1.71g/ml,微溶于冷水,溶于热水和稀酸,不溶于乙醇,遇碱溶液则分解。
磷酸镁铵在氨气流中加热到100℃时,脱去5分子结晶水,成为一水物。
继续加热至600℃,分解成焦磷酸镁;其水溶液加热至48℃—50℃,析出一水物。
磷酸镁铵用作饲料添加剂,肥料添加剂。
在医药上也有应用,也可用于提料,氨基甲酸酯、软泡阻燃剂的制造。
磷酸镁铵在国外已被列入肥料之列,用作长效无机氨肥,主要用于果树、草坪、花卉等。
二、制备方法
1、磷酸盐法
①磷酸二氢铵(钠)法
a、将磷酸二氢铵与氢氧化镁按一定比例,在40℃—65℃下反应生成磷酸镁铵,其反应式如下:NH4H2PO4+Mg(OH)2+4H2O—
NH4MgPO4·6H2O↓.上述反应在75℃—100℃下进行,生成
NH4MgPO4·H2O,其反应式如下:NH4H2PO4+Mg(oh)2—NH4MgPO4·H2O+H2O.
b、将氯化镁货硫酸镁溶液加入磷酸二氢铵(钠)溶液中,边搅
拌边加入氨水,控制PH在6.0—6.5,可得硫酸镁按。
其反应
式如下:(NH4)2HPO4+MgSO4+NH3·H2O+5H2O—NH4MgPO4·6H2O↓+
(NH4)2SO4或Na2HPO4+MgCl2+NH3·H2O+5H2O—NH4MgPO4·6H2O↓
+2NaCl.另外硫酸镁和氢氧化铵反应也可制成。
2、磷酸法
由磷酸、氧化镁货氢氧化镁、氨水直接反应制成,其反应式如下:
H3PO4+MgO+NH3·H2O+4H2O—NH4MgPO4·6H2O↓或
H3PO4+Mg(OH)2+NH3·H2O+3H2O—NH4MgPO4·6H2O↓
实验室方法:用磷酸和氢氧化镁支取磷酸镁铵。
分2步进行:
首先在50—65℃,PH=4-6下,氢氧化镁和磷酸反应生成三水磷
酸铵镁,然后在75-100℃,PH=6-8下用浓氨水氨化生成磷酸铵镁,其反应式:H3PO4+Mg(OH)2+H2O—MgHPO4·3H2OMgHPO4·3H2O+NH3—NH4MgPO4·6H2O↓+H20
3、硫铵过磷酸钙法
首先利用硫酸铵和过磷酸钙反应制得磷酸二氢铵,然后在镁离
子存在下,用碳酸氢铵调节同业的PH值在6-6.5制得,其反应
式如下:(NH4)2SO4+Ca〈H2PO4〉2·H2O+H2O—CaSO4·2H2O↓
+2NH4H2PO4,NH4H2PO4+MgSO4+2NH4HCO3+4H2O—NH4MgPO4·6H2O↓+2CO2↑+(NH4)SO
4、其他方法:
a、以苦卤水为原料:将磷酸盐和氨(铵盐)与苦卤水的镁反应,制取磷酸铵镁。
其工艺具有成本低,产出率高等优点。
b、以碱厂过滤母液为原料:利用碱厂分离重碱牧业种的游离氨及结合氨与工业磷酸,氧化镁进行反应制得。
c、以含磷(氨)废水为原料:向含磷废水加入镁盐、氨(铵盐)制得。
三、磷酸镁铵在农业上的应用
磷酸镁铵石一种含N、P、Mg的多元素复合肥,切所有成分全部有效。
在水中的溶解度极低。
由于具有极溶性,所以在施用后的土地上可以贮存氮,并在微生物的作用下逐步发生硝化作用,缓慢分解,提供植物养分。
粒径不同,硝化速度有所不同,可通过控制粒径大小满足作物对养分的需要。
1、作基肥,追肥
磷酸镁铵可做基肥、追肥,它与其他肥料一起配合施用。
作基肥时,它在酸性荼毒上浅施。
按镁计算,一般每667㎡施用1-1.5㎏,施用一次可满足作物整个生长期对营养的需要,而不需要追肥。
即施用量过大,也不易使作物发生烧苗、徒长、倒状等现象。
甚至几年的用量一次施入,也不会引起烧苗。
用于蔬菜和禾谷类作物时,应混掺一些速效性化学氨肥。
作为追肥时
宜早施。
磷酸镁铵的缓释性,不易淋失的特性,特别适用于缺镁,高温多雨的南方土地。
2、作长效肥料的包膜材料(添加剂)
若用磷酸镁铵为薄膜材料,在缓释性能上优于包硫尿素,且整个包膜均为植物营养成分。
驶入土地后不会造成任何残留物质,在防止二次污染上优于聚合物包膜材料。
在题本采用磷酸镁铵涂覆水溶性颗粒肥料表面,以延长贮存稳定性和提高肥料利用率。
在国内,为了减少碳酸氢铵肥料的挥发和提法哦基肥效,在含水3%—5%的碳酸铵中添加5%—9%的磷酸镁铵制成长效碳酸氢铵,是碳酸氢铵具有较好的稳定性,其有效成分明显提高。
郑州乐喜施磷复肥技术研究推广中心,以磷酸镁铵为包裹层主图研制的乐喜施(LUXECOTE)系列控制释放肥料在澳大利亚、美国、新加坡等国用于高尔夫球场、运动场、景观草坪取得了良好的效果;在国内用于夏玉米一次性含量基肥与常规施肥相比节肥1/3—1/2;经水稻一次性基肥施用田间对比试验表明,可节肥1/3.
3、农用效果
4、磷酸镁铵溶解性小,不伤根系,作物需多少就吸收的多少,不易被水淋六十,促进作物生长,增强抗病能力,提高瓜果、蔬菜、花卉等的品质和产量,使作物的过世色泽更鲜艳、味道更醇美、营养更丰富,完全没有环境污染。
法国使用这种复合肥料使马铃薯增产1倍,使小麦增产50%,使之叶菜和蔬菜作物增产40%。
四、结语
1、磷酸镁铵是一种较好的长效复合肥,它具有肥效长,养分利用率高,增产幅度大,改善作物品质,对环境无污染等特点,应用前景广阔。
建议有条件的企业应大力开发和推广。
2、含有磷酸盐、铵盐、镁盐任意或几种废水(或污水),都可以采用磷酸镁铵制备方法来处理,达到变废为宝,保护环境的目的。
