高中化学 每日一题 有关气体的相对密度和平均摩尔质量的计算 新人教版
气体相对分子质量的求法

专题 气体相对分子质量的求法 时间:2015.11.141.标况密度法:由气体标况下的密度可知: 例题: 方法点拨:由气体标况下的密度可知:2. 相对密度法: 已知气体A 对B 的相对密度为D :例题2、某气体对空气的相对密度为1.52,则该气体的摩尔质量为多少?3.平均法:由混合物的平均摩尔质量1L 4.22)(-⋅⨯=mol M 标ρ气体的摩尔质量?,求该的密度为、已知某气体在标况下g/L 96.111L 4.22)(-⋅⨯=mol M 标ρ111444.2296.1)()(---⋅=⋅⨯⋅=⋅=mol g mol L L g V M m 标标解:ρ)()()()()()()(p T D B M A M B M A M B A D 、使用条件:同得:由:⋅===ρρ114452.129)(--⋅=⨯⋅=⋅=mol g mol g D M M 空气解:])()()()([)()()()()()()()(M )()()()()()(的体积分数、为气体、的物质的量分数;、为气体、或得:B A B A B A B x A x B B M A A M M B x B M A x A M B n A n B n B M A n A M M ϕϕϕϕ+=⋅+⋅=++⋅=例题3:空气中氮气的体积分数为78%,氧气的体积分数为21%。
若其余1%按二氧化碳来计算,则空气的平均相对分子质量为多少?练习:1.标准状况下,气体A 的密度约为1.51g/L ,则该气体的相对分子质量为多少? 若A 气体的化学式为H 2X,则X 的相对原子质量为多少?2. 同温同压下,某气态氮的氧化物相对氢气的密度为38,则该氧化物为( ) A 、NO B 、N 2O 3 C 、NO 2 D 、N 2O 5 (写计算过程)3. 0.1molH 2, 0.2molO 2, 0.3molN 2, 0.4molCO 2 组成的混合气体,其平均摩尔质量为多少?4. 在标准状况下,8.96L 甲烷和一氧化碳的混合气体的质量为7.6g ,则混合气体的平均相对分子质量为多少?29%144%2132%7828)()()()()()()(222222=⨯+⨯+⨯=++=CO CO M O O M N N M M r r r r ϕϕϕ空气解:。
第一章气体密度的计算

3.物质的量浓度c(B)与质量分数w的关系为
1.分别用浓度都为0.1mol/LNaCl的溶液、 MgCl2溶液、AlCl3溶液与AgNO3溶液反
应,产生质量相等的氯化银沉淀。消耗这 三种溶液的体积D比为 ( )
A . 1∶2∶3
B. 3∶2∶1
C. 2∶3∶6
D. 6∶3∶2
C
3.定量MnO2与VmL10mol/L的盐酸共热
4、溶质是气体的溶液浓度的计
算
例.在标准状况下,700体积氨气溶解于1体
积水中,得到密度为0.85
的氨水,求
此氨水的质量分数和物质的量浓度。
例1:有SO2与CO2组成的混合气体,对H2的
相对密度为27,求SO2与CO2的质量比A
()
A 16:11 B 11:16 练习:
C 1:1 D 11:8
1.已知标况时某气体的密度ρ标(g·L-1),则
该气体的摩尔质量M为
。
2.若相同条件下,气体1对气体2的相对密度D,
则M1与M2及D的关系为
。
3.150 ℃时碳酸铵完全分解产生气态混合物, 求分解后所得气体的平均相对分子质量及其对
(第三课时)
教学内容: 有关气体密度(标况)和混和气体平均相对
分子质量的计算。
掌握物质的量浓度的概念;掌握有关物质的量浓 度的计算(与溶液体积、溶质物质的量的关系, 与质量分数的换算,有关稀释的计算等);
一、有关气体密度的计 算
1.气体在标况下的密度
2.气体的相对密度(D)ห้องสมุดไป่ตู้
二、混合气体的平均摩尔质量(M)
H2的相对密度。
4.某化合物X在一定条件下受热分解 2X=A↑+2B ↑ +4C ↑测得生成物的混合气体
平均摩尔质量的计算讲课文档

第一页
优选平均摩尔质量的计算课件
第二页
知识回顾:
1、摩尔质量的定义式
2、相同T、P时,气体摩尔质量与密 例关系
度的比
3、质量,密度和体积的关系
第三页
平均摩尔质量的常用求算方法
1、已知混合物的总质量和总的物质
的量:M(平)= m(总)/n(总)
适用对象:固、液、气
2、已知标准状况下气体的密度: M(平)= 22.4×ρ
第七页
三、有关混合气体平均式量的计算(即 平均摩尔质量)
M=
m总 n总
=M1×V1% + M2×V2%+… =M1×n1% + M2×n2%+…
第八页
例、某混合气体含2摩尔氧气和8摩尔氮气 ,求其平均式量。 解:
答:混合气体的平均式量为28.8 。
第九页
练习1:
标准状况下,0.4L某混合气体重1.143g,求 该气体的相对分子质量。
适用对象:气体(单一或混合)
第四页
平均摩尔质量的常用求算方法
3、已知A、B两种气体的相对密度为d(A 、B为单一或混合气体均可) M(A)= d×M(B)
适用对象:气体(单一或混合)
4、已知混合物各组分的摩尔质量及 各自所占的物质的量分数n%
M(平) = M1×n1%+M2×n2%+M3×n3%+……
第六页
由阿伏伽德罗定律可以推知,同温同压下:
T、P相同:V1/V2 = n1/n2 = N1/N2 即它们各自的物质的量分数等于其对应的体积分数。所以
有:
M=M1xV1 %+ M2xV2%+…+ MixVi %Байду номын сангаас
高中化学复习-阿伏伽德罗定律及推论 平均摩尔质量

(4)已知同温同压下某气体或混合气体的密度是另一气体A
密度的数倍:
M
D 1 1
M
A
A
M DM
1
A
练1:标况下,某气体的密度为0.005g/cm3,则此气体的摩尔
质量为多少? 112g/mol
练2:某气体对空气的相对密度为1.517,求这种气体的相对分子 质量 44 。
练3:1个12C的质量是akg,1个Na的质量是bkg,Na的摩尔质量
练1:同温同压下,1mol H2和3molNH3的体积比是 _1_:_3__,分子个数之比是____1_:3____ 。
练2:标准状况下,22.4LCO和17gNH3的体积之比为 __1_:1__ ,所含分子数之比为__1_:1__, 所含原子数之比为 __1_:2__
推 论2
同温同体积下,气体的压强比等于其物质的量之比
摩尔质量(M):单位物质的量的物质的质量叫做摩尔质量.
单位: g·mol-1
数值: 等于相对原子(分子)质量
某原子的质量
相对原子质量= 12 C的质量 1
12
mm
(1)根据定义:
M
n N/N
A
(2)已知1个分子或原子的质量: M m N A
(3)标准状况下的气体的密度:M Vm 22.4
推 论3
同温同压下,气体的密度之比等于摩尔质量之比
练4:同温同压下,相同质量的SO2和CO2的密度比 为_1_6_:_1_1___。 练5:相同条件下的下列气体密度比空气(空气的平 均式量为29)密度大的是(① ③ ④) ①CO2 ②H2 ③Cl2 ④HCl ⑤N2
二、摩尔质量和平均摩尔质量的计算
是
。(用含a、b的表达式表示)(课时作业P89第8题)
高中化学每日一题气体溶于水所得溶液的相关计算新人教版必修1(new)
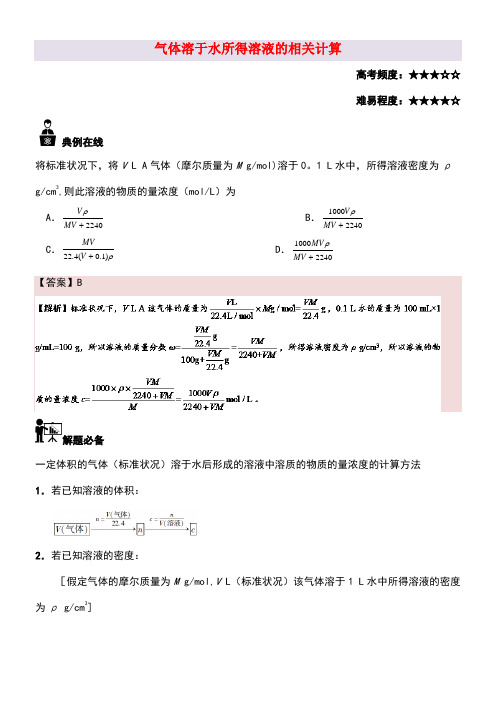
气体溶于水所得溶液的相关计算 高考频度:★★★☆☆ 难易程度:★★★★☆ 典例在线将标准状况下,将V L A 气体(摩尔质量为M g/mol)溶于0。
1 L 水中,所得溶液密度为ρ g/cm 3,则此溶液的物质的量浓度(mol/L )为A .2240V MV ρ+ B .10002240V MV ρ+ C .22.4(0.1)MVV ρ+ D .10002240MV MV ρ+【答案】B解题必备一定体积的气体(标准状况)溶于水后形成的溶液中溶质的物质的量浓度的计算方法1.若已知溶液的体积:2.若已知溶液的密度:[假定气体的摩尔质量为M g/mol,V L (标准状况)该气体溶于1 L 水中所得溶液的密度为ρ g/cm 3]计算过程:a .先计算溶质的物质的量:n =22.4V mol;b .再计算溶液的体积: V =m ρ(溶液)(溶液)=3mol g/mol 1000g 22.4g /cm V M ρ⨯+×1×10−3 L/mL=2240022400MV ρ+L ;c .最后计算溶质的物质的量浓度: c =n V =mol 22.422400L 22400V MV ρ+=100022400+V MVρmol/L 。
学霸推荐 1.若在标准状况下,将V L HCl 气体溶于1 L 水中,所得溶液密度为d g/mL ,则此溶液的物质的量浓度为A .100036.522400Vd V + mol/L B .36.522400Vd V +mol/L C .100036.522.4Vd V +mol/L D .36.522.4(1)V V d + mol/L 2.(1)4。
8 g O 2和0。
2 mol CO 2,质量之比是 ,在同温同压下的体积之比是 。
相同物质的量的SO 2和SO 3,所含分子的数目之比为 ,所含O 原子的物质的量之比为 。
(2)在标准状况下,将224 L HCl 气体溶于635 mL 水(ρ=1.0 g·cm −3)中,所得盐酸的密度为1.18 g·cm −3。
最新人教版高一化学必修1第一章第二节气体摩尔体积的常见应用

气体摩尔体积的常见应用
标准状况下1mol 气体为22.4L ,即可导出其质量便是该气体的摩尔质量。
据此可求出未知化学式的气体摩尔质量和相对分子质量,也可求出1L 气体的质量即气体密度。
反之也可由气体密度求摩尔质量。
同温同压下两气体的密度比叫气体的相对密度,可据此由气体的相对密度求气体的摩尔质量,如某气体对2H 的相对密度为15,则其相对分子质量为215⨯。
常见的有:
(1)由标准状况下气体密度求相对分子质量:d M r 4.22=
(2)由相对密度求气体的相对分子质量:若为对2H 的相对密度则为:22⨯=H r d M 对,若为对空气的相对密度则为:29⨯=对空气d M r
*(3)求混合气体的平均相对分子质量(r M ):即混合气体1mol 时的质量数值。
在已知各组成气体的体积分数时见①,若为质量分数见②:
① ++⨯=b a r M b M a M %%
②)%%/(1 +÷+÷=b a r M b M a M
(4)由同温同压下气体反应时的体积比求分子数比,进而推分子式。
(5)直接将气体摩尔体积代入有关化学方程式进行计算。
(6)气体反应物的体积比即分子数比可便于找出过量气体。
混合气体平均摩尔质量计算
【混合气体平均摩尔质量计算】 1.某种氢气和CO的混合气体,其密度是氧气的一半,则氢气的体积百分含量约为( B ) A.40% B.46% C.50% D.54% 2.空气可近似视为N2和O2按体积比为4:1组成的混合气体,则空气的平均分子质量约为( B ) (A)28 (B)29 (C)34 (D)60 3.在标准状况时密度为2.5g/L的是( A ) (A)C4H8 (B)C2H4 (C)C2H2 (D)CH4 4.用向下排气法在容积为V mL的集气瓶中收集氨气,由于空气尚未排净,最后瓶内气体的平均式量为19,将此盛满气体的集气瓶倒置于水中,瓶内水马上升到一定高度后,即停止上升,则在同温同压下,瓶内剩余气体的体积为 ( C )
A. VmL4 B. VmL5 C. VmL6 D. 无法判断
5.有一种气体的质量是14.2g,体积是4.48升(STP),该气体的摩尔质量是 ( D ) A.28.4 B.28.4g·mol-1 C.71 D.71g·mol-1 6.体积为1L干燥容器中充入HCl气体后,测得容器中气体对氧气的相对密度为1.082。将此气体倒扣在水中,进入容器中液体的体积是[C ] (A)0.25L (B)0.5L (C)0.75L (D)1L 7.在标准状况下,气体A的密度为1.25g/L,气体B的密度为1.875g/L,A和B的混合气体在相同状况下对氢气的相对密度为16.8,则混
合气体中A与B的体积比为[ D ] A.1:2 B.2:1 C.2:3 D.3:2 8、碳酸氢铵完全分解并保持温度150℃,则分解产生的混合气体密度是相同条件下氢气密度的( B ) A、26.3倍 B、13。2倍 C、19。8倍 D、无法计算 9、某物质A在一定条件下加热全部分解,产物都是气体,分解方程式为2A=B+2C+2D,测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为( B ) A、7d B、5d C、2.5d D、2d
气体的平均相对分子质量
气体的平均相对分子质量介绍气体的平均相对分子质量是指气体分子的平均质量相对于碳-12原子的质量的比值。
它是一个重要的概念,在化学和物理学领域中被广泛应用。
本文将深入探讨气体的平均相对分子质量的定义、计算方法、应用以及相关的实验技术等内容。
二级标题什么是平均相对分子质量?平均相对分子质量是指气体分子的平均质量相对于碳-12原子的质量的比值。
它是通过计算气体分子质量的加权平均值得到的。
在化学反应和热力学计算中,平均相对分子质量的概念非常重要。
如何计算平均相对分子质量?计算气体的平均相对分子质量需要知道气体分子的质量和它们在混合气体中的相对摩尔分数。
平均相对分子质量可以通过以下公式计算:M‾=∑M ix ii其中,M‾代表平均相对分子质量,M i代表第i种气体分子的相对分子质量,x i代表该气体在混合气体中的摩尔分数。
通过计算每种气体分子的质量和摩尔分数的乘积,并将它们相加,就可以得到混合气体的平均相对分子质量。
为什么要计算平均相对分子质量?计算气体的平均相对分子质量能够帮助我们了解气体的组成、性质和行为。
在化学反应中,平均相对分子质量的概念被应用于配平化学方程式、计算反应物和生成物的摩尔比以及确定化学反应的产物。
在热力学计算中,平均相对分子质量被用于计算混合气体的焓、熵和自由能等热力学性质。
三级标题实验技术:测量气体的密度和相对分子质量测量气体的密度和相对分子质量是确定气体平均相对分子质量的一种常用实验技术。
以下是一种常见的实验方法:1.使用气体收集瓶收集一定量的气体样品。
2.确定气体样品的质量和体积。
可以使用天平测量质量,使用容积计或气体收集器测量体积。
3.计算气体样品的密度。
密度可以通过气体样品的质量除以其体积计算得到。
4.根据气体的密度和理想气体状态方程(PV=nRT),计算气体的摩尔数。
5.确定气体样品的成分。
可以通过气体的摩尔比例和已知的气体相对分子质量计算得到混合气体的平均相对分子质量。
高一化学知识点计算题
高一化学知识点计算题化学作为一门实验性科学,涉及到许多基本的计算题。
在高一阶段的化学学习中,我们会接触到一些常见的计算题,掌握这些计算题的方法和思路非常重要。
今天,我们就来探讨一些高一化学知识点的计算题。
一、摩尔与摩尔质量的计算化学中常用到的一个重要概念就是摩尔(mol),它是物质的质量除以摩尔质量的比值。
摩尔质量是指物质的质量除以物质的摩尔数。
在计算中,我们常用到以下公式:摩尔数 = 质量 / 摩尔质量摩尔质量 = 质量 / 摩尔数例题1:已知20克氧气(O2)的摩尔质量为32 g/mol,求氧气的摩尔数。
解题思路:使用公式“摩尔数 = 质量 / 摩尔质量”,代入已知数据,得到摩尔数=20 / 32=0.625 mol。
例题2:已知某样物质的摩尔数为2.5 mol,质量为50 g,求摩尔质量。
解题思路:使用公式“摩尔质量 = 质量 / 摩尔数”,代入已知数据,得到摩尔质量=50 / 2.5 = 20 g/mol。
二、反应物的计算在化学反应中,化学方程式告诉了我们反应物的摩尔比。
通过摩尔比,我们可以计算出所需的物质的摩尔数和质量。
例题3:已知氢气(H2)和氧气(O2)按照2:1的摩尔比发生反应,求当氢气的摩尔数为4 mol时,氧气的摩尔数和质量分别是多少?解题思路:根据摩尔比,氢气的摩尔数是氧气的两倍,所以氢气为4 mol时,氧气的摩尔数为2 mol。
再根据摩尔质量,氧气的质量为2 mol * 32g/mol = 64 g。
三、溶液的计算在溶液中,我们经常需要计算溶质的摩尔数、溶质的质量以及溶液的浓度等。
例题4:某药水中含有15克NaOH,溶液的体积为500毫升,求NaOH的摩尔数和浓度。
解题思路:首先,将体积单位转换为升,得到溶液的体积为0.5升。
然后,根据质量和摩尔质量的关系,NaOH的摩尔数为15g / 40 g/mol = 0.375 mol。
最后,将摩尔数与体积的比值作为浓度,得到浓度为0.375 mol / 0.5 L = 0.75 mol/L。
气体平均摩尔质量课件.
高考集训
题组一 对阿伏加德罗常数的考查 1.NA 表示阿伏加德罗常数,判断下列各项是否正确。 考查物质的结构 1 mol 羟基中电子数为 10 NA 1.7 g H2O2 中含有电子数为 0.9 NA ( )× (2010· 江苏-5B) )√ (2010· 上海-7B) ) × (2009· 浙江理综-8C) ( (
58.5 g 的 NaCl 固体中含有 NA 个氯化钠分子
(5)24 g 镁的原子最外层电子数为 NA 考查物质的物理性质 (6)标准状况下,22.4 L 乙醇的分子数为 NA
(×) (2009· 福建理综-8A) (×)
(2009· 福建理综-8D)
(17)标准状况下,22.4 L 空气含有 NA 个单质分子
因为 ρ 甲>ρ 乙,则 V 甲<V 乙,同温同压下,n 乙>n 甲。由 m m M 甲= ,M 乙= 得 M 乙<M 甲,因此 B 正确。 n甲 n乙
思维提升 若充入的是体积相同的甲、乙两种气体,则 甲、乙两种气体的物质的量及相对分子质量大小关系 如何呢?
提示 根据阿伏加德罗定律,同温、同压、同体积的 甲、 乙两种气体, 其物质的量一定相同; 由于 ρ 甲>ρ 乙, 因此 m 甲>m 乙,M 甲>M 乙,所以甲的相对分子质量比 乙大。
(×)
(2010· 福建理综-7B) (18)分子数为 NA 的 CO、C2H4 混合气体体积约为 22.4 L, 质量约为 28 g (×) (2009· 上海-12C) (20)乙烯和环丙烷(C3H6 )组成的 28g 混合气体中含有 3NA 个氢原子 (× ) (2009· 广东-6B)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有关气体的相对密度和平均摩尔质量的计算
典例在线
以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是
A.现有 CO、CO2、O3 三种气体,它们分别都含有 1 mol O,则三种气体的物质的量之比为 3∶
2∶1
B.n g Cl2 中有 m 个 Cl 原子,则阿伏加德罗常数 NA 的数值可表示为 35.5m n
C.标准状况下,11.2 L X 气体分子的质量为 16 g,则 X 气体的摩尔质量是 32
D.5.6 g CO 和 22.4 L CO2 中含有的碳原子数一定相等
【答案】B
【解析】含 1 mol O 的 CO、CO2、O3 的物质的量分别是 1 mol、 1 mol、 1 mol,三者之比为 6∶
2
3
3∶2,A 错误;n g Cl2 物质的量为 n mol,含 Cl 原子数 n ×NA×2=m,NA= 35.5m ,B 正确;
71
71
n
摩尔质量的单位为 g·mol−1,C 错误;未说明温度、压强状况,不能进行气体体积与物质的量
的一切相关计算和比较,D 错误。
解题必备 标准状况下,气体物理量的计算
利用公式 n= m = N =
V
(标准状况)进行换算。
M N A 22.4 L / mol
(1)气体物质的量与体积:n=
V。
22.4 L / mol
(2)气体的摩尔质量:M=Vm·ρ =ρ 标×22.4 L/mol。
(3)气体的分子数与体积:N=n·NA=
V
·NA。
22.4 L / mol
(4)气体质量与体积:m=n·M=
V
·M=ρ 标·V。
22.4 L / mol
学霸推荐
1.如图两瓶体积相等的气体,在同温同压下瓶内气体的关系一定正确的是
A.原子数相等
B.密度相等
C.质量相等
D.摩尔质量相等
2.标准状况下的下列气体关系正确的是
①6.72 L CH4 ②3.01×1023 个 HCl 分子 ③13.6 g H2S ④0.2 mol NH3
A.体积:④>①>②>③
B.密度:②>③>①>④
C.质量:②>③>①>④
D.氢原子数:①>②>③>④
3.(1)同温同压下,同体积的氨气(NH3)和硫化氢(H2S)气体的质量比为________。
(2)同温同压下,氨气和硫化氢气体的密度比为________。
(3)在标准状况下,0.01 mol 某气体的质量为 0.44 g,则该气体的密度为________g·L−1(保
留小数点后两位),该气体的相对分子质量为________。
(4)在标准状况下,14 g CO 与 2 g H2 的混合气体体积为________L。
4.某双原子分子构成的气体,其摩尔质量为 M g/mol,一定量的该气体质量为 m g,阿伏加
德罗常数为 NA,则:
(1)该气体的物质的量为________mol。
(2)该气体在标准状况下的体积为________ L。
(3)该气体在标准状况下的密度为________ g/L。
(4)该气体所含原子总数为________个。
(5)该气体的一个分子的质量为________g。
参考答案 1.【答案】A
【解析】根据阿伏加德罗定律可知:同温同压同体积的气体具有相同的分子数,又因为气体均为双原 子分子,故原子数相等。
2.【答案】C 【解析】①6.72 L CH4 物质的量为 6.72 L÷22.4 L/mol=0.3 mol;②3.01×1023 个 HCl 分子的物质的量 为 0.5 mol;③13.6 g H2S 的物质的量为 13.6 g÷34 g/mol=0.4 mol,④0.2 mol NH3。
A、相同条件
下,气体的体积之比等于物质的量之比,所以体积②>③>①>④,A 错误;B、相同条件下气体的密度之 比是相应的摩尔质量之比,则密度②>③>④>①,B 错误;C、各物质的质量分别为①CH4 为 0.3 mol×16 g/mol=4.8 g,②HCl 为 0.5 mol×36.5 g/mol=18.25 g,③H2S 13.6 g,④NH3 为 0.2 mol×17 g/mol=3.4 g,所以质量②>③>①>④,C 正确;D、各物质中 H 原子的物质的量分别为①CH4 为 0.3 mol×4=1.2 mol, ②HCl 为 0.5 mol,③H2S 0.4 mol×2=0.8 mol,④NH3 为 0.2 mol×3=0.6 mol,所以氢原子个数①>③> ④>②,D 错误。
答案选 C。
3.【答案】(1)1∶2 (2)1∶2 (3)1.96 44 (4)33.6
4.【答案】(1) m (2) 22.4m (3) M (4) 2mNA (5) M
M
M
22.4
M
NA
【解析】(1)由公式 n= m 直接求解。
M
(2)由 n= m 、n=
V
可求得标准状况下的体积为 m ×22.4 L。
M 22.4 L / mol
M
(3)根据 ρ = m ,可求得该气体在标准状况下的密度为 M g/L。
V
22.4
(4)由于为双原子分子,所以原子总数为 m ×2 NA= 2mNA 。
M
M
(5)由摩尔质量 M g/mol 知一个分子的质量为 M g。
NA
。
