等效平衡专题(超级详细)
高中化学 等效平衡专题

等效平衡专题2002.10.20.1.等效平衡的定义在一定条件(定温、定容或定温、定压)下,只是起始加入情况不同的同一可逆反应达到平衡后,任何相同组分的分数(体积、物质的量)均相同,这样的化学平衡互称等效平衡。
2.等效平衡的分类(1)定温(T)、定容(V)条件下的等效平衡I类:对一般可逆反应,一定T、V条件下,只改变起始加入情况,只要通过可逆反应的化学计量数比换算成平衡式左右两边同一边物质的物质的量与原平衡相同,则二平衡等效。
例1 在一定温度下,把2 molSO2和1 molO2通入一个一定容积的密闭容器里,发生如下反应:2SO2+O2 2SO3,当此反应进行到一定程度时,反应混合物就处于化学平衡状态。
现在该容器中维持温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量( mol )。
如a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体积分数仍跟上述平衡时的完全相同。
请填写下列空白:(1)若a=0, b=0,则c= 。
(2)若a=0.5,则b= 和c= 。
(3)若a、b、c必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c):、。
(全国高考考题)II类:在定T、V情况下,对于反应前后气体分子数不变的可逆反应,只要反应物(或生成物)的物质的量的比例与原平衡相同,则二平衡等效。
例2 在一个固定体积的密闭容器中,保持一定温度进行以下反应:H2 ( g )+Br2 ( g ) 2HBr ( g )已知加入1 mol H2和2 mol Br2时,达到平衡后生成对下列编号①~③的状态,填写表中的空白。
(高考科研试测题)(2)定T、P下的等效平衡在T、P相同的条件下,改变起始加入情况,只要按化学计量数换算成平衡式左右两边同一边物质的物质的量之比与原平衡相同,则达平衡后与原平衡等效。
例3 在一个盛有催化剂容积可变的蜜闭容器中,保持一定温度和压强,进行以下反应:N2+3H22NH3。
等效平衡专题(超级详细)

a+c/2 = 2
b+3c/2 = 6
第12页,共36页。一Βιβλιοθήκη 恒温恒容 2:(△n(g) ≠ 0)
2SO2
+ O2
2SO3
2molSO2 1molO2
A
平衡状态Ⅰ SO2 a% O2 b% SO3 c%
方法:
放大缩小法
极限转换法或一边倒法
4molSO2 2molO2
B
2molSO2 1molO2
B
B
1mol H2 1mol I2
B
第18页,共36页。
2HI(g)
2mol H2 2mol I2
B
例1、恒温恒容时对于反响:H2(g) + I2(g)
2HI(g)
以下条件能与以开下始图到达等效平平衡衡状的态是〔
AB〕CD
1mol H2 1molI2
A. 2 mol HI 〔1
B. 2 mol H2+2 mol I2
A 2molA+1molB+3molC+1molD
B 3molC+1molD+1molB
C 3molC+1molD
D 1molA+0.5molB+1.5molC+0.5molD
第10页,共36页。
例2 在一定温度下,把2molSO2和1molO2通入一个一定容积的 密闭容器中,发生以下反响:
2SO2+O2
产生结果:
各组分百分量、c一样,n同比例变化
第27页,共36页。
在一定温度下,一个压强恒定的密闭容器中发
生反响2A(g)+B(g)
3C(g)+D(g),根据下表有
高中化学专题—等效平衡详细讲解

高中化学专题—等效平衡详解一、概念。
在一定条件(恒温恒容或恒温恒压)下,同一可逆反应体系,不管是从正反应开始,还是从逆反应开始,(体积分数、物质的量分数等)均相同,这样的化学平衡互在达到化学平衡状态时,任何相同组分的百分含量....称等效平衡(包括“全等等效和相似等效”)。
(体积分数、物质的量分数等)一定相同理解:(1)只要是等效平衡,平衡时同一物质的百分含量....(2)外界条件相同:通常可以是①恒温、恒容,②恒温、恒压。
(3)平衡状态只与始态有关,而与途径无关,(如:①无论反应从正反应方向开始,还是从逆反应方向开始②投料是一次还是分成几次③反应容器经过扩大—缩小或缩小—扩大的过程,)比较时都运用“一边倒”倒回到起.........进行比较。
始的状态....二、分类(一)全等等效和相似等效1、全等等效:一边倒后要和标准状态数值完全相同才能等效,达到平衡后,w%(百分含量,如质量分数、体积分数、物质的量分数等)、n(物质的量)、m(质量)、V(体积)等量完全相同。
2、相似等效:一边倒后和标准状态数值成比例就可以等效,达到平衡后,w%一定相同,但n、m、V等量不一定相同但一定成比例。
(二)具体分析方法针对反应mA(g)+n B(g)pC(g)+ qD(g),1、若m + n =p + q,则无论恒温恒容还是恒温恒压,都满足相似等效。
例:对于反应H2(g)+ I2(g)2HI(g),在某温度下,向某一密闭容器中加入1molH2和1molI2,平衡时HI的浓度为a,HI的物质的量为b,则(1)若保持恒温恒容,开始时投入_______molHI,与上述情况等效(2)若保持恒温恒压,开始时投入_______molHI,与上述情况等效(3)若保持恒温恒容,开始时投入0.5molH2,还需要加入_______mol I2和_______molHI,与上述情况等效(4)若保持恒温恒压,开始时投入4molHI,则平衡时,HI的浓度为_______,物质的量为_______2、若m + n ≠p + q,(1)若恒温恒容,则满足全等等效;(2)若恒温恒压,则满足相似等效。
等效平衡专题讲解

等效平衡一、概念在一定条件(恒温恒容或恒温恒压)下,同一可逆反应体系,以不同的投料方式(不管是从正反应开始,还是从逆反应开始或从中间状态开始),在达到化学平衡状态时,任何相同组分的含量(体积分数、物质的量分数、质量分数等)均相同,这样的化学平衡互称等效平衡(包括“相同的平衡状态”)二、等效平衡的分类(共三类)第一类:恒T恒V下,对于反应前后气体体积发生变化的反应如果按化学方程式的计量关系转化为同一边的物质,其物质的量与对应组分的起始加入量相同(等质量投放),则建立的化学平衡状态是等效的。
平衡后,各组分的百分含量及各组分的浓度都相等(绝对等效)。
例1:在一定温度下,把2 mol SO2和1 mol O2通入一定容积的密闭容器中,发生如下反应,,当此反应进行到一定程度时反应混合物就处于化学平衡状态。
现在该容器中维持温度不变,令a、b、c分别代表初始时加入的的物质的量(mol),如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡状态时,反应混合物中三种气体的百分含量仍跟上述平衡完全相同。
请填空:(1)若a=0,b=0,则c=___________。
(2)若a=0.5,则b=___________,c=___________。
(3)a、b、c的取值必须满足的一般条件是___________,___________。
(请用两个方程式表示,其中一个只含a和c,另一个只含b和c)第二类:在恒T恒V下,对于反应前后气体体积不变的可逆反应以不同的投料方式进行反应,如果依据化学方程式的计量关系换算到同一边,只要反应物(生成物)中各组份的物质的量的比例相同(等比例投放),即为等效(相似等效)例2:在一个固定容积的密闭容器中,保持一定的温度进行以下反应:已知加入1 mol H2和2 mol Br2时,达到平衡后生成a mol HBr (见下表已知项),在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号①~③的状态,填写下表中的空白。
等效平衡专题(较好的资料)
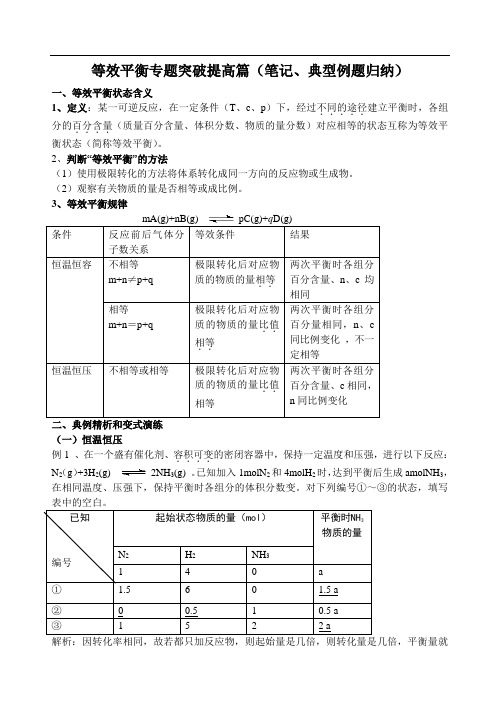
等效平衡专题突破提高篇(笔记、典型例题归纳)一、等效平衡状态含义1、定义:某一可逆反应,在一定条件(T 、c 、p )下,经过不同的途径.....建立平衡时,各组分的百分含量....(质量百分含量、体积分数、物质的量分数)对应相等的状态互称为等效平衡状态(简称等效平衡)。
2、判断“等效平衡”的方法(1)使用极限转化的方法将体系转化成同一方向的反应物或生成物。
(2)观察有关物质的量是否相等或成比例。
3、等效平衡规律二、典例精析和变式演练(一)恒温恒压例1 、在一个盛有催化剂、容积可变....的密闭容器中,保持一定温度和压强,进行以下反应: N 2(g )+3H 2(g) 2NH 3(g) 。
已知加入1molN 2和4molH 2时,达到平衡后生成amolNH 3,在相同温度、压强下,保持平衡时各组分的体积分数变。
对下列编号①~③的状态,填写表中的空白。
解析:因转化率相同,故若都只加反应物,则起始量是几倍,则转化量是几倍,平衡量就是几倍,又因等压条件下物质的量之比等于体积之比,故起始量之比等于平衡量之比。
①和题干量之比是1.5,平衡之比就是1.5。
②的平衡量是题干平衡量的一半,则若没有NH3,只有N2、H2,则其物质的量应分别为0.5和2mol,又因1 mol NH3完全转化生成N20.5 mol,H21.5mol,故原来的N2、H2分别为0 mol 和0.5mol。
③可同理推得。
例2、恒温、恒压..下,在一个可变容积的容器中发生如下发应:A(g)+B(g)C(g)(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol 和3a mol,则x=mol,y=mol。
平衡时,B的物质的量(选填一个编号)(甲)大于2 mol (乙)等于2 mol(丙)小于2 mol (丁)可能大于、等于或小于2mol作出此判断的理由是。
等效平衡专题

等效平衡专题一、等效平衡的含义在一定条件下(恒温恒容或恒温恒压),对于同一可逆反应而言,如果起始加入的情况不同,但达到平衡后,任何一种相同组分的含量(体积分数或物质的量分数)均相同,这样的化学平衡互称为等效平衡。
化学平衡状态的建立与条件有关,而与平衡建立的途径无关。
同一可逆反应,无论是从正反应开始,还是从逆反应开始,只要达到平衡时各组分的含量完全相同,都可形成等效平衡。
如:常温常压下,可逆反应2SO2(g)+O2(g) 2SO3(g)在一密闭容器中进行,起始物质分别如下:2SO2(g)+O2(g) 2SO3(g)①2mol 1mol 0mol②0mol 0mol 2mol③0.5mol 0.25mol 1.5mol①从正反应开始,②从逆反应开始,③正、逆反应同时开始,由于①、②、③三种情况中,如果按方程式的计量关系折算成同一方向的反应物,对应各组分的物质的量均相等[如将②、③折算为①],因此三者达平衡时的状态必然相同,故为等效平衡。
二、等效平衡的分类(1) 恒温恒容..的可逆反应,如果起始时....条件下,对于反应前后气体分子数改变物质的投入量不同,但是通过方程式的化学计量数换算成同一侧的物质后,各物质的量对应相等..,则两平衡等效。
【例1】在一定温度下,把2mol SO2和1mol O2通入一容积固定的密闭容器里,在一定条件下发生如下反应:2SO2+O22SO3,当此反应进行到一定程度时达到化学平衡状态。
若保持该容器中的温度不变,令a、b、c分别代表初始时SO2、O2和SO3的物质的量(mol)。
如a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的体积分数仍跟上述平衡时的完全相同。
请填写下列空白:(1)若a=0,b=0,则c=(2)若a=0.5,则b= 、c=(3)a、b、c必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c。
另一个只含b和c)、练习:1.在一个固定容积的密闭容器中加入2molA和1molB,发生反应2A(g)+B(g) 3C(g)+D(g),达到平衡时,C的浓度为wmol/L。
等效平衡专题超级详细共37页文档
46、我们若已接受最坏的,就再没有什么损失。——卡耐基 47、书到用时方恨少、事非经过不知难。——陆游 48、书籍把我们引入最美好的社会,使我们认识各个时代的伟大智者。——史美尔斯 49、熟读唐诗三百首,不会作诗也会吟。——孙洙 50、谁和我一样用功,谁就会和我一样成功。——莫扎特
等效平衡专题超级详细
51、没有哪个社会可以制订一部永远 适用的 宪法, 甚至一 条永远 适用的 法律。 ——杰 斐逊 52、法律源于人的自卫本能。——英 格索尔
53、人们通常会发现,法律就是这样 一种的 网,触 犯法律பைடு நூலகம்的人, 小的可 以穿网 而过, 大的可 以破网 而出, 只有中 等的才 会坠入 网中。 ——申 斯通 54、法律就是法律它是一座雄伟的大 夏,庇 护着我 们大家 ;它的 每一块 砖石都 垒在另 一块砖 石上。 ——高 尔斯华 绥 55、今天的法律未必明天仍是法律。 ——罗·伯顿
等效平衡专题
等效平衡专题一、等效平衡原理:[例]一定温度下密闭容器中发生反应:1L 容器800℃时可逆反应:CO(g) +H 2O(g) CO 2(g) +H 2(g)途径1:起始0.01mol 0.01mol 0 0 平衡0.005mol 0.005mol 0.005mol 0.005mol 途径2:起始0 0 0.01mol 0.01mol 平衡0.005mol0.005mol0.005mol0.005mol上述两种途径,同一可逆反应,外界条件相同,通过不同的途径(正向和逆向),平衡时同种物质的物质的量相等(同种物质的含量相等)-----效果相同的平衡对于同一个可逆反应,在相同的条件下(恒温恒容或恒温恒压),不管是从正反应开始,还是从逆反应开始,或从正反应和逆反应同时开始,都可以建立同一平衡状态。
即化学平衡状态与条件有关,而与建立平衡的途径无关二、等效平衡定义及规律:1、定义:同一可逆反应当外界条件一定时,反应无论从正反应开始还是从逆反应开始,平衡时平衡混合物中同种物质的含量(体积分数或物质的量分数)相同的状态。
2、规律:等效类型(1)(2)(3)条件恒温、恒容恒温、恒容恒温、恒压起始投料折算为方程式同一边物质,其“量”相同折算为方程式同一边物质,其“量”符合同一比例折算为方程式同一边物质,其“量”符合同一比例对反应的要求任何可逆反应反应前、后气体体积相等任何可逆反应等效情况完全等效:各物质的百分含量、浓度、物质的量均相同不完全等效:各物质的百分含量相同,但各物质的浓度、物质的量不一定相同不完全等效:各物质的百分含量相同,但各物质的浓度、物质的量不一定相同[分析]规律一:[例1]恒温恒容时,2SO 2(g)+O 2(g)2SO 3(g)途径1起始2mol 1mol 0 途径2起始0 0 2mol 途径3起始1mol 0.5mol 1mol 途径4起始0.5mol ? ? 途径5起始amolbmolcmol[问题] ①途径2、3与1等效吗?②途径4 中O 2(g) 和SO 3(g)的起始量为多少, 平衡时可与途径1平衡时SO 3(g)的含量相同?③途径5中a 、b 符合怎样的关系达到的平衡状态与1相同?[练习1]将2molSO 2(g)和2molSO 3(g)混合于某固定体积的容器中,在一定条件下达平衡。
等效平衡专题(超级详细)ppt
B 3molC+1molD+1molB
C 3molC+1molD
D 1molA+0.5molB+1.5molC+0.5molD
例2 在一定温度下,把2molSO2和1molO2通入一个一 定容积的密闭容器中,发生以下反应:
2SO2+O2 2SO3,当此反应进行到一定程度时,反应混 合物就处于化学平衡状态。现维持该温度不变,令a、b、 c分别代表初始加入的SO2、O2和SO3的物质的量(mol), 如果a、b、c取不同的数值,它们必须满足一定的相互关 系,才能保证达到平衡时反应混合物中三种气体的含量仍 跟上述平衡时的完全相同。请填写下列空白:
二、等效平衡的分类
1、完全等同——相同组分的百分含 量、物质的量、物质的量浓度都相 同(等量等效)
2、比例相同——相同组分的百分含 量相同,但物质的量、物质的量浓 度不等(等比等效)
等效平衡的解法 — 极值转换法(一边倒)
无论平衡从哪个方向建立,在判断 时都可根据题给条件和反应计量系数把 生成物全部推算为反应物或把反应物全 部推算成生成物再与原平衡加入的物质 的量相比较,若物质的量“相当”,则 为等效平衡.
恒温恒容
(△n(g) ≠ 0)
催化剂
2SO2 + O2 加热
平衡状态
2mol SO2 1mol O2
SO2 a% O2 b%
2mol SO2 1mol O2
B
A
SO3 c%
方法:放大缩小法 2mol SO2 1mol O2
非等效平衡!
B
2SO3
4mol SO2 2mol O2
等效平衡问题及解题技巧
专题一、等效平衡问题1、定义:在相同条件下定温定容或定温定压,对同一可逆反应,由于起始有关物质的量“相当”,无论从正反应开始还是从逆反应开始,均可达到平衡,且任何组分的含量通常为百分含量相同,这样的平衡互称为等效平衡;2、等效平衡的类型及建立等效平衡的条件规律一: 恒.温.恒.容.条件下,对于任何....,如..无论反应前后气体分子数是否相同可逆反应果起始加入物质的物质的量不同,按化学方程式中的化学计量关系换算成同一方向的物质即“一边倒”后,各组分的物质的量与原平衡相同,则两平衡等效,平衡时,同种组分的体积分数、物质的量浓度、物质的量均相同也可叫全等平衡;如: mAg+nBg pCg+qDg起始① mmol nmol 0 0起始② 0 0 pmol qmol上述两种情况投料不同,但是将②中投料“左边倒”后,四种物质的物质的量均同①相同,因此两种情况可达到等效平衡,平衡时,同种组分如A的体积分数、物质的量浓度、物质的量均相同;例1.在一固定体积的密闭容器中通入2molA和1molB发生反应2Ag+Bg3Cg+Dg反应达到平衡时,测得C的物质的量浓度为wmol/L.若维持容器的容积不变,按下列四种配比做起始浓度,达平衡后,C的浓度仍维持wmol/L的是A、4molA+2molBB、2molA+1molB+3molC+1molDC、3molC+1molD+1molBD、3molC+1molD例2、在固定体积的密闭容器中,加入2molA,1molB,发生反应:Ag+Bg 2Cg达到平衡时,C 的质量分数为ω%,在相同条件下按下列情况充入物质达到平衡时C的质量分数仍为ω%的是,2molB ,2molC例3、在一个固定体积的密闭容器中,保持一定浓度,进行以下反应:4Ag+5Bg 4Cg+6Dg,已知加入4molA和5molB时,反应进行到一定程度时,反应混合物就处于平衡状态,现在该容器中,保持温度不变,令a,b,c,d分别代表初始加入的A,B,C,D的物质的量,如果a,b,c,d取不同的数值,它们必须满足一定关系,才能保证达到平衡时,反应混合物中几种物质的百分含量仍跟上述平衡时完全相同,请填写下列空白:1若a=0,b=0, 则c= ,d= .2若a=1,则b= ,c= ,d=3a,b,c,d取值必须满足的一般条件是请用方程式表示,其中一个只含a和c,另一个只含b 和c: , .规律二: 恒温恒...压.条件下,对于任何..无论反应前后气体分子数是否相同可逆反应....,如果起始加入物质的物质的量不同,按化学方程式中的化学计量关系“一边倒”后, 各组分的物质的量之比与原平衡相同,则两平衡等效,平衡时,同种组分的体积分数、物质的量浓度相同,但物质的量不同;如: mAg + nBg pCg + qDg起始① mmol nmol 0 0起始② 0 0起始③上述三种情况投料不同,但②③两种情况“左边倒”后,nA 和nB 的比值均同①相同,因此三种情况可达到等效平衡,平衡时,同种组分如A 的体积分数、物质的量浓度相同,但物质的量不同;例4.恒温恒压下,在一个可变容积的密闭容器中发生如下反应: Ag+Bg Cg开始时放入1molA 和1molB,达到平衡后,生成amolC.1若开始时放入3molA 和3molB,达到平衡后,生成C 的物质的量为 mol2若开始时放入xmolA 、3molB 和1molC,达到平衡后,A 和C 的物质的量分别是ymol 和3amolx= ,y=规律三: 恒温恒容....条件下,对于反应前后气体分子数相同...........的可逆反应,如果起始加入物质的物质的量不同,按化学方程式中的化学计量关系“一边倒”后, 各组分的物质的量之比与原平衡相同,则两平衡等效,平衡时,同种组分的体积分数相同,但物质的量浓度、物质的量不同;如:H2g + I2g 2HIg起始① 1mol 1mol 0 起始② 0 0 4mol 起始③ 0上述三种情况投料不同,但将②中投料“左边倒”后三种情况下nH2和nI2的比值相同,②可认为①容积减半压强加倍得到,③可认为容积加倍压强减半得到,压强改变平衡不移动,所以三种情况可达等效平衡;三种情况达到平衡时,同种组分如H2的体积分数相同,物质的量及物质的量浓度不相同;例5.有甲、乙两个容积相等的恒容密闭容器,向甲容器中通入6molA和2molB,向乙容器中通入、和3molC,将两容器的温度恒定在770K,使反应3Ag+Bg xCg达到平衡,此时测得甲、乙两容器中C的体积分数都是,试回答下列有关问题:1若平衡时,甲、乙两容器中A的物质的量不相等,则x= ;若平衡时甲、乙两容器中A的物质的量不相等,则x= .2平衡时,甲、乙两容器中A、B的物质的量之比是否相等填“相等”或“不相等”,平衡时甲中A的体积分数为3若平衡时两容器中的压强不相等,则两容器中压强之比为3、等效平衡的解题思路1分析是否属于等效平衡问题 2属何种类型的等效平衡3选择建立平衡的条件极值法练习1.在t℃时,向一容积不变的密闭容器内放入1molA和1molB,发生如下反应:Ag+Bg Cg+2Dg.达到平衡时C的含量m%,保持温度不变,若按下列配比将物质放入容器中,达到平衡时,C的含量仍为m%的是和2molB ,1molA和1molB和2molD 和1molD2. 在一定条件下,向一带活塞的密闭容器内充入2molSO2和1molO2,发生下列反应:2 SO2 g+O2g2SO3g,达到平衡后改变下列条件,SO3气体平衡浓度不改变的是A.保持温度和容器体积不变,充入1mol SO3B. 保持温度和容器压强不变,充入1mol SO3C. 保持温度和容器压强不变,充入1mol O2D. 保持温度和容器压强不变,充入1mol Ar3.恒温恒容下,有反应2Ag + 2Bg Cg + 3Dg,现从两条途径分别建立平衡;途径I:A、B 的起始浓度均为2mol/L;途径II:C、D起始浓度分别为2mol/L和6mol/L,下列叙述错误的是A.平衡时,体系内混合气体的百分组成相同B.平衡时,途径I所得各组分浓度为途径II所得各组分浓度的一半C.平衡时,途径I 的反应速率vA等于途径II的反应速率vAD.平衡时,途径I所得混合气体密度为途径II所得混合气体密度的一半3.在一恒定的容器中充入2molA和1molB发生反应:2Ag+Bg xCg达到平衡后,C的体积分数为a%;若维持容器的容积和温度不变,按起始物质的量A为, B为, C为充入容器中,达到平衡后,C的体积分数仍为a%,则x的值为A.只能为2B.只能为3C.可能为2,也可能为3D.任意值4.Ⅰ.在一个固定体积的密闭容器中2molA和1molB发生反应2Ag+Bg3Cg +Dg, 达到平衡时,C的浓度为Wmol/L维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,若C的浓度仍为Wmol/L,该配比是+2molB +1molD+1molB+2molA +1molD+1molB +1molDⅡ.①若题中改为1molA,,,作为起始物质,达到平衡后,C的浓度是否仍为Wmol/L②若题中A为L,B为,则C为mol,D为 mol作为起始物质时,达到平衡后,C的浓度仍为Wmol/L.③若题中改为amolA,bmolB,cmolC,dmolD作为起始物质,达到平衡后,C的浓度如果仍为Wmol/L,则a与c,b与d分别满足什么关系:、5.Ⅰ.恒温恒压下,在一个可变容积的容器中发生如下反应:Ag+Bg Cg1若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为 mol. 2若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol.3若开始时放入xmolA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3amol,则x= mol,y= mol.平衡时,B的物质的量选一个编号甲大于2mol 乙等于2mol丙小于2mol 丁可能大于、等于或小于2mol作出此判断的理由是(1)若在3的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是Ⅱ.若维持温度不变在一个与1反应前起始体积相同、且容积固定的容器中发生上述反应;(2)开始时放入1molA和1molB到达平衡后生成bmolC,将b与1小题中的d进行比较选一个编号甲a<b 乙a>b 丙a=b 丁不能比较a和b的大小作出判断的理由是专题二、化学平衡问题的解题技巧及规律一、当外界条件改变引起多方面因素发生改变时,可以通过构造一个中间状态来解题,思维模式为:例1:一真空密闭容器中盛有1molPCl5,加热到20℃时发生如下反应:PCl5g PCl3g+ Cl2g反应达到平衡时,PCl5所占体积分数为M%,若在同一温度和同一容器中最初投入的是2molPCl5,反应达到平衡时 PCl5所占的体积分数为N%,则M和N的正确关系是>N <N =N D.无法比较例2:一定温度下,在容积固定的密闭容器中发生可逆反应2Ag Bg并达到平衡,在相同条件下,若分别再向容器中通入一定量的气体A或气体B,重新达到平衡后,容器内A的体积分数与原平衡相比A.都减小B.前者增大,后者减小C.都增大D.前者减小,后者增大练习1:某温度下,在固定容积的密闭中,可逆反应Ag+3Bg2Cg达到平衡,测得平衡时A,B,C物质的量之比nA:nB:ng=2:2:1,若温度保持不变,以2:2:1的物质的量之比再充入A,B 和C,下列判断中正确的是A.平衡向逆反应方向移动B.平衡不发生移动C. C 的质量分数增大D. C的质量可能减小练习2:某温度下,在一容积可变的容器中,反应2Ag+Bg2Cg达到平衡时,A,B,C的物质的量分别为4mol,2mol和4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是A.均减半B.均加倍C.均增加1molD.均减少1mol练习3:在一密闭容器中,反应aAg bBg达平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时B的浓度是原来的60%,则A.平衡向正反应方向移动了B.物质A的转化率减小了C.物质B的质量分数增加了 >b练习4:有两只密闭容器A和B,A容器有一个可移动活塞使容器内保持恒压,B容器保持恒容,起始时向两只容器中分别充入等量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等.在保持400℃条件下使之发生反应:2SO2 +O22SO3,填写下列空白:1达到平衡所需时间A比B ,A中的SO2转化率比B .2达到1 所述平衡后,若向两容器通入数量不多的等量氩气,A容器的化学平衡移动,B容器的化学平衡移动.3达到1所述平衡后,向两容器中通入等量的原反应气体,达到平衡后,A中的SO3体积分数增大、减小、不变,B中的SO3体积分数练习5:在373K,把气体通入体积为500ml的真空密闭容器中立即出现红棕色,反应进行到2s时,NO2含量为,进行到60s时,达到平衡,此时容器内混合气体的密度是氢气密度的倍,则下列叙述中正确的是A.开始2s内CN2O4的变化表示的反应速率为L-1s-1B.达到平衡时体系内压强是开始时的倍C.平衡时CN2O4为 L-1D.平衡后若压缩容器,减小体积,则再达平衡时NO2浓度下降二、平衡正向移动与反应物的转化关系1.由于温度或压强改变而引起平衡正向移动时,反应物的转化率必定增大;2.由于增加反应物浓度引起平衡正向移动时,有以下几种情况:1对于反应物不考虑固体反应物不只一种的可逆反应,如N2+3H22NH3,平衡时增加一种反应物浓度,平衡正向移动,另一种反应物的转化率增大,而自身的转化率却减小;2对于反应物只有一种的可逆反应并规定起始时只有反应物,若反应前后气体分子数不变,如2HIg H2g+I2g,则无论增大或减小HI的浓度,HI的转化率都不改变,若反应后气体分子数减少,如2NO2g N2O4g,则增大NO2的浓度,NO2的转化率增大;若反应后气体分子数增大,如2NH3N2+3H2,则增大 NH3的浓度,NH3的转化率减小;专题三、化学平衡图象题的解法1.步骤:①一看面即纵坐标与横坐标的意义,二看线即线的走向和趋势,三看点即起点、折点、交点、终点,四看辅助线如等温线、等压线、平衡线等,五看量的变化如浓度变化,温度变化,转化率变化等;②想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律;③作判断:根据图象中表现的关系与所学规律相比较,作出符合题目要求的判断;2.原则:①“定一议二”②“先拐先平”例1.在一密闭体系中发生下列反应:N2g+3H2g2NH3g正反应放热,下图是某一时间段中反应速率与反应进程的曲线关系图.回答下列问题: 1处于平衡状态的时间段是2t1, t3, t4时刻体系中分别是什么条件发生了变化 t1: t3: t4:3下列各时间段时,氨的体积分数最高的是A. t0~t1B. t2~t3C. t3~t4D. t5~t6例g+nBg qCg反应在密闭容器中进行,如图表示反应过程中温度T,压强P与B%气体B在混合气体中的百分含量的关系曲线由曲线分析,下列结论正确的是+n>q 正反应为放热反应 +n>q 正反应为吸热反应+n<q正反应为放热反应 +n<q 正反应为吸热反应例3.某一达到化学平衡状态的可逆反应:mAg+nBg pCg + qDg,如图表示A的转化率αA与温度,压强的关系,分析该图示可以得出的结论是A. 正反应吸热,m+n>p+qB. 正反应吸热,m+n<p+qC. 正反应放热,m+n>p+qD. 正反应放热,m+n<p+q例4.可逆反应nXg+Yg mZg正反应为放热反应的x%x%为x混合气体中的体积分数与温度关系如右图所示,图中曲线上a,d点是代表平衡时x%与温度关系的两点,b,c两点是反应混合物未平衡时的两点,若研究与密闭容器中以定压进行反应,当V正>V逆时,则在右图中,表示此种情况下的点是点;例5.反应mAg +nBg pCg+qDg,开始充入A,B或C,D,下图一,图二分别表示反应达到平衡后,改变温度、压强对反应速率及平衡的影响,下列判断正确的是A.开始时充入A、B,m+n>p+q,正反应为放热反应B. 开始时充入A、B,m+n<p+q,正反应为吸热反应C. 开始时充入C、D,m+n>p+q,正反应为放热反应D.开始时充入C、D, m+n<p+q,正反应为吸热反应例6.可逆反应mAg+nBg eCg+fDg,当其它条件不变时,C 的体积分数φ与温度T、压强P的关系如图1和如图2所示,c下列说法正确的是A.达平衡后使用催化剂,C的体积分数变大B.达平衡后升温,平衡左移C.方程式系数m+n>e+fD.达平衡后增加A的量有利于平衡向正反应方向移动。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
产生结果:各组分百分量相同,n、c同比例变化,
则为等效平衡。
例1.在一定温度下,把1 mol CO和2 mol H2O通 入一个密闭容器中,发生如下反应: CO(g)+H2O (g) CO2(g)+H2(g),一定时 间后达到平衡,此时,CO的含量为p%,若 维持温度不变,改变起始加入物质的物质的 量,平衡时CO的含量仍为p%的是( BD )
1mol H2 1mol I2
A
HI c%
2mol H2 2mol I2
等效平衡
1mol H2 1mol I2
B
B
B
1mol H2 1mol I2
B
二)恒温恒压
1:(△n(g) ≠ 0)
2molSO2 1molO2
2SO2 + O2
SO2 a% O2 b%
催化剂 加热
2SO3
平衡状态Ⅰ
A
方法: 放大或缩小法
2mol H2 2mol I2
B
1mol H2 1mol I2
I2 b%
HI c%
B
H2 a%
I2 b% HI c%
B
二)恒温恒压
2:(△n(g)=0)
1mol H2 1mol I2
H2(g) + I2(g)
催化剂 加热
2HI(g)
平衡状态 H2 a% I2 b% 1mol H2 1mol I2
B
A
HI c%
方法: 放大缩小法
平衡状态Ⅱ H2HI c% 平衡状态Ⅱ H2 a% I2 b%
1mol H2 1mol I2
2mol H2 2mol I2
B
1mol H2 1mol I2
B
HI c%
?
B
二)恒温恒压
2:(△n(g)=0)
A.1molCO2 、2molH2
B. 0.2molCO2 、0.2molH2 、
0.8molCO 、 1.8molH2O C.1molCO2、1molH2O D.1molCO2 、1molH2 、1molH2O
2、恒温恒压条件下
改变起始加入情况,只要按化学计
量数换算成平衡式左右两边中同一
边物质的物质的量之比与原平衡相
概念的理解:
(1)一定条件下:通常可以是①同T同V,②同T同P
(2)平衡状态(终态)只与始态有关,而与途径无 关,(如:①无论反应从什么方向开始②投料是一次还 是分成几次,扩大—缩小或缩小—扩大的过程,)只要 起始浓度相当,就达到等效平衡状态。 (3)体积分数相同:即平衡混合物各组分的百分含 量对应相同,但各组分的物质的量、浓度可能不同,反 应的速率、(内)压强等可以不同.
D 1molA+0.5molB+1.5molC+0.5molD
例2 在一定温度下,把 2molSO2和1molO2通入一个一 定容积的密闭容器中,发生以下反应: 2SO2+O2 2SO3,当此反应进行到一定程度时,反应混 合物就处于化学平衡状态。现维持该温度不变,令a、b、 c 分别代表初始加入的 SO2 、 O2 和 SO3 的物质的量 (mol) , 如果 a、b、 c取不同的数值,它们必须满足一定的相互关 系,才能保证达到平衡时反应混合物中三种气体的含量仍 跟上述平衡时的完全相同。请填写下列空白: (1)若a=0,b=0,则c= 2 。 (2)若a=0.5,则b= 0.25 ,c= 1.5 。
2mol SO2 1mol O2
2mol SO2 1mol O2
B
2mol SO2 1mol O2
A
SO3 c%
4mol SO2 2mol O2
方法:放大缩小法
非等效平衡!
4mol 2mol SO2 2mol 1mol O2
B
B
2mol SO2 1mol O2
B
B
二、等效平衡的建成条件、判断方法及产 生结果: 一)恒温、恒容:
一)恒温恒容
2:(△n(g) ≠ 0)
2molSO2 1molO2
2SO2 + O2
SO2 a% O2 b% SO3 c%
催化剂 加热
2SO3
平衡状态Ⅰ
A
方法: 放大缩小法 极限转换法或一边倒法
平衡状态Ⅱ SO2 a% 平衡状态Ⅱ
2molSO2 1molO2
4molSO2 2molO2
B
2molSO2 1molO2
1mol H2 1mol I2
H2(g) + I2(g)
催化剂 加热
2HI(g)
平衡状态 H2 a% I2 b% 1mol H2 1mol I2
B
1mol H2 1mol I2
A
HI c%
2mol H2 2mol I2
等效平衡
1mol H2 1mol I2
B
B
B
1mol H2 1mol I2
B
例1、恒温恒容时对于反应:H2(g) + I2(g) 催化剂 2HI(g) 加热 下列条件能与下图达到等效平衡的是( ABCD)
同,则达平衡后与原平衡等效。
(一边倒、投料比相同) 等 比 等 效
二)恒温恒压
2:(△n(g)=0)
H2(g) + I2(g)
平衡状态 H2 a% I2 b%
催化剂 加热
2HI(g)
1mol H2 1mol I2
A
1mol H2 1mol I2
HI c%
平衡状态 H2 a% I2 b% 平衡状态 HI c% H2 a%
与可逆反应气态物质的化学计量数无关,使 用极限转化的方法将各种情况变换成同一反应 物或生成物,然后观察有关物质的物质的量比 是否相等。若相等,
产生结果:
各组分百分量、c相同,n同比例变化
在一定温度下,一个压强恒定的密闭容器 中发生反应2A(g)+B(g) 3C(g)+D(g),根 据下表有关数据分析恒温、恒压达平衡时D的 体积分数(分别选填a% 或b% a≠b )。 A 起 始 充 入
2、对于气态物质反应前后分子数变化的可逆反应等 效平衡的判断方法是:
mA(g) + nB(g) pC(g) + qD(g)
m+n≠p+q (△n(g)≠0)
使用极限转化的方法将各种情况变换成同一反应 物或生成物,然后观察有关物质的物质的量是否对应 相等。若相等
产生结果: 各组分百分量、n、c均相同,则为等
2mol 1mol 4mol
B
1mol
0.5mol
C
0
1.5mol
D
0
0.5mol 0
平衡时D的体积分数
2mol
0
a% a% a%
b% (a≠b)
2mol
2mol
0
0
例1、温度压强不变时,将1molN2和4molH2 充入一个装有催化剂容积可变的密闭容器中, 发生N2(g)+3H2(g) 2NH3(g),达到化 学平衡后生成a mol的NH3,在相同温度和压 强下,保持平衡时各组分的体积分数不变, 填表:
二、等效平衡的建成条件、判断方法 及产生结果:
一)恒温、恒容:
1:对于气态物质反应前后分子数不变化的可逆反应等 效平衡的判断方法是:
mA(g) + nB(g) pC(g) + qD(g)
m+n = p+q (△n(g)=0)
使用极限转化的方法将各种情况变换成同一反应 物或生成物,然后观察有关物质的物质的量比是否相 等。若相等
开始 1mol H2 1molI2
平衡状态
H2 a% I2 b% HI c%
A. 2 mol HI
(1 1
0 )
B. 2 mol H2+2 mol I2 (2 2
极限转化 或一边倒
0)
C. 1 mol H2+1 mol I2+2 mol HI (2 2 0) D. 0.5 mol H2+0.5 mol I2+1 mol HI (1 1 0)
等效平衡专题
侯占祥 高二化学备课组
例: 2SO2+ O2 起始C(mol/L) 2 1 0.4
2SO3 0 1.2
2SO2+ O2 0 0
2SO3 2
平衡C(mol/L) 0.8
0.8
0.4
1.2
以上两个平衡,有什么异同?
一、等效平衡的含义
一定条件(温度体积一定或温度
压强一定)下的同一可逆反应,只要 起始组分的量相当,无论经过何种途 径,达到平衡后,任何相同组分的百 分含量(体积分数、物质的量分数、 质量分数等)均相同,这样的化学平 衡互称为等效平衡。
(mol/L)
N2 + 3H2
2NH3
起始浓度 1
起始浓度 0 1/3
3
0 1
0 -----①
2 4/3 ---- ② -----③
在恒温恒容下,按不面同的投料方式进行反应
平衡后各体系内相同组分浓度是否对应相同
N2 +
(1) 1mol
3H2
4mol
2NH3
0mol
(2)
0mol
1mol
1mol
(3+1)mol 2.5mol
效平衡(绝对等效等同平衡)
1、恒温恒容条件下
Ⅱ类:对于反应前后气体分子数不变 的可逆反应,只要反应物(或生成物) 的物质的量的比例与原平衡相同,则 二平衡等效。
(一边倒、投料比相同)
等 比 等 效
一)恒温恒容
1:(△n(g)=0)
H2(g) + I2(g)
催化剂 加热
2HI(g)
平衡状态Ⅰ 1mol H2 1mol I2 H2 a% I2 b%
