第3章 电化学热力学
合集下载
大学物理化学 第三章 多组分系统热力学习指导及习题解答

证明: RT d ln f =Vmdp
RT Vm p A Bp
积分区间为 0 到 p,
RT
p
d ln
f=
(p RT
A Bp)dp
0
0p
RT p d ln( f )= (p A Bp)dp Ap 1 Bp2
0
p0
2
因为
lim ln( f ) 0 p0 p
则有
RT ln( f )=Ap 1 Bp2
为两相中物质的量浓度,K 为分配系数。
萃取量
W萃取
=W
1
KV1 KV2 V2
n
二、 疑难解析
1. 证明在很稀的稀溶液中,物质的量分数 xB 、质量摩尔浓度 mB 、物质的量浓度 cB 、质量分数 wB
之间的关系: xB
mBM A
MA
cB
MA MB
wB 。
证明:
xB
nA
nB nB
nB nA
)pdT
-S
l A,m
dT
RT xA
dxA
-S(mg A)dT
-
RT xA
dxA =
S(mg A)-S
l A,m
dT
Δvap Hm (A) T
dT
-
xA 1
dxA = xA
Tb Tb*
Δvap Hm (A) R
dT T2
若温度变化不大, ΔvapHm 可视为常数
- ln
xA =
Δvap Hm (A) R
真实溶液中溶剂的化学势 μA μ*A(T, p) RT ln γx xA =μ*A(T, p) RT ln aA,x
真实溶液中溶质 B μB μB* (T, p) RT ln γx xB =μ*A(T, p) RT ln aB,x
RT Vm p A Bp
积分区间为 0 到 p,
RT
p
d ln
f=
(p RT
A Bp)dp
0
0p
RT p d ln( f )= (p A Bp)dp Ap 1 Bp2
0
p0
2
因为
lim ln( f ) 0 p0 p
则有
RT ln( f )=Ap 1 Bp2
为两相中物质的量浓度,K 为分配系数。
萃取量
W萃取
=W
1
KV1 KV2 V2
n
二、 疑难解析
1. 证明在很稀的稀溶液中,物质的量分数 xB 、质量摩尔浓度 mB 、物质的量浓度 cB 、质量分数 wB
之间的关系: xB
mBM A
MA
cB
MA MB
wB 。
证明:
xB
nA
nB nB
nB nA
)pdT
-S
l A,m
dT
RT xA
dxA
-S(mg A)dT
-
RT xA
dxA =
S(mg A)-S
l A,m
dT
Δvap Hm (A) T
dT
-
xA 1
dxA = xA
Tb Tb*
Δvap Hm (A) R
dT T2
若温度变化不大, ΔvapHm 可视为常数
- ln
xA =
Δvap Hm (A) R
真实溶液中溶剂的化学势 μA μ*A(T, p) RT ln γx xA =μ*A(T, p) RT ln aA,x
真实溶液中溶质 B μB μB* (T, p) RT ln γx xB =μ*A(T, p) RT ln aB,x
电化学系统的热力学pPPT课件

1.电化学系统的热力学基本方程(fundamental equations of thermodynamics for electrochemical systems)
封闭体系内能的变化为:
dU dQR dWR dQR dWR,体积 dWR
dQR TdS, dWR,体积 pdV
非体积功用广义力乘以广义位移表示,若可逆也可
则反应进度D =1,若这个反应过程是可逆的:
WR ΔGT , p ΔrGmΔ gG rR d D eE WR BB NhomakorabeaB
化学反应的可逆非体积功:
WR
B
B
B
电池只不过是将化学能转化为电功的一种装置而已, 非体积功就是电功。假设电池是可逆的,记电池的 电势为E,并约定电池对外输出功时,电势为正,由 法拉第定律知通过的电量为zF,则电池做的可逆非 体积功:
静电能变化=电荷电势 =q
Zn Cu2 Zn2 Cu
(Zn)
(CuSO4 )
(ZnSO4 )
(Cu)
电势能微变 zZnFdnZ(Znn)
z Fdn (Zn)
Zn2
( ZnSO4 ) Zn2
(ZnSO4 )
z Fdn z Fdn (Cu) (Cu)
(CuSO4 ) (CuSO4 )
电化学系统的热力学
消除液接电势,在电路断开或电路闭合且可逆做功 时,电池处于平衡态,其电势是状态函数。
用吉氏函数可逆性判据推导电池电动势表达式
ΔGT , p WR W
将其应用于一定温度压强下的化学反应
dD eE gG rR
d mol D、e mol E…反应生成 g mol G、r mol R …,
2F
用盐桥消除液接电势, (CuSO4 ) (ZnSO4 )
第三章(电化学平衡)

12
四类常见电极
电极类型 金属电极 非金属电 极 难溶盐电极 电 对(举例) Zn2+/Zn Cl2/ClAgCl/Ag 电 极 Zn2+(c) | Zn Cl- (c) | Cl2(p) | Pt Fe3+ (c1),Fe2+ (c2) | Pt Cl- (c) | AgCl | Ag
氧化还原电极 Fe3+/Fe2+
13
2、 原电池的热力学
电池反应的△Gm与电动势E的关系 对电动势为E的电池反应:
Cu2++Zn→Zn2++Cu 根据标准摩尔生成焓和标准摩尔生成吉 布斯函数,可求得(298.15K时):
ΔrHm = -217.2 kJ·mol-1 ΔrGm = -212.69 kJ·mol-1
14
由于 ΔrGm 是系统可用来做非体积功的那部分能量 , 而在原电池中,非体积功w ' 即为电功we,
25
(4)查阅标准电极电势数据时,要注意电对的具体 存在形式、状态和介质条件等都必须完全符合。 如:Fe2+(aq)+2e- = Fe(s) Fe3+(aq)+e- = Fe2+(aq)
H2O2(aq) + 2H+(aq) + 2eˉ O2(g) + 2H+(aq) + 2eˉ
φ (Fe2+/ Fe)= -0.447v φ (Fe3+/ Fe2+) = 0.771v
7
(3) 氧化态和相应的还原态物质能用来组成电对, 通常称为氧化还原电对,用符号“氧化态/还原态”表 示。 一般只把作为氧化态和还原态的物质用化学式表示出 来,通常不表示电极液的组成。如,铜锌原电池中的 两个半电池的电对可分别表示为Zn2+/Zn和Cu2+/Cu。 又如: Fe3+/Fe2+, O2/OH-, Hg2Cl2/Hg, MnO4-/Mn2+ 等。
现代电化学-第3章
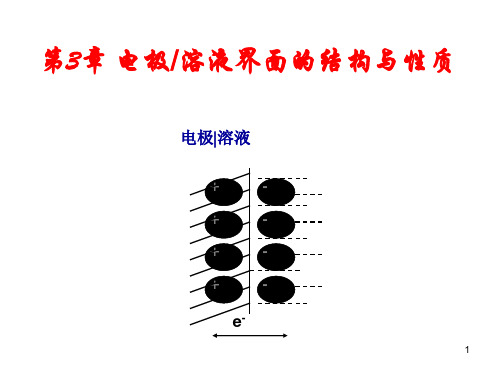
溶液
9
在恒温、恒压下:
Ad ni di 0
ni d di 0 A ni i — i的表面吸附量(mol/cm2) A
d i di 0
— Gibbs吸附等温式
10
一般情况下,不带电的固相中没有可以自由移动而在 界面吸附的粒子,因而对固/液界面,化学势一项只 需要考虑液相中的吸附粒子。但对电极电位可变的电
若参比电极对负离子可逆, 则: 若参比电极对正离子可逆, 则:
参比电极对负离子可逆:
相对
参比电极对正离子可逆:
18
相对
具体求解离子表面剩余量的步骤: (1)测量不同浓度电解质溶液的电毛细曲线 (2)从各条电毛细曲线上取同一相对电势下的值,作出 -lna关系曲线 (3)根据-lna关系曲线,求出某一浓度下的斜率 ln a
根据Lippman公式,可以判断表面剩余电荷密度的符号
(1)当电极表面存在正的剩余电荷时,
q 0, 0
随电极电势变正,界面张力不断减小—带正电。 (2)当电极表面存在负的剩余电荷时,
q 0, 0
29
• 若以ψa表示整个双电层的电位差,则紧密层的电 位差为(ψa - ψ1),分散层的电位差ψ1。 • ψa 和 ψ1均是相对于溶液深处的电位(规定为零)而 言的。 • 双电层电容看作串连模型。可用下式计算双电层 电容:
d a d a 1 d 1 1 1 1 Cd dq dq dq C紧 C 分
• 在溶液相中,当溶液总浓度较高,电极表面 电荷密度较大时,由于离子热运动较困难, 对剩余电荷分布的影响较小,而电极与溶液 间的静电作用较强,对剩余电荷的分布起主 导作用,溶液中的剩余电荷也倾向于紧密分 布,形成紧密双电层。
电化学原理-第3章:电极溶液界面的结构性质-4

(2)参与建立或改变双电层。由于形成有一定电 极电位的双电层结构,只需要一定数量的电量,故这 部份电流的作用类似于给电容器充电,只在电路中引 起短暂的充电电流。
为了研究界面的结构 和性质,就希望界面 上不发生电极反应, 使外电源输入的全部 电流都用于建立或改 变界面结构和电极电 位,即可等效为图3.1 (b)中的电路。
( ) ' ln a
根据(3.21)或(3.22) 求得该浓度下的离子表 面剩余量 v
(v v ) RT ln a ( ) '
v ( ) ' (v v ) RT ln a
当电极表面带负电时,(曲 线右半部分),正离子表面
1.界面电场对电极反应速度的影响
界面电场是由电极/溶液相间存在的双电层所引起的。
而双电层中符号相反的两个电荷层之间的距离非常小, 因而能给出巨大的场强。 例如 双电层电位差(即电极电位)为1V,而界面两 个电荷层的间距为 108 cm 时,其场强可
达 10 V cm 。
8
已知电极反应是得失电子的反应,也就是有电荷在相 间转移的反应。 巨大的界面电场下,电极反应速度必将发生极大的变 化,甚至某些在其他场合难以发生的化学反应也得以 进行。
特别有意义的是,电极电位可以被人为的,连续的加
以改变,因而可以通过控制电极电位来有效地,连续 地改变电极反应速度。这正是电极反应区别于其他化
学反应的一大优点。
2.电解液性质和电极材料及其表面状态的影响
电解质溶液的组成和浓度,电极材料的物理,化学性质及其 表面状态均能影响电极/溶液界面的结构和性质,从而对电 极反应性质和速度有明显的作用。 例如在同一电极电位下,同一种溶液中,析氢反应
这样,可以把电极电位 改变到所需要的数值, 并可定量分析建立这种 双电层结构所需要的电 量。 这种不发生任何电极反 应的电极体系称为理想 极化电极。
为了研究界面的结构 和性质,就希望界面 上不发生电极反应, 使外电源输入的全部 电流都用于建立或改 变界面结构和电极电 位,即可等效为图3.1 (b)中的电路。
( ) ' ln a
根据(3.21)或(3.22) 求得该浓度下的离子表 面剩余量 v
(v v ) RT ln a ( ) '
v ( ) ' (v v ) RT ln a
当电极表面带负电时,(曲 线右半部分),正离子表面
1.界面电场对电极反应速度的影响
界面电场是由电极/溶液相间存在的双电层所引起的。
而双电层中符号相反的两个电荷层之间的距离非常小, 因而能给出巨大的场强。 例如 双电层电位差(即电极电位)为1V,而界面两 个电荷层的间距为 108 cm 时,其场强可
达 10 V cm 。
8
已知电极反应是得失电子的反应,也就是有电荷在相 间转移的反应。 巨大的界面电场下,电极反应速度必将发生极大的变 化,甚至某些在其他场合难以发生的化学反应也得以 进行。
特别有意义的是,电极电位可以被人为的,连续的加
以改变,因而可以通过控制电极电位来有效地,连续 地改变电极反应速度。这正是电极反应区别于其他化
学反应的一大优点。
2.电解液性质和电极材料及其表面状态的影响
电解质溶液的组成和浓度,电极材料的物理,化学性质及其 表面状态均能影响电极/溶液界面的结构和性质,从而对电 极反应性质和速度有明显的作用。 例如在同一电极电位下,同一种溶液中,析氢反应
这样,可以把电极电位 改变到所需要的数值, 并可定量分析建立这种 双电层结构所需要的电 量。 这种不发生任何电极反 应的电极体系称为理想 极化电极。
工程化学第三章电化学基础

-ΔGm=-W’=-We=QE=nFE 即 ΔGm=-nFE 若反应在标准条件下进行,同理有
ΔGm =-nFE 式中,n为电池反应过程转移电子的物质的量; F称 为法拉第常数,其值为96485C/mol(需牢记)。
可见,若将前述反应在原电池中可逆地做电功,能 量利用率为 212.40 /218.66=97%
• 再将参比电极与待测电极 组成原电池,测得待测电 极的电极电势。
甘汞电极的构造
2021/2/17
工程化学第三章电化学基础
11
甘汞电极的电极电势与温度、KCl浓度有关:
电极名称
电极电势
饱和甘汞电极
0.2412-7.6×10-4(t/℃-25)
1mol·L-1甘汞电极
0.2801-2.4×10-4(t/℃-25)
(-)Ag,AgBr│Br-(c1)‖Cl-(c2) │Cl2,Pt(+) (-)Pt,H2(p) │H+(c1)‖Fe3+(c2),Fe2+(c3)│Pt(+)
2021/2/17
工程化学第三章电化学基础
6
3、可逆电极的类型
第一类电极 金属-金属离子电极:Zn|Zn2+:Zn2++2e=Zn; Zn-2e=Zn2+ Cu|Cu2+:Cu2++2e=Cu Cu-2e=Cu2+ 气体-离子电极:Cl-|Cl2,Pt:Cl2+2e=2Cl- 2Cl--2e=Cl2 Pt,O2|OH-:O2+2H2O+4e=4OH- 4OH--4e=O2+2H2O
第三章 电化学基础
• 本章从氧化还原反应出发,简要介绍原电池的组 成和符号、半反应式和电池反应式以及电极电势 的产生和测量等概念;
ΔGm =-nFE 式中,n为电池反应过程转移电子的物质的量; F称 为法拉第常数,其值为96485C/mol(需牢记)。
可见,若将前述反应在原电池中可逆地做电功,能 量利用率为 212.40 /218.66=97%
• 再将参比电极与待测电极 组成原电池,测得待测电 极的电极电势。
甘汞电极的构造
2021/2/17
工程化学第三章电化学基础
11
甘汞电极的电极电势与温度、KCl浓度有关:
电极名称
电极电势
饱和甘汞电极
0.2412-7.6×10-4(t/℃-25)
1mol·L-1甘汞电极
0.2801-2.4×10-4(t/℃-25)
(-)Ag,AgBr│Br-(c1)‖Cl-(c2) │Cl2,Pt(+) (-)Pt,H2(p) │H+(c1)‖Fe3+(c2),Fe2+(c3)│Pt(+)
2021/2/17
工程化学第三章电化学基础
6
3、可逆电极的类型
第一类电极 金属-金属离子电极:Zn|Zn2+:Zn2++2e=Zn; Zn-2e=Zn2+ Cu|Cu2+:Cu2++2e=Cu Cu-2e=Cu2+ 气体-离子电极:Cl-|Cl2,Pt:Cl2+2e=2Cl- 2Cl--2e=Cl2 Pt,O2|OH-:O2+2H2O+4e=4OH- 4OH--4e=O2+2H2O
第三章 电化学基础
• 本章从氧化还原反应出发,简要介绍原电池的组 成和符号、半反应式和电池反应式以及电极电势 的产生和测量等概念;
物理化学03章_热力学第二定律(二)

Ssys = 19.14 J K
Ssur = 0
1
(系统未吸热,也未做功)
Siso = Ssys + Ssur = 19.14 J K 1 > 0
(2)为不可逆过程.
例2:在273 K时,将一个 22.4 dm3 的盒子用隔板一分为二,
0.5 mol 0.5 mol O2 (g) N2 (g)
p1 V1 p2 V2 T2 p2 V2 ∵ = ∴ = T1 T2 T1 p1V1
V2 p2V2 ∴ S = nR ln + nCV ,m ln V1 p1V1
V2 p2 V2 = nR ln + nC V ,m ln + nC V ,m ln V1 p1 V1
p2 V2 ∴ S = nCV ,m ln + nC p ,m ln p1 V1
因为在可逆相变中压力恒定,所以可逆热即为相 因为在可逆相变中压力恒定, 变焓.又由于温度一定,所以, 变焓.又由于温度一定,所以,物质 B 由 α 相态 转化为 β 相态
p ,T B (α ) → B ( β )
的相变熵为: 的相变熵为:
β α H β α S = T
用上式,可计算正常熔点下的熔化熵, 用上式,可计算正常熔点下的熔化熵,正常 沸点下的蒸发熵等等. 沸点下的蒸发熵等等.
= TC S > 0
Q W
热源
R2
TC
1
W2
Q W2
TB热源做功能力低于TA
TB热源做功能力低于TA
其原因是经过了一个不可逆的热传导过程 功变为热是无条件的,而热不能无条件 地全变为功. 热和功即使数量相同,但"质量"不等, 功是"高质量"的能量. 高温热源的热与低温热源的热即使数量相 同,但"质量"也不等,高温热源的热"质量" 较高,做功能力强. 从高"质量"的能贬值为低"质量"的能 是自发过程.
电化学原理第三章

从理论上解释微分电容的变化规律,说明界面结构及影响因素对 微分电容的影响,正是建立双电层模型时要考虑的一个重要内容 ,根据微分电容曲线所提供的信息来研究界面结构与性质的实验 方法叫微分电容法。
2021/12/31
微分电容曲线可求给定电极电位下的电极表面剩余电荷q Cd=dq/dQ 积分后可得
qCdd积分常数
无电荷排斥作用,界面张力最大; 此时的电极电位称为零电荷电位,常用符号Φ0表示。
q( )i
3.6
无论电极表面存在剩余电荷符号如何,界面张力均随剩余电 荷数量的增加而降低。 由上式
可直接由电毛细曲线斜率求某一电位密度下电极电位 表面剩余电荷密度q判断表面剩余电荷密度符号 及零电荷电位。
2021/12/31
由微分电容定义和李普曼方程,由电毛细曲线很易求得微分电容 值
因
q
所以 Cd2
2
(3.25)
2021/12/31
可根据电毛细曲线确定零电荷电位φO,从而可利用式(3.24)求得 任-电极电位下的电极表面剩余电荷密度q,即
q
qodq
oCdd
(3.3)6
故可计算从零电荷电位φO到某一电位φ之间的平均电容值Ci
即由3.21和3.22求得该浓度下的离子表面剩余量。
2021/12/31
§ 双电层的微分电容
一、 双电层的电容
界面剩余电荷的变化将引起界面双电层电位差改变,因而电极/溶 液界面具有贮存电荷的能力,即具有电容的特性。
理想极化电极可作为平板电容器处理,即把电极/溶液界面的两个 剩余电荷层比拟成电容器的两个平行板,由物理学知,该电容器 的电容值为一常数,即
d为紧贴电极表面排列的水化离子的电荷中心与电极表面的 距离,也为离子电荷能接近表面的最小距离。紧密层厚度为d, 若假定d内介电常数为恒定值。则该层内电位分布是线性变化的。 从x=d到溶液中远处剩余电荷为零的双电层部分即为分散层。其 电位分布是非线性变化的。
2021/12/31
微分电容曲线可求给定电极电位下的电极表面剩余电荷q Cd=dq/dQ 积分后可得
qCdd积分常数
无电荷排斥作用,界面张力最大; 此时的电极电位称为零电荷电位,常用符号Φ0表示。
q( )i
3.6
无论电极表面存在剩余电荷符号如何,界面张力均随剩余电 荷数量的增加而降低。 由上式
可直接由电毛细曲线斜率求某一电位密度下电极电位 表面剩余电荷密度q判断表面剩余电荷密度符号 及零电荷电位。
2021/12/31
由微分电容定义和李普曼方程,由电毛细曲线很易求得微分电容 值
因
q
所以 Cd2
2
(3.25)
2021/12/31
可根据电毛细曲线确定零电荷电位φO,从而可利用式(3.24)求得 任-电极电位下的电极表面剩余电荷密度q,即
q
qodq
oCdd
(3.3)6
故可计算从零电荷电位φO到某一电位φ之间的平均电容值Ci
即由3.21和3.22求得该浓度下的离子表面剩余量。
2021/12/31
§ 双电层的微分电容
一、 双电层的电容
界面剩余电荷的变化将引起界面双电层电位差改变,因而电极/溶 液界面具有贮存电荷的能力,即具有电容的特性。
理想极化电极可作为平板电容器处理,即把电极/溶液界面的两个 剩余电荷层比拟成电容器的两个平行板,由物理学知,该电容器 的电容值为一常数,即
d为紧贴电极表面排列的水化离子的电荷中心与电极表面的 距离,也为离子电荷能接近表面的最小距离。紧密层厚度为d, 若假定d内介电常数为恒定值。则该层内电位分布是线性变化的。 从x=d到溶液中远处剩余电荷为零的双电层部分即为分散层。其 电位分布是非线性变化的。
